华南农业大学有机化学课件第十章醚和环氧化合物
第八章 醚和环氧化

教学要求:
掌握:醚的质子化;醚键的断裂;环氧化合物的开环 反应。 熟悉或理解:醚的结构、命名及物理性质;环氧化合 物的命名;环氧化合物的开环反应机理。 了解:冠醚的结构和用途。
第一节 醚
醚可看作是醇或酚羟基上的氢被烃基取代的化合物,化学性 质较稳定,常用做有机溶剂,有的还可做麻醉剂。环氧化合物是 指含有三元环的醚及其衍生物,化学性质活泼,是药物合成的重 要中间体。
一. 结构、分类和命名
1、通式:R-O-R(R’)、Ar-O-R或Ar-O-Ar(Ar为苯基或其它芳基)。
2、分类:
3、命名
• 醚的普通命名法
烃基名称之后加上“醚”字,单醚:“二”字可以省 略;混醚:两个不同基团排列顺序通常为先小基团后大基 团原则;芳香醚:习惯苯基或芳烃基在前。
• 醚的系统命名法:
力越强,则在水中溶解度就越大。例如,四氢呋喃和1,4-二氧
六环就可以与水互溶。一般高级醚难溶于水。
三.化学性质
醚很稳定,稳定性仅次于烷烃,不能与强酸、强碱、稀酸 、氧化剂及还原剂(如Na)发生反应,只能与强的浓酸反应。 (一) 醚的质子化: 盐的形成 醚键的氧原子上具有孤对电子,可作为路易斯碱与 强酸中的H+结合而形成类似盐类结构的化合物-盐(oxonium salt)。因此醚溶于强酸如H2SO4, HCl等。例如:
对结构较复杂的醚,将较小基团烷氧基作为取代基命 名。例如:
分子中含有多个-OCH2CH2-结构单元的大环醚 称为冠醚。如:
二.物理性质
沸点: 醚分子间不能形成氢键,因此沸点与分子质量相近的 烷烃相近,低于异构体的醇。如乙醚、正丁醇和正戊烷的分子 量分别为74、74、72,相差不多,沸点却分别为34.6, 118,35。 溶解度:醚键中的氧原子可以与水中氢原子形成氢键,因此 低级醚在水中溶解度与分子质量相近的醇相近。形成氢键的能
大学化学《有机化学-醇和醚》课件

稀酸,反应条件温和, 不饱和键不受影响
反应式
ROH + HX 醇的活性比较: 苯甲型, 烯丙型 > 3oROH > 2oROH > 1oROH > CH3OH HX的活性比较: HI > HBr > HCl RX + H2O
浓盐酸和无水氯化锌的混合物称为卢卡斯试剂。
用卢卡斯试剂可鉴别六碳和六碳以下的一级、二级、三级醇。
将三种醇分别加入盛有卢卡斯试剂的试管中,经振荡后可发现: 三级醇立刻反应(烯丙型及苯甲型的醇也可以很快地发生反 应),生成油状氯代烷,它不溶于酸中,溶液呈混浊后分两层, 反应放热;
H3C CH3 + Br- + C O P Br Br H CH3
Br (CH3)3C OH + Br P Br
SN2
SN1
(CH3)3C+ + HOPBr2
Br -
(CH3)3CBr
10.6.3 与亚硫酰氯反应 (1) 反应方程式
ROH + SOCl2
b.p. 79oC
RCl + SO2
+ HCl
酸性条件
醇各类氧化反应的总结-2
氧化剂 新制 MnO2*1 沙瑞特试剂 CrO3吡啶 一级醇 醛 醛 二级醇 三级醇 酮 酮 特点和说明 中性 不饱和键不受影响 弱碱,反应条件温和, 不饱和键不受影响。
琼斯试剂
CrO3+稀H2SO4 费兹纳-莫发特试剂
醛(产率不高, 不用。)
醛(产率很高)
酮 酮
乙二醇二硝酸酯
2 磷酸酯的制备
3C4H9OH +
Cl Cl Cl P=O
C4H9O C4H9O C4H9O
有机化学基础知识点整理醚的性质与应用

有机化学基础知识点整理醚的性质与应用醚的性质与应用醚是一类有机化合物,其分子中含有氧原子与两个烷基或芳基基团连接。
醚广泛存在于生活与工业中,并具有多种重要的性质与应用。
本文将对醚的性质与应用进行整理,以帮助读者更好地理解和应用这一有机化合物。
一、醚的物理性质1. 沸点和熔点:一般情况下,醚的沸点和熔点较低,表明它们具有较弱的分子间力。
这使得醚在常温下为液体,易挥发。
例如,乙醚(C2H5OC2H5)的沸点为35℃,甲醚(CH3OCH3)的沸点为-24.8℃。
2. 溶解性:醚是良好的溶剂,在许多有机化合物中具有良好的溶解性。
它们可溶于非极性和某些极性溶剂,如乙醇和酯类。
但醚对水的溶解性较小,大多数醚在水中只能溶解一定比例。
例如,乙醚的溶解度为6.9 g/100 mL水。
二、醚的化学性质1. 醚的酸碱性:由于醚分子中的氧原子对电子密度的吸引能力较弱,醚不具有酸性和碱性。
醚与酸或碱反应时通常作为中性配体。
2. 醚的氧化性:对于含有亚甲基(-CH2-)基团的醚,其亚甲基的氧化性较强。
例如,甲醚可以被氧气氧化为甲酸。
但对于一般的醚,其氧化性较弱。
3. 醚的环加成反应:醚可以参与环加成反应,生成环化合物。
例如,环氧乙烷可以与氢酸钠反应生成醇类,并释放出醇的氢氧。
三、醚的应用1. 溶剂:醚具有良好的溶解性,特别适合用作有机合成中的溶剂。
乙醚是一种常用的溶剂,在化学实验和合成过程中广泛应用。
2. 麻醉剂:乙醚被广泛用作麻醉剂。
它在医疗领域中曾被广泛使用,但由于其易燃性和爆炸性,现在已经被更安全的麻醉剂所取代。
3. 清洁剂:醚可以用作清洁剂,用于去除脂肪、油污和其他有机物。
许多清洁剂中的活性成分包含醚类化合物。
4. 燃料:醚也可被用作燃料。
例如,甲醚可以作为替代石油的燃料,用于发动机和炉具等。
5. 食品香料和调味剂:某些醚具有良好的香气,可用于食品香料和调味剂的生产。
例如,乙醚可以用来制造水果香精。
结论:醚是一类重要的有机化合物,具有较弱的分子间力,良好的溶解性和多种化学性质。
醚的化学通式-概述说明以及解释

醚的化学通式-概述说明以及解释1.引言1.1 概述醚是一类重要的有机化合物,具有许多独特的化学性质和广泛的应用。
其分子结构中含有一个氧原子与两个有机基团相连,通式为R-O-R'。
醚在化学反应中通常表现出较弱的活性,但在有机合成、药物制备、溶剂和润滑剂等领域有着重要的应用价值。
本文将对醚的定义、性质和应用进行深入探讨,旨在全面了解醚在化学领域中的重要性和潜在发展方向。
1.2 文章结构文章结构部分主要包括以下内容:1. 引言部分:包括对醚的概述、文章结构和目的的介绍,为读者提供文章的背景和主要内容概述。
2. 正文部分:详细介绍醚的定义、性质和应用,通过分析醚的化学特性和用途,让读者对醚有更深入的了解。
3. 结论部分:总结醚的重要性,并展望醚在未来的发展前景。
最后提出结论,总结整篇文章的内容并强调醚在化学领域的重要性和潜力。
通过以上三大部分的内容,读者可以全面了解醚的化学通式,掌握其概念、特性和应用,从而对醚这一化学物质有更深入的认识。
1.3 目的本文旨在通过对醚的化学通式的详细介绍,使读者对醚这一化合物有一个全面的了解。
通过深入探讨醚的定义、性质和应用,希望能够帮助读者更好地理解醚在化学领域中的重要性和广泛应用。
同时,通过展望醚在未来的发展,本文也将为读者提供对醚这一化合物未来发展方向的一些思考和展望。
最终,通过总结醚的重要性和应用领域,使读者能够深刻认识到醚在化学研究和工业生产中的不可替代地位。
2.正文2.1 醚的定义醚是一类含有氧原子的有机物,其中氧原子连接两个碳原子。
在化学结构中,醚的通用式通常表示为R-O-R',其中R和R'代表有机基团。
醚分为两种类型:对称性醚和非对称性醚。
在对称性醚中,两个有机基团相同;而在非对称性醚中,两个有机基团不同。
醚的结构使其具有一些特殊的化学性质,如惰性和不导电性。
此外,醚还具有一定的溶解性,在有机和无机化合物中都可以起到溶剂的作用。
醚的化学反应包括裂解、缩合和氧化等,这些反应使得醚在有机合成和工业生产中具有重要的应用价值。
有机化学醇和醚
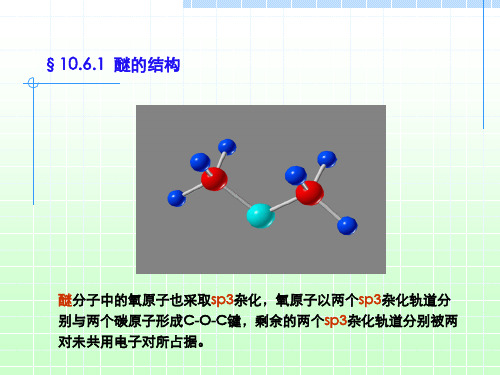
3. 溶解性 醚一般微溶于水,能与水分子形成氢键;易溶于有机溶剂。 由于 醚的化学性质不活泼,是良好的溶剂。
§10.9 醚的化学性质
醚键(C-O-C)的极性很小,比较稳定。
对碱、氧化剂、还原剂都很稳定; 在常温下醚也不与金属钠作用; 但是在一定条件下,醚也能发生某些化学反应。
§10.9 醚的化学性质
+ CH3CH2I
CH 3CH 2I
+ H2O
混醚与氢碘酸作用时,一般是较小的烃基生成碘代烷,较大的烃基
生成醇或酚。
CH 57%HI O C H 2 5 3 △ O C H 2 5 HI △ C H OH 2 5 OH + C H I 2 5 +
CH I 3
§10.9.2 络合物的生成 醚可以将氧上的未共用电子对与缺电子的试剂(如BF3、AlCl3、 RMgX等)形成相应的络合物。
HOCl
HOCH2 CH2 Cl
§10.10 重要的醚
环氧乙烷
b. 化学反应
在酸或碱催化下可以与许多含活泼氢的试剂(如水、氢卤酸、醇、氨
等)发生化学反应。
CH2 O
CH2
+
HA
CH2 OH
CH2 A
式中:A代表-OH,-X,-OR,-NH2等。
§10.10 重要的醚
环氧乙烷
b. 化学反应
① 与水反应
用,形成佯盐,而溶于强酸体系(如浓硫酸、浓盐酸)。
金 羊盐不稳定,遇水很快分解为原来的醚。
§10.9.1 佯盐的形成和醚键的断裂
醚键的断裂
醚与浓氢卤酸(一般用氢碘酸)共热,醚键可以断裂生成卤代烷 和醇。如果氢卤酸过量,生成的醇进一步反应生成卤代烷。
有机化学第九章醚

四氢呋喃 tetrahydrofuran
四氢吡喃 tetrahydropyran
二噁烷(1,4-二氧六环) 1,4-dioxane
1,2-环氧丙烷(氧化丙烯) 1,2-epoxypropane
四氢吡喃的 椅式构象
有机化学 (第9版)
一、环氧化合物
(一)结构和命名
系统命名:三元环氧化合物以“氧杂环丙烷”(oxirane)为母体,四元环 氧化合物以“氧杂环丁烷”(oxetane)为母体。
第九章
醚
第一节 醚 第二节 环醚
重点难点
掌握 掌握醚的命名、结构和化学性质;掌握环氧化合物 的命名、结构和化学性质
熟悉 冠醚的结构和命名
了解 冠醚的性质
第一节
醚
有机化学 (第9版)
一、结构和命名
1.醚的结构
甲醚分子的结构
醚键中的氧原子为sp3杂化,其中两个sp3杂化轨道分别与两个烃基碳原子 形成σ键,键角约112°,未成键的两个sp3杂化轨道含两对孤对电子。
有机化学 (第9版)
二、冠醚
含有多个氧原子的大环多醚。通常分子中具有—OCH2CH2—重复单元。立体结构 状似王冠,故称冠醚。冠醚命名时称“m-冠-n”,m代表构成环的碳原子和氧原 子的总数,n代表环中氧原子数。 冠醚的结构特点是随环的大小不同而与不同金属离子形成络合物,从而可以选择
性地识别金属离子。如18-冠-6的空穴直径和K+的直径相近,所以它能与K+离子
(二)开环反应
1. 酸催化开环反应 酸性条件下为具有SN1性质的SN2反应,亲核试剂进攻取代基较多的环碳原 子,这个碳由于取代基的供电效应使正电荷分散而稳定。
更稳定
有机化学 (第9版)
一、环氧化合物
有机化学 高鸿宾 第四版 答案 第十章_醚和环氧
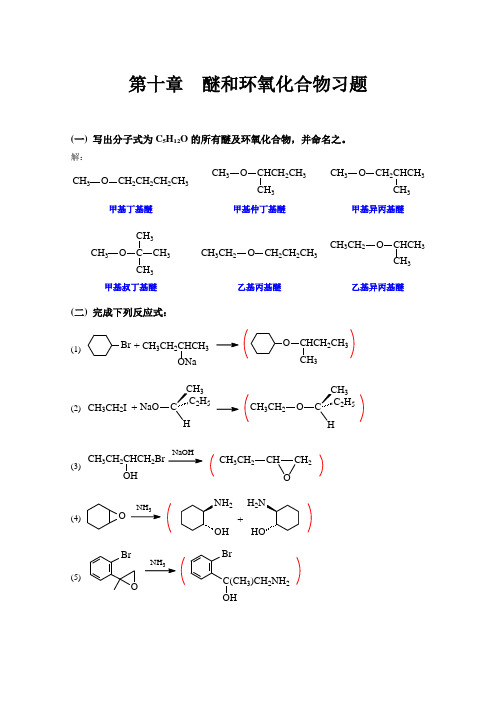
第十章醚和环氧化合物习题(一) 写出分子式为C5H12O的所有醚及环氧化合物,并命名之。
解:CH3O CH2CH2CH2CH3CH3O CHCH2CH33CH3O CH2CHCH3CH3甲基丁基醚甲基仲丁基醚甲基异丙基醚CH3O C CH3CH33CH3CH2O CH2CH2CH3CH3CH2O CHCH3CH3甲基叔丁基醚乙基丙基醚乙基异丙基醚(二) 完成下列反应式:(1) Br+ CH3CH2CHCH3O CHCH2CH33(2) CH3CH2I +CNaO2H53COH2H53CH3CH2(3) CH3CH2CHCH2BrOHCH2CHOCH3CH2(4)ONH2H2+(5)BrO3BrC(CH3)CH2NH2(6)CH 2CH OHCl 3CH 2OHCH Cl+CH 2CHO(三) 在3,5-二氧杂环己醇OOOH的稳定椅型构象中,羟基处在a 键的位置,试解释之。
解:羟基处于a 键时,有利于形成具有五元环状结构的分子内氢键:或O OOH(四) 完成下列转变:(1)C OCH 3OCH 2OCH 3解:C OCH 3OCH 2OCH 33NaOHNa + C H OHCH 2OH(2)BrOH O Ph及解:K Cr O 24OHOMgBr2+MgTHFOHBrC H CO HO(TM)(3)Br 及CH 2CHCH 3OHCH 3CHCH 3解:CH 3CHCH 3OHCH CH 2OCH 324CH 2=CHCH 3CF 3CO 3HCH 2CHCH 3MgBr2+MgTHFBr CH CH 2OCH 3(4)CH 2OH CH 3CH 2OHCH 2CH 2CH 2OCH 2CH 3及解:CH 3CH 2Br24o33CH 3CH 2OH CH =CH CH 2CH 2OCH 22+CH 2OH CH 2MgClMg dry etherO2CH 2CH 2CH 2OC 2H 5CH 2CH 2CH 2OH25(5)及CH 3CH 2OH解:24oCH 3CH 2OHCH 2=CH 2CH 2=CH 2+CF 3CO 3H(五) 推测下列化合物A~F 的结构,并注明化合物E 及F 的立体构型。
有机化学 11
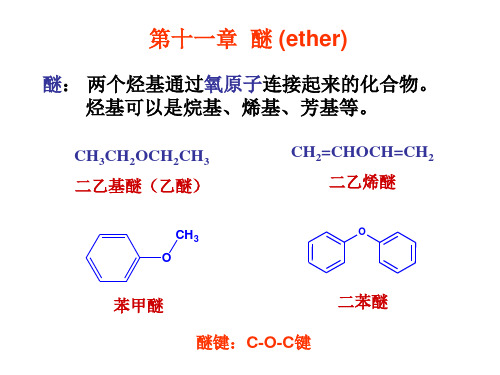
氧与二个1 相连 发生S , 相连, 氧与二个 oC相连,发生 N2, 氧与2 、 相连, 氧与 oC、 3oC相连,发生 N1。 相连 发生S 。
烷基芳基混合醚: 烷基芳基混合醚: 一起加热生成碘代烷和酚 与HI一起加热生成碘代烷和酚,酚不与氢碘酸作用 。 一起加热生成碘代烷和酚,
O
CH3 + HI
O
-
Cl
-Cl-
O
Cl
Cl
+ HOCl
OH
NaOH
O-
分子内S 分子内 N2
O
Cl OH H
NaOH E2
HO
(4) 冠谜的合成
HO-CH2-CH2-OH + 2
O
苯甲醚 醚键: 醚键:C-O-C键 键
二苯醚
醚的结构、 第一节 醚的结构、命名和物理性质 1. 分类
开链醚:没有环的醚。 开链醚:没有环的醚。
CH 3 O
CH2=CHOCH=CH2
O O O
15 16 17 14 18 O 13 O1 2 12 O 11 O 10 9 O 8 7 6 O4 3 5
链增长: 链增长:
• (CH3)2COCH3 + O2
优先形成稳定 的自由基。 的自由基。
(CH3)2COCH3 OO •
(CH3)2COCH3 + (CH3)2CHOCH3 OO • • (CH3)2COCH3 + (CH3)2COCH3 OOH
关键中间体
3. 醚的碳氧键断裂反应
CH3OCH3 + HI (1mol)
RO
- ...
... CH2
X
取代
ROCH2CH2R' + X-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华南农业大学有机化学课件 第
十章 醚和环氧化合物
———————————————————————————————— 作者:
———————————————————————————————— 日期:
第十章 醚和环氧化合物
1. 命名下列化合物:
(1)异丙基仲丁基醚 (2)2-甲基-5-甲氧基己完烷
(3)4-甲基-4’-硝基二苯醚 (4)对硝基苯基叔丁基醚
2. 完成下列反应式:
(1)
(2)
(3)CHCH=CH2OCH2CHOOHC2H5I+
(4)
(5)
O
OH
O
CH
3
C6H5OH,H
+
C6H5OH
NaOH
CH2OHCHCH
3
OC6H
5
CH2OC6H5CHCH
3
OH
O
CH
3
CH
3
CH
3
CH3OH,H
+
CH3ONa
CH3OH
(CH3)2CHOCH3CHCH
3
OH
(CH3)2CHOHCHCH
3
OCH
3
(6)
(8)
O
CH
3
C6H
5
C6H5CHCHCH
3
OHCl
C6H5CHOHCHCH
3
NH
2
(7)
HCl
NH
3
OOR
(9)
C2H
5
O
CH
3
H2O/H
+
H2O/OH
-
HO
CCH2OH
C2H
5
CH
3
HO
CCH2OH
C2H
5
CH
3
H2O
H
+
H
+
3.
CH3OCH=CH2CH3OCHCH
3
+
CH3O=CHCH
3
+
CH3OCHCH
3
OH
2
+
CH3OCHCH3OH+HCH3CHO
CH3OH
4. 因为CH2=CHCH2OH能形成很稳定的碳正离子CH2=CHCH2+。
H
+
+
H
O
5.
+
O
HOHOH
6. 解释下列事实:
H
+
H
+
+
+
(CH3)3COCH
3
HI
(CH3)3C
O
-
CH3I
(CH3)3COH
+
(CH3)3COCH
3
HI
(CH3)3C
CH3O
-
(CH3)3CI
无水
水溶液
CH3OH
I
-
SN1
SN2
7. 写出下列反应的可能过程:
H+H+(1)++CC6H5C6H5RCO3H
OC6H5C6H5O
C6H
5
C6H
5
H
C6H
5
C6H
5
OH
C6H
5
C6H
5
OH
+
C6H
5
C6H
5
O
(2)
CH
CHCH
2
Cl
O
OH
-
CH
CHCH2OH
Cl
O
-
O
CH
CHCH2OH
Cl
-
8. (1)他得到的化合物为:
O
CH
3
OH
CH
3
OH
OH
OH
和
(2)正确的合成路线如下:
H
+
O
CH
3
OH
CH
3
OH
OH
CH
3
O
O
O
CH
3
CH3MgBrH+/H2O
9. 以环氧乙烷为原料合成下列化合物:
(1)
H
+
CH3CH2OH
CH3CH2OCH2CH2OHCH3CH2OCH2CH2OCH2CH2OH
O
O
H
+
H2O
(2)
H
+
HOCH2CH2OH
HOCH2CH2OCH2CH2OH
O
O
H
+
(3)
HOCH2CH2NH2HOCH2CH2NHCH2CH2OH
O
O
NH
3
10.以苯、甲苯、乙苯、环己醇和四个碳以下的有机物原料合成下列化合物:
(1)
PBr
3
H2O
H
+
CH3CH2CH2CH2BrMg乙醚CH3CH2CH2CH2MgBrHCHOCH3CH2CH2CH2CH2OH
CH3CH2CH2CH2CH2Br
(CH3)3CONa
CH3CH2CH2CH2CH2OC(CH3)
3
H2SO
4
(2)
醇
CH2CH
3
Cl2hvCHCH3ClNaOH
CH=CH
2
RCO3H
O
OH
NaOH
CHCH2O
OH
SO3H
NaOH
熔融
OH
其中
(3)
H2SO4B2H6H2O2OH-OHH2O
H+C6H5MgBrOOHC6H5OHC6H5K2Cr2O7H2SO
4
C6H
5
+
(4)
O
CNaCH3C
CCH2CH2OHCH3C
Na
CCH2CH2ONaCH3C
C6H5CH2Cl
CCH2CH2OCH2C6H5CH3C
(5)
CH2CH
3
Mg
乙醚
H2O
H
+
Br
2
Fe
BrCH3CH
2
MgBrCH3CH
2
O
CH2CH2OHCH3CH
2
CH2ClCH3CH
2
CH2OCH3CH2CH2CH=CH2H2SO4(6)OCH2CH=CH2NaOHSO3HNaOH熔融ONaCH2=CHCH2Cl200 C。OHCH2CH=CH
2
CH2CH
3
其中
HCHO
HCl/ZnCl
2
CH2ClCH3CH
2
NaOH熔融H2SO4HNO3Cl2FeOCH3NaOH2SO4(7)NaOHClO2N熔融ONa其中CH3OONO2OCH3CH3BrH2SO
4
OCH3HO3SOCH3NaO
HNO
3
H
2
Ni
(8)
NaOCH3CH=CHCH2ClOCH2CH=CHCH
3
OH
CHCH=CH
2
CH
3
OH
CHCH2CH
3
CH
3
OH
CHCH2CH
3
CH
3
CH
3
OH
CHCH2CH
3
CH
3
CH
3
NO
2
CH3OH
H3PO
4
NaOH
熔融
H2SO
4
11. A、B、C、D的可能结构式如下:
OCH3CH
3
Br
ABCD
OCH
3
CH2Br
OCH3COOH
Br
OCH2CH
3
Br
有关反应如下:
OCH
3
COOH
OCH3CH3BrABDOCH3CH2BrOCH3COOH
Br
热碱性
KMnO
4
热碱性
KMnO
4
E
OCH3CH
3
Br
A
B
OCH3CH2Br热氢溴酸OHCH
3
Br
F
热氢溴酸
OH
CH2Br
G
OCH
3
COOH
C
OCH2CH
3
Br
热氢溴酸
E
OHBr热氢溴酸COOHOH
H2OBr2Fe
NaOH
D
OCH3COOHBrCOOHHO
(CH3)2SO
4
HCl
COOHCH3O
J
