三种主要黏土矿物(高岭石、水云母、蒙脱石)的性质。
黏土矿物组成

黏土矿物组成摘要:1.引言2.黏土矿物的定义与分类3.黏土矿物的主要成分4.黏土矿物的性质与特征5.黏土矿物的形成与分布6.黏土矿物的应用7.结论正文:【引言】黏土矿物是一类广泛存在于自然界的重要矿物,它们具有独特的物理、化学和矿物学特性。
黏土矿物的研究不仅有助于我们了解地球表层系统的演化过程,还可以为各类工程和技术应用提供重要参考。
本文将对黏土矿物的组成、性质、特征、形成与分布以及应用等方面进行详细介绍。
【黏土矿物的定义与分类】黏土矿物是一类主要由硅、铝、铁等元素组成的层状硅酸盐矿物。
它们具有较低的结晶度和较广泛的分布,是地球表层系统中最常见的一类矿物。
根据黏土矿物的成分和结构特征,可以将其分为高岭石、伊利石、蒙脱石和绿泥石等主要类型。
【黏土矿物的主要成分】黏土矿物的主要成分是硅、铝和铁,它们在黏土矿物中的含量和比例决定了黏土矿物的矿物组成和性质。
其中,硅是黏土矿物的主要成分,占黏土矿物总重量的50% 以上;铝和铁则分别占20% 和10% 左右。
此外,黏土矿物中还包含少量的钾、钙、镁等元素。
【黏土矿物的性质与特征】黏土矿物具有以下特征:首先,黏土矿物的结晶度较低,一般为1-2 个晶胞层;其次,黏土矿物具有良好的塑性,能够在外力作用下发生变形;第三,黏土矿物具有较高的比表面积,能够吸附大量水分和其他物质;最后,黏土矿物具有较低的溶解度和较高的抗蚀性。
【黏土矿物的形成与分布】黏土矿物的形成主要与地球表层系统的风化、沉积和成岩作用有关。
在风化作用中,岩石中的硅酸盐矿物经过水解和离子交换等过程,形成黏土矿物;在沉积作用中,黏土矿物通过水体的搬运和沉积,形成黏土矿床;在成岩作用中,黏土矿物在高温、高压条件下发生变质,形成各类岩石。
黏土矿物广泛分布于地球表层系统,包括土壤、河流、湖泊、海洋和地下水等。
【黏土矿物的应用】黏土矿物在工程和技术领域具有广泛的应用,主要包括以下几个方面:一是作为建筑材料,如制作砖、瓦、陶器等;二是作为陶瓷工业的原料,如制作瓷器、陶器等;三是作为催化剂和吸附剂,如用于催化剂载体、废水处理等;四是作为钻井泥浆的重要成分,如提高泥浆的性能等。
高岭石简介

高岭石简介
高岭石英文名称为kaolinite,是长石和其他硅酸盐矿物天然蚀变的产物,是一种含水的铝硅酸盐。
它还包括地开石、珍珠石和埃洛石及成分类似但非晶质的水铝英石,因此叫作一它们属于粘土矿物类[1],它们总是以极微小的微晶或隐晶状态存在,并以致密块状或土状集合体产生。
高岭石为或致密或疏松的块状,一般为白色,如果含有杂质便呈米色。
高岭石经风化或沉积等作用变成高岭土,而高岭土则是制作陶瓷的原料。
除此以外,高岭土还可作化工填料、耐火材料、建筑材料等等,用途十分广泛。
中国江西的景德镇有一个高岭村,这里盛产高岭土,故名。
明末,在景德镇高岭村开采此矿,后经德国地质学家李希霍芬按高岭土之音译成“Kaolin”介绍到世界矿物学界。
高岭石属于粘土矿物,其化学组成为Al4[Si4O10]·(OH)8,晶体属三斜晶系的层状结构硅酸盐矿物。
多呈隐晶质、分散粉末状、疏松块状集合体。
白或浅灰、浅绿、浅黄、浅红等颜色,条痕白色,土状光泽。
摩氏硬度2-2.5,比重2.6-2.63。
吸水性强,和水具有可塑性,粘舌,干土块具粗糙感。
高岭石是组成高岭土的主要矿物,常见于岩浆岩和变质岩的风化壳中。
中国高岭石的著名产地有江西景德镇、江苏苏州、河北唐山、湖南醴陵等。
世界其它著名产地有英国的康沃尔和德文、法国的伊里埃、美国的佐治亚等。
高岭石是陶瓷的主要原料,在其它工业中也有广泛使用。
各种非金属矿物性质
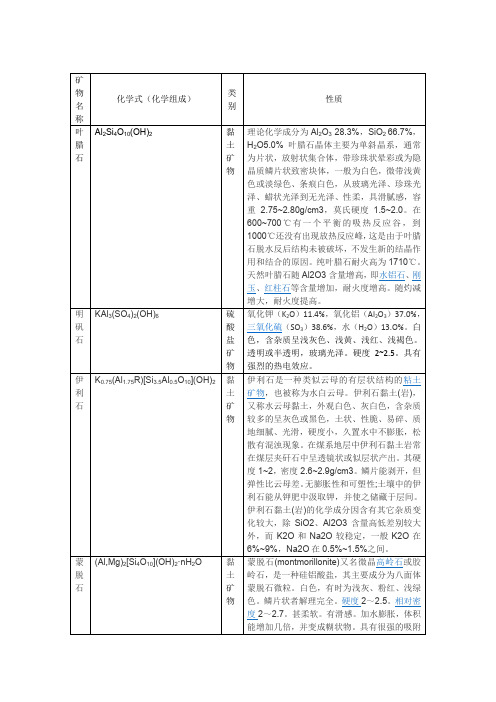
伊利石是一种类似云母的有层状结构的粘土矿物,也被称为水白云母。伊利石黏土(岩),又称水云母黏土,外观白色、灰白色,含杂质较多的呈灰色或黑色,土状、性脆、易碎、质地细腻、光滑,硬度小,久置水中不膨胀,松散有混浊现象。在煤系地层中伊利石黏土岩常在煤层夹矸石中呈透镜状或似层状产出。其硬度1~2,密度2.6~2.9g/cm3。鳞片能剥开,但弹性比云母差。无膨胀性和可塑性;土壤中的伊利石能从钾肥中汲取钾,并使之储藏于层间。伊利石黏土(岩)的化学成分因含有其它杂质变化较大,除SiO2、Al2O3含量高低差别较大外,而K2O和Na2O较稳定,一般K2O在6%~9%,Na2O在0.5%~1.5%之间。
蒙脱石
(Al,Mg)2[Si4O10](OH)2·nH2O
黏土矿物
蒙脱石(montmorillonite)又名微晶高岭石或胶岭石,是一种硅铝酸盐,其主要成分为八面体蒙脱石微粒。白色,有时为浅灰、粉红、浅绿色。鳞片状者解理完全。硬度2~2.5。相对密度2~2.7。甚柔软。有滑感。加水膨胀,体积能增加几倍,并变成糊状物。具有很强的吸附力及阳离子交换性能。热分析:在80~250°C之间出现第一个吸热谷,脱去层间水和吸附水。一般钠蒙脱石脱水温度较低,且为单吸热谷,钙蒙脱石脱水温度较高,并出现复合谷。第二个吸热谷出现于600~700°C之间,脱结构水。第三个吸热谷在800~935°C,晶格完全破坏。其后,紧接着一放热峰,有新相尖晶石和石英生成。
白云石加热到700~900℃时分解为二氧化碳和氧化钙、氧化镁的混合物,称苛性镁云石,易与水发生反应。当白云石经1500℃煅烧时,氧化镁成为方镁石,氧化钙转变为结晶a-CaO,结构致密,抗水性强,耐火度高达2300℃。
滑石
[Mg3(Si4O10)(OH)2]
高岭土的微观结构及其导致的特殊性质

高岭土的微观结构及其导致的特殊性质高岭土是一种用途广泛的黏土矿物,在陶瓷、建材、塑料等领域都有着重要应用。
它的微观结构决定了它的化学、物理、机械等性质,而这些特殊性质使得高岭土成为一种不可替代的材料。
本文将深入探讨高岭土的微观结构及其导致的特殊性质。
一、高岭土的成分及形成过程高岭土化学式为Al2Si2O5(OH)4,是一种具有层状结构的硅铝酸盐矿物。
它由正长石、云母等矿物经过侵蚀、风化等作用形成。
高岭土主要成分是二氧化硅和三氧化二铝,在其晶格中还有水分子以及一定量的其他离子。
二、高岭土的微观结构高岭土的微观结构是高岭土特殊性质的源泉。
高岭土分为层状结构和非层状结构两种类型,其中层状结构的占大部分,是高岭土最典型的结构。
高岭土的层状结构由硅氧四面体和氢氧八面体交替排列而成。
氧原子共用使硅和氢氧八面体通过共价键结合成层状结构,硅氧四面体层和氢氧八面体层之间同时存在着氢键和加里文力,这种层状结构呈现出带电的特性,层与层之间的空隙是由O层和OH层之间的间隙形成的,因此,高岭土的离子交换能力相较于其他土壤类型来说较强。
层状结构的高岭土在热力学上比较稳定,晶体内部形成微小的无定形孔道,这是由于矿物层之间的相互作用力和弱的热震荡所致,其孔径和孔隙度决定了高岭土的吸附性能和储存水分的能力,这也是高岭土优良的物理性质之一。
三、高岭土的特殊性质高岭土的特殊性质与它的微观结构密切相关,以下是关于高岭土的特殊性质和微观结构的几点讨论:1. 离子交换能力高岭土具有良好的离子交换能力,这是由于层状结构的存在,带电的层面上可吸附大量的阴离子,也能释放出相应数目的阳离子。
这种离子交换性能是其广泛应用于水净化和废水处理中的原因之一。
2. 吸附性能高岭土的层状结构孔道和表面具有良好的吸附能力,可以吸附金属离子、有机物等污染物质。
吸附性质的增强则是由于层状结构中的微小孔道,孔道的大小和组分,通过调整晶格、颗粒度和酸度来改进吸附性质。
高铝粘土的化学性质及表征方法综述

高铝粘土的化学性质及表征方法综述高铝粘土是一种重要的矿物资源,具有广泛的应用前景。
了解高铝粘土的化学性质和表征方法对于深入研究其物理性质和应用领域具有重要意义。
本文将对高铝粘土的化学性质进行综述,并介绍目前常用的表征方法。
高铝粘土的化学性质主要包括成分组成和结构特征。
高铝粘土的主要成分是硅酸盐矿物,主要有伊利石、蒙脱石、高岭石等。
其中,伊利石是一种2:1型的层状硅酸盐矿物,结构上由一个硅酸四面体层和两个铝酸八面体层组成。
蒙脱石和高岭石是一种1:1型的层状硅酸盐矿物,结构上由一个硅酸四面体层和一个铝酸四面体层组成。
高铝粘土的成分组成和结构特征直接影响其物理性质和应用领域。
了解高铝粘土的化学性质需要通过一系列的表征方法。
目前常用的表征方法包括X射线衍射(XRD)、傅里叶变换红外光谱(FTIR)、热重-差热分析(TG-DTA)、扫描电子显微镜(SEM)等。
X射线衍射是一种常用的物相分析方法,可用于确定高铝粘土的结晶相和晶体结构。
通过测量高铝粘土样品的衍射谱,可以推断出样品中主要的矿物组成和结构特征。
例如,伊利石的XRD谱图中会出现3个主要的衍射峰,对应于其层间间距的三个值。
蒙脱石和高岭石的XRD谱图中也会出现不同的衍射峰,可以用来确定其结晶相和晶体结构。
傅里叶变换红外光谱是一种用于表征高铝粘土的矿物组成和结构特征的方法。
不同的矿物组成和结构特征会在红外光谱中表现出不同的吸收峰。
通过测量高铝粘土样品的红外光谱,可以推断出样品中所含矿物的种类和结构特征。
例如,伊利石的红外光谱中会出现一个特征峰,对应于其层间结构的振动模式。
蒙脱石和高岭石的红外光谱中也会出现不同的吸收峰,可以用来确定其矿物组成和结构特征。
热重-差热分析是一种用于研究高铝粘土的热稳定性和热降解行为的方法。
通过测量高铝粘土样品的质量变化和热量释放,可以推断出样品的热稳定性和热降解过程。
例如,伊利石具有较高的热稳定性,可以在较高温度下保持其结构稳定。
粘土是一种重要的矿物原料

粘土是一种重要的矿物原料粘土是一种重要的矿物原料。
由多种水合硅酸盐和一定量的氧化铝、碱金属氧化物和碱土金属氧化物组成,并含有石英、长石、云母及硫酸盐、硫化物、碳酸盐等杂质。
粘土矿物的颗粒细小,常在胶体尺寸范围内,呈晶体或非晶体,大多数是片状,少数为管状、棒状。
粘土矿物用水湿润后具有可塑性,在较小压力下可以变形并能长久保持原状,而且比表面积大,颗粒上带有负电性,因此有很好的物理吸附性和表面化学活性,具有与其他阳离子交换的能力。
工业用粘土矿有高岭土、膨润土(主要组成为蒙脱石)、活性白土(组成不定)等。
高岭土最早由中国在江西高岭村开采,用来制造陶瓷。
膨润土于1888年在美怀俄明州开始开采,活性白土于1906年在美国得克萨斯州首次开采。
粘土矿广泛分布于世界各地的岩石和土壤中。
世界膨润土矿资源为 1.3Gt以上,主要分布于美国和加拿大。
高岭土矿储量约 1.6Gt,主要分布于中国、美国、苏联、墨西哥、西班牙等国。
中国是高岭土资源十分丰富的国家,矿质优良、成因类型齐全,主要产地有江苏苏州、湖北均县、四川叙永县等地。
活性白土主要产于美国和加拿大。
高岭土的加工大多采用湿法。
矿石经破碎、洗矿、浆化、除砂、分级、精选、漂白、过滤,最后经喷雾干燥得产品。
膨润土矿的加工仅需简单的粉碎技术以及除去水分等挥发物,先将矿石粉碎、浆化,然后采用沸腾床干燥器干燥,再经粉碎、筛分得产品。
活性白土是将膨润土脱水,加入硫酸活化、分离、水洗、过滤、干燥、粉碎后制得产品。
高岭土主要用于制造陶瓷和耐火材料。
造纸工业中使用大量高岭土作造纸填料和涂层,以提高纸张强度并降低透明度,还用于制造无碳纸。
膨润土主要用作石油钻井泥浆成分。
活性白土用于动植物油、工业用油、机械润滑油、石脑油等的漂白。
在金属加工中大量的膨润土用作金属铸造翻砂粘合剂。
另外,高岭石和多水高岭石粘土矿还可用作生产汽油的催化剂。
粘土是配制钻井液的重要原材料,它的主体矿物为粘土矿物,粘土矿物的结构和基本特性是钻井液的性能及其控制与调整密切相关。
土壤学各类土壤特征
草甸白浆土、潜育白浆土
合理利用:白浆土是吉、黑两省主要农业土壤之一,约占两省耕地面积的9%~10%。首先开垦者是白浆土亚类,可占耕地白浆土一半以上,由于地势较高,水分较适宜,垦后熟化。草甸白浆土次之,潜育白浆土因土壤过湿,开垦较晚,它们分别占耕地白浆土的32.45%和12.45%。
褐土以残积粘化为主碳酸盐母质
上述两大特点,也可称之为广义的棕壤化过程
棕壤与褐土的区别:棕壤无石灰反应
褐土有石灰反应
棕壤
分布地域:辽东半岛及山东半岛最为集中
分布地形:山地、丘陵
形成条件:
气候:
暖温带湿润气候和半湿润季风气候条件下,年均气温约5~15℃,≥10℃积温2700~4500℃,降水量为500~1200mm,干燥度在0.5~1.4之间。具有明显的季风影响,降水量主要集中于夏季。冬夏干旱,水热同步,干湿分明。
亚类划分及其特征:
(一)棕色针叶林土(66.14%)
(二)灰化棕色针叶林土
(三)表浅针叶林土
合理利用:
发展林业
暗棕壤
分布地域:东北,黑龙江,吉林,四川,青藏高原边缘
分布地形:多为中山、低山和丘陵(主要分布于500-1000 m)
形成条件:
气候:
年平均气温为-1~5℃之间,年≥10℃积温2000~3000℃,土壤冻结深度为1~2.5 m,最深可达3 m,冻结时间为120~200天。甚至有些地区季节性冻层特别明显。年降雨量600~1100mm,无霜期115~135天,属温带湿润季风气候区。这一地区年温差较大,而日温差较小,最冷月平均气温为-28℃,暗棕壤最低极值可达-45℃,最热月平均气温为15-25℃。土壤冻结时间约7个月。
母质:第四纪红色粘土、第三纪红沙岩、花岗岩、千枚岩、石灰岩、玄武岩等风化物,且较深厚
精细陶瓷——第一章:常用陶瓷原料及特性
层 [AlO2 (OH) 4] 八面体组成,四面体 的顶端均指向 [AlO2 (OH) 4] 八面体, 并和八面体共有O原子,以此进行连接 ,构成结构单位层。这种结构单位层 在c轴方向一层层重重叠排列,在a、b 轴方向无限的展开,从而构成片状高 岭石晶体,单位层厚度为7.25埃。
高岭石矿物的结构
高岭石层间由 O 和 OH -重叠在一 起,层与层之间由氢键连接着。虽 然氢键结合力较弱,但与蒙脱石类 层间O晶面的连接比起来,结合力要 强一些,因此,高岭石和蒙脱石相 比不易解理与粉碎。
粘土的可塑性
粘土的触变性 粘土的结合性
干燥收缩和烧成收缩
吸附性 粘土的烧结性
1)粘土的可塑性
粘土与适量的水混练以后形成泥团
,这种泥团在外力的作用下产生变 形但不开裂,当外力去掉以后,仍 然能保持其原有形状,粘土的这种 性质称之为粘土的可塑性,可塑性 是陶瓷塑性成型的基础。
v)碳酸盐及硫酸盐
方解石(CaCO3)、菱镁矿(MgCO3)
2H2O) 、 明 矾 石 , 石 膏 (CaSO4· (K2SO4· Al2 (SO4) 3· 6H2O)及可溶性硫 酸盐K2SO4、Na2SO4等。 硫酸盐在氧化气氛中的分解温度较高 ,容易引起坯泡。石膏还会和粘土溶 化பைடு நூலகம்成绿色玻璃质熔洞,这些都是对 陶瓷材料性能不利的成分。
2、粘土的组成
粘土的化学组成 化学组成为SiO2,Al2O3 和结晶水 (x Al2O3· y SiO2· zH2O)。
随着地质生成条件的不同,同时会含 有少量的碱土金属氧化物 Fe2O3 、 TiO2等。
粘土的化学组成在一定程度上反映其 工艺性质,对陶瓷材料的性能和制备工 艺有很大影响:
关于高岭土的详细介绍及应用资料
“高岭土(Kaolin)”一词来源于中国江西景德镇高岭村产的一种可以制瓷的白色粘土而得名。
高岭土矿是高岭石亚族粘土矿物达到可利用含量的粘土或粘土岩。
高岭土因具有许多优良的工艺性能,广泛用于造纸、陶瓷、橡胶、塑料、耐火材料,化工、农药、医药、纺织、石油、建材及国防等部门。
随着工业技术的发展和科技迅速提高,陶瓷制品的种类愈来愈多,它不仅与人们日常生活密切相关,而且在国防尖端技术的应用也很广泛,如电气、原子能、喷气式飞机、火箭、人造卫星、半导体、微波技术、集成电路、广播、电视及雷达等方面几乎都需要陶瓷制品。
可见高岭土矿产在国民经济和国防建设中所占的重要地位。
一、矿物原料特点高岭土的岩石学特征与矿物学特征相同,具有松散土状和坚硬岩石状两种外貌,其矿物成分、化学成分和粒度变化都较大。
高岭土的矿物成分由粘土矿物和非粘土矿物组成,前者主要包括高岭石、迪开石、珍珠陶土、变高岭石(1.0nm和0.7nm埃洛石)、水云母和蒙脱石;后者主要是石英、长石、云母等碎屑矿物,少量的重矿物及一些自生和次生的矿物,如磁铁矿、金红石、褐(针)铁矿、明矾石、三水铝石、一水硬铝石和一水软铝石等(表4.22.1)。
高岭石及其多型矿物迪开石和珍珠陶土同属1∶1型二八面体的层状硅酸盐,结构单元层完全相同,单位构造高度为0.7nm,层间以氢键相联结, 无水分子和离子。
它们的理想结构式为Al4[Si4O10](OH)8,理论化学成分为SiO2 46.54%、Al2O339.50%、H2O13.96%,它们之间区别在于单元层间堆叠方式不同。
高岭石为三斜晶系,一般为无色至白色的细小鳞片,单晶呈假六方板状或书册状,平行连生的集合体往往呈蠕虫状或手风琴状,粒径以0.5~2nm为主,个别蠕虫状可达数毫米。
自然界高岭土中高岭石常见,迪开石少见,珍珠陶土罕见。
变高岭石(也称埃洛石)包括1.0nm和0.7nm两种。
1.0nm埃洛石的结构特征是结构单元层与高岭石相同,但层间有一层水分子。
1粘土矿物
(五)粘土的水化膨胀作用及分散 1、表面水化膨胀——晶格膨胀 是由于粘土颗粒吸附水份子,从而形成水化膜。粘土的 内外表面水化时,水在晶层间凝结,引起晶格膨胀。
2、渗透水化膨胀
由于晶层间的阳离子浓度大于液体内部,因而水发生 浓差扩散,进入层间,因此增加晶层间距,引起渗透膨胀。
渗透膨胀引起的体积增加比晶格膨胀大得多。
2、可变(负)电荷 粘土所带电荷的数量随介质的pH值改变而改变。
原因:
(1)铝氧八面体中>Al-OH是两性的,在碱性介质中电出 H+,使粘土带负电荷; 在酸性介质中则电离出OH-,使粘土带正电荷。 一般情况下钻井液呈碱性,所以粘土带负电荷。 (2)粘土晶层在外力作用下发生断裂,则在断裂的边缘处 可能带负电,可能带正电荷。
边缘
AI-O八面体 SI-O四面体
(三)粘土-水界面的吸附作用——离子交换吸附
1、离子交换吸附:
就是一种离子被吸附的同时从吸附剂表面顶替出等电量 的带相同电荷的另一种离子的过程。 由于粘土颗粒带负电荷,它在溶液中能吸附阳离子,进 行阳离子交换吸附。离子交换吸附是经常发生的,例如:在泥 浆中2Na+ 与Ca2+ 的交换吸附,又如饱含盐水泥浆pH下降, Na+与H+的交换吸附。
•如果交换离子是Ca2+,则晶层间的静电吸引力大于晶层间 斥力,只能发生晶格膨胀,只能形成粗分散体系。
•如果是Na+则晶层间的静电吸引力小于晶层间斥力,形成水 化分散好的细分散体系。
蒙脱石水化膨胀过程
(六)粘土-水分散体系的稳定性
1、粘土颗粒表面的双电层结构 扩散双电层特点是粘土表面紧 密吸附着部分阳离子及其部分 水分子,构成了吸附溶剂化层。
它反映了粘土晶体的晶格取代度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
·
Word资料
1、试比较三种主要黏土矿物(高岭石、水云母、蒙脱石)
的性质。
(1) 高岭石(1:1型铝硅酸盐矿物)
由一个硅氧片和一个水铝片,通过共用硅氧顶端 的氧原子连接起来
的片状晶格构造。
每个晶层的一面是OH离子组(水铝片上的),另一面是O离子(硅
氧片上的),因而叠加时晶层间可形成氢键,使各晶层之间紧密相连
从而形成大颗粒,晶粒多呈六角形片状。
其分子结构外形特征为
OHOH OH .......OH
顶层 ─────────────
底层 ─────────────
O O O ........O
许多晶片相互重叠形成高岭矿物
特点:晶层与晶层间距离稳定,连接紧密,部空隙小,电荷量少,单
位个体小,分散度低。多出现于酸性土壤。如高岭石类。
高岭石的性质特点:
·
Word资料
晶格的水铝片和硅氧片很少发生同晶替代,
因此无永久性电荷。但水铝片上的--OH 在一
定条件下解离出氢离子,使高岭石带负电。
晶片与晶片之间形成氢键而结合牢固,水分子及其他离子难以进入
层间,并且形成较大的颗粒。因此其吸湿性、粘结性和可塑性较弱,
富含高岭石的土壤保肥性差。
(2)蒙脱石类( 2:1型铝硅酸盐矿物)
由两片硅氧片和一片水铝片结合成的一个晶片(层)单元,再相互叠
加而成的。
每个晶层的两面均由O离子组(硅氧片上的),因而叠加时晶层间不
能形成氢键,而是通过“氧桥”联结,这种联结力弱,晶层易碎裂,
其晶粒比高岭石小。
特点:
胀缩性大,吸湿性强,易在两边硅氧片中以Al3+代Si4+,有时可在
硅铝片中,一般以Mg2+代Al3+→带负电→吸附负离子。
如蒙脱石,这类矿物多出现于北方土壤。如东北、华北的栗钙土、
黑钙土和褐土等。
·
Word资料
(3)水云母类 (2:1型粘土矿物)
结构与蒙脱石相类似,只是同晶替代产生的负电荷主要被钾离子中和,
而少量被钙镁离子中和.
特点:
a、永久性电荷数量少于蒙脱石。
b、层与层之间由钾离子中和,使得各层相互紧密结合。形成的颗粒
相对比蒙脱石粗而比高岭石细。其粘结性、可塑、胀缩性居中。
c、钾离子被固定在硅氧片的六角形网孔中,当晶层破裂时,可将被
固定的钾重新释放出来,供植物利用。
三种主要粘土矿物的性质比较
粘土 矿物 结晶 类型 分子层 排列情况 晶格距离 (nm) 晶层间 联结力 颗粒 大小 比面 (m2•g-1) CEC (cmol(+)·kg-1) 粘结性 可塑性 胀缩性
高岭石 1:1 -OH层与O层相接 0.72 强 大 5~20 5~15 弱 弱
水云母 2:1 -O层相接中间有K 1.00 较强 中 100~120 20~40 中等 中等
·
Word资料
蒙脱石 2:1 -O层相接 0.96~2.14 弱 小 700~800 80~100 强 强
2、影响土壤阳离子交换量的因素有哪些?
1. 阳离子的交换能力
是指一种阳离子将胶体上另一种阳离子交换下来的能力。
主要决定于阳离子被胶粒吸附的力量(或称阳离子与胶体的结合强
度),它实质上是阳离子与胶体之间的静电能。
影响阳离子交换能力的因素:
a、离子电荷价 :
M3+> M2+> M+(M表示阳离子)
库仑定律:离子的电荷价越高,受胶体典型的吸持力愈大,交换能力
也越大
b、离子的半径及水化程度:
同价离子,离子半径越大,离子的水化半径越小,离子交换能力越强。
c、离子运动速度:
·
Word资料
凡离子运动速度愈大的,其交换力也愈大。例如氢离子就是这样,而
且氢离子水化很弱,通常H+只带一个水分子,即以H3O+的形态参加
交换,水化半径很小,因此它在交换力上具有特殊位置。
阳离子交换能力顺序:
Fe3 + >Al 3+ >H + >Ca2 + >Mg 2+ >K + >NH4+ >Na+
3、写出土壤具有缓冲性的原因.
1 土壤胶体的阳离子交换作用是土壤产生缓冲性的主要原因
土壤胶体吸附有H+、K+、Ca2+、Mg2+、Al3+等多种阳离子。由于这
些阳离子有交换性能,故胶体上吸附的盐基离子能对加进土壤的H+
(酸性物质)起缓冲作用,而胶体上吸附的致酸离子能对加进土壤的
OH-(碱性物质)起缓冲作用。
2 土壤溶液中的弱酸及其盐类组成的缓冲系统
土壤中的碳酸、硅酸、胡敏酸等离解度很小的弱酸及其盐类,构成缓
冲系统,也可缓冲酸和碱的变化。
如醋酸和醋酸钠盐的缓冲:
·
Word资料
CH3COOH+NaOH CH3COONa+H2O
CH3COONa+HCl CH3COOH+NaCl
3 、土壤中两性物质的存在
土壤中存有两性有机物和无机物,如蛋白质、氨基酸、胡敏酸、无机
磷酸等。如氨基酸,它的氨基可以中和酸,羧基可以中和碱,因此对
酸碱都具有缓冲能力。
4 、在酸性土壤中,铝离子也能对碱起缓冲作用
2Al(H2O)63++2OH- [Al2(OH)2(H2O)8]4++4H2O
在极强酸性土壤中(pH<4),铝以正三价离子状态存在,每个Al3+
周围有6个水分子围绕,当加入碱类时,6个水分子中即有一二个解
离出H+来中和OH-。这时带有OH-的铝离子很不稳定,与另一个相同
的铝离子结合,在结合中,两个OH-被两个铝离子所共用,并且代替
了两个水分子的地位,结果这两个铝离子失去两个正电荷。
