全自动电位滴定仪测试锰酸锂正极材料中锰含量的方法
全自动电位滴定法测定锂电池原料碳酸锂中主成分的含量

Vol. 11, No. 270 〜74第11卷第2期2021年4月中国无机分析化学ChineseJournalofInorganicAnalyticalChemistrydoi :10. 3969". itsn. 2095-1035. 2021. 02. 015全自动电位滴定法测定锂电池原料碳酸锂中主成分的含量邓• 欧阳志勇1邓飞跃2"(1.江西省锂电产品质量监督检验中心,江西宜春,336000;2.中南大学化学与化工学院,长沙,410000)摘要采用全自动电位滴定法测定锂电池原料碳酸锂中主成分的含量,用盐酸标准溶液进行滴定,考 虑自动电位滴定仪的灵敏性和准确度,通过多次对比实验,确定了仪器的最佳工作参数、滴定剂浓度和样品称样量等滴定条件;对两个不同品位试样分别进行了 11次平行测定,相对标准偏差(RSD)均小于 1% $在碳酸锂试样中加入基准物质无水碳酸钠进行碳酸根的加标回收实验,碳酸根的加标回收率在 99.4%〜100%。
与传统的酸碱滴定法相比,全自动电位滴定法方便、快捷,同时方法测定结果准确、可靠、精密度高,适合大批量样品快速分析$ 关键词 锂离子电池;碳酸锂;全自动电位滴定法中图分类号:O655. 2;TH744. 11文献标志码:A文章编号= 2095-1035(2021)02-0070-05Determination of Principal Components in Battery Lithium Carbonate by Automatic Potentiometric Titration MethodDENG Bei 1 ,OUYANG Zhiyong ,DENG Feiyue 2*(9. Jiangxi Province Lithium Product Quality Supervision and Inspection Center ,Yichun ,Jiangxi 336000,China *2. College of Chemistry and Chemical Engineering ,Central South University ,Changsha ,Hunan 410000,China )Abstract The main components in lithium carbonate were determined by automatic potentiometric titrationmethod.Thestandardsolutionofhydrochloricacidwasusedasthetitrator.Consideringthesensitivityandaccuracy oftheautomaticpotentiometrictitrator the optimum operating parameters the titrator concentration and thesample weight were determined through several comparative experiments. The relative standard deviations (RSD ) of two di f erent grade samples werelessthan1% for11 para l el measurements.Asrecoverytests anhydroussodium carbonate were added as standard materials to the lithium carbonate samples and the recovery of carbonate ions were in the range of 99. 4%——100%. Compared with the double indicator titration method ,the automaticpo7eniome7ric iraion me7hodisconvenien7andfas.A77hesame ime 7his me7hodisaccura7e reliableandprecise. It is suitable for rapid analysis of large quantities of samples.Keywords lithium ion ; lithium carbonate ; automatic potentiometric titration收稿日期:2020-06-04修回日期:2020-07-01作者简介:邓蓿,女,工程师,主要从事理化检验研究$ E-mail :beibei_4_21@163. com"通信作者:邓飞跃,男,教授$ E-mail : 520175284@qq. com引用格式:邓蓿,欧阳志勇,邓飞跃•全自动电位滴定法测定锂电池原料碳酸锂中主成分的含量中国无机分析化学,2021 11 2):70-74FDENG Bei ,OUYANG Zhiyong ,DENG Feiyue. Determination of Principal Components in Battery Lithium Carbonate byAutomatic Potentiometric Titration Method[J'Chinese Journal of Inorganic Analytical Chemistry ,2021,11(2): 70-74.第2期邓舊,等:全自动电位滴定法测定锂电池原料碳酸锂中碳酸锂的含量71■>I—1—刖_锂离子电池具有比能量大、工作电压高、循环寿命长、安全性能好、自放电小、质量轻和环境友好等优点&'。
任务三锰矿石中锰含量的测定知识目标
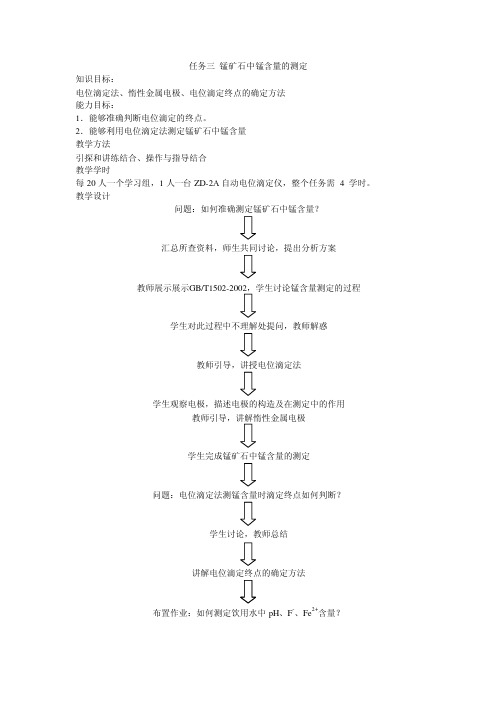
任务三锰矿石中锰含量的测定知识目标:电位滴定法、惰性金属电极、电位滴定终点的确定方法能力目标:1.能够准确判断电位滴定的终点。
2.能够利用电位滴定法测定锰矿石中锰含量教学方法引探和讲练结合、操作与指导结合教学学时每20人一个学习组,1人一台ZD-2A自动电位滴定仪,整个任务需 4 学时。
教学设计问题:如何准确测定锰矿石中锰含量?汇总所查资料,师生共同讨论,提出分析方案教师展示展示学生对此过程中不理解处提问,教师解惑教师引导,讲授电位滴定法学生观察电极,描述电极的构造及在测定中的作用学生完成锰矿石中锰含量的测定问题:电位滴定法测锰含量时滴定终点如何判断?学生讨论,教师总结讲解电位滴定终点的确定方法布置作业:如何测定饮用水中pH、F-、Fe2+含量?教案课程引入由问题引入教学:问题:锰含量是锰矿石的技术指标之一,那么该如何测定呢? 学生根据所查资料分组讨论并提出解决方案。
答案:原子吸收光谱法、电位分析法、分光光度法等。
比较优劣,引出本次课程的教学任务:“电位滴定法测定锰矿石中锰含量”展示GB/T1502-2002,学生分组讨论实验过程。
知识点讲解-1 Ø 电位滴定法 ² 定义:电位滴定法是利用滴定过程中指示电极电位的突跃来确定滴定终点的一种电化学容量分析方法。
² 比较电位滴定法与直接电位法和化学滴定法的区别 与化学滴定法的区别 定量参数不同 与直接电位法的区别确定滴定终点方法不同² 基本原理:开始滴定时,随着滴定剂的不断加入,待测离子与滴定剂之间发生化学反应,被测离子浓度发生相应的变化。
由于指示电极的电位与被测离子浓度有关,因此,指示电极的电位也相应发生变化。
在化学计量点附近,被测离子浓度发生突变,指示电极的电位也相应发生突变。
根据电池电动势的变化,可以判断滴定终点。
² 实验装置:指示电极:铂电极、参比电极:双液接甘汞电极、滴定管、酸度计、电磁搅拌器、搅拌子² 滴定方法:组装仪器装置后,将滴定剂装入滴定管,调节好零点,准确移取一定量试液于滴定池中,插入电极,开启电磁搅拌器和直流毫伏计,读取初始电动势(或pH )后开始滴定。
镍钴锰酸锂化学分析方法
镍钴锰酸锂化学分析方法
镍钴锰酸锂化学分析方法
镍钴锰的测定
A1范围
本方法规定了锂离子电池正极材料镍钴锰酸锂中镍钴锰的测定方法
A.2方法提要
试样经盐酸溶解后,用原子吸收光谱仪测量镍.钴.锰.的含量
A.3试剂
A.3.1盐酸(1+1).硫酸(1+5).浓硝酸.双氧水
A.3.2镍.钴.锰标准贮存溶液:1000μg/mL(国家标准溶液)
A.3.3标准溶液
A.3.3.1镍.钴.锰的标准溶液浓度为1μg/mL、2μg/mL、3μg/mL、4μg/mL,由标准储备液(A.3.2)逐级稀释而得到。
A.4仪器
原子吸收光谱仪乙炔空气火焰法测定镍钴锰元素含量的参考工作条件见下表(A.1)(以使用瀚时CAAM2001型为例)
表A.1
A 5试样
准确称取锂离子电池材料0.1000克于100毫升烧杯中,用少量水润湿。
加入盐酸5 毫升,盖上表面皿后,置于电加热板上加热溶解,(若有不溶物补加双氧水数滴)。
待样品完全溶解后取下,冷却。
用蒸馏水冲洗表面皿,转入100毫升容量瓶中,定容。
然后按实验方法测定。
A6实验方法
在相应的仪器条件工作下,根据正极材料中镍钴锰的含量,分别移取一定体积的镍钴锰标准溶液于50毫升容量瓶中,用水稀释至刻度,摇匀,用蒸馏水做空白实验。
偏转燃烧头或采取次灵敏线,依次测定吸光度值。
A7分析结果的计算
根据标准溶液和试液的吸光度值,由计算机绘制工作曲线并计算出所测元素的质量分数。
锰酸锂检验标准

图a
图a
图1-4.1XXLiMn2O4SEM图,图a为×4000;图b为×1000
图1-4.2 XXLiMn2O4的XRD图
附页(5)
XX锰酸锂检验标准
检验项目
规格
形貌
XRD
振实密度(g/cm3)
压实密度(g/cm3)
比表面积(m2/g)
粒径分布(um)
D10
D50
D90
DMAX
ZHM01
图1-5.1
电池型号:053048S
3、极片的最大压实密度的测试方法参见
附页V.
4、每种材料的检测标准由研发中心在引进时进行确定。
A
≥95×2.50(250)
说明:做来料检验时最大压实密度比应用的2.50g/cm3压实密度数值大0.05以上,克比容量发挥比应用的95mAh/g克比容量大0.5以上。在划分档次时,克比容量和压实密度必须同时满足要求。
图1-5.2
≥2.0
≥2.6
0.2-1.1
≥2.0
12-20
≤40
≤65
图a
图a
图1-5.1XXLiMn2O4SEM图,图a为×4000;图b为×1000
图1-5.2XXLiMn2O4的XRD图
图1-3.2 XXLiMn2O4的XRD图
附页(4)
XX锰酸锂(RDF16)检验标准
检验项目
规格
形貌
XRD
振实密度(g/cm3)
压实密度(g/cm3)
比表面积(m2/g)
粒径分布(um)
D10
D50
D90
DMAX
RDF16
图1-4.1
图1-4.2
≥2.0
≥2.60
三元正极材料中镍钴锰含量的化学分析测定
三元正极材料中镍钴锰含量的化学分析测定作者:安浩娜来源:《科学与信息化》2020年第18期摘要镍钴锰酸锂是一种高性能、高前景的锂离子电池正极材料,分析研究镍、钴、锰的含量对三元正极材料影响有重大意义。
受制于化学分析法、AAS法的缺陷,本文通过采用EDTA滴定的方式进行试验操作,试验结果表明,该方法操作简单,试验数据准确度高[1]。
关键词三元正极材料;EDTA滴定;化学分析法1 实验部分1.1 主要仪器与试剂仪器:磁力数显恒温磁力搅拌器,厂家:常州高德仪器制造有限公司,型号:85-2C。
试剂:(1)水:二次去离子。
(2)EDTA、过氧化氢(分析纯),厂家:东海县富彩矿物制品有限公司。
(3)N-苯代邻氨基苯甲酸、盐酸羟胺、硫酸亚铁铵、紫脲酸胺、硝酸、高氯酸、稀硫酸、磷酸(分析纯),厂家:济南普莱华化工有限公司。
1.2 实验方法(1)镍、钴、锰三元合量的质量摩尔浓度的测定准备150mL烧杯,依次加入样品0.29g、少量水、盐酸5mL,低温加热至煮沸,冷却,倒入100mL容量瓶定容,在300mL三角瓶分别加入10mL溶液。
加入50°C水40mL、盐酸羟胺1g并用氨水将PH数值调到7后加入PH=10缓冲液10mL,预滴定采用EDTA,至终点前0.5~1mL加入0.05g紫脲酸铵(1%)继续滴定,直到溶液呈亮紫色,然后计算三元合量的质量摩尔浓度m三元。
(2)锰的质量摩尔浓度的测定准备150mL烧杯,依次加入样品0.29g、少量水以及盐酸5mL,低温加热至煮沸,冷却,用100mL容量瓶定容,在125mL三角瓶分别加入10mL溶液。
将饱和焦磷酸钠15mL和磁力搅拌子加入溶液中,加入硫酸将溶液的pH调为6.5~7.5即可。
将溶液放在准备好的电位滴定仪上,指示电极用铂电极,参比电极用锰电极表示,终点的滴定采用高锰酸钾标准溶液操作,终点时也计算锰的质量摩尔浓度mMn。
(3)镍的质量摩尔浓度的测定准备150mL烧杯,依次加入样品0.5g、少量水以及盐酸5mL,低温加热沸腾,冷却,溶液到入100mL容量瓶定容,在150mL烧杯中分别加10mL溶液。
溶液中锰含量的测定方法

溶液中锰含量的测定方法引言锰是一种重要的金属元素,广泛存在于自然界中。
溶液中锰含量的测定方法对于环境科学、化学工业以及医学等领域具有重要意义。
本文将介绍几种常见的溶液中锰含量的测定方法,并对其原理、步骤以及应用进行详细阐述。
一、分光光度法1. 原理分光光度法是一种通过测量溶液中物质吸收或透射光的强度来确定物质浓度的方法。
在溶液中,锰离子会吸收可见光,而吸收光的强度与溶液中锰离子的浓度成正比关系。
根据比尔定律,吸光度与溶液中物质浓度之间存在线性关系。
2. 步骤•准备一系列不同浓度的锰标准溶液,使用紫外可见分光光度计测量每个标准溶液的吸光度。
•绘制吸光度与锰标准溶液浓度的标准曲线。
•测量待测溶液的吸光度,并利用标准曲线计算出锰离子的浓度。
3. 应用分光光度法广泛应用于环境监测、水质分析以及化学工业中锰含量的测定。
二、电化学法1. 原理电化学法是通过测量电极在溶液中的电位变化来确定物质浓度的方法。
在锰溶液中,锰离子可以在电极上发生氧化还原反应,通过测量电极电势的变化可以确定锰离子的浓度。
2. 步骤•准备工作电极和参比电极,并将其插入待测溶液中。
•通过施加电位或电流来促使锰离子在电极上发生氧化还原反应。
•测量电极电势的变化,并利用标准曲线计算出锰离子的浓度。
3. 应用电化学法广泛应用于电池、蓄电池以及金属材料中锰含量的测定。
三、原子吸收光谱法1. 原理原子吸收光谱法是一种通过测量物质吸收特定波长的光的强度来确定物质浓度的方法。
在溶液中,锰离子会吸收特定波长的紫外光,吸收光的强度与溶液中锰离子的浓度成正比关系。
2. 步骤•准备一系列不同浓度的锰标准溶液,使用原子吸收光谱仪测量每个标准溶液的吸收光强度。
•绘制吸收光强度与锰标准溶液浓度的标准曲线。
•测量待测溶液的吸收光强度,并利用标准曲线计算出锰离子的浓度。
3. 应用原子吸收光谱法广泛应用于环境监测、食品安全以及地质勘探等领域中锰含量的测定。
四、比色法1. 原理比色法是一种通过测量溶液中物质溶解后所产生的颜色强度来确定物质浓度的方法。
电位滴定仪的使用方法 滴定仪操作规程
电位滴定仪的使用方法滴定仪操作规程电位滴定仪是依据电位法原理设计的用于容量分析的常见的一种分析仪器,通过测量电极电位变化,来测量离子浓度。
也可用于pH 值或电极电位的掌控滴定以及pH和电位测定。
准备工作1.安装好滴定装置,在试杯中放入搅拌棒,并将试杯放在JB—1A搅拌器上。
2.电极的选择:取决于滴定时的化学反应假如是氧化还原反应,可采纳铂电极和甘汞电极和钨电极;如属中和反应,可用pH复合电极或玻璃电极和甘汞电极;如属银盐与卤素反应,可采纳银电极和特别甘汞电极。
电位自动滴定1.尽头设定:“设置”开关置“尽头”,“pH/mV”开关置“mV”,“功能”开关置“自动”,调整“尽头电位”旋钮,使显示屏显示你所要设定的尽头电位值。
尽头电位选定后,“尽头电位”旋钮不可再动。
2.预控点设定:预控点的作用是当离开尽头较远时,滴定速度很快,当到达预控点时,滴定速度很慢。
设定预控点就是设定预控点到达尽头的距离。
其步骤如下:“设置”开关置“预控点”,调解“预控点”旋钮,使显示屏显示你所需要的预控点数值。
例如:预控点为100mV,仪器将在离尽头100mV处转为慢滴。
预控点选定后,“预控点”调解旋钮不可再动。
3.尽头电位和预控点电位设定好后,将“设置”开关置“测量”,打开搅拌器电源,调解转速使搅拌从慢速加快至适当转速。
4.掀一下“滴定开始”按钮,仪器即开始滴定,滴定灯闪亮,滴液快速滴下,在接近尽头时,滴定减慢。
到达尽头时,滴定灯不再闪亮,过10s左右,尽头灯亮,滴定结束。
注意:到达滴定尽头后,不可再掀“滴定开始”按钮,否则仪器将认为另一极性相反的滴定开始,而连续进行滴定。
5.记录滴定管中滴液的滴液的消耗读数。
自动电位滴定仪的使用介绍自动电位滴定仪重要用于化验室的容量分析,同时又能精准地显示溶液的PH计值;仪器安装连接好以后,插上电源线,打开电源开关,电源指示灯亮。
经15分钟预热后再使用。
1mV测量1“设置”开关置“测量”,“pH/mV”选择开关置“mV”;2将电极插入被测溶液中,将溶液搅拌均匀后,即可在读取电极电位(mV)值;3假如被测信号超出仪器的测量范围,显示屏会不亮,作超载报警。
电位滴定法测定矿石中锰的含量
电位滴定法测定矿石中锰的含量
刘红平
【期刊名称】《新疆有色金属》
【年(卷),期】2013(036)005
【摘要】锰矿石中锰的测定方法很多.重量法因手续繁冗,已经不再采用.电位滴定法已被列为国家标准分析方法,在锰的测定中获得了广泛的应用.基于氧化还原反应的容量法均是先用氧化剂将锰(Ⅱ)氧化,再用还原剂滴定,然后用高锰酸钾返滴定.用硝酸铵将二价锰氧化为三价,再用硫酸亚铁铵标准溶液滴定氧化锰至高价,再用硫酸亚铁铵标准溶液滴定的容量法至今应用仍很普遍.本次研究中的电位滴定锰的方法是基于试样经盐酸、硝酸(氢氟酸)和高氯酸处理后,以焦磷酸钠配合共存的干扰离子,调节pH为6.5~7.5,用高锰酸钾标准溶液滴定.
【总页数】2页(P72-73)
【作者】刘红平
【作者单位】新疆维吾尔自治区有色地质勘查局704队哈密839000
【正文语种】中文
【相关文献】
1.不同氧化法—硫酸亚铁铵滴定法测定锰矿石、硫酸锰中锰含量 [J], 卢燕;黄忠
2.火焰原子吸收光谱法测定矿石中锰的含量 [J], 杨杰
3.火焰原子吸收光谱法测定矿石中锰的含量 [J], 杨杰;
4.自动电位滴定法测定铁矿石中全铁含量 [J], 李艳霞;李敏;谢红;欧阳丽
5.电位滴定法测定铁矿石中水溶性氯化物含量 [J], 王虹;李权斌;马德起
因版权原因,仅展示原文概要,查看原文内容请购买。
电位滴定操作方法
电位滴定操作方法
电位滴定是一种常用的化学分析方法,适用于定量测定溶液中的物质含量。
下面是电位滴定的一般操作方法:
1. 准备滴定液:将需要滴定的物质溶解在适量的溶剂中,并进行适当的稀释,以得到合适浓度的滴定液。
2. 准备滴定仪器:将电位滴定仪器(如滴定管、电位计)进行校准,确保它们能够准确测量滴定过程中的电位变化。
3. 准备被滴定溶液:将需要滴定的溶液放入一个装有磁子的烧杯或容量瓶中。
4. 开始滴定:通过滴定管,滴加滴定液到被滴定溶液中,同时用电位计测量溶液的电位。
5. 判断滴定终点:滴定过程中,滴定液的加入会引起被滴定溶液的电位发生变化。
当溶液的电位发生明显的跳变时,说明滴定终点已经到达。
6. 计算结果:根据滴定液的浓度和滴定过程中所加入的滴定液的体积,可以计算出被滴定溶液中所含物质的含量。
需要注意的是,每个滴定方法的具体操作细节可能会有所不同,因此在进行电位
滴定之前,最好参考相应的滴定方法手册,按照指导操作。
自动电位滴定法测定fe2+实验报告
自动电位滴定法测定fe2+实验报告
实验目的:使用自动电位滴定法测定Fe2+的浓度。
实验原理:自动电位滴定法是一种电化学分析方法。
它利用电流与电势之间的关系,通过向溶液中滴加标准溶液,控制电位变化来测定待测溶液中的物质含量。
实验步骤:
1. 预处理:将所需玻璃仪器清洗干净,使其干燥;
2. 准备标准溶液:称取0.025mol/L的KMnO4溶液和0.2mol/L的
H2SO4溶液,混合,用去离子水定容至1L,摇匀;
3. 将待测Fe2+溶液和标准KMnO4溶液各取10mL,加入预处理好的电极中,同时加入1~2mL的三乙胺,开始滴定;
4. 在滴定过程中,记录滴定电压和溶液体积,直至滴定结束;
5. 用公式计算Fe2+的浓度:C(Fe2+)= (V2 –V1)×C1/V1×n,其中V1为待测溶液体积,C1为KMnO4溶液浓度,V2为滴定终点体积,n 为KMnO4溶液中含有的Fe2+的当量数。
实验结果:对10 mL的待测Fe2+溶液滴加了9.8 mL的
0.025mol/L KMnO4溶液,计算得到Fe2+的浓度为:C(Fe2+)= (9.8-0)×0.025/0.01×5 = 12.25mol/L。
实验结论:本实验使用自动电位滴定法测定了Fe2+的浓度,可得到较准确的结果。
但需注意滴定过程中要控制好滴液速度,以免出现误差。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全自动电位滴定仪测试锰酸锂正极材料中锰含量的方法朱玉巧【摘要】The contents of Mn in LiMn2O4cathode material were detected by automatic potentio-metric titration method with two chemical analysis methods of(NH4)2Fe(SO4)2titration and Na2EDTA titration.By contrast with the experiments,the results of the test were the same,but with theNa2EDTA titration the time of the sample processing was less,the operation was simp-ler and the reaction was more easier controlling than with the(NH4)2Fe(SO4)2titration.The rel-ative standard deviation of the Na2EDTA titration was less than 0.2%,and the recovery of Mn standard was between 98.92% ~100.5%,which met the accuracy requirement.The method of Na2EDTA titra-tion could be used to detect the contents of Mn in the LiMn 2O4cathode material production.%采用自动电位滴定法,分别用硫酸亚铁铵滴定和Na2EDTA滴定化学分析测试方法,测定锰酸锂正极材料中锰的含量.通过两种测试方法试验对比发现,两种测试方法的结果一致,但Na2EDTA滴定法具有样品处理耗时短,操作简单,反应过程易控制等优势,且该测试方法的相对标准偏差不大于0.2%,锰的回收率在98.92% ~100.5% 之间,精确度和准确度都能达到要求,适用于规模化锰酸锂正极材料生产中锰含量的快速分析.【期刊名称】《电池工业》【年(卷),期】2018(022)001【总页数】3页(P3-5)【关键词】锰酸锂;锰含量;自动电位滴定法;化学分析【作者】朱玉巧【作者单位】浙江瓦力新能源科技有限公司,浙江慈溪 315100【正文语种】中文【中图分类】TQ137.121 前言锰酸锂正极材料中锰的含量对电极材料的电化学性能有着直接的影响,所以在其工业生产中需对锰酸锂的前驱体,中间体和成品中的锰含量进行及时、快速、准确的检测。
目前,锰含量的化学分析检测方法主要有两种:一是采用硫酸亚铁铵氧化还原滴定法,二是采用Na2EDTA络合滴定法。
在传统手工滴定试验中,发现以肉眼观察指示剂颜色变化作为滴定终点判断依据时,Na2EDTA滴定二价锰溶液时终点颜色突变不明显[1],在实际检测工作中很难应用,因此目前主要采用硫酸亚铁铵滴定法,但硫酸亚铁铵标准溶液的稳定性受光照、温度等环境因素的影响较大[2],每次测试前必须标定,直接影响了锰含量的测试效率。
本文用全自动电位滴定代替手工滴定[3-4],分别用两种测试方法测定锰含量,通过对比试验发现,以电位值作为滴定终点判断依据时,Na2EDTA络合滴定法测定结果具有很高的精确度和准确度,且操作过程比硫酸亚铁铵滴定法的简单易控,能满足规模化生产时对锰含量的测试需求,能有效地对锰酸锂正极材料的生产过程进行质量控制。
2 实验部分2.1 实验原理2.1.1 硫酸亚铁铵测定锰含量原理锰酸锂中的Mn以Mn3+和Mn4+的形式存在,经硝酸溶解后,Mn以Mn2+的形式存在于溶液中,在220℃~270℃的热磷酸介质中,过量的固体硝酸铵能将Mn2+全部氧化成Mn3+,再用硫酸亚铁铵标准溶液滴定,将Mn3+还原成Mn2+。
2.1.2 Na2EDTA测定锰含量原理用盐酸和双氧水加热溶解锰酸锂时,Mn能以Mn2+的形式稳定存在于溶液中。
溶解完成后,常温下加入盐酸羟胺,作用有:(1)掩蔽其他杂质金属离子[5],(2)在pH=10的氨水-氯化铵的缓冲溶液中,Mn2+与OH-发生可逆反应生成Mn(OH)2,盐酸羟胺具有还原性,可防止Mn2+及Mn(OH)2被氧化。
Na2EDTA标准溶液滴定过程中,Mn2+的浓度逐渐减小,可逆反应往生成Mn2+的方向进行,直至溶液中所有的Mn2+与Na2EDTA络合反应形成稳定的锰的络合物。
2.1.3 全自动电位滴定仪工作原理选用适当的指示电极和参比电极,与待测溶液组成一个工作电池。
在滴定过程中,待测离子浓度不断变化,指示电极的电位也会随之变化。
在滴定终点附近,待测离子的浓度发生突变,引起电极电位的突跃,当电位突跃大于门限值后形成等当点值,根据消耗的体积值,仪器自动计算,直接显示测试结果。
2.2 试剂及仪器C-MAG HS10型恒温磁力搅拌器、Metrohm 848型电位滴定仪(瑞士万通公司)。
磷酸、浓硫酸、硝酸铵、硫酸亚铁铵、盐酸、双氧水、盐酸羟胺、氨水、乙二胺四乙酸钠(Na2EDTA)、二次去离子水。
2.3 实验方法2.3.1 硫酸亚铁铵滴定法准确称取0.1g试样(精确到0.00001g),于250ml烧杯中,加入10ml磷酸、5ml浓硝酸,置于磁力搅拌器上270℃恒温加热,待溶液液面有白烟冒出时,趁热加入3g硝酸铵[6],晃动烧杯,加速棕色气体排出,待反应完全从磁力搅拌器上取下,冷却至70℃~80℃,加入100ml二次去离子水,选用铂电极作为指示电极,用0.03mol/L硫酸亚铁铵标准溶液滴定至等当点。
2.3.2 Na2EDTA滴定法准确称取0.5g试样(精确到0.00001g),置于100ml烧杯中。
加入10ml盐酸(1+1)、2mlH2O2后[7],放置在磁力搅拌器上270℃恒温加热,至完全溶解并除去过量的H2O2。
待溶液冷却后,定容到100ml容量瓶中,用移液管移取25ml溶液至250ml烧杯中,加入5ml的10%盐酸羟胺溶液、pH=10的氨水-氯化铵缓冲溶液、100ml二次去离子水,选用铜电极为工作电极,汞电极作为指示电极,用0.03mol/L Na2EDTA标准溶液滴定至等当点。
3 现象及结果分析3.1 样品处理过程对比a 溶解温度对测定结果的影响b 氧化温度对测定结果的影响图1 硫酸亚铁铵滴定法样品处理过程中温度对检测结果的影响Fig.1 The influence of temperature during sample processingby (NH4)2Fe(SO4)2 titration硫酸亚铁铵滴定法:用硝酸和磷酸溶解样品,磷酸会粘在烧杯底部,为防止液体受热飞溅出来,需不时摇动烧杯;样品溶液为深紫色,需仔细观察样品是否溶解完全;溶解温度对检测结果有直接影响,如图1(a)所示,当溶解温度低于270℃时,溶解不完全,测试结果偏低,当溶解温度高于270℃时,有白色焦磷酸锰沉淀生成,检测结果偏低;氧化温度对测试结果也有直接影响,如图1(b)所示,当温度低于230℃时,氧化反应不完全,检测结果偏低,当温度高于230℃时,硝酸铵易分解,氧化也不完全,检测结果偏低;样品处理过程耗时大于1h。
Na2EDTA滴定法:用盐酸(1+1)和双氧水溶解样品,加热时双氧水分解释放出氧气,能够加快盐酸溶解的速度,约15min后溶液变得清亮透明,溶解程度非常容易观察。
如图2所示,溶解温度对测试结果影响不大。
图2 Na2EDTA滴定法样品处理过程中温度对检测结果的影响Fig.2 The influence of temperature during sample processing by Na2EDTA titration 3.2 两种测试方法结果对比分别选取锰酸锂正极材料的前驱体、中间体、成品3组样品进行对比测试,每组样品平行测定3次,方法允差为0.5%,结果见表1。
表1 两种方法结果对比Tab.1 The results compared with two methods样品编号硫酸亚铁铵滴定法Na2EDTA滴定法测定值%平均值%测定值%平均值%两种方法测定结果之差%171.0271.1871.2771.1771.0571.1271.2171.130.04256.6056.4256.6356.5 556.5756.7856.6756.67-0.12359.6759.5059.7659.6459.6259.4259.5059.510.13比较表1数据可知,使用全自动电位滴定仪测试时,Na2EDTA滴定法的测试结果与硫酸亚铁铵滴定法的一致,都在允差0.5%的范围之内,都可以作为锰含量的测试方法。
3.3 Na2EDTA滴定法精密度实验选择2个样品,按照Na2EDTA滴定法测定锰含量各9次,结果见表2。
表2 Na2EDTA滴定法精密度实验结果Tab.2 Precision experimental results of Na2EDTA titration样品编号含量%平均值%标准偏差%相对标准偏差%156.4856.3956.4956.5856.6956.6056.6356.6156.3756.540.1110.196259. 6459.6159.5459.6959.5359.6559.4559.6859.7259.610.0890.149由表2可知,Na2EDTA滴定法测试锰含量的相对标准偏差不大于0.2%,具有很高的精密度。
3.4 Na2EDTA滴定法加标回收率实验选择2个样品,按照Na2EDTA滴定法处理样品后,分别加入不同含量的锰标准标液,进行回收率实验,结果见表3。
表3 回收率实验结果Tab.3 Results of recovery experiment元素样品中锰含量/mg锰的加入量/mg测定值/mg回收量/mg回收率/%Mn56.5814.8871.5414.96100.529.7586.2829.7099.8359.6114.8874.3314.7 298.9229.7589.2729.6699.70由表3可知,锰的回收率在98.92%~100.5%之间,说明Na2EDTA滴定法测试锰的准确度较高。
4 结论采用全自动电位滴定仪测试锰酸锂正极材料中的锰含量时,通过Na2EDTA滴定法与硫酸亚铁铵滴定法的对比试验发现,两种方法的测试结果一致,硫酸亚铁铵滴定法用磷酸加硝酸溶解样品,过程缓慢,溶解程度不易观察,反应温度不易控制,而Na2EDTA滴定法采用盐酸加双氧水溶解样品,具有处理耗时短,操作简单,反应过程易控制等优势,且该测试方法的相对标准偏差不大于0.2%,锰的回收率在98.92%~100.5%之间,精确度和准确度都能达到要求,因此,Na2EDTA滴定法更适用于规模化锰酸锂正极材料生产中锰含量的快速测试。
