2019年高中化学第二章第2节离子反应及其发生的条件(含解析)
高一化学年第2章 第2节离子反应 第1课时课件

_________________( NaCl===Na++Cl- 为简便起见,仍用离子符号表示水合离子)。
第二章 第二节 第1课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修1
HCl===H++Cl- HCl的电离方程式:______________________________ ;
提示: 带电粒子的定向移动就可以形成电流,像电子、 阴离子、阳离子等。金属内的电子本来就是自由电子,当外 加电场时可以定向移动形成电子流而导电。氯化钠晶体内虽
然有阴阳离子,但不能自由移动,即使有外加电场,也不能
定向移动形成电流。而氯化钠在熔融态或在水溶液中,吸收 了来自热或水分子作用等外界的能量,而离解出自由移动的 钠离子和氯离子,即发生了电离,当外加电场作用时,离子 从自由移动状态改为分别向两极定向移动而形成带电离子
+ 2- H SO ===2H + SO 2 4 4 H2SO4的电离方程式:___________________________ ; + - HNO ===H + NO HNO3的电离方程式:____________________________ 。 3 3
3.从电离的角度认识酸、碱、盐 (1)酸:电离时生成的阳离子____________ 全部是H+ 的化合物。
第二章
第二节
第1课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修1
新情境· 激趣入题
第二章
第二节
第1课时
成才之路 ·高中新课程 ·学习指导 ·人教版 ·化学 ·必修1
物理学上,根据能否导电,可将物体分为导体和绝缘 体。化学上,根据在水溶液里或熔融状态下能否导电,可将 化合物分为电解质和非电解质。学习电解质及其相互间反应 的知识,对于认识物质及其变化具有十分重要的作用。
高中化学第二章化学物质及其变化第2节离子反应第2课时离子反应及其发生的条件高一化学

_无__明__显__现__象___
__产__生__白__色__沉__淀_____
第八页,共二十八页。
反应前溶 液中微粒
Na+、SO24- K+、Cl-
Na+、SO24- Ba2+、Cl-
混合液中微粒
Na+、SO24-、K+、 Cl-
3 __B_a_S__O_4_____、Na+、Cl-
离子之间的 反应
2021/12/11
第二十四页,共二十八页。
(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消 化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围 内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病 人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为 _____________________________________________。 ②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分 是 Al(OH)3]反应的离子方程式为___________________________。
2021/12/11
第十二页,共二十八页。
(3)意义 ①表示某一个具体的化学反应。 AgNO3+NaCl===AgCl↓+NaNO3 该反应可表示为 12 _A_g_+_+ ___C_l_-_=_=_=_A_g_C__l↓__。 ②表示同一类型的离子反应。如 13 __H_+_+__O__H_- __=_=_=_H_2_O_可以 表示强酸和可溶性强碱生成水和可溶性盐的反应。
第十六页,共二十八页。
解析:选 C H++OH-===H2O 代表强酸和可溶性强碱反应 生成可溶性盐和 H2O 的反应,A、B、D 均符合;而 C 项中 Cu(OH)2 为难溶性弱碱,应写成 Cu(OH)2 形式。
高中化学必修一第二章第二节 离子反应
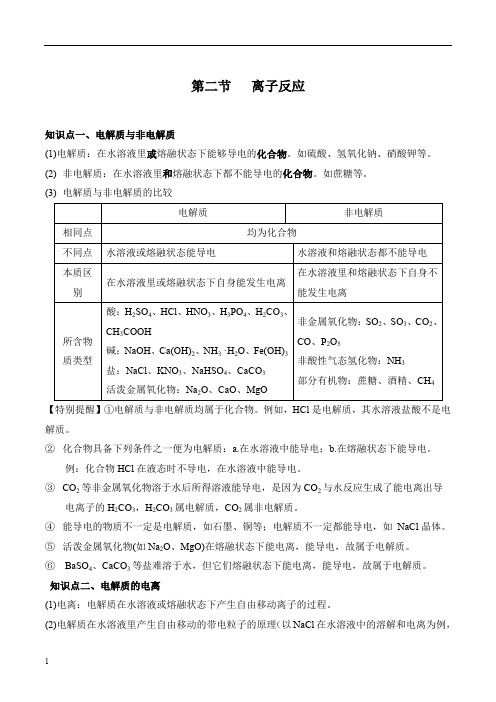
第二节离子反应知识点一、电解质与非电解质(1)电解质:在水溶液里或熔融状态下能够导电的化合物。
如硫酸、氢氧化钠、硝酸钾等。
(2) 非电解质:在水溶液里和熔融状态下都不能导电的化合物。
如蔗糖等。
(3) 电解质与非电解质的比较电解质非电解质相同点均为化合物不同点水溶液或熔融状态能导电水溶液和熔融状态都不能导电本质区别在水溶液里或熔融状态下自身能发生电离在水溶液里和熔融状态下自身不能发生电离所含物质类型酸:H2SO4、HCl、HNO3、H3PO4、H2CO3、CH3COOH碱:NaOH、Ca(OH)2、NH3 ·H2O、Fe(OH)3盐:NaCl、KNO3、NaHSO4、CaCO3活泼金属氧化物:Na2O、CaO、MgO非金属氧化物:SO2、SO3、CO2、CO、P2O5非酸性气态氢化物:NH3部分有机物:蔗糖、酒精、CH4【特别提醒】①电解质与非电解质均属于化合物。
例如,HCl是电解质,其水溶液盐酸不是电解质。
②化合物具备下列条件之一便为电解质:a.在水溶液中能导电;b.在熔融状态下能导电。
例:化合物HCl在液态时不导电,在水溶液中能导电。
③CO2等非金属氧化物溶于水后所得溶液能导电,是因为CO2与水反应生成了能电离出导电离子的H2CO3,H2CO3属电解质,CO2属非电解质。
④能导电的物质不一定是电解质,如石墨、铜等;电解质不一定都能导电,如NaCl晶体。
⑤活泼金属氧化物(如Na2O、MgO)在熔融状态下能电离,能导电,故属于电解质。
⑥BaSO4、CaCO3等盐难溶于水,但它们熔融状态下能电离,能导电,故属于电解质。
知识点二、电解质的电离(1)电离:电解质在水溶液或熔融状态下产生自由移动离子的过程。
(2)电解质在水溶液里产生自由移动的带电粒子的原理(以NaCl在水溶液中的溶解和电离为例,如下图所示):(3)电解质导电的原因电解质导电的前提条件是电解质能产生自由移动的离子,还必须具备一定的外因条件,就是溶于水或受热使电解质呈熔融状态。
高中化学 离子反应

(3)解释小灯泡在实验过程中随着CO2气体通入时的变 化。(证据推理与模型认知)
提示:灯泡先变暗后熄灭,因为发生了CO2+Ca(OH)2 ====CaCO3↓+H2O,溶液中自由移动的离子减少。 灯泡熄灭后又逐渐变亮 :CaCO3+CO2+H2O====Ca(HCO3)2, Ca(HCO3)2完全电离出自由移动的离子,溶液中离子 浓度增大。
如Na2CO3与稀硫酸反应:C +H+====CO2↑+H2O( )
C +2H+====CO2↑+H2O( ) O32
×
(如4O钠)32看 与是稀否硫遵酸守反电应荷:N守a+恒2H√+====Na++H2↑( )
2Na+2H+====2Na++H2↑( )
×
√
(5)看是否漏掉参加反应的离子
如CuSO4与Ba(OH)2溶液反应:Ba2++S ====BaSO4↓( ) Ba2++S +Cu2++2OH-====BaSO4↓+CuO(24OH)2↓( ) ×
评价
正确
错误,反应物 和产物的配 比不正确
按要求完成下列化学用语:
1、(水溶液中)电离方程式:醋酸、碳酸、碳酸氢钠、 一水合氨(NH3.H20)、硫酸氢钠、氢氧化镁、NH4Fe(SO4)2 以下写离子方程式: 2.硫酸氢钠溶液逐滴滴加到氢氧化钡溶液中,至呈中性 3.硫酸铜溶液逐滴滴加到氢氧化钡溶液中,至Cu2+沉淀完全 4.氯气的尾气处理 5.过氧化钠固体加入到水中 6.钠与水的反应 7.醋酸溶液与碳酸氢钠溶液反应 8.碳酸氢钠溶液与澄清石灰水(物质的量1:1)反应
人教版高一化学必修1第二章第2节离子反应PPT(共21页)

人教版高一化学必修1第二章第2节离 子反应( 共21张 PPT)
ห้องสมุดไป่ตู้
人教版高一化学必修1第二章第2节离 子反应( 共21张 PPT)
书写离子方程式
氯气溶于水
⑴ 写:正确书写化学方程式 Cl2 + H2O = HCl + HClO
⑵ 拆:将易溶于水、易电离的物质拆成离子形式 Cl2 + H2O = H+ + Cl- + HClO
NH4+ + OH-
离子反应
硫酸钾溶液与氯化钡溶液反应
K2SO4 + BaCl2 = BaSO4 ↓ + 2KCl
K2SO4 = 2K+ + S﹢O42-
BaCl2 = 2Cl - + Ba2+
BaSO4↓
反应的实质是钡离子和硫酸根离子的反应
Ba2+ + SO42- = BaSO4 ↓ 有离子参加的反应称离子反应
人教版高一化学必修1第二章第2节离 子反应( 共21张 PPT)
人教版高一化学必修1第二章第2节离 子反应( 共21张 PPT)
离子方程式可表示同一类型的离子反应
H2SO4 + BaCl2 = BaSO4 ↓ + 2HCl K2SO4 + BaCl2 = BaSO4 ↓ + 2KCl Na2SO4 + BaCl2 = BaSO4 ↓ + 2NaCl ZnSO4 + BaCl2 = BaSO4 ↓ + ZnCl2 Na2SO4 + Ba(NO3)2 = BaSO4 ↓ + 2NaNO3 K2SO4 + Ba(NO3)2 = BaSO4 ↓ + 2KNO3 MgSO4 + Ba(NO3)2 = BaSO4 ↓ + Mg(NO3)2 上列反应的离子方程式均是: Ba2+ + SO42- = BaSO4↓
第二章第2节 离子反应(共75张PPT)

的电离方程式为 NaHSO4===Na +HSO4
+
-
。
②多元弱酸酸式盐,第一步完全电离,其余部分电离。 如:NaHCO3===Na++HCO3-,HCO3-
[特别提醒]
H++CO32-。
(1)单质和混合物既不是电解质也不是非电解
质,如Cu、NaCl溶液。 (2)必须是由本身电离而导电的化合物才是电解质,如 CO2、SO2、NH3的水溶液能导电,但它们属于非电解质。
H +S2
+
-
。
②多元弱碱分步电离,但一步写出。 如
Cu(OH)2 Cu2++2OH-
。
③两性氢氧化物双向电离。例如Al(OH)3的电离方程式:
H +AlO2 +H2O
+ OH
+
-
。
(3)酸式盐 ①强酸酸式盐完全电离,一步到底。NaHSO4在水溶液中
2 的电离方程式为 NaHSO4===Na +H +SO4 ,在熔融状态下
追本溯源拓认知
知识点一
强电解质和弱电解质
1.强电解质、弱电解质
电 在水溶液中 解―――――→ 或熔融 质
全部电离强电解质包括:强酸 、 强碱 、 ――→ 活泼金属的氧化物 、 大部分盐 部分 电离 弱酸、弱碱
――→ 弱电解质包括:
及水
2.电离方程式的书写 (1)强电解质:完全电离,用===表示。如H2SO4、NaOH、 (NH4)2SO4的电离方程式分别
。
检查方程式两边是否符合 原子 守恒和 电荷 守恒。
[特别提醒]
(1)易溶、易电离的物质(可溶性强电解质,包
括强酸、强碱、可溶性盐)以实际参加反应的离子符号表示;非 电解质、弱电解质、难溶物、气体、单质、氧化物均用化学式 表示。 (2)离子方程式书写中,浓硫酸不能拆写成离子形式,而浓 硝酸、浓盐酸要拆写成离子形式。 (3)多元弱酸的酸式酸根不能拆写成离子形式,如NaHCO3 不能拆写成“Na++H++CO32-”。
【鼎尖教案】高中化学第二节离子反应的本质(第二课时)
第二课时[引言]上节课我们学习了离子反应的本质和离子反应发生的两个条件,本节课我们来继续学习离子反应发生的条件。
[板书]第二节离子反应的本质(第二课时)二、离子反应发生的条件[师]请大家先做以下练习。
[投影练习]写出下列反应的离子方程式1.实验室制CO2的反应。
2.用Na2SO3和稀硫酸反应制SO2气体。
3.(NH4)2SO4的浓溶液和NaOH的浓溶液混合。
[请一位同学上黑板书写][学生板书]CaCO3+2H+===CO2↑+H2O+Ca2+SO-23+2H+===SO2↑+H2ONH+4+OH-===NH3↑+H2O[问]上述离子反应为何能发生?[生]因为生成了易挥发性的物质。
[师]很正确!这也是离子反应发生的又一条件。
[板书]3.生成易挥发性物质[讲解]中学化学中常见的挥发性物质主要有CO2、SO2、NH3、H2S等。
其中,CO2、SO2既是挥发性物质,也是难电离物质(H2CO3、H2SO3)进一步分解而生成的产物。
因此,生成CO2、SO2等挥发性物质的反应,与生成相应的难电离物质的反应在本质上是相同的。
[讨论]实验室制氨气的反应物Ca(OH)2和NH4Cl均为离子化合物?它们之间的反应能否用离子方程式表示?分析它们反应的环境与我们前面所学离子反应的例子有何不同?[学生回答讨论结果]甲:Ca(OH)2和NH4Cl均为离子化合物,它们反应的实质是离子发生了互换,因为有离子参加的反应就是离子反应,故能用离子方程式表示。
乙:不能用离子方程式表示,因为Ca(OH)2和NH4Cl中的离子均处于固态物质中,而我们前面所学离子反应均是在溶液中进行的。
它们所处环境不同,所以不能用同一形式表示。
[师]大家讲得都有道理。
在我们所接触的化学反应中,有些离子化合物在固体状态下也能够发生离子反应,但由于固态物质的离子不能自由移动,所以一般不写离子方程式。
除此之外,固体与浓硫酸之间的反应也不写离子方程式,因浓硫酸中主要是硫酸分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子反应及其发生的条件(建议用时:45分钟)1.下列不是离子反应的是( )A.氢气与氧气点燃生成水B.硝酸银溶液中加入氯化钠溶液生成白色沉淀C.CuO与稀盐酸反应D.二氧化碳使澄清石灰水变浑浊2.下列各组物质相互混合后,不会发生离子反应的是( ) A.NaOH溶液和CuCl2溶液B.Na2CO3溶液和稀硫酸C.Na2SO4溶液和MgCl2溶液D.Ca(OH)2溶液和盐酸3.加入适量的硫酸溶液,可使溶液中下列离子数量显著减少的是()A.Cl-B.Ba2+C.NO错误!D.Na+4.离子方程式Ba2++SO错误!===BaSO4↓它可能表示()①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应③稀硫酸与可溶性钡盐溶液之间的反应④氢氧化钡溶液与稀硫酸反应A.①②B.①②④C.②③D.①②③5.下列离子反应方程式相对应的化学方程式正确的是()A.Cu2++2OH-===Cu(OH)2↓CuCO3+2NaOH===Cu(OH)2↓+Na2CO3B.Ba2++SO错误!===BaSO4↓Ba(OH)2+H2SO4===BaSO4↓+2H2OC.Ag++Cl-===AgCl↓AgNO3+NaCl===AgCl↓+NaNO3D.Cu+2Ag+===Cu2++2Ag↓Cu+2AgCl===2Ag+CuCl26.下列离子方程式正确的是( )A.碳酸镁和盐酸反应:CO错误!+2H+===H2O+CO2↑B.向氢氧化钡溶液中加硫酸溶液:Ba2++SO错误!===BaSO4↓C.向稀盐酸溶液中加铁:2Fe+6H+===2Fe3++3H2↑D.向硝酸银溶液中加盐酸:Ag++Cl-===AgCl↓7.某无色溶液中,可大量共存的离子组是( )A.Na+、HCO错误!、SO错误!、Br-B.Cu2+、NO错误!、Cl-、SO错误!C.H+、Cl-、K+、CO错误!D.K+、Mg2+、SO2-,4、OH-8.在酸性的无色透明溶液中,能大量共存的离子组是( )A.Al3+、Ag+、NO错误!、Cl-B.Mg2+、NH错误!、NO错误!、Cl-C.Na+、K+、CO2-3、Cl-D.Cu2+、Na+、NO-,3、SO错误!9.一种无色溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,则该溶液中含有的离子是()A.一定溶有SO2-,4B.一定溶有CO2-3C.一定有Ag+D.可能有SO错误!10.下列各组中两溶液间的反应,不可用同一离子方程式表示的是( )A.HCl+Zn,Zn+NaHSO4B.Cu(OH)2+H2SO4,Cu(OH)2+HNO3C.CaO+HCl,CaO+HNO3D.BaCl2+NaHSO4,Ba(OH)2+NaHSO411.(1)书写下列反应的离子方程式①NaOH溶液和H2SO4溶液:______________________________________;②NaCl溶液和AgNO3溶液:_______________________________________;③Ba(OH)2溶液和H2SO4溶液:____________________________________;④Fe与CuSO4溶液反应:_________________________________________;⑤Na2CO3溶液与Ca(OH)2溶液反应:________________________________。
(2)写出下列离子方程式相应的化学方程式①CO错误!+2H+===CO2↑+H2O:_____________________________________②Cu2++2OH-===Cu(OH)2↓:______________________________________③Ba2++SO错误!===BaSO4↓12.某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
(1)写出制取过程中反应的离子方程式:____________________________________________________________________________________ _________。
(2)请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器).①用蒸馏水完全溶解CaCl2后,加入__________________________________;②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-;③加入__________________,使沉淀完全溶解;④____________________,得到纯净的硝酸钙晶体.13.下列反应的离子方程式书写正确的是( )A.将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+===Ca2++H2O+CO2↑B.向CuSO4溶液中加入NaOH溶液:Cu2++2OH-===Cu(OH)2↓C.将Cu丝插入AgNO3溶液中:Cu+Ag+===Cu2++AgD.向KHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性:H ++SO错误!+Ba2++OH-===H2O+BaSO4↓14.铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。
图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )A.OH-+HCl===H2O+Cl-B.Ca(OH)2+Cu2+===Ca2++Cu(OH)2C.Fe+Cu2+===Cu+Fe2+D.Fe+2H+===Fe3++H2↑15.某无色溶液既可能是强酸性又可能是强碱性,在该溶液中一定能大量共存的离子是()A.H+Na+MnO-,4SO错误!B.Na+CO2-3Al3+Cl-C.K+Na+Cl-SO2-,4D.K+Cl-Ba2+HCO错误!16.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。
请填写下列空白:(1)不做任何实验就可以肯定原溶液中不存在的离子是________.(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。
说明原溶液中,肯定存在的离子是________,有关离子方程式为______________________________________________________ _________。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有________,有关的离子方程式为______________________________.(4)原溶液可能大量存在的阴离子是下列的________。
A.Cl-B.NO错误!C.CO错误!D.OH-参考答案与解析1。
【解析】离子反应是指有离子参加或生成的反应,发生的条件是:生成难溶物或水或挥发性物质。
B、C、D符合以上条件。
A项氢气与氧气的反应是分子之间的反应。
【答案】A2. 【解析】各选项所给物质均为电解质溶液,可电离出自由移动的离子。
是否能够发生离子反应,可根据是否生成难溶性物质、难电离物质、挥发性物质来进行判断。
Na2SO4溶液和MgCl2溶液混合后,不具备上述条件,故二者不会发生离子反应。
【答案】C3. 【解析】此题有助于理解离子反应发生的条件:生成沉淀、气体或水.加入硫酸后硫酸根离子与Ba2+生成沉淀。
【答案】B4. 【解析】④中还存在OH-与H+反应生成H2O的反应。
【答案】D5。
【解析】A项,CuCO3不溶于水,与NaOH不反应;B 项,漏掉了H+与OH-的反应;D项,AgCl不溶于水,与Cu不反应。
【答案】C6。
【解析】离子方程式首先要符合化学反应事实;其次因为它是化学方程式的一种特殊形式,即遵循质量守恒定律和电荷守恒定律;第三因为它反映的是离子反应的本质,所以须按电离的实际进行拆写。
A项中碳酸镁不应拆写;B项中还有水,不应拆写后抵消;C项不符合化学反应的事实,因为铁只能被氢离子氧化为亚铁离子.【答案】D7。
【解析】B项,Cu2+有颜色;C项,H+与CO2-3不能共存;D项,Mg2+与OH-不能共存。
【答案】A8。
【解析】A项中Ag+和Cl-可以生成沉淀而不能大量共存;B项中各离子之间不能发生反应,能大量共存;C项中CO错误!和H+生成气体而不能大量共存;D项中各离子能大量共存,但Cu2+有颜色。
【答案】B9。
【解析】与氯化钡能生成白色沉淀的有很多,但不溶于硝酸的只有氯化银和硫酸钡,所以溶液中可能是SO2-,4或是Ag+。
【答案】D10。
【解析】D项中,BaCl2和NaHSO4反应的离子方程式为Ba2++SO错误!===BaSO4↓,Ba(OH)2和NaHSO4反应的离子方程式为Ba2++OH-+H++SO错误!===BaSO4↓+H2O。
【答案】D11。
【答案】(1)①H++OH-===H2O②Cl-+Ag+===AgCl↓③Ba2++2OH-+2H++SO错误!===BaSO4↓+2H2O④Fe+Cu2+===Fe2++Cu⑤CO2-3+Ca2+===CaCO3↓(2)①Na2CO3+2HCl===2NaCl+CO2↑+H2O②CuCl2+2NaOH===2NaCl+Cu(OH)2↓③BaCl2+Na2SO4===2NaCl+BaSO4↓12. 【解析】题目要求最终制得纯净的硝酸钙晶体,从提供的试剂看发生反应的离子方程式应为:Ca2++CO错误!===CaCO3↓,CaCO3+2H+===Ca2++CO2↑+H2O。
其实验步骤:加入Na2CO3使CaCl2转化为CaCO3沉淀,过滤洗涤后在沉淀中加HNO3溶解生成的Ca(NO3)2,再用蒸发结晶的方法制得纯净的Ca(NO3)2。
【答案】(1)Ca2++CO错误!===CaCO3↓,CaCO3+2H+===Ca2++CO2↑+H2O(2)①碳酸钠溶液③稀硝酸④蒸发结晶13。
【解析】A项,醋酸不能拆开,错误;C项,电荷不守恒,错误;D项,Ba2+和OH-不符合1∶2的组成关系。
【答案】B14. 【解析】A项中HCl应拆为离子的形式,正确的离子方程式为OH-+H+===H2O;B项中Ca(OH)2应拆为离子形式,应为Cu2++2OH-===Cu(OH)2↓;D项中应生成Fe2+,不应为Fe3+,应为Fe+2H+===Fe2++H2↑。
【答案】C15。
【解析】A项,MnO-,4是紫红色;B项,酸性时CO错误!+2H+===CO2↑+H2O,碱性时Al3+生成沉淀;D项,酸性时HCO-3+H+===CO2↑+H2O,碱性时HCO错误!+OH-===CO错误!+H2O。
【答案】C16. 【解析】(1)无色透明溶液中不可能含有Cu2+、Fe3+有色离子.(2)加盐酸有不溶于稀硝酸的白色沉淀生成,则肯定存在Ag+,离子方程式为Ag++Cl-===AgCl↓。
