由环戊酮和碳原子的有机物合成
有机化学各大名校考研真题第十二,十三章

12-1试为下述反应建议合理的,可能的分布反应机理:O CH 3OCH3OHCH3ONaCH3OO解:钠醇攻击羰基,打开碳氧双键,形成烷氧负离子,同时OCH3加到碳原子上,电子发生转移后,环断裂,同时另一个环上的酮异构为烯醇式结构,再成环即得到产物。
机理过程为:OOOCH3OO OCH3CH3COOCH3O CCH3O OOCH3 CH3O OCH3OCH3HO OOCH3OCH3O12-2反应机理推断 1)CHO+CH 3NO 2NaOHC HCHNO 2(2)C OR 'CH 2R+HCHO +HN(CH 3)2HCOR 'H C RCH 2N(CH 3)2解(1)硝基甲烷在碱性条件下失去一个质子形成碳负离子,碳负离子为亲核试剂,攻击羰基使电子转移形成氧负离子,得到一个质子后氧负离子变为羟基,脱去一分子水形成双键,得到所求产物,反应机理如下:OHCH 3NO 2OHCH 2NO 2+CH 2NO2C OHCH 2NO2C OH HCH 2NO 2H 2OCH CHNO 2(2)甲醛与仲胺发生加成反应,羟基在酸性条件下脱去形成双键和氮原子,酮异构为烯醇结构,电子转移后发生亲核加成得到产物,过程为:H 2CO+HN(CH 3)2H 2COHN(CH 3)2HH 2CN +(CH 3)2COR 'CH 2RHCCHROHR'H 2CN(CH 3)2COHR 'H C CH 2N(CH 3)2RCR 'H C OHRCH 2N(CH 3)2-H +12-3对下列反应提出合理解释。
OO+OEtONaOO解; 该题涉及两个反应,分别为碳负离子与羰基加成以及碳负离子与αβ不饱和烯烃的迈克尔加成反应,均为碳负离子机理。
机理为:OOEtO -OOOOOEtO -OOO OHO O-H 2OOOO12-4用合理分步的反应机理解释下列反应事实:OOOHOHHOO解:环状缩酮中的一个O 结合H 开环生成羟基,另一个收H 2O 攻击,碳氧双键断裂。
环类物质连接基团

环类物质连接基团环类物质是一类化学物质,其分子结构中含有环状结构的基团。
这些环状结构可以通过不同的连接基团与其他化合物相结合,形成多种不同的化合物。
环类物质连接基团的种类繁多,每一种连接基团都有其独特的性质和应用领域。
一种常见的环类物质连接基团是芳香环基团。
芳香环基团是由连续的碳原子构成的环状结构,具有高度的稳定性和特殊的化学性质。
芳香环基团可以与其他化合物中的基团发生取代反应,形成新的化合物。
例如,苯环基团可以与氨基基团发生取代反应,形成氨基苯化合物,具有重要的生物学活性。
另一种常见的环类物质连接基团是环酮基团。
环酮基团是由碳氧原子构成的环状结构,具有独特的化学性质。
环酮基团可以与其他化合物中的基团发生加成反应,形成新的化合物。
例如,环戊酮基团可以与氰基基团发生加成反应,形成氰基环戊酮化合物,具有广泛的应用领域。
环类物质连接基团还包括环氧基团、环胺基团、环醚基团等。
环氧基团是由氧原子和两个相邻的碳原子构成的环状结构,具有活泼的化学性质。
环氧基团可以与其他化合物中的基团发生环氧化反应,形成新的化合物。
环胺基团是由氮原子和相邻的碳原子构成的环状结构,具有碱性和亲电性。
环胺基团可以与其他化合物中的基团发生胺基取代反应,形成新的化合物。
环醚基团是由氧原子和两个相邻的碳原子构成的环状结构,具有稳定性和特殊的化学性质。
环醚基团可以与其他化合物中的基团发生醚化反应,形成新的化合物。
环类物质连接基团的多样性为化学合成和药物研发提供了丰富的资源。
研究人员可以通过合成环类物质连接基团的方法,设计和合成具有特定功能和活性的化合物。
例如,通过在芳香环基团中引入不同的取代基团,可以改变化合物的溶解性、稳定性和生物活性。
通过在环酮基团中引入不同的官能团,可以改变化合物的反应性和选择性。
通过在环氧基团中引入不同的官能团,可以改变化合物的环氧化活性和稳定性。
环类物质连接基团是一类重要的化学基团,具有广泛的应用领域。
研究人员可以利用环类物质连接基团的多样性,设计和合成具有特定功能和活性的化合物,推动化学合成和药物研发的进展。
[指南]环戊酮的制备
![[指南]环戊酮的制备](https://img.taocdn.com/s3/m/33a7202c86c24028915f804d2b160b4e767f8168.png)
4.6 环戊酮的制备一、实验目的1.学习用己二酸脱羧制备环戊酮的原理和方法。
2.学习盐浴的使用方法及反应过程中的蒸馏操作。
二、实验原理实验室中常用的脂肪酮是通过相应的仲醇氧化制备得到的。
最常用的氧化剂有重铬酸钾(钠)与浓硫酸的混合物、三氧化铬的冰醋酸溶液等。
环状的酮还可以通过二元酸的脱水、脱羧反应制备。
如己二酸和庚二酸受热时既脱水又脱羧可分别得到环戊酮和环己酮。
本实验采用二元酸的脱水、脱羧反应制备环戊酮:三、实验用品50ml、100ml圆底烧瓶各1只,蒸馏头1只,尾接管1只,直形冷凝管1根,50ml锥形瓶2只,200℃温度计1支。
己二酸(C.P),氢氧化钡(C.P),碳酸钾(C.P),无水碳酸钾(C.P)。
四、实验步骤将22g(约0.15mol)的己二酸粉末与2g氢氧化钡在研钵中混合均匀后置于100ml圆底烧瓶中,装配蒸馏装置,把温度计插入圆底烧瓶中(温度计末端距瓶底约0.5cm),50ml的锥形瓶置于冰水浴中接收馏出物。
用熔融的盐浴[1]小心加热进行脱羧反应。
维持反应温度在285~295℃之间[2],带有水和少量己二酸的环戊酮慢慢蒸出,直至瓶内仅有少量残渣为止。
在馏出液中加入适量K2CO3粉末,振摇锥形瓶,直至水层饱和。
将其移至分液漏斗中,静置后分去水层,有机层置于50ml干燥的锥形瓶中,用无水K2CO3干燥过夜。
将干燥后的粗产品滤入50ml圆底烧瓶中,用石棉网加热蒸馏,收集128~131℃的馏分。
称量,计算产率。
纯环戊酮的b.p为130.6℃,nD20为1.4366。
注释[1]盐浴由等量的硝酸钾和硝酸钠混合而成,将混合盐置于蒸发皿中。
使用时应倍加小心,勿使熔融的盐触及皮肤。
[2]若温度过高,未作用的己二酸将被大量蒸出。
思考题1.除用二元酸脱羧的方法外,还有什么方法可用于制备环戊酮?写出反应方程式。
2.为什么馏出液要先用K2CO3饱和后再进行分离?。
高三化学有机物的命名试题

高三化学有机物的命名试题1.苯有多种同系物,其中一种结构简式为:,则它的名称为()A.2,4-二甲基-3-乙基苯B.1,3-二甲基-2-乙基苯C.1,5-二甲基-6-乙基苯D.2-乙基-1,3-二甲基苯【答案】B【解析】以苯为母体,将苯环上最简单的取代基(甲基)所连的碳原子编为“1”号,然后顺时针或逆时针编号,使取代基位置编号之和最小。
2.某烯烃与H2加成后得到2,2-二甲基丁烷,该烯烃的名称是()A.2,2-二甲基-3-丁烯B.2,2-二甲基-2-丁烯C.2,2-二甲基-1-丁烯D.3,3-二甲基-1-丁烯【答案】D【解析】先由烷烃的名称写出结构简式为3.下列有机物名称正确的是A.氨基丁酸B.2-羟基-3-甲基-戊烷C.1,2-二甲苯D.3-乙基-1-丁炔【答案】C【解析】A.未说明氨基的位置,错误。
B.主体应该是醇,错误。
C.1,2-二甲苯,正确。
D.正确名称是1-戊炔,错误。
【考点】本题主要考查有机物的命名。
4.下列有机物的命名正确的一组是()A.二溴乙烷B.3-乙基-1-丁烯C.2-甲基-2,4-己二烯D.2-甲基-1-丙醇【答案】C【解析】烷烃的命名原则是:找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙...)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷;从最近的取代基位置编号:1、2、3...(使取代基的位置数字越小越好)。
以数字代表取代基的位置。
数字与中文数字之间以-隔开;有多个取代基时,以取代基数字最小且最长的碳链当主链,并依甲基、乙基、丙基的顺序列出所有取代基;有两个以上的取代基相同时,在取代基前面加入中文数字:一、二、三...,如:二甲基,其位置以 , 隔开,一起列于取代基前面。
如果含有官能团,则含有官能团的最长碳链作主链,编号也是从离官能团最近的一端开始。
所以选项C正确,ABD分别应该是1,2-二溴乙烷、3-乙基-1-戊烯、2-丁醇,答案选C。
5.下列说法正确的是A.羟基的电子式为:.B.结构中含有酯基C.顺- 2-丁烯和反-2-丁烯的加氢产物不同D.HCO3-的水解方程式为:HCO3-+H2O CO32-+H3O+【答案】B【解析】羟基是个缺电子基团,A错误。
醛类有机化合物的氧化还原反应方程式汇总

醛类有机化合物的氧化还原反应方程式汇总醛类有机化合物是一类含有醛基(-CHO)的化合物,其分子结构中的碳原子与一个氧原子和一个氢原子相连。
氧化还原反应是有机化学中常见的一种反应类型,醛类有机化合物也可以参与氧化还原反应,并产生相应的产物。
本文汇总了一些常见的醛类有机化合物的氧化还原反应方程式。
1. 乙醛的氧化反应方程式:CH₃CHO + [O] → CH₃COOH2. 丙醛的氧化反应方程式:CH₃CHCHO + [O] → CH₃CHCOOH3. 叔丁醛的氧化反应方程式:(CH₃)₃CCCHO + [O] → (CH₃)₃CCCOOH4. 苯甲醛的氧化反应方程式:C₆H₅CHO + [O] → C₆H₅COOH5. 戊醛的氧化反应方程式:CH₃(CH₂)₃CHO + [O] → CH₃(CH₂)₃COOH6. 环戊酮的还原反应方程式:C₆H₁₀O + 2H₂ → C₆H₁₀OH7. 焦糖的氧化反应方程式:C₁₂H₂₂O₁₁ + 12[O] → 12CO₂ + 11H₂O8. 乙醛的还原反应方程式:CH₃CHO + H₂→ CH₃CH₂OH9. 甲醛的氧化反应方程式:HCHO + [O] → HCOOH10. 己醇的氧化反应方程式:CH₃(CH₂)₄OH + [O] → CH₃(CH₂)₄COOH需要注意的是,醛类有机化合物的氧化还原反应方程式中,氧化剂"[O]"可以是氧气(O₂)或者其他能够提供氧原子的化合物,而还原剂通常是氢气(H₂)或者其他能够提供氢原子的化合物。
这些方程式只是一些常见的反应,实际上醛类有机化合物可以参与多种不同的氧化还原反应。
总结:本文汇总了常见的醛类有机化合物的氧化还原反应方程式,这些方程式显示了醛类有机化合物在氧化还原反应中的转化过程。
在进行这些反应时,需要根据具体的实验条件选择适当的氧化剂和还原剂。
通过了解这些反应方程式,可以进一步理解醛类有机化合物的性质和反应特点。
高中化学-有机合成专题训练(五)
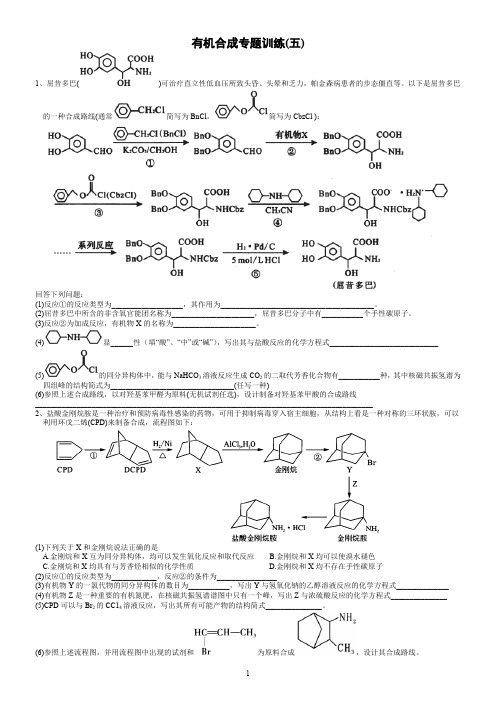
有机合成专题训练(五)1、屈昔多巴()可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等。
以下是屈昔多巴的一种合成路线(通常简写为BnCl,简写为CbzCl ):回答下列问题:(1)反应①的反应类型为___________________,其作用为_________________________________________。
(2)屈昔多巴中所含的非含氧官能团名称为______________________,屈昔多巴分子中有___________个手性碳原子。
(3)反应②为加成反应,有机物X的名称为______________________。
(4)显______性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式_____________________________(5)的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有___________种,其中核磁共振氢谱为四组峰的结构简式为_________________________________(任写一种)(6)参照上述合成路线,以对羟基苯甲醛为原料(无机试剂任选),设计制备对羟基苯甲酸的合成路线__________________________________________________________________________________________2、盐酸金刚烷胺是一种治疗和预防病毒性感染的药物,可用于抑制病毒穿入宿主细胞,从结构上看是一种对称的三环状胺,可以利用环戊二烯(CPD)来制备合成,流程图如下:(1)下列关于X和金刚烷说法正确的是A.金刚烷和X互为同分异构体,均可以发生氧化反应和取代反应B.金刚烷和X均可以使溴水褪色C.金刚烷和X均具有与芳香烃相似的化学性质D.金刚烷和X均不存在手性碳原子(2)反应①的反应类型为____________,反应②的条件为________________(3)有机物Y的一氯代物的同分异构体的数目为___________,写出Y与氢氧化钠的乙醇溶液反应的化学方程式______________(4)有机物Z是一种重要的有机氮肥,在核磁共振氢谱谱图中只有一个峰,写出Z与浓硫酸反应的化学方程式_______________(5)CPD可以与Br2的CC14溶液反应,写出其所有可能产物的结构简式_______________。
有机合成邻氯苯基环戊酮反应机理的概述

合成邻氯苯基环戊酮的反应机理:以邻氯苯甲酰氯为主要原料,以无水三氯化铝作为催化剂、苯和1,2-二氯乙烷作为溶剂、与环戊烯发生加成反应,经一系列后处理,然后经减压蒸馏提纯而得到邻氯苯基环戊酮。
还有一条路线是邻氯苯腈为主要原料,通过溴代环戊烷,镁粉,乙醚或者四氢呋喃,合成格氏试剂环戊烷基溴化镁,然后加入邻氯苯晴,经减压蒸馏提纯得到邻氯苯基环戊酮。
以邻氯苯甲酰氯为主要原料的方法,收率低,质量时好时坏,不稳定,操作麻烦。
以邻氯苯腈为主要原料的方法,格氏试剂合成,特别怕水,对无水环境要求苛刻。
要在无水和无氧的环境下用惰性气体(氮气,氩气)做保护进行反应,溶剂要求十分严格,而且对温度要求比较高,温度控制不好,活性很强,不容易停留在酮这一步,会进一步反应成醇或醛,实际操作比第一种方法困难。
两者相对对比一下,还是前者相对简单,因此在这里我们主要讲解以邻氯苯甲酰氯为主要原料的方法。
而以邻氯苯甲酰氯为主要原料合成邻氯苯基环戊酮这个工艺技术,也经历了第一代,第二代,第三代的改进。
最早在上世纪20年代,工艺中用的是苯,后来技术工艺改进后,采用环己烷,这个大多资料是用环己烷作还原剂的,把脱去氯化氢之后的双键还原成单键。
环己烷还原性非常强,不但能还原羰基还能还原硝基,酯基,卤素等等。
而现在最新工艺都改成氢气还原了,傅克化加成反应后,氢气还原反应,收率可以达到85%,下面就是后处理了。
前期的加成很简单,主要是后期的脱氯化氢和还原双键。
因为很大一部分在我这学习技术qq1903004211的客户,化学方面的知识懂得不是太多,再加上高压加氢操作不好就会出现爆炸的重大事故,因此我也不敢随便把这种教给别人。
所以就给大家介绍第一代技术,相对简单,容易上马。
以邻氯苯甲酰氯为主要原料的方法,此反应为傅瑞德尔-克拉夫茨反应,简称傅-克反应,,无水三氯化铝作为催化剂,用苯,二氯乙烷做溶剂,使用苯的时候,建议苯多加一点,苯用钠先回流除水。
催化机理是从氯代烃中夺走氯,形成[AlCl4]-,并使有机物转化为碳正离子,正离子和四氯化铝负离子对双键加成再和苯发生亲核取代反应,反应加热,缓慢升温或者阶段升温。
有机化学:β-二羰基化合物(2H含合成)

1.2 碳链的减短
烯烃、炔烃被KMnO4/H+氧化:羧酸 芳环侧链被KMnO4/H+氧化:羧酸 烯烃、炔烃被O3氧化:醛或羧酸 甲基酮的卤仿反应:羧酸 二元羧酸、酮酸的脱羧反应:一元羧酸、酮 酰胺的霍夫曼降级反应:伯胺
1.3 利用重排反应改变碳胳
如何由环戊酮合成螺[4.5]癸烷 ?
Mg-Hg OH HO Zn-Hg HCl H+ O
氯乙酸
丙二酸二乙酯
二、性质 丙二酸二乙酯分子中亚甲基上的氢原子比较活泼, 具有弱酸性,在性质上与乙酰乙酸乙酯相似。
CO2C2H5 CH2 CO2C2H5
C2H5ONa
CO2C2H5 CH CO2C2H5
-
Na
三、在有机合成上的应用
1、合成增长碳链及支链的一元羧酸
CO2C2H5 CH2 CO2C2H5 1)NaOEt 2)RX CO2C2H5 R CH CO2C2H5 1)OH-,H2O 2)H+;3)
CHO CH=CHCOC(CH3)3
CH3COC(CH3)3 OH-,
α,β-不饱和酮
格氏试剂与羰基化合物的反应
O R'C H(R'') 1)RMgX 2)H2O,H
+
R R' C-OH H(R'')
仲醇或叔醇
O R'C Cl
1)RMgX 2)H2O,H
+
1)RMgX R'COR 2)H2O,H
+
1,4-环己烷二甲酸
2.3 合成脂环羧酸
O 四元脂环
4、迈克尔(Michael )加成反应
O C2H5ONa C2H5OH CH(CO2C2H5)2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
由环戊酮和碳原子的有机物合成
环戊酮是一种含有五个碳原子的有机化合物,可以通过与其他有机物反应来合成新的有机物。
以下是环戊酮与碳原子的有机物合成的一些常见反应:
1. 环戊酮缩合反应:环戊酮与一些含有活泼亲电基团(如含有酰基的化合物)的化合物反应,可以在缩合反应中形成新的有机物。
例如,环戊酮与乙酸酐反应可以得到己酮。
2. 氢化反应:环戊酮可以通过氢化反应与氢原子(或还原剂)反应来还原成环戊醇或其他醇类。
例如,环戊酮可以与氢气反应,在氢气存在下通过催化剂催化就可以生成环戊醇。
3. 反应生成环戊酸:环戊酮可以通过弱碱的催化反应产生五碳环戊酸。
例如,环戊酮与碱水解后,生成的五碳环戊酸可以用于合成其他有机物。
4. 环加成反应:环戊酮可以与含有双键的丙烯、苯乙烯等化合物发生环加成反应,从而形成新的有机物。
例如,环戊酮可以与乙烯反应,生成含有六个碳原子的环己酮。
通过这些反应,环戊酮可以被用作合成大量有机物的起始物质。
同时,这些反应也可以在有机化学合成、医药化工等领域中得到广泛应用。
