化学元素发现史
元素发现史

狐刚子名狐丘,又叫胡罡子,东汉未年的炼丹家,著有 《五金粉图决》、《出金矿图录》、《河车经》、《玄珠经》 等。另外,郑樵撰的《通志·艺文略》中还记载有“狐刚子著 《金石还丹术》一卷”。狐刚子在唐宋的方士们心目中是一 位极受祟敬、颇有威望的炼丹祖师和先圣。由于他是我国炼 丹术前期的一位方土,因此他的成就和论著具有特殊重要的 意义。
在汉朝司马迁所著的《史记·秦始皇本纪》中记述有:“以 水银为百川、江河、大海,机相灌输,上具天文,下具地 理” 。是叙述秦始皇在自营坟墓,用大量水银保护他的棺材, 数量上也许有些夸大,事实上还是相当可观。
启迪篇——中国古代化学代表人物与著作
1、炼丹大师——狐刚子 中国炼丹术自汉初兴起,在它得到巨大发展的400余年 里,曾涌现许多卓越约炼丹家,炼丹大师狐刚子就是他 们当中的一位杰出代表。他不仅是中国炼丹术中的勤奋 的实干家,而且是一位卓越的古代化学发明家。他的著 作既反映了当时炼丹术成就所达到的高度,也堪称我国 古代化学中的瑰丽篇章。
根据古代文献的记载,我国人民在汉朝就已经知道煤可燃烧。 元朝初期,来我国的意大利人马可·波罗在归国后所作的游记中, 曾把“用石作燃料”列为专章介绍。
当时这位欧洲人惊奇地看到我国人民用煤作燃料,甚为惊奇, 竟至当作奇闻大书特书,哪知我们的祖先已经使用将近一千年 了。英国到十三世纪初才在北部设矿采煤。
古代的七种金属:金、银、铜、铁、锡、铅和汞--金属 “七宝”,其中金、银在自然界中有单质形式存在。其他 的又是通过什么方式得到的呢?还好,人在的金、 银、硫
最早的新技术---火
控制火,木材燃 烧得到木炭
提炼更多的矿石
碳是在自然界中分布相当广泛的元素之一。自然界中以游 离状态存在的碳有金刚石、石墨和煤;各种形态的煤在自然 界中分布很广,煤中合碳达99%。
化学发展史之新元素发现

制作:晨林
01
60 50 40 30 20 10 0
新元素的发现史简介
51
元素种类数
元素种类数 14 18
18世纪前
18世纪
19世纪
20世纪前人类发现新元素的种类数
01
18世纪之前发现的元素
东方炼丹术
西方炼金术
02
18世纪之前发现的元素
东方炼丹术
西方炼金术
03
18世纪之前发现的元素
Al Ga Nb Xe Sm Tm Ra
电解法
原子发射 原子吸收
02
19世纪70年代前发现的元素
பைடு நூலகம்研究斱法1 电解法
03
19世纪70年代前发现的元素
戴维(H•Davy) 1778~1829
中文名:汉弗莱•戴维 外文名:Humphry•Davy 出生地:英格兰 彭赞斯 身份: 著名化学家 英国皇家化学会主席 成就: 发现了钠钾钡镁钙等元素 电解法制取金属 发现氧化亚氮的麻醉作用 煤矿安全灯发明者
锡
铜
银
金
10种金属元素
4种非金属元素
03
18世纪之前发现的元素
碳
辉铋矿
闪锌矿
汞
10种金属元素
4种非金属元素
03
18世纪之前发现的元素
汞
磁铁矿
斱铅矿
锡
10种金属元素
4种非金属元素
03
18世纪之前发现的元素
砷
硫磺
碳
10种金属元素
4种非金属元素
03
18世纪之前发现的元素
碳
辉铋矿
闪锌矿
汞
10种金属元素
4种非金属元素
化学元素周期表的发展历程

化学元素周期表的发展历程化学元素周期表是化学领域中的重要工具,它将元素按照一定的规律排列并分类,使得我们能够更好地理解元素之间的相互关系。
下面将介绍化学元素周期表的发展历程。
一、早期的元素分类早在古代,人们就已经开始研究元素。
公元前4世纪的古希腊化学家柏拉图,他假设存在着四种基本的物质:地、火、水和空气。
这种分类方法是主观的,缺乏科学依据。
17世纪和18世纪,研究者开始通过化学实验发现了一些元素,尝试对其进行分类。
如托贝哈特对矿石中的金属元素进行了分组。
此时的元素分类是基于性质的相似性,但还没有建立起系统性的规律。
二、道尔顿和元素原子论19世纪初,英国化学家约翰·道尔顿提出了元素原子论。
他相信所有物质都是由不可再分的小颗粒构成,这就是原子。
道尔顿的理论为元素的分类和元素周期表的发展奠定了基础。
根据道尔顿的理论,他提出了一些元素的原子量,并通过比较元素的化学反应发现了元素的不同比例组成。
这些发现为后来研究者提供了重要线索。
三、门捷列夫的周期定律1869年,俄国化学家门捷列夫根据元素的原子量和性质提出了元素周期定律。
他将当时已知的元素按照一定的原子量顺序排列,并发现了一些周期性的规律。
门捷列夫将元素周期表分为8个组,他将元素按照氧化性从强到弱排列,发现了周期性的重复现象。
这一发现引起了众多科学家的关注,推动了元素周期表的进一步研究。
四、门捷列夫周期表的改进门捷列夫的原始周期表只有8个组,后来的研究者对其进行了改进和扩展。
德国化学家门德列夫在1880年提出了基于周期性的核电荷的分类方法。
此后,化学家们开始将元素周期表进行了不断的调整和改进。
五、现代的周期表20世纪,随着科学技术的快速发展,人们对元素和原子结构有了更深入的了解。
英国物理学家亨利·莫塞里和威廉·劳伦斯·布拉格在1913年提出了电子结构理论,即著名的玻尔理论,该理论解释了电子在原子中的分布。
根据玻尔理论,美国化学家格伦·塞博根在1919年提出了基于电子结构的现代周期表。
元素的发展史

元素的发展史一、古代对元素的朴素认识1. 古希腊时期- 古希腊哲学家恩培多克勒提出世界是由土、气、水、火四种元素组成的。
这一观点在当时是基于对自然现象的直观观察。
例如,看到水的流动、火的燃烧、土地的坚实和空气的无形等,认为这四种物质是构成万物的基本元素。
- 亚里士多德进一步发展了这一理论,他认为这四种元素可以相互转化,并且还存在第五种元素“以太”,认为以太是构成天体的元素,这一观点在欧洲影响了很长时间。
2. 中国古代- 中国古代的五行学说认为世界是由金、木、水、火、土五种基本物质组成的。
这五种元素之间存在相生相克的关系,如金生水、水生木、木生火、火生土、土生金;金克木、木克土、土克水、水克火、火克金。
这种学说被广泛应用于中医、哲学、天文等多个领域,体现了古人对物质组成和相互关系的一种朴素理解。
3. 古印度- 古印度哲学家提出世界是由地、水、火、风四种元素组成的,与古希腊的四元素说有相似之处,这种认识也是基于对周围自然现象的感知和总结。
二、炼金术与元素概念的发展(中世纪 - 近代早期)1. 炼金术的兴起- 中世纪的欧洲,炼金术盛行。
炼金术士们试图将普通金属转化为黄金,虽然他们没有实现这个目标,但在这个过程中做了大量的化学实验,积累了许多关于物质性质和转化的知识。
- 他们认为物质是由汞、硫、盐三种基本要素组成的。
汞被认为是金属的灵魂,硫是金属的可燃性要素,盐是金属的固体性要素。
这种观点虽然与现代元素概念不同,但也是对物质组成探索的一部分。
2. 波义耳的贡献三、近代元素发现与元素周期律(18 - 19世纪)1. 元素的大量发现- 在18世纪和19世纪,随着化学分析技术的发展,许多新元素被发现。
例如,1774年英国化学家约瑟夫·普利斯特里发现了氧气,后来拉瓦锡确定了氧气的性质并对燃烧现象进行了正确解释。
- 汉弗莱·戴维通过电解法发现了钾、钠等活泼金属。
随着更多元素的发现,化学家们开始思考这些元素之间的关系。
化学元素周期表的发现与发展

化学元素周期表的发现与发展化学元素周期表是描述和分类化学元素的重要工具,对化学科学研究和应用具有极大的价值。
本文将从历史的角度,介绍化学元素周期表的发现与发展过程。
1. 元素分类的起步在18世纪末19世纪初,化学家开始研究元素的性质和相互关系。
1808年,英国化学家道尔顿提出了原子理论,认为所有物质都由不可分割的小粒子组成。
随后,化学家们开始将已知的元素进行分类。
2. 前身——三法则19世纪中叶,化学家们发现了三种规律,为元素分类提供了基础。
分别是达布林金(Döbereiner)的三种类比律、诺斯特拉夫(Newlands)的八度律和门德莱耶夫(Mendeleev)的周期律。
3. 达布林金的三种类比律达布林金观察到一些具有相似性质的元素,他将这些元素组成了一组,这被称为质量三法则。
其中最著名的是他发现了三种类比律,它们分别是氯、溴和碘的类比,钙、锶和钡的类比,锂、钠和钾的类比。
4. 诺斯特拉夫的八度律诺斯特拉夫打破既定的元素分类模式,提出了八度律。
他认为元素的性质会每隔八个元素重复一次。
尽管八度律的规律性有限,但这是化学元素分类的重要进展。
5. 门德莱耶夫的周期律门德莱耶夫是化学元素周期表发展过程中最重要的贡献者之一。
他将已知的70多种元素按照其性质进行了分类,并基于这些性质提出了周期律。
门德莱耶夫预测了期未发现的元素的性质,并预测了一些元素的存在。
6. 化学元素周期表的完善随着科学技术的进步,越来越多的元素被发现和研究,化学元素周期表也在不断完善和调整。
随着元素周期表的进一步发展,新的元素不断被添加进去,已有元素的属性也得到了更新。
7. 现代化学元素周期表现代化学元素周期表根据门德莱耶夫的周期律进行排列,并加以修改和扩展。
元素周期表通常按照元素的原子序数从小到大排列,并根据元素的属性进行分组。
现代化学元素周期表一般包含18个竖排,称为主族元素和残余元素。
8. 元素周期表的应用化学元素周期表被广泛应用于科学研究、教学和工业生产。
化学元素周期表的发展历史

化学元素周期表的发展历史化学元素周期表是化学领域中非常重要的一种工具,它的发展历史见证了人类对化学元素的认识和理解的不断深入。
以下是化学元素周期表的发展历史的知识点介绍:1.早期元素发现:早在古代,人们就已经开始发现并使用一些元素,如金、银、铜、锡、铅等。
到了17世纪和18世纪,随着化学的兴起,科学家们开始系统地研究元素,陆续发现了更多的元素。
2.门捷列夫的周期表:1869年,俄国化学家门捷列夫发表了第一个元素周期表。
他根据元素的原子量和化学性质,将已知元素排列成一个表格。
这个周期表初步展现了元素之间的关系,并预测了一些尚未发现的元素。
3.周期表的改进:在门捷列夫的周期表基础上,科学家们不断进行改进。
1913年,丹麦物理学家玻尔提出了玻尔模型,对原子的内部结构有了更深入的理解,为周期表的改进奠定了基础。
4.长式和短式周期表:随着元素种类的增加,周期表也不断演变。
目前常用的周期表有两种形式:长式和短式。
长式周期表将元素按照原子序数递增的顺序排列,短式周期表则将元素按照电子排布的规律排列。
5.周期表的现代结构:现代周期表共有7个周期和18个族。
周期表示元素原子的电子层数,族表示元素原子的最外层电子数。
周期表的这种结构反映了元素的原子结构和化学性质的周期性变化。
6.周期表的新元素:随着科学技术的不断发展,人类对元素的认识也在不断拓展。
截至2021年,周期表已知的元素达到118种,其中大部分是在20世纪发现的。
新元素的发现往往是通过粒子加速器等高精尖设备实现的。
7.周期表的应用:周期表在化学、物理学、材料科学等领域具有广泛的应用。
它不仅有助于科学家们预测元素的性质和反应,还有助于我们了解宇宙中元素的分布和地球资源的开发利用。
综上所述,化学元素周期表的发展历史见证了人类对化学元素的认识的不断深化,为我们了解元素的世界提供了重要的工具。
习题及方法:1.习题:门捷列夫是哪个国家的化学家?解题方法:通过查阅相关资料,可以得知门捷列夫是俄国的化学家。
化学元素的发现年事表
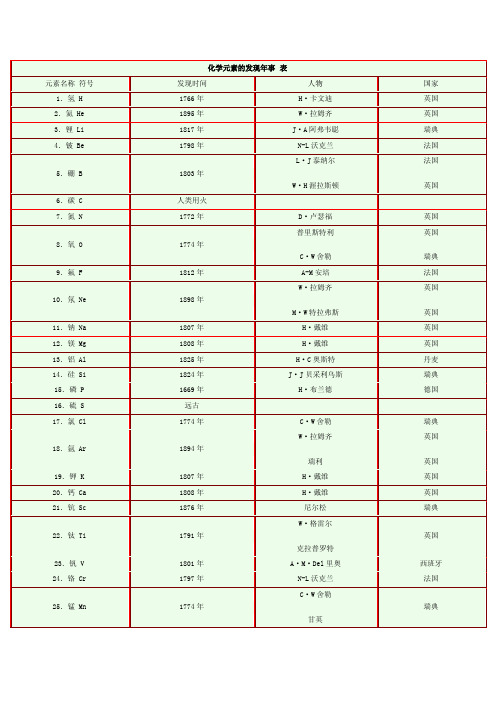
化学元素的发现年事表元素名称符号发现时间人物国家1.氢 H 1766年H·卡文迪英国2.氦 He 1895年W·拉姆齐英国3.锂 Li 1817年J·A阿弗韦聪瑞典4.铍 Be1798年N-L沃克兰法国5.硼 B 1803年L·J泰纳尔W·H渥拉斯顿法国英国6.碳 C 人类用火7.氮 N 1772年D·卢瑟福英国8.氧 O1774年普里斯特利C·W舍勒英国瑞典9.氟 F 1812年A-M安培法国10.氖 Ne1898年W·拉姆齐M·W特拉弗斯英国英国11.钠 Na 1807年H·戴维英国12.镁 Mg1808年H·戴维英国13.铝 Al1825年H·C奥斯特丹麦14.硅 Si1824年J·J贝采利乌斯瑞典15.磷 P 1669年H·布兰德德国16.硫 S 远古17.氯 Cl1774年C·W舍勒瑞典18.氩 Ar 1894年W·拉姆齐瑞利英国英国19.钾 K1807年H·戴维英国20.钙 Ca 1808年H·戴维英国21.钪 Sc 1876年尼尔松瑞典22.钛 Ti 1791年W·格雷尔克拉普罗特英国23.钒 V 1801年A·M·Del里奥西班牙24.铬 Cr1797年N-L沃克兰法国25.锰 Mn1774年C·W舍勒甘英瑞典26.铁 Fe 公元前1400年前小亚细亚的赫梯人27.钴 Co 1735年G·布兰特瑞典28.镍 Ni 1751年A·F·克龙斯泰德29.铜 Cu 公元前2000年前中国、埃及30.锌 Zn 约1300年印度31.镓 Ga 1875年布瓦博德朗法国32.锗 Ge 1886年C·温克勒尔德国33.砷 As 317年葛洪中国34.硒 Se 1817年J·J贝采利乌斯瑞典35.溴 Br 1824年A·J巴拉尔法国36.氪 Kr1898年W·拉姆齐M·W特拉弗斯英国英国37.铷 Rb 1861年R·W本生G·R基尔霍夫德国德国38.锶 Sr 1808年H·戴维英国39.钇 Y 1794年J·加多林芬兰40.锆 Zr1789年M·H克拉普罗特德国41.铌 Nb1801年哈切特英国42.钼 Mo1782年P·J耶尔姆瑞典43.锝 Tc1937年C·佩列尔E·G塞格雷意大利美国44.钌 Ru 1827年T·B奥赞俄国45.铑 Rh1803年W·H渥拉斯顿英国46.钯 Pd1803年W·H渥拉斯顿英国47.银 Ag 公元前3000年前埃及人48.镉 Cd1817年施特罗尔德国49.铟 In1863年H·T·里希特赖赫·李希特德国50.锡 Sn 公元前2000年51.锑 Sb 古代52.碲 Te 1782年F·J米勒·冯·赖兴施泰因奥地利53.碘 I 1811年B·库图瓦法国54.氙 Xe 1898年W·拉姆齐M·W特拉弗斯英国英国55.铯 Cs1860年R·W本生G·R基尔霍夫德国德国56.钡 Ba1808年H·戴维英国57.镧 La 1839年C·G莫桑德瑞典58.铈 Ce1803年M·H克拉普罗特J·J贝采利乌斯W·希辛格德瑞典瑞典59.镨 Pr 1885年C·A·von韦耳斯奥地利60.钕 Nd 1885年C·A·von韦耳斯奥地利61.钷 Pm1945年J·A·马林斯基L·E格伦丁宁美国美国62.钐 Sm1879年布瓦博德朗法国63.铕 Eu1896年E·A德马尔盖法国64.钆 Gd1880年J·C·G·de马里尼亚克瑞士65.铽 Tb1843年C·G·莫桑德尔瑞典66.镝 Dy 1886年布瓦博德朗法国67.钬 Ho 1879年J·克利夫瑞典68.铒 Er 1848年C·G·莫桑德尔瑞典69.铥 Tm 1879年P·T·克利夫瑞典70.镱 Yb 1879年J·C·G·de马里尼亚克瑞士71.镥 Lu1808年C·A·von韦耳斯拔G·于尔班奥地利法国72.铪 Hf1923年G·C·de郝维西D·科斯特匈牙利荷兰73.钽 Ta 1802年A·G·厄克贝里瑞典74.钨 W1781年C·W舍勒瑞典75.铼 Re 1925年W·诺达克O·C·贝格德国德国76.锇 Os 1803年S·坦南特H-V科莱-德斯科蒂英国法国A·F·de富尔克鲁瓦N-L沃克兰法国法国77.铱 Ir1803年S·坦南特H-V科莱-德斯科蒂A·F·de富尔克鲁瓦N-L沃克兰英国法国法国法国78.铂 Pt1735年乌罗阿武德西班牙西班牙79.金 Au 公元3000年前埃及人80.汞 Hg 古代中国、埃及81.铊 Tl 1861年W·克鲁克斯英国82.铅 Pb 公元3000年前埃及、罗马、中国83.铋 Bi 1450年B·瓦伦丁德国84.钋 Po1898年M·居里P·居里法国法国85.砹 At 1940年D·R·加森(等)E·G·塞格雷(等)美国美国86.氡 Rn1899年R·B·欧文斯E·卢瑟福英国英国87.钫 Fr 1939年M·佩雷法国88.镭 Ra 1898年M·居里P·居里法国法国89.锕 Ac1899年A-L德比埃尔内法国90.钍 Th 1828年J·J贝采利乌斯瑞典91.镤 Pa1913年K·法扬斯(等)美国92.铀 U 1789年M·H·克拉普罗特德国93.镎 Np1940年E·M麦克米伦P·H艾贝尔森美国美国G·明贝格(等)G·明贝格(等)。
化学元素周期表发现和演变历程概述

化学元素周期表发现和演变历程概述化学元素周期表是研究化学的基础,它对于科学界、教育界和工业界都具有重要意义。
元素周期表的发现和演变历程是一段充满智慧和创新的历史。
本文将对这段历程进行概述,介绍元素周期表的发现、演变和现代化。
1. 元素周期表的起源元素周期表的起源可以追溯到18世纪末和19世纪初的化学研究。
当时的科学家开始认识到,化学物质是由一种或多种基本组成部分构成的,并试图对这些组成部分进行分类和系统化。
一开始,人们试图将化学元素按照它们的质量、化学性质和其他特征进行分类,但是这样的分类方法并不完善。
2. 近代元素周期表的发现1869年,俄国化学家德米特里·门捷列夫发表了《化学元素周期系统试论》,这是第一个现代意义上的元素周期表。
门捷列夫根据元素的原子质量和化学性质将元素分类,并将它们排列成一个周期性的表格。
门捷列夫的周期表为后来的研究和发展奠定了基础。
3. 周期表的演变随着科学家对元素的研究的深入,元素周期表也不断演变和完善。
20世纪初,质子和电子的发现为元素分类提供了新的线索。
亨利·莫塞里、威廉·拉文德和格伦·塞卡共同发现了质子数(即元素的原子序数)与元素的性质之间存在着规律性关系。
这些发现使得新的元素周期表能够更好地解释元素的性质和行为。
4. 莫尔规则和原子量20世纪初,西班牙化学家门德莱夫·莫尔提出了著名的莫尔规则。
莫尔规则指出,元素的性质与其原子序数(质子数)有密切关系。
这个规律改变了以往将元素按照原子质量进行分类的方式,转而将元素按照原子序数进行分类。
此外,莫尔还提出了一种新的单位,即原子量。
原子量是一个相对质量单位,以碳-12同位素为参照进行计算。
5. 考夫斯基的周期表1913年,英国化学家亨利·莫塞里的学生尤金·考夫斯基提出了一种新的元素周期表,在这个表中,元素按照它们的电子构型进行排列。
考夫斯基的周期表更加符合元素的化学性质和行为,成为近代元素周期表的又一里程碑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学元素发现史(1)原子序数为1的元素是氢[H]。
氢是在1766年由英国的H.卡文迪许发现的。
H.卡文迪许用金属铁(锌)与盐酸(硫酸)反应制得氢气, 并且看到“不管用什么样的酸来溶解具有相同重量某种金属时都会产生相同重量的同样气体”。
H.卡文迪许将之称为可燃空气,并证明它在空气中燃烧生成水。
H.卡文迪许研究了氢气的多种制法;研究了氢气的物理性质和化学性质;确定了氢气同空气混合爆鸣的体积比。
1787年,法国化学家拉瓦锡证明氢是一种单质并命名。
1670年,波义耳曾经研究过氢气,已知其易燃性,然而未把其看作是一种单质,也未做过较全面的研究。
氢的英文名称为HYDROGEN,它来源于希腊文,原意为“水素”。
(2)原子序数为2的元素是氦[He]。
1868年8月8日,法国天文学家P.詹森和英国物理学家J.N.洛克耶尔在各自观测日全食时,用光谱分析仪研究了太阳光谱,发现有一条格外明亮的黄线,但不是钠线。
经查明,这条黄线只能属于某种未知的新元素所发射出来的。
他们俩人几乎同时把他们的发现以信件报告的形式分别寄给了法国巴黎科学院,引起了轰动。
当时人们普遍认为这条谱线仅属于太阳上某个未知元素,称之为“太阳的元素”。
1890年,美国化学家W.F.希尔布兰德用硫酸处理沥青铀矿时得到一种不活泼的气体,其化学性质具有惰性。
英国化学家W.雷姆赛1895年读到这个报告后立即重复进行实验,并把收集到的气体充入放电管精心做辉光光谱检查。
W.雷姆赛开始估计可能是刚发现不久的氩气,然而却发现辉光是黄色的,这使他想起了27年前发现的“太阳的元素”。
W.雷姆赛没有贸然下结论,他把气体标本寄给了当时最权威的光谱学家W.克鲁克斯进行判定,结果证明这种气体就是氦,从而在地球上也发现了“太阳的元素”。
W.雷姆赛发现氦的性质与氩相似,和其它所有元素的性质相差太远,无法归到现有元素周期表的任何一族。
W.雷姆赛建议开辟一个以氦和氩为代表的新的一族,即后来的零族元素,从而补充和完善了元素周期律。
W.雷姆赛以后,化学家们又陆续从其它矿石、空气、天然气中发现了氦。
氦的英文名为HELIUM,此名来自希腊文,原意为“太阳”。
(3)原子序数为3的元素是锂[Li]。
锂是第三个被发现的碱金属元素。
锂是在1817年由瑞典的J.A.阿弗尔聪发现的。
J.A阿弗尔聪是在分析透锂长矿石的组成成分时,发现这种矿石已知的各种成分的总重量占矿石重量的97%,J.A.阿弗尔聪考虑到这种矿石中可能含有某种未知元素没有被分析出来。
他在进一步的研究中发现,这种新金属元素的硫酸盐与钾和钠的硫酸盐的性质不同。
它不同于钾盐,与酒石酸不产生沉淀;不同于钠盐,与碳酸钠相比,该金属碳酸盐的溶解度很小。
根据该金属同钾和钠的硫酸盐在水中溶解度的不同,他分离出了锂的硫酸盐。
J.A.阿弗尔聪试图从锂的氧化物中提取金属锂,没有成功。
1818年,德国化学家C.G.格梅林发现锂盐能使火焰着上鲜艳的红色,找到了一种锂元素的鉴定方法。
大量的金属锂的提取是在1855年由德国化学家R.W.本生等人实现的。
锂的英文名称CITHIUM来源于希腊文,原意是“石头”。
这是J.A.阿弗尔聪的老师J.J.贝采里乌斯提议的,意思是从石头中发现的,而不同于钠和钾是从植物体中发现的。
(4)原子序数为4的元素是铍[Be]。
铍是在1798年由法国的福克林发现的。
福克林在对绿柱石和祖母绿进行化学分析时发现了铍。
他把绿宝石溶于酸中后添加过量的氢氧化钾溶液,获得了一种沉淀物,开始他认为是铝土,然而它不仅不能溶于稀碱液中,而且在其它方面也有与氢氧化铝不同的地方。
例如这种沉淀能溶于碳酸铵中;溶于硫酸后加入硫酸钾,不能析出明矾样的结晶;它的盐类具有甜味,因此他认为是一种新金属的氧化物,福克林将之先称为“甜土”,后接受他人的建议改称“铍土”。
福克林在1798年向法国科学院提交了研究报告和标本。
1828年,德国的维勒和法国的比西分别用金属钾还原熔融的氯化铍得到了纯铍。
铍的英文名称BERYLLIUM是由维勒命名的,来源于铍的主要矿石绿柱石的英文名称BERYL。
(5)原子序数为5的元素是硼[B]。
硼是在1808年由法国的盖?吕萨克和泰那尔发现的,他们用金属钾还原硼酸制得单质硼。
约在公元前两千年以前,古埃及、罗马、巴比伦曾经用硼砂制造玻璃和焊接黄金。
1892年,法国的穆瓦桑用镁还原硼酸,制得纯度为98%的硼。
1909年温特劳布用氢和三氯化硼混合气流在水冷铜电极的电弧上还原,制得高纯硼。
硼的英文名称为BORON,来源于阿拉伯文,原意为“焊剂”,因为硼砂具有溶解金属氧化物的能力,在焊接中作为助熔剂。
(6)原子序数为6的元素是碳[C]。
远古时代的人类就对碳有所认识。
碳的英文名称CARBON来自拉丁文,原意是“炭”。
(7)原子序数为7的元素是氮[N]。
氮是在1772年由瑞典的药剂师C.W.舍勒和英国的化学家D.卢瑟福同时发现。
C.W.舍勒用硫磺与铁粉的混合物吸收空气中的氧气而取得氮气,C.W.舍勒将其称为“浊气”、“乏空气”。
C.W.舍勒对氮气的性质做了研究,指出“这种气体比空气轻;它能灭火,性质颇似‘固定空气’(当时对二氧化碳的称呼),不过灭火效力没有‘固定空气’显著。
可从试验结果看出:蜡烛在洁净的空气中燃烧,可维持80秒之久;若放在空气与‘固定空气’之比为6:55的混合气体中,便立即熄灭;但在洁净空气与这种燃过的空气等比混合气体中大概可燃烧26秒左右。
C.W.舍勒第一个认为氮气是空气的成分之一。
D.卢瑟福研究了物质在空气中燃烧后剩余气体的性质。
为了得到这种气体,他先将老鼠放在密闭容器中呼吸直至死亡,发现空气体积减少了十分之一;用碱液吸收后体积又减少十一分之一,而剩余气体仍可使蜡烛燃烧;再加入磷燃烧后所得得剩余气体已经不能助燃了,他把这部分空气称为“浊气”,在一篇题为《固定空气和浊气导论》的论文中发表了这一成果。
但是,D.卢瑟福没有认识到氮气是一种元素和空气的一个组成部分,只认为是“被燃烧物质吸去燃素后的空气”。
法国化学家拉瓦锡确定氮是一种新元素。
氮的英文名称NITROGEN,来源于希腊文,原意是“硝石”。
(8)原子序数为8的元素是氧[O]。
氧是在1774年由英国的化学家J.普里斯特利首先公开宣布发现的。
J.普里斯特利当时正在研究存在于各种固体物质中的不同“空气”,他用朋友送给它的一个直径为12英寸的大凸透镜,把阳光聚焦起来,加热他所收集和保存的各种固体物质,以求驱赶出存在于其中的各种“空气”。
当他加热氧化汞时,看到有大量的气体冒出,并有汞珠出现,他用排水集气法收集了这种气体,并研究了这种气体的性质。
他发现蜡烛在这种气体中以极强的火焰燃烧;老鼠在瓶中存活时间为相同容积的普通空气的两倍;他用玻璃管从放满这种气体的大瓶里吸取它,感到十分舒畅。
普里斯特利是第一位详细叙述氧气各种性质的科学家。
普里斯特利将氧气的制法和性质告诉了拉瓦锡,拉瓦锡经实验后指出氧在与其它元素结合时有形成酸的倾向。
舍勒在1773年就分离出了氧气,舍勒将其称为“火空气”。
他在给硝石的加热中得到了一种气体,这种气体能强烈地助燃,使点燃的蜡烛发出耀眼的光芒。
他还在对硝酸镁、硝酸汞、氧化汞等物质的加热中得到了这种气体。
1775年底写了《论空气与火》一书,介绍了他的发现,但该书在1777年才出版。
氧气的发现在化学发展史占有重要地位,是气体化学的最大成果。
氧的英文名称为OXYGENE,来源于希腊文,原意为“酸形成者”。
(9)原子序数为9的元素是氟[F]。
1768年,德国的马格拉夫发现了氢氟酸。
1812年法国的安培曾指出氢氟酸与盐酸在组成相似,其中有一种新元素,但没有制出单质氟。
将氟从其化合物中分离出来很难,事实上用化学方法不可能制得游离氟。
没有任何别的元素可以做氧化剂将氟置换出来。
氟的腐蚀性太强,并能同潮湿空气立即发生变化。
有许多化学家为获得单质氟中毒或丧命。
1768年,德国的马格拉夫发现了氢氟酸。
1886年法国化学家H.穆瓦桑总结了前人的经验和教训,对三氟化磷和三氟化砷进行电解以提取氟,但屡遭失败,期间曾经四次因中毒而中断试验。
H.穆瓦桑后来将干燥的氢氧化钾溶于无水的氢氟酸中以此作为电解质。
在铂制U形管中,用铂铱合金作电极,用萤石做的螺旋帽盖紧管口,管内温度约200℃,管外用氯代甲烷作致冷剂(-23℃)以排除电解过程的热量。
经过电解终于获得单质氟。
H.穆瓦桑在分离氟的过程中,发明“穆瓦桑电炉”,并用它制备了许多新化合物。
H.穆瓦桑详细研究了氟的化学性质,制得了一批氟化物。
,当时氟被人称为“不可驯服的元素”。
因为分离出单质氟,H.穆瓦桑获得1906年的诺贝尔化学奖。
氟的英文名称FLUORITE,来源于氟的主要矿物萤石的英文名FLUORITE。
(10)原子序数为10的元素是氖[Ne]。
氖是在1898年由英国的拉姆奇与特拉弗斯发现的。
他们在蒸发液态氩时,收集最先逸出的低沸点气体。
对这部分气体用光谱分析法分析时发现了其中的一个新元素,命名为氖。
氖的发现时间是1898年6月12日。
氖的英文名称为NEON,来源于希腊文,原意为“新的”。
(11)原子序数为11的元素是钠[Na]。
钠是第二个被发现的碱金属元素。
钠是在1807年由英国的化学家H.戴维在电解氢氧化钠时得到的。
他是在电解出金属钾的几天后,就电解出了金属钠。
钠的英文名称SODIUM,来源于希腊文,原意为“苏打碱”,因为钠来自苏打碱。
(12)原子序数为12的元素是镁[Mg]。
镁是在1808年由英国化学家H.戴维发现的。
他电解氧化镁和氧化汞的混合物制得汞齐,蒸发出其中的汞后,得到了金属镁。
1828年,法国的科比西用金属钾还原熔融的无水氯化镁得到纯镁。
镁的英文名称为MAGNESIUM,来源于希腊文,原意为镁的发现地“美格尼西亚”。
(13)原子序数为13的元素是铝[Al]。
铝是在1825年由丹麦的H.C.奥斯忒用无水三氯化铝与钾汞齐作用,并蒸发掉汞以后得到金属铝。
1854年H.S.C.德维尔用金属钠还原氯化钠与氯化铝的熔盐,制得金属铝。
1886年年仅23岁的美国化学家C.M.霍尔和法国化学家P.L.埃鲁分别发明了电解氯化铝和冰晶石的熔盐制得金属铝的方法,使铝的成本大大降低,可以大规模生产,使铝成为可实用的金属。
在这之前,铝属于贵重物质。
法国皇帝在皇宫里用黄金餐具招待他的一般客人,而用铝制餐具招待尊贵客人。
铝的英文名称为ALUMINIUM。
(14)原子序数为14的元素是硅[Si]。
硅是在1823年由瑞典化学家J.J.贝采利乌斯分离出来的。
1811年,法国化学家J.L.盖?吕萨克就试图从四氟化硅中提取单质硅,但没有成功。
1823年,J.J.贝采利乌斯把金属钾置于四氟化硅的气体中加热,获得了褐色粉末。
然后把这种物质投入水中,则有氢气放出,这是由残余的金属钾引起的,与此同时,有深褐色粉末沉于水底。
