化合物的溶度积常数表
ag2s 溶度积常数

ag2s 溶度积常数
AG2S是一种重要的无机化合物,它的溶度积常数(Ksp)是指在一定温度下,该化合物在溶液中达到饱和时,其离
解产物的浓度乘积与固体化合物的溶解度之间的关系。
AG2S的溶度积常数可以用以下方程表示:AG2S ⇌ 2Ag+ +
S2-在该方程中,AG2S是固体化合物,Ag+和S2-是离解产物。
溶度积常数Ksp可以通过实验测定得到。
AG2S的溶解
度与其溶度积常数密切相关。
当Ksp值较大时,表示该化
合物在水中更容易溶解,并且其离解产物浓度较高。
相反,当Ksp值较小时,表示该化合物在水中不容易溶解,并且
其离解产物浓度较低。
通过研究AG2S的溶度积常数,我们
可以了解该化合物在不同条件下的溶解性质。
例如,在不
同温度下测定Ksp值可以得到该化合物的热力学性质。
此外,通过改变pH值或添加其他化学试剂,我们还可以研究
影响AG2S溶解性质的因素。
AG2S的溶度积常数对于许多领
域的研究和应用都具有重要意义。
在环境科学中,了解
AG2S的溶解性质可以帮助我们研究土壤和水体中的硫化银
污染物。
在材料科学中,控制AG2S的溶解度可以用于制备
具有特定性质的纳米材料。
在生物医学领域,了解AG2S的
溶解性质可以帮助我们研究其在药物传递和成像方面的应用。
总之,AG2S的溶度积常数是研究该化合物溶解性质和
应用潜力的重要参数。
通过实验测定Ksp值,并结合其他
相关因素,我们可以深入了解该化合物在不同条件下的溶
解行为,并为其在各个领域的应用提供理论基础。
氟化镁与氟化钙的溶度积常数

氟化镁与氟化钙的溶度积常数
氟化镁(MgF2)与氟化钙(CaF2)都是常见的含氟化合物,它们在水中溶解度较小,但在酸中溶解度较大。
这两种化合物的溶度积常数(Ksp)是表征它们溶解度的物理量。
氟化镁的溶度积常数Ksp(MgF2) = 3.2 × 10^-9,这意味着在溶液中,当浓度达到一定值时,氟化镁会从溶液中沉淀出来。
这个值随着温度的变化而变化,但在25℃时,氟化镁的溶解度约为1.5 × 10^-4 mol/L。
相比之下,氟化钙的溶度积常数Ksp(CaF2) = 4.8 × 10^-11,这意味着在相同条件下,氟化钙的溶解度比氟化镁还要小。
在25℃时,氟化钙的溶解度约为1.9 × 10^-4 mol/L。
这两种化合物的溶度积常数与温度有关,温度升高会导致溶解度增大。
此外,这些值也会受到其他离子或溶剂的影响。
因此,在实际应用中,需要结合具体条件来确定它们的溶解度。
总之,氟化镁与氟化钙的溶度积常数是描述它们溶解度的关键参数。
这些参数对于含氟化合物的化学过程和工程应用具有重要意义。
金属盐类溶度积表

化合物的溶度积常数表化学溶解性表常见物质溶解性CU2+蓝色(稀)绿色(浓) FE3+黄色FE2+浅绿MNO4-紫色,紫红色沉淀的颜色MG(OH)2 ,AL(OH)3 ,AGCL,BASO4,BACO3,BASO3,CASO4等均为白色沉淀CU(OH)2蓝色沉淀FE(OH)3红褐色沉淀AGBR淡蓝色AGI ,AG3PO4黄色CuO 黑Cu2OFe2O3 红棕FeO 黑Fe(OH)3红褐Cu(OH)2 蓝FeS2 黄PbS 黑FeCO3 灰Ag2CO3 黄AgBr 浅黄AgCl 白Cu2(OH)2CO3 暗绿氢氧化铜(蓝色);氢氧化铁(红棕色)氯化银(白色)碳酸钡(白色)碳酸钙(白色)2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑ 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=B aSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4•H2O 蓝色晶体变为白色粉末CuSO4•H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体合成氨工业和硝酸的生产密切相关,氨和空气混合后,通过铂铑合金网(催化剂)便被氧化为一氧化氮。
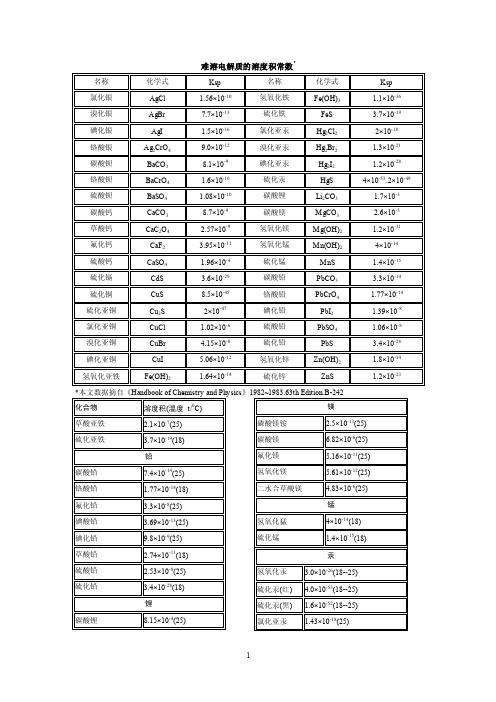
难溶电解质的溶度积常数
亚砷酸(H3AsO3) 25 正硼酸(H3BO3) 20 碳酸(H2CO3) 25
25
5.1×10-10 9.29 5.4×10-10 9.27 1 4.5×10-7 6.35 2 4.7×10-11 10.33
焦磷酸(H4P2O7) 20 25 25 25
1 1.2×10 0.91 2 7.9×10 2.10 3 2.0×10 6.70 4 4.8×10 9.32
氢氧化汞 硫化汞(红) 硫化汞(黑) 氯化亚汞
3.0×10-26(18--25) 4.0×10-53(18--25) 1.6×10-52(18--25) 1.43×10-18(25)
1
碘化亚汞 溴化亚汞
硫化镍(a) (ß) (r)
5.2×10-29(25) 6.4×10-23(25)
镍 3.2×10-19(18--25) 1.0×10-24(18--25) 2.0×10-26(18--25)
难 溶电 解质的 溶度 积常数 *
名称
化学式
Ksp
名称
化学式
Ksp
氯化银 溴化银
AgCl AgBr
1.56×10-10 7.7×10-13
氢氧化铁 硫化铁
Fe(OH)3 FeS
1.1×10-36 3.7×10-19
碘化银 铬酸银 碳酸钡 铬酸钡 硫酸钡 碳酸钙 草酸钙 氟化钙 硫酸钙 硫化镉 硫化铜 硫化亚铜 氯化亚铜 溴化亚铜
50g(NH4)2SO4 溶于 100ml 热水,冷却后过滤
溶解 69.5gFeSO4·7H2O 于适量水中,加入 5ml18mol·L-1 H2SO,用水稀释至 1L,置入小铁钉数枚
溶解 12.2g 锑粉于 50ml 浓 HNO3 微热,使锑粉全部作用成白色粉末, 用倾析法洗涤数次,然后加入 50ml6mol·L-1NaOH 溶解,稀释至 1L
标准溶度积常数

标准溶度积常数标准溶度积常数是描述溶解度的一个重要物理化学常数,它是指在特定温度下,溶液中某种物质的溶解度所对应的离子浓度乘积的常数。
在化学反应和溶解过程中,标准溶度积常数的大小直接影响着溶解度和溶液中离子浓度的变化,因此对于理解溶解平衡和溶解度规律具有重要意义。
标准溶度积常数通常用Ksp表示,它是溶解度积的平衡常数。
对于一般的离子化合物,比如AB,其溶解度平衡反应可以表示为:AB(s) ⇌ A+(aq) + B-(aq)。
在溶解度平衡达到动态平衡时,AB(s)溶解成A+和B-离子,而A+和B-离子又会重新结晶成AB(s),这时溶解度积Ksp定义为:Ksp = [A+][B-]其中[A+]和[B-]分别代表A+和B-离子在溶液中的浓度。
Ksp是一个与温度有关的常数,它描述了在特定温度下,溶质在溶剂中达到饱和溶解时的平衡状态。
对于一般的离子化合物,Ksp的大小与其溶解度直接相关。
当Ksp值较大时,溶质在溶剂中的溶解度较高,溶液中的离子浓度较大;反之,Ksp值较小时,溶质的溶解度较低,溶液中的离子浓度也较小。
因此,Ksp常数的大小可以直接反映出溶质在溶剂中的溶解度大小。
在实际应用中,Ksp常数对于溶解度的预测和控制具有重要意义。
通过测定不同条件下的Ksp值,可以预测溶质在溶剂中的溶解度,从而指导实际生产和实验操作。
此外,Ksp常数还可以用于溶解度限度的控制,对于一些需要控制溶解度的工业生产过程,Ksp常数的准确测定和控制具有重要意义。
需要注意的是,Ksp常数只描述了溶质在溶剂中的溶解度大小,并不能直接反映出溶质在溶液中的活性系数。
在实际应用中,为了更准确地描述溶质在溶液中的行为,还需要结合活度系数等因素进行综合考虑。
综上所述,标准溶度积常数是描述溶解度的重要物理化学常数,它直接反映了溶质在溶剂中的溶解度大小。
通过对Ksp常数的测定和控制,可以预测和调控溶质在溶剂中的溶解度,具有重要的理论和应用价值。
金属盐类溶度积表

化合物的溶度积常数表化学溶解性表常见物质溶解性CU2+蓝色(稀)绿色(浓) FE3+黄色FE2+浅绿MNO4-紫色,紫红色沉淀的颜色MG(OH)2 ,AL(OH)3 ,AGCL,BASO4,BACO3,BASO3,CASO4等均为白色沉淀CU(OH)2蓝色沉淀FE(OH)3红褐色沉淀AGBR淡蓝色AGI ,AG3PO4黄色CuO 黑Cu2OFe2O3 红棕FeO 黑Fe(OH)3红褐Cu(OH)2 蓝FeS2 黄PbS 黑FeCO3 灰Ag2CO3 黄AgBr 浅黄AgCl 白Cu2(OH)2CO3 暗绿氢氧化铜(蓝色);氢氧化铁(红棕色)氯化银(白色)碳酸钡(白色)碳酸钙(白色)2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑ 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4•H2O 蓝色晶体变为白色粉末CuSO4•H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体合成氨工业和硝酸的生产密切相关,氨和空气混合后,通过铂铑合金网(催化剂)便被氧化为一氧化氮。
标准溶度积常数

标准溶度积常数溶度积常数(Ksp)是描述在一定温度下,溶液中固体物质溶解度的一个重要物理化学常数。
它是溶液中固体物质离子浓度的乘积,当固体物质溶解度达到饱和时,溶度积常数的值将保持不变。
在化学反应中,溶度积常数的大小直接影响着溶解度平衡的位置,对于溶解度平衡的研究和控制具有重要意义。
溶度积常数的概念最早由瑞士化学家贝尔特洛特·弗里德里希·庞特斯特(Berthollet Friedrich Pottstett)于1785年提出。
他发现,当溶液中的阳离子和阴离子的浓度乘积等于一定值时,固体物质达到饱和溶解度。
而这个乘积就是溶度积常数,即Ksp。
溶度积常数的大小与固体物质的溶解度密切相关,它反映了固体物质在溶液中的溶解程度。
溶度积常数的数值大小取决于溶质的种类和温度。
对于一般的离子化合物,溶度积常数可以通过溶解度实验得到。
以一般的离子化合物AB为例,其溶度积常数可以表示为:AB(s)⇌ A+(aq)+ B-(aq)。
在该反应中,AB为固体物质,A+和B-为离子。
溶度积常数Ksp可以用离子浓度的乘积表示:Ksp = [A+][B-]其中,[A+]和[B-]分别表示A+离子和B-离子的浓度。
溶度积常数的大小可以直观地反映出固体物质在溶液中的溶解度,当Ksp值较大时,意味着固体物质的溶解度较高;反之,Ksp值较小则表示固体物质的溶解度较低。
溶度积常数的应用广泛,特别是在化学工业生产和环境保护中具有重要意义。
在化学生产中,控制和调节溶度积常数可以有效地控制反应过程,提高产物纯度,减少废物产生。
在环境保护中,溶度积常数可以帮助我们了解溶液中固体物质的溶解度,从而预测和控制环境中的污染物质扩散和沉淀过程。
除此之外,溶度积常数还可以用来预测沉淀反应的发生。
当两种离子在溶液中浓度达到一定程度时,它们会发生沉淀反应。
通过溶度积常数的大小,我们可以判断溶液中是否会发生沉淀反应,从而指导实际生产和环境监测工作。
硫化铜的溶度积常数

硫化铜的溶度积常数
硫化铜的溶度积常数:1.3×10-36
溶度积,是指沉淀的溶解平衡常数,用Ksp表示,溶度积的大小反映了难溶电解质的溶解能力。
溶度积常数仅适用于难溶电解质的饱和溶液,对易溶的电解质不适用。
在温度一定时,每一难溶盐类化合物的Ksp皆为一特定值。
在一定温度下,难溶电解质晶体与溶解在溶液中的离子之间存在沉淀溶解和生成的平衡,称为沉淀溶解平衡。
将难溶电解质AgCI放入水中,固体表面的一部分Ag+和Cl-在水分子的不断作用下脱离AgCl固体,与水分子缔合成水合离子进入溶液,此过程称作沉淀的溶解。
与此同时,溶液中的水合Ag+和Cl-不断运动,其中一部分受到AgCl 固体的表面带相反电荷的离子吸引,又会重新结合成固体AgCI,此过程称作沉淀的生成。
难溶电解质的溶解和生成是可逆过程。
一段时间后,当难溶电解质溶解的速率和生成的速率相等,溶液中各离子的浓度不再发生变化,难溶电解质固体和溶液中水合离子间的沉淀溶解平衡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.01×10-9(25)
溴化亚铜
6.27×10-9(25)
镉
氯化亚铜
1.72×10-7(25)
草酸镉
1.42×10-8(25)
碘化亚铜
1.27×10-12(25)
氢氧化镉
7.2×10-15(25)
硫化亚铜
2×10-47(25)
硫化镉
3.6×10-29(18)
硫氰酸亚铜
1.77×10-13(25)
化合物的溶度积常数表
化合物
溶度积
化合物
溶度积
化合物
溶度积
醋酸盐
氢氧化物
*CdS
8.0×10-27
**AgAc
1.94×10-3
*AgOH
2.0×10-8
*CoS(α-型)
4.0×10-21
卤化物
*Al(OH)3(无定形)
1.3×10-33
*CoS(β-型)
2.0×10-25
*AgBr
5.0×10-13
2.0×10-9
*SrSO4
3.2×10-7
**Ni(丁二酮肟)2
4×10-24
*PbCrO4
2.8×10-13
硫化物
**Mg(8-羟基喹啉)2
4×10-16
*SrCrO4
2.2×10-5
*Ag2S
6.3×10-50
**Zn(8-羟基喹啉)2
5×10-25
摘自 David R.Lide, Handbook of Chemistry and Physics, 78th. edition, 1997-1998
*CaSO4
9.1×10-6
**Al(8-羟基喹啉)3
5×10-33
*CaCrO4
7.1×10-4
Hg2SO4
6.5×10-7
*K2Na[Co(NO2)6]·H2O
2.2×10-11
*CuCrO4
3.6×10-6
*PbSO4
1.6×10-8
*Na(NH4)2[Co(NO2)6]
4×10-12
*Hg2CrO4
*Cu2[Fe(CN)6]
1.3×10-16
*PbCO3
7.4×10-14
**PbC2O4
8.51×10-10
AgSCN
1.03×10-12
SrCO3
5.6×10-10
*SrC2O4·H2O
1.6×10-7
CuSCN
4.8×10-15
ZnCO3
1.46×10-10
ZnC2O4·2H2O
1.38×10-9
铝
草酸钙
2.32×10-9(25)
铝酸H3AlO3
4×10-13(15)
草酸钙(CaC2O4·H2O)
2.57×10-9(25)
1.1×10-15(18)
硫酸钙
4.93×10-5(25)
3.7×10-15(25)
钴
氢氧化铝
1.9×10-33(18---20)
硫化钴(CoS)a
4.0×10-21(18---25)
钡
(CoS)b
2.0×10-21(18---25)
碳酸钡
2.58×10-9(25)
铜
铬酸钡
1.17×10-10(25)
一水合碳酸铜
6.94×10-8(25)
氟化钡
1.84×10-7(25)
草酸铜
4.43×10-10(25)
碘酸钡Ba(IO3)2·2H2O
1.67×10-9(25)
硫化铜
8.5×10-45(18)
锌
溴化银
5.38×10-5(25)
氢氧化锌
3×10-17(225)
硫氰酸银
0.49×10-12(18)
草酸锌 ZnC2O4·2H20
1.38×10-9(25)
硫氰酸银
1.03×10-12(25)
硫化锌
1.2×10-23(18)
锶
碳酸锶
5.60×10-10(25)
氟化锶
4.33×10-9(25)
草酸锶
*AgBrO3
5.3×10-5
铬酸盐
硫酸盐
*AgIO3
3.0×10-8
Ag2CrO4
1.12×10-12
*Ag2SO4
1.4×10-5
Cu(IO3)2·H2O
7.4×10-8
*Ag2Cr2O7
2.0×10-7
*BaSO4
1.1×10-10
**KHC4H4O6(酒石酸氢钾)
3×10-4
*BaCrO4
1.2×10-10
8.7
10
13
Cd(OH)2
7.2-8.2
9.7
Mn(OH)2
7.8-8.8
9.8-10.4
14
4×10-14
Mg(OH)2
9.3-10.4
10.8-12.4
5×10-12
Fe(OH)3
1.5-2.3
4.1
14
1.1×10-36
Al(OH)3
3.3-4
5.2
7.8
10.8
2×10-33
Cr(OH)3
溴化银
5.35×10-13(25)
镁
碳酸银
8.46×10-12(25)
磷酸镁铵
2.5×10-13(25)
氯化银
1.77×10-10(25)
碳酸镁
6.82×10-6(25)
铬酸银
1.2×10-12(14.8)
氟化镁
5.16×10-11(25)
铬酸银
1.12×10-12(25)
氢氧化镁
5.61×10-12(25)
5.61×10-8(18)
硫酸锶
3.44×10-7(25)
铬酸锶
2.2×10-5(18---285)
一些化合物的沉淀溶解pH值
氢氧化物
pH值
pH值
Ksp
开始沉淀
沉淀完全
开始溶解
溶解完全
HgO
1.3-2.4
5
11.5
Ag2O
6.2-8.2
11.2
12.7
Sn(OH)2
0.9-2.1
4.7
10
13.5
Cu(OH)2
铅
硫化汞(红)
4.0×10-53(18--25)
碳酸铅
7.4×10-14(25)
硫化汞(黑)
1.6×10-52(18--25)
铬酸铅
1.77×10-14(18)
氯化亚汞
1.43×10-18(25)
氟化铅
3.3×10-8(25)
碘化亚汞
5.2×10-29(25)
碘酸铅
3.69×10-13(25)
溴化亚汞
钙
亚铁氰化铜
1.3×10-16(18---25)
碳酸钙
3.36×10-9(25)
铁
×
氟化钙
3.45×10-11(25)
氢氧化铁
2.79×10-39(25)
碘酸钙
7.10×10-7(25)
氢氧化亚铁
4.87×10-17(25)
化合物
溶度积(温度t/0C)
化合物
溶度积(温度t/0C)
硫化银
1.6×10-49(18)
1.6×10-7
Mg3(PO4)2
1.04×10-24
*CuCO3
1.4×10-10
*CaC2O4·H2O
4×10-9
*Pb3(PO4)2
8.0×10-43
FeCO3
3.13×10-11
CuC2O4
4.43×10-10
*Zn3(PO4)2
9.0×10-33
Hg2CO3
3.6×10-17
*FeC2O4·2H2O
26
(C5H8O4N)2Zn
6.3-6.5
0.5
C5H7O4N Cu·2.5H2O
3
0.03
(C5H8O4N)2Ba
1.72
C5H8O4N·NH4
76.3
谷氨酸钠
谷氨酸钴
8.45×10-12
*Zn(OH)2
1.2×10-17
Cu3(PO4)2
1.40×10-37
*BaCO3
5.1×10-9
草酸盐
FePO4·2H2O
9.91×10-16
CaCO3
3.36×10-9
Ag2C2O4
5.4×10-12
*MgNH4PO4
2.5×10-13
CdCO3
1.0×10-12
*BaC2O4
3.2×10-7
其它盐
MgCO3
6.82×10-6
Hg2C2O4
1.75×10-13
*[Ag+][Ag(CN)2-]
7.2×10-11
MnCO3
2.24×10-11
MgC2O4·2H2O
4.83×10-6
*Ag4[Fe(CN)6]
1.6×10-41
NiCO3
1.42×10-7
MnC2O4·2H2O
1.70×10-7
**NiS
1.07×10-21
*CuI
1.1×10-12
*Cr(OH)3
6.3×10-31
*PbS
8.0×10-28
*Hg2Cl2
1.3×10-18
*Cu(OH)2
2.2×10-20
*SnS
1×10-25
*Hg2I2
4.5×10-29
*Fe(OH)2
8.0×10-16
**SnS2
2×10-27
