药品名称 生产单位
药物标识管理制度

药物标识管理制度一、总则为规范药物标识管理,提高药物标识的质量和安全性,保障药品使用者的权益,保证药物标识的有效性,制定本制度。
二、适用范围本制度适用于所有生产、销售、使用药物标识的单位。
三、药物标识的管理责任1. 生产单位(1)生产单位应当按照相关法律法规和国家标准规定,保证药物标识的合法合规,确保药物标识的真实有效。
(2)生产单位应当建立健全药物标识管理制度,明确药物标识的设计、生产、质量控制等流程和责任。
(3)生产单位应当对药物标识的设计、印刷、质量检验等环节严格把关,确保药物标识的质量和安全性。
2. 销售单位(1)销售单位应当严格执行国家规定的药物标识要求,不得私自更改、篡改药物标识。
(2)销售单位应当在销售药物时,对药物标识进行全面检查,确保药物标识的真实有效。
3. 使用单位(1)使用单位应当按照使用者使用药物需要的要求,对药物标识进行合理使用和保存,不得擅自更改、涂改药物标识。
(2)使用单位应当对有关药物标识的破损、损坏情况及时向生产厂家或销售单位报告,要求提供替换或维修。
4. 监督管理部门(1)监督管理部门应当加强对药物标识的监督检查,及时发现药物标识的违法行为,并依法进行处罚。
(2)监督管理部门应当指导、支持生产、销售和使用单位加强药物标识管理,提供技术支持和培训。
四、药物标识的设计与印刷要求1. 药物标识设计(1)药物标识应当符合国家有关法律法规和标准规定,具有准确、清晰、完整、标准的特点。
(2)药物标识应当包括药品名称、规格、生产日期、保质期、批号、生产厂家等基本信息,并根据需要添加其他信息。
(3)药物标识设计应当科学、合理,便于在不同环境条件下清晰可读。
2. 药物标识印刷(1)药物标识的印刷应当选择符合国家标准的印刷设备和材料,确保药物标识的质量和安全性。
(2)药物标识印刷过程应当按照标准操作规程进行,确保药物标识的印刷效果和质量。
(3)药物标识印刷后,应当按照规定对药物标识进行抽样检验,确保药物标识的合格率不低于国家标准规定的要求。
兽药GSP各种记录表
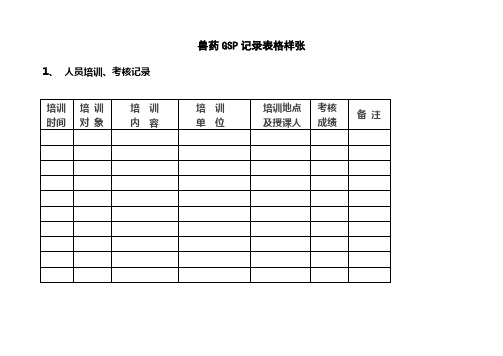
兽药GSP记录表格样张1、人员培训、考核记录
2、设施、设备的维护、保养、清洁、运行状态记录
3、兽药质量评估记录
4、兽药采购、验收、入库、储存、销售、记录
兽药采购及销售记录第页
药品名称: 通用名称: 剂型:规格: 生产单位: 批准文号: 生产批号: 有效期:
进货日期:年月日供货单位: 进货数量: 验收人:
2、药品名称:填写商品名称,通用名称:填写化学名称。
3、销售对象名称/姓名:单位填写名称,个人填写姓名。
5、兽药质量投诉、质量纠纷、质量事故、不良反应等记录
6、不合格兽药和退货兽药处理记录
7、兽医行政管理部门监督检查情况记录。
药检填写说明

深圳市药品检验所委托检验合同填写说明发布时间::2009-05-14信息来源::深圳市药品检验所1.检品名称:请详细填写药品通用名(化学名),如有商品名,将商品名放在括号内。
如:(1)成药:复方氢氧化铝片(胃舒平)。
(2)中药材名称按《中国药典》格式填写,不能写别名或习用名。
如:牡丹皮,不能写丹皮。
(3)中药饮片则先写中药名称,饮片放在括号内。
如:大黄(饮片),不能写大黄片。
2.生产单位:指生产企业的名称(要求写全称,不能简写,如:北京同仁堂)。
若中药材没有生产单位,请填写产地,如:产地—云南。
产地不详的在表格内划“/”。
3.规格:(1)单方制剂—按说明书中【规格】项填写。
如:20mg;2ml:3mg。
(2)中成药—按说明书中【规格】项填写。
如:每8丸相当于原药材5g,每粒装0.3g。
(3)原料药、药用辅料—填写“原料药”、“药用辅料”。
(4)复方制剂—填写“复方制剂”。
(5)中药材填写“药材”或“饮片”。
4.包装:检品的外包装。
如:塑料瓶;铝塑板、铝塑袋及纸盒;安瓿及纸盒。
5.批号:按药品包装上所标明的批号填写。
若为中药材或中药饮片,无批号的,在表格内划“/”,若样品无批号有生产日期的,可在此表格内填生产日期,如:2009年01月01日(生产日期)。
6.有效期:按包装上“有效期至”的日期填写。
如:2008年10月1日。
若为中药材或中药饮片无效期的情况,在相应的表内划“/”;若为药用原辅料等,在相应的空格内填写具体时间,如“两年”。
7.数量:委托单位所送样品的实际数量。
最小原包装量×实际的最小原包装数量×总包装数,如:10片/板×10板/盒×3盒。
若为中药材或中药饮片、药用原辅料等填写样品重量,如:10g×3袋。
8.检验目的:请注明送检的目的,在相应的情况后划“√”。
如:药品安全指标专项√。
9.检验项目:请注明是全检、部分检验或单项检验,若为部分检验或单项检验,请注明具体的检验项目名称。
药品质量公告2015年

16
枳壳
江西樟树天齐堂中药饮片有限公 司
1403003
饮片(麸炒 枳壳)
常山县医药有限公司
《中国药典》2010年版一部
17
枳壳
江西樟树葛玄中药饮片有限公司 2013090104
饮片(麸炒 枳壳)
浙江江山百草堂医药有限 公司
《中国药典》2010年版一部
18 枳壳Байду номын сангаас
安徽石田中药饮片有限公司
140101
饮片(麸炒 浙江再生方医药科技有限
14 五加皮
亳州市远光中药饮片厂
20130510
饮片 饮片
台州市大德生医药连锁有 限公司
《中国药典》2010年版第二增补本
浙江海州医药有限公司 《中国药典》2010年版第一增补本
假冒生产 假冒生产
浙江省食品药品检验研究院 台州市食品药品检验所
15 小通草 亳州市国苑中药材饮片有限公司 140125
饮片 浙江海州医药有限公司 《中国药典》2010年版一部
浙江善益堂药品零售连锁 有限公司
《中国药典》2010年版第二增补本
[性状]
[检查](装量差 异)
检验机构 宁波市药品检验所
丽水市食品药品检验所
第 2 页,共 10 页
3 板蓝根颗粒 广西金海堂药业有限责任公司
20121101
每袋装 3g(无蔗 糖,相当于 饮片7g)
4 穿心莲片 库尔勒龙之源药业有限责任公司 20130401
枳壳)
公司
《中国药典》2010年版一部
19 枳壳 安徽亿源中药饮片科技有限公司 20130401 饮片 浙江安泰医药有限公司 《中国药典》2010年版一部
20 枳壳
国家药品监督管理局

国家药品监督管理局国家药品标准(试行)颁布件国家药品监督管理局2002年11月16 日中华人民共和国国家药品监督管理局 发布 湖南省药品检验所 复核贵州康诺制药有限公司 提出本标准自2002年12月1日起试行,试行期2年。
中 华 人 民 共 和 国国家药品监督管理局标 准 (试行)双 羊 喉 痹 通 颗 粒Shuangyang Houbitong Keli【处方】 野烟叶468.7g 羊耳菊468.7g 矮地茶312.5g羊奶奶叶312.5g 僵蚕312.5g 荆芥312.5g薄荷312.5g蔗糖835g制成 1000g【制法】 以上七味药材,加水浸泡30分钟,煎煮三次,每次1小时,同时收集挥发油,备用;合并煎液,滤过,滤液减压浓缩至相对密度为1.25(80℃)的清膏,加蔗糖,混匀,制成颗粒,干燥,加入上述挥发油(用乙醇适量使溶解),混匀,即得。
【性状】 本品为棕褐色颗粒;具薄荷香气,味甜。
【鉴别】 (1)取本品10g ,研细,加乙醚30ml ,振摇10分钟,放置30分钟,滤过,滤液挥至1ml ,作为供试品溶液。
另取薄荷对照药材1g 、荆芥对照药材0.8g ,分别置圆底烧瓶中,加水150ml ,连接挥发油测定器,自测定器上端加水使充满刻度,再加石油醚(60~90℃)1ml ,连接回流冷凝管,加热回流2小时,放冷,分取石油醚液,作为对照药材溶液。
再取薄荷脑对照品,加乙醚制成每1ml 含2mg 的溶液,作为对照品溶液。
照薄层色谱法(中国药典2000年版一部附录VI B )试验,吸取上述四种溶液各10μl ,分别点于同一硅胶G 薄层板上,以苯一醋酸乙酯(20∶1)为展开剂,展开,取出,晾干,喷以2%香草醛的50%硫酸乙醇液,热风吹至斑点显色清晰。
供试品色谱中,分别在与对照药材及对照品色谱相应的位置上,显相同颜色的斑点。
(2)取本品5g ,研细,加甲醇40ml ,超声处理20分钟,滤过,滤液浓缩至2ml ,作为供试品溶液。
如何解读药品说明书

如何解读药品说明书药品说明书(package insert,drug instruction)是药品生产企业提供的包含药理学、毒理学、药效学等药品安全性、有效性的重要科学数据信息,是医生和患者安全、合理使用药品的重要参考依据。
一个完整的药品说明书包括药品名称、成份、性状、适应症、规格、用法用量、不良反应、禁忌、注意事项、孕妇及哺乳期妇女用药、儿童用药、老年用药、药物相互作用、药物过量、药理毒理、药代动力学、贮藏、包装、有效期、执行标准、批准文号、生产企业等22项内容。
1.药品名称(drug name):依次包括以下几种名称。
1.1通用名称(generic name):是同一种药品在一个国家或世界范围内的公有名称,分为:国际通用名称和中文通用名称。
国际通用名称:世界卫生组织(WHO)制定了药品命名原则,并依据此原则制定了国际非专利药品名称(International Nonproprietary Names for Pharmaceutical Substances, INN)。
INN给予世界各国的药品以通用性和唯一性,因此可理解为国际通用名称。
中文通用名称(Chinese Approved Drug Names, CADN):是1997年国家药典委员会编写出版的《中国药品通用名称》中规定的药品名称,是国家药典委员会按照“中国药品通用名称命名原则”制定的药品名称,该命名原则规定,中文名尽量与外文名相对应。
可采取音译、意译或音、意合译,一般以音译为主;应避免采用可能给患者以暗示的有关解剖学、生理学、病理学或治疗学的药品名称,并不得用代号命名。
也就是说药品命名不可“顾名思义”。
我们常用的药品通用名大多为英文通用名的音译名,如阿齐霉素(Azithromycin)、昂丹司琼(Ondansetron)、阿莫西林(Amoxicillin)、头孢唑林(Cefazolin)、阿米卡星(Amikacin)、阿司匹林(Aspirin)、可待因(Codeine)、地西泮(Diazepam)、地高辛(Digoxin)、阿替洛尔(Atenolol)、吲哚美辛(Indometacin)和辛伐他汀(Simvastatin)等。
药品名称与药品说明书
药物在体内的分布、药物浓度随时间
变化规律的科学。
医学ppt
34
药品说明书撰写原则与规定 (4) 药品的适应症
应按国家药品监督管理局批准内 容书写,不得随意夸大。
(5) 用法用量 用药方法与用药剂量是药品说明
书中的核心部分,是临床安全、有 效用药的重要基础。用药方法应明 确,详细列出口服、皮下注射、肌 肉注射、静脉注射等用药途径和用 药时间。
医学ppt
28
存在主要问题:
①药品名称不规范。药品说明书无通 用名,只有商品名。
②用法剂量不明确,病人不易理解。 如口服1次4~8片,用量差异太大,病人 无法掌握。如只标1日3次,每次1片,但 不知饭前饭后。
③不良反应不全,不提或少提药物不 良反应,使临床用药安全性受到影响。
④药物动力学资料欠缺。
⑤有效期不明,目前很多药品只有生
产批号而无有效期限。造成临床用药混
乱。
医学ppt
29
药品说明书撰写原则与规定 (2) 药品说明书的撰写原则与编制 内容
药品说明书的撰写应遵循以下原则: 资料要真实、准确、科学,文字表达要 简明易懂,计量单位要统一,记载项目 要全面。
医学ppt
30
药品说明书撰写原则与规定 2001年12月1日开始施行的新的药品管 理法,说明书必须注明药品的通用名称、 成分、规格、生产企业、批准文号、产品 批号、生产日期、有效期、适应症或功能 主治、用法、用量、禁忌症、不良反应和 注意事项。
医学ppt
13
WHO药品INN命名原则
(1)药品名称读音:应清晰易辨,全词 不宜过长,应避免与目前已经使用的药品相 似
(2)同类药效药物:名称力求以适当方 法显示这一关系;凡易令病人从解剖学、生 理学、病理学和治疗学角度猜测药效的名称, 不应采用
药品标识标签管理制度
药品标识标签管理制度一、总则为了规范药品标识标签管理,保障药品质量安全,防范药品安全事故的发生,特制订本管理制度。
二、适用范围本管理制度适用于所有在我国境内生产、流通的药品的标识标签管理。
三、药品标识标签的内容要求1. 药品名称:药品名称要真实、准确、清晰,与国家药品注册批准的名称一致。
2. 规格、剂型:规格和剂型应明确标示,便于医生、药师和患者正确使用。
3. 生产批号及有效期:生产批号和有效期是药品追溯和保质期管理的重要依据,必须在标签上清晰标注。
4. 生产单位和地址:生产单位要真实可靠,详细标注生产地址,以便监管部门和消费者查询。
5. 成分和含量:药品成分和含量是患者用药安全的重要保障,必须真实准确地在标签上注明。
6. 使用说明:药品的使用说明应简明清晰,包括用法、用量、不良反应、注意事项等内容。
7. 禁忌症:药品的禁忌症是使用者在用药过程中需要遵守的重要规定,必须在标签上提示。
8. 注意事项:药品使用过程中需要特别注意的事项,如存储条件、注意事项等,应在标签上明示。
9. 生产日期:药品的生产日期是质量控制的重要参考,必须在标签上清晰标注。
四、药品标签标识的设计要求1. 药品标签标识的设计应符合国家法律法规的要求,不得存在虚假信息或误导性内容。
2. 药品标签标识的字体大小、颜色应清晰可辨,不得存在模糊或混淆信息的情况。
3. 药品标签标识不得使用与药品功能无关的虚构信息或图案,不得夸大宣传。
4. 药品标签标识应注重信息的简洁性和易懂性,方便用药者快速获取必要信息。
五、药品标识标签管理制度责任制1. 药品生产企业应负责制定、实施药品标识标签管理制度,保证药品标签标识的准确性和完整性。
2. 药品流通企业应认真审核药品标签标识信息的准确性和完整性,确保假冒冒牌药品不得违规流通。
3. 药品零售企业应在向患者提供药品时,必须核对药品标签标识信息是否完整、准确,并就用药事项进行告知。
4. 监管部门应加强对药品标识标签管理制度的监督检查,确保药品标签标识符合相关法规规定。
麻醉精神药品表
表1:*******医院麻醉药品、第一类精神药品处方医师签名(签章)式样备案表表2:麻醉药品、第一类精神药品、第二类精神药品处方笺处方为A5纸大小处方为A5纸大小处方为A5纸大小XXXXXX医院麻醉药品、第一类精神药品处方登记专册登记人:XXXXXX医院麻醉药品、第一类精神药品入库验收记录专簿及进出库专用帐册药品名称:剂型:规格:单位:生产单位:供货单位:表5:XXXXXX医院药房麻醉药品、第一类精神药品逐日消耗专用帐册药品名称:剂型:规格:单位:生产厂家:价格:表6:XXXXXX医院临床使用麻醉药品、第一类精神药品交接班记录本科别(病区):表7:XXXXXX医院麻醉药品、第一类精神药品临床使用、空安瓿回收、残余液销毁登记记录科别(病区):表8:XXXXXX医院部门麻醉药品、第一类精神药品退库记录表表9:XXXXXX医院患者剩余麻醉药品、第一类精神药品回收凭证XX年XX月XX日收到患者(代办人为)交回的麻醉药品、第一类精神药品:品名:规格:数量品名:规格:数量医疗机构将按照国家有关规定销毁处理。
特此证明……………………………………..……此联医疗机构保存………………………………………XXXXXX医院患者剩余麻醉药品、第一类精神药品回收凭证XX年XX月XX日收到患者(代办人为)交回的麻醉药品、第一类精神药品:品名:规格:数量品名:规格:数量医疗机构将按照国家有关规定销毁处理。
特此证明……………………………………………患者凭证联…………………..…….………………表10:XXXXXX医院麻醉药品、第一类精神药品空安瓿及废贴回收、销毁记录表主任签字:表11:XXXXXX医院麻醉药品、精神药品销毁记录表编号:销毁日期:年月日主题词:药品管理通知──────────────────────────抄送:卫生部医政司,省药监局,省公安厅。
───────────────────────────────────────────────-────浙江省卫生厅办公室 2005年12月26日印发───────────────────────────16 ─。
麻醉药品、第一类精神药品记录表格
麻醉药品、第一类精神药品出入库记录
药品名称:剂型:规格:生产单位:单位:
麻醉药品、第一类精神药品处方登记表
麻醉药品、第一类精神药品基数保管登记表
药品名称:剂型:规格:单位:固定基数:
说明:基数是指为满足门诊药房、手术室、肿瘤科室等有关科室紧急使用麻醉药品、一类精神药品的需要,医疗机构配备某固定量的麻醉药品、一类精神药品存放在这些科室内,这个限定量称为基数。
基数设定应切合实际。
不合格麻醉药品、第一类精神药品报告记录
麻醉药品、第一类精神药品报废销毁表
2、“规格”、“批号”、“有效期”、“生产厂家”等项目内容无法辨认的,应在相应单元格内注明“不详”。
部门:药品名称:
规格:剂型:单位:
麻醉药品、第一类精神药品退库记录
麻醉药品、第一类精神药品空安瓿交接记录
2、“是否为原批号”一项是指核对空安瓿批号与原领出的相应药品的批号是否一致。
麻醉药品废贴回收、销毁记录
麻醉药品、第一类精神药品空安瓿销毁记录一、安瓿销毁审批
经办人:年月日
批准人:年月日
二、现场销毁记录
销毁日期:年月日
销毁地点:
销毁方式:
负责销毁的部门:
销毁人:年月日
复核人:年月日
-
麻醉药品专用卡发卡登记表
-。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件1
2013年第1期《药品质量公告》中不合格药品明细
药品名称 生产单位 批号 规格 被抽样单位 检验依据 检验结果 不合格 项目 检验机构
羟基脲片 山西远景康业制药有限公司 20120801 0.5g 山西长城药品零售连锁有限公司 《中国药典》2010年版二部 不符合规定 有关物质 山西省食品药品检验所
低硼硅玻璃安瓿 濮阳市东方高科(玻璃)有限公司 20130301 5ml 山西太原药业有限公司 国家药品监督管理局国家药用包装容器(材料)标准(试行)YBB00332002 不符合
规定
折断力 山西省食品药品检验所
沉香* 安徽颐生堂中药饮片有限公司 121028 / 武乡县健康人大药房一部 《中国药典》2010年版一部 不符合规定 性状、鉴别1、2、3;浸出物 长治市食品药品检验所
檀香* 安徽颐生堂中药饮片有限公司 121028 / 武乡县健康人大药房一部 《中国药典》2010年版一部 不符合规定 性状、鉴别1、2;含量测定 长治市食品药品检验所
白鲜皮* 亳州市中药饮片厂 110526 / 榆社县人民医院 《中国药典》2010年版一部 不符合规定 性状 晋中市食品药品检验所
谷精草* 亳州市中药饮片厂 091216 / 榆社县人民医院 《中国药典》2010年版一部 不符合规定 性状 晋中市食品药品检验所
金钱草* 安徽亿源中药饮片科技有限公司 20120801 / 介休市药业有限责任公司 《中国药典》2010年版一部 不符合规定 性状 晋中市食品药品检验所
金钱草* 安徽亿源中药饮片科技有限公司 20120901 / 介休市定阳药业有限公司 《中国药典》2010年版一部 不符合规定 性状 晋中市食品药品检验所
款冬花(秘炙)* 安徽国鑫中药饮片有限公司 20121001 / 寿阳县人民医院 《中国药典》2010年版一部 不符合
规定
性状 晋中市食品药品检验所
木通* 亳州市中药饮片厂 110602 / 榆社县人民医院 《中国药典》2010年版一部 不符合规定 性状 晋中市食品药品检验所
苍耳子 安徽国奥中药饮片有限公司 20130101 / 山西恒山中药有限责任公司 《中国药典》2010年版一部 不符合规定 性状、鉴别(薄层色谱) 临汾市食品药品检验所
海金沙* 亳州市中药饮片厂 110521 / 忻州市双鹤大药房 《中国药典》2010年版一部 不符合规定 总灰分 忻州市食品药品检验所
蒲黄* 亳州市中药饮片厂 120101 / 忻州市仁济便民药房 《中国药典》2010年版一部 不符合规定 总灰分、浸出物 忻州市食品药品检验所
茯苓 / / / 忻州市本草堂大药房连锁有限公司南北大街店 《中国药典》2010年版一部 不符合规定 总灰分 忻州市食品药品检验所
青果 / / / 忻州市本草堂大药房连锁有限公司南北大街店 《中国药典》2010年版一部 不符合规定 性状 忻州市食品药品检验所
丁香 / / / 芮城县中医院 《中国药典》2010年版一部 不符合规定 杂质 运城市食品药品检验所
僵蚕 / / / 平陆县中医医院 《中国药典》2010年版一部 不符合规定 性状、杂质、总灰分 运城市食品药品检验所
皂角刺 / / / 华强百汇康健源药店 《中国药典》2010年版一部 不符合规定 性状、鉴别2 运城市食品药品检验所
皂角刺 / / / 芮城县中医医院 《中国药典》2010年版一部 不符合规定 性状、鉴别2 运城市食品药品检验所
备注:标注“*”的产品经向相关省局核查为假冒产品。
