高考化学元素周期律
高考化学专题复习7元素周期表元素周期律(共84张PPT)

4.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别 为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( ) A.单质的沸点:W>X B.阴离子的还原性:W>Z C.氧化物的水化物的酸性:Y<Z D.X与Y不能存在于同一离子化合物中
答案 D 本题考查物质结构基础知识。由Z是地壳中含量最多的元素可推出Z为O;由Y、Z 同周期且相邻,Y的原子序数小于Z,推出Y为N;由W是短周期中金属性最强的元素可知W为 Na;因X原子序数最小且为主族元素,又知只有Y、Z处于同周期,推出X为H。A项,原子半径 r(Y)>r(Z);B项,NaOH为强碱;C项,N2的氧化性比O2的弱;D项,HNO3(或HNO2)为共价化合物, NH4NO3为离子化合物。
答案 C 本题考查元素周期律相关知识。A项,Na2CO3的溶解度大于NaHCO3的溶 解度;B项,Cl元素的非金属性比P元素的强,所以HCl比PH3稳定;D项,Li元素的金属性 比Be元素的强,所以LiOH的碱性强于Be(OH)2的碱性;C项,乙醇分子间可以形成氢键 ,使乙醇的沸点高于C2H5SH。
易错警示 C项未指明最高价氧化物的水化物,所以不能判断酸性强弱;D项对磷酸形成的铵 盐不熟悉而错选。
教材研读
二 元素周期律及其应用
教材研读
二 元素周期律及其应用
原子序数
周期性
增大 减小
增大 增多
增大
减小 减小 >
+1 +7
-(8-主族序数)
高考化学 元素周期表和周期律(一)考点讲解试题

冠夺市安全阳光实验学校19 元素周期表和周期律(一)【考情报告】【考向预测】1、掌握元素周期律的实质。
元素周期律一直是高考改基本概念、基本理论内容的考查,从“位-构-性”三者的关系等多方面对学生进行考查,在近几年高考中出现频率达100%。
题型相对稳定,多为选择题。
围绕元素周期律,利用信息背景,将元素周期律知识迁移应用,同时考查学生对信息的处理和归纳总结的能力。
2、了解元素周期表(长式)的结构(周期、族)及其应用。
元素同期表是元素周期律的具体体现,是中学化学最重要的基本理论之一,也是学习化学的法。
通过编排元素周期表考查的抽象思维能力和逻辑思维能力;通过对元素原子结构、位置间的关系的推导,培养学生的分析和推理能力。
从近几高考试题看,元素周期律与元素周期表是中学化学的重要理论基础,是无机化学的核心知识是高考中每年必考的的重点内容。
此类题目考查空间很大,知识面很广。
高考中该类型题主要是通过重大科技成果(化学科学的新发展、新发明等)尤其是放射性元素、放射性同位素、农业、医疗、考古等方面的应用为题材,来考查粒子的个微粒的相互关系;元素“位”“构”“性”三者关系的题型会继续以元素及其化合物知识为载体,用物质结构理论,解释现象、定性推断、归纳总结相结合。
可集判断、实验、计算于一体,题型稳定。
试题虽然计算难度不大,但规律性强、区分度好,今后会继续保持。
【经典在线】1.知识梳理一、元素周期表(一).原子序数1、对于一个原子:原子序数=核电荷数=质子数=核外电子数=质量数-中子数。
2.1~20号元素的特殊的电子层结构(1)最外层有1个电子的元素:H、Li、Na、K;(2)最外层电子数等于次外层电子数的元素:Be、Ar;(3)最外层电子数是次外层电子数2倍的元素:C;(4)最外层电子数是次外层电子数3倍的元素:O;(5)最外层电子数是内层电子数总数一半的元素:Li、P;(6)最外层电子数是次外层电子数4倍的元素:Ne;(7)次外层电子数是最外层电子数2倍的元素:Li、Si;(8)次外层电子数是其他各层电子总数2倍的元素:Li、Mg;(9)次外层电子数与其他各层电子总数相等的元素Be、S;(10)电子层数与最外层电子数相等的元素:H、Be、Al。
2017年全国高考化学试题 元素周期律 专题汇编 含答案与解析

2017年全国高考化学试题元素周期律专题汇编Ⅰ—原子结构1.(2017•北京-8)2016年IUPAC命名117号元素为T S,T S的原子核外最外层电子数是7,下列说法不正确的是A.T S是第七周期第ⅦA族元素B.T S的同位素原子具有相同的电子数C.T S在同族元素中非金属性最弱D.中子数为176的T S核素符号是117176Ts【答案】D【解析】A.根据原子核外电子排布规则,该原子结构示意图为,据此判断该元素位于第七周期、第VIIA族,故A正确。
B.同位素具有相同质子数、不同中子数,而原子的质子数=核外电子总数,则T S的同位素原子具有相同的电子数,故B正确;C.同一主族元素中,随着原子序数越大,元素的非金属性逐渐减弱,则T S在同族元素中非金属性最弱,故C正确;D.该元素的质量数=质子数+中子数=176+117=293,该原子正确的表示方法为:117293Ts,故D错误;【考点】原子结构与元素的性质;元素周期律与元素周期表【专题】元素周期律与元素周期表专题【点评】本题考查原子结构与元素性质,题目难度不大,明确原子结构与元素周期律的关系为解答关键,注意掌握原子构成及表示方法,试题培养学生的分析能力及灵活应用能力。
2.(2017•新课标Ⅱ-9)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是A.原子半径:d>c>b>aB.4种元素中b的金属性最强C.c的氧化物的水化物是强碱D.d单质的氧化性比a单质的氧化性强【答案】B【解析】由以上分析可知a为O元素、b可能为Na或Mg、c为Al、d为S元素.A.同周期元素从左到右原子半径逐渐减小,应为b>c>d,a为O,原子半径最小,故A错误;B.同周期元素从左到右元素的金属性逐渐降低,则金属性b>c,a、d为非金属,金属性较弱,则4种元素中b的金属性最强,故B正确;C.c为Al,对应的氧化物的水化物为氢氧化铝,为弱碱,故C错误;D.一般来说,元素的非金属性越强,对应的单质的氧化性越强,应为a的单质的氧化性强,故D错误。
高考化学元素周期律知识

高考化学元素周期律知识利用元素周期表判断:周期表中同周期靠前、同主族靠下的金属,金属性强下面是小编为大家整理的关于高考化学元素周期律知识,希望对您有所帮助。
欢迎大家阅读参考学习!高考化学元素周期律知识第一片:概述1.概念:元素的性质随原子序数的递增,呈现周期性的变化。
2.决定因素:周期表中元素核外电子排布的周期性变化3.内容同周期(左→右)同主族(上→下)核外电子排布电子层数相同,最外层电子数从1逐渐增加至稳定结构电子层数逐渐增加,最外层电子数相同元素化合价最高正价从+1逐渐增加到+7(一、二周期除外)从第ⅣA族出现-4逐渐增加至-1,最后以0价结束最高正价及最低负价相同,最高正价等于其族序数原子半径逐渐减小逐渐增大金属性、非金属性金属性逐渐减弱,非金属性逐渐增强金属性逐渐增强,非金属性逐渐减弱电负性逐渐变大逐渐变小电离能逐渐增大逐渐减小第二片:中学阶段需要知道的几个相关问题(1)1.化合价知识:⑴数值是化合物中原子得失电子(离子化合物)或形成共用电子对(形成共价化合物)的数目⑵单质化合价为0,但化合价为0的不一定是单质,如HCHO、C2H4O2中的C 的化合价等(也可能是分数→氧化数)⑶金属只有正价,有负价的一定的非金属⑷主族元素最高正价等于其族序数(F、O除外)⑸F是唯一没有正价的元素(O有+2价,OF2)⑹化合物中各元素化合价代数和等于0⑺通常元素的最高正价+∣最低负价∣=8⑻共价化合物中,若最外层电子数+∣化合价∣=8的原子,为8电子稳定结构。
2.粒子(包括原子和阴、阳离子)半径大小对比:通常情况是:先对比电子层数,电子层数愈多,其半径愈大;电子层数相同时,再对比核电荷数,核电荷数愈大,其粒子半径愈小。
第二片:中学阶段需要知道的几个相关问题(2)3.元素金属性、非金属性的强弱对比⑴金属性强弱对比标准:①利用金属活动性顺序表判断:靠前的金属金属性强②利用元素周期表判断:周期表中同周期靠前、同主族靠下的金属,金属性强③和水或酸反应产生氢气剧烈的金属性强④置换反应中,被置换的金属,金属性弱⑤原电池中负极金属的金属性强⑥电解池中阴极优先放电(即氧化性强)的金属阳离子的金属性弱(Fe3+→Fe2+例外)⑦最高价氧化物对应的水化物的碱性强的金属,金属性强。
高考化学知识点讲解考点元素周期律

目夺市安危阳光实验学校考点13元素周期律1.复习重点1.同周期元素及其化合物性质的递变规律;2.同主族元素及其化合物性质的递变规律,理解元素周期律的实质3..理解元素周期律与原子结构的关系。
4..能根据元素周期律预测元素的性质。
2.难点聚焦元素周期律:(1)元素原子核外电子排布的周期性变化:随着原子充数的增加,元素排列呈周期性变化结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。
(2)元素原子半径的周期性变化:(3)元素主要化合价的周期性变化:注:①元素重要化合价的变化中O一般无正价,F无正价,最高正价与最低负价的关系;②最高正化合价+|最低负化合价|=8(仅适用于非金属元素)③金属无正价④有些非金属有多种化合价,如:C元素有+2,+4,-4价(在有机物中也可以有-3,-2,-1价);S元素有+4,+6,-2价;Cl元素有-1,+1,+3,+5,+7价;N元素有-3,+1,+2,+3,+4,+5价。
(4)元素的金属性和非金属性的周期性变化:电子层数相同,随着原子序数的递增,原子半径递减,核对核外电子的引力逐渐增强,失电子能力逐渐减弱,得电子能力逐渐增强,即元素的金属性逐渐减弱,非金属性逐渐增强。
①.元素的金属性:指元素气态原子失去电子的能力。
元素金属性强弱判断的实验依据:a.金属单质跟水或酸反应置换出氢气的难易程度:越容易则金属性越强,反之,金属性越弱;b.最高价氧化物对应水化物的碱性强弱:最高价氢氧化物的碱性越强,这种金属元素金属性越强,反之,金属性越弱;c.金属单质间的置换反应例:比较1:①镁与2mL1mol/L 盐酸反应②铝与2mL1mol/L 盐酸反应 所以金属性:l Mg A > 比较2:⑴钠与水反应(回忆) ⑵镁与水反应【实验5-1】 碱性:2aOH Mg(OH)N > 金属性:Na Mg Al >>②元素的非金属性:指元素气态原子得到电子的能力。
元素非金属性强弱判断的实验依据:a.非金属元素单质与氢气化合的难易程度及生成氢化物的稳定性强弱:如果元素的单质跟氢气化合生成气态氢化物容易且稳定,则证明这种元素的非金属性较强,反之,则非金属性较弱; b.最高价氧化物对应水化物的酸性强弱:酸性越强则对应的元素的非金属性越强;c.非金属单质间的置换反应例:222222()l 2HCl l r 2HBr r 2()H F HF H C HI HI +=+2加热22阴暗处混合爆炸,HF 最稳定=(混合气体光照爆炸,HC 稳定)H +B (混合加热反应,HB 较稳定)H +I 缓慢反应,很不稳定非金属性:l r F C >>B >I 对于同一周期非金属元素:如2i l S P S C 、、、等非金属单质与2H 反应渐趋容易,其气态氢化物的稳定性为:432i l S H PH H S HC <<<上述非金属元素最高价氧化物对应水化物的酸性强弱顺序为: 非金属性:i l S P S C <<< 结论: a g l i l N M A S P S C金属性逐渐减弱,非金属性逐渐增强 (5)元素周期律的实质:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
高中化学一轮复习:元素周期律和元素周期表知识点总结
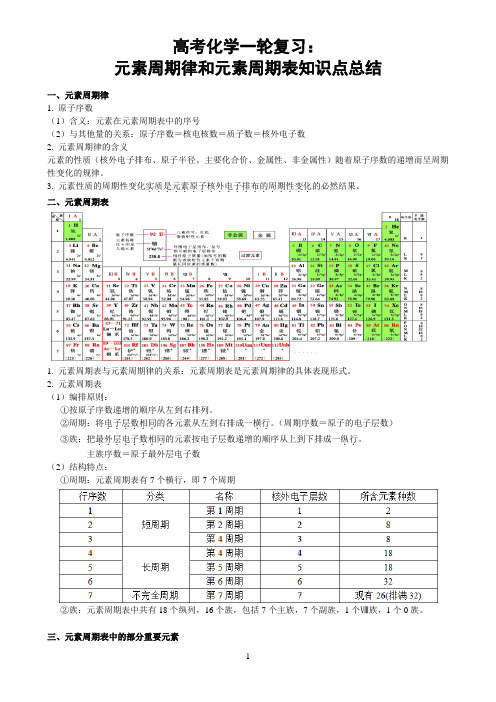
高考化学一轮复习:元素周期律和元素周期表知识点总结一、元素周期律1. 原子序数(1)含义:元素在元素周期表中的序号(2)与其他量的关系:原子序数=核电核数=质子数=核外电子数2. 元素周期律的含义元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着原子序数的递增而呈周期性变化的规律。
3. 元素性质的周期性变化实质是元素原子核外电子排布的周期性变化...................的必然结果。
二、元素周期表1. 元素周期表与元素周期律的关系:元素周期表是元素周期律的具体表现形式。
2. 元素周期表(1)编排原则:①按原子序数递增的顺序从左到右排列。
②周期:将电子层数相同..。
(周期序数=原子的电子层数)......的各元素从左到右排成一横行③族:把最外层电子数相同..。
........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数(2)结构特点:①周期:元素周期表有7个横行,即7个周期②族:元素周期表中共有18个纵列,16个族,包括7个主族,7个副族,1个Ⅷ族,1个0族。
三、元素周期表中的部分重要元素四、焰色反应1、Na 黄Li 紫红K 浅紫(透过蓝色钴玻璃观察,因为钾里面常混有钠,黄色掩盖了浅紫色)2、Rb 紫Ca 砖红色Sr 洋红Rb 紫Cu 绿Ba 黄绿Co 淡蓝五、微粒半径的大小与比较(1)一看“电子层数”:当电子层数不同时,电子层数越多,半径越大。
如:同一主族元素,电子层数越多,半径越大如:r(Cl)>r(F)、r(O2-)>r(S2-)、r(Na)>r(Na+)。
(2)二看“核电荷数”:当电子层数相同时,核电荷数越大,半径越小。
如:同一周期元素,电子层数相同时核电荷数越大,半径越小。
如r(Na)>r(Cl)、r(O2-)>r(F-)>r(Na+)。
(3)三看“核外电子数”:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
如:r(Cl-)>r(Cl) 、r(Fe2+)>r(Fe3+)。
全国高考化学元素周期律的综合高考真题汇总及答案
全国高考化学元素周期律的综合高考真题汇总及答案一、元素周期律练习题(含详细答案解析)1.已知元素X 、Y 均为短周期元素,X 元素的一种核素常用于测文物的年代,Y 元素原子半径是所有原子中最小的,元素X 、Y 可形成两种常见化合物M 和N ,已知M 可以使高锰酸钾酸性溶液褪色,M 分子中所含X 元素的质量是Y 元素质量的6倍,且M 的相对分子质量为56。
N 是一种常用溶剂,它的实验式XY 。
回答下列问题:(1)符合条件的M 的有 ______种。
(2)任意写一种不带支链的M 的结构简式__________。
(3)若在N 与液溴的混合液中加入铁粉可以发生反应(在如图装置a 容器中反应),则:①写出a 容器中发生的所有反应的化学方程式:_____________。
②d 容器中NaOH 溶液的作用是_____________。
(4)在碘水中加入N 振荡静置后的现象是__________。
(5)等质量M 、N 完全燃烧时消耗O 2的物质的量较多的是________(填“M ”或“N ”)。
【答案】3 CH 2=CH -CH 2-CH 3 2Fe +3Br 2=2FeBr 3、+Br 23FeBr −−−→+HBr 吸收HBr 和Br 2,防止污染环境 溶液分层,下层无色,上层紫红色 M【解析】【分析】短周期元素X 元素的一种核素常用于测文物的年代,则X 为碳(C );Y 元素原子半径是所有原子中最小的,则Y 为氢(H )。
元素X 、Y 可形成两种常见化合物M 和N ,已知M 可以使高锰酸钾酸性溶液褪色,M 分子中所含X 元素的质量是Y 元素质量的6倍,且M 的相对分子质量为56,则M 为分子式C 4H 8的烯烃;N 是一种常用溶剂,它的实验式XY ,则N 为苯(C 6H 6)。
【详解】由以上分析可知,M 是分子式为C 4H 8的烯烃,N 是分子式为C 6H 6的苯。
(1)符合条件的M 有CH 2=CHCH 2CH 3、CH 3CH =CHCH 3、(CH 3)2C =CH 2,共3种。
高考化学元素周期律综合练习题附答案
高考化学元素周期律综合练习题附答案一、元素周期律练习题(含详细答案解析)1.下表列出了①~⑩十种元素在周期表中的位置。
族周期ⅠA01①ⅡAⅢAⅣAⅤAⅥAⅦA2②④⑩3⑤⑥⑦③⑧⑨回答下列问题:(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是____________________(填化学式)(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
【答案】 O=C=O Ne O 2Na+2H2O=2NaOH+H2↑ 2HClO4+Na2CO3=CO2↑+2NaClO4 +H2O H2S Al(OH) 3 +OH- = AlO2- +2 H2O H2O(或H2O2) Na2O(或Na2O2或NaH)【解析】【分析】从表中元素所在的位置,可推出①为氢(H),②为碳(C),③为磷(P),④为氧(O),⑤为钠(Na),⑥为镁(Mg),⑦为铝(Al),⑧为硫(S),⑨为氯(Cl),⑩为氖(Ne)。
高考化学三轮复习回归教材重难点 05 元素周期律再熟悉 Word版含解析
回归教材重难点05 元素周期律再熟悉物质结构、元素周期律在高考中主要以选择题型考查,常见形式为“元素推断型选择题”,也有对原子“位-构-性”关系的直接考查,试题比较基础。
本考点是高考五星高频考点,2020年~2022年高考全国卷均为必考题。
一、原子结构1.核反应遵循规律:nm X+baY dcZ+feW(1)质子数守恒:m+a=c+e(2)质量数守恒:n+b=d+f2.常见的等电子微粒(1)常见的“10电子”粒子(2)常见的“18电子”粒子3.具有相同电子层排布的微粒(1)与He原子具有相同电子层排布的微粒(2电子微粒)阴离子原子阳离子电子层排布H-He Li+Be2+(2)与Ne原子具有相同电子层排布的微粒(10电子微粒)阴离子原子阳离子电子层排布N3-O2-F-Ne Na+Mg2+Al3+(3)与Ar原子具有相同电子层排布的微粒(18电子微粒)阴离子原子阳离子电子层排布P3-S2-Cl-Ar K+Ca2+(4)特点①结构特点:电子层数相同,电子总数相同②位置特点:阴前阳后稀中间,负电多前正多后③半径特点:原子序数越大,微粒半径越小4.1~18号元素原子核外电子排布的特点(1)电子层排布:x 或2,x或2,8,x(22或10(3)简单离子的最外层电子数为0或2或8(4)1~20号元素原子结构的特殊关系特殊关系元素最外层电子数等于次外层电子数的一半Li、Si最外层电子数等于次外层电子数Be、Ar最外层电子数等于次外层电子数的2倍 C最外层电子数等于次外层电子数的3倍O最外层电子数等于次外层电子数的4倍Ne最外层电子数等于电子层数H、Be、Al最外层有1个电子H、Li、Na、K最外层有2个电子He、Be、Mg、Ca内层电子数之和是最外层电子数2倍的元素Li、P电子总数为最外层电子数2倍的元素Be二、元素周期表1.元素周期表的结构2.族序数与列数的关系(1)2、3周期IIA和IIIA相邻,原子序数相差1(2)4、5周期IIA和IIIA之间有副族和VIII族,原子序数相差11(3)6、7周期IIA和IIIA之间有副族和VIII族,还额外多出镧系和锕系,原子序数相差25 3.元素周期表的实际应用4.周期表中的元素(1)元素种类最多的族:ⅢB族,共32种元素(2)元素种类最多的主族:ⅠA族,共7种元素(3)元素种类最多的周期:7周期,共32种元素(4)在短周期中非金属元素多,在周期表中金属元素多。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学元素周期律☞基础题1.下列说法正确的是()A.元素周期表中元素排序的依据是原子的核电荷数B.元素周期表有16个纵行,也就是16个族C.原子的最外层电子数相同的元素,一定属于同一族D.电子层数相同的粒子,其对应元素一定属于同一周期3.现行元素周期表中已列出112种元素,其中元素种类最多的周期是() A.第四周期B.第五周期C.第六周期D.第七周期【答案】C【解析】现行元素周期表中,第六、七周期第ⅢB族为镧系和锕系元素,各有15种元素,由于第七周期未排满,故第六周期元素种类最多。
4.下图各为元素周期表的一部分(数字为原子序数),其中X为35的是()6.已知33As、35Br位于同一周期。
下列关系正确的是()A.原子半径:As>Cl>PB.热稳定性:HCl>AsH3>HBrC.还原性:As3->S2->Cl-D.酸性:H3AsO4>H2SO4>H3PO47.近年来,我国在超导体材料研究方面居于世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第六周期第ⅢA族。
下列对铊的可能性质的推导正确的是()①是易导电的银白色金属②Tl(OH)3是两性氢氧化物③Tl3+氧化能力比Al3+强④单质能与稀硝酸反应生成硝酸盐A.①④B.②③C.只有①D.只有④【答案】A9.元素周期表是学习化学的重要工具,它隐含着许多信息和规律。
下表所列是五种短周期的原子半径(2)B元素处于元素周期表中________周期________族;(3)在元素周期表中________的分界处,可以找到制半导体材料的元素;(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是________(填化学式);(5)C、E形成的化合物为________(填化学式)。
【答案】10.A、B、C、D、E五种短周期元素的原子序数依次增大,上述元素中只有一种金属元素。
A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。
又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体。
(1)写出C、D、E三种元素的名称:C.________,D________,E________。
(2)写出AB2使澄清石灰水变浑浊的化学方程式:_______________________________________________________________________ _。
(3)写出C、E的单质分别与NaOH溶液反应的离子方程式:______________________________________,_ _______________。
☞提升题1.甲、乙是周期表中同主族相邻元素,若甲的原子序数为x,则乙的原子序数不可能是() A.x+2 B.x+4C.x+8 D.x+18【答案】B【解析】同一主族相邻的两元素的原子序数可以相差2(如H和Li)、8(如O和S)、18(如Cl和Br),但不能相差4。
2.“嫦娥一号”卫星在北京航天飞机控制中心科技人员的精确控制下,准确落于月球东经52.36°、南纬1.50°的预定撞击点。
“嫦娥一号”担负的四大科学目标之一是探测下列14种元素的含量和分布情况:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于主族元素的有()A.4种B.5种C.6种D.7种4.A、B、C三种元素的原子序数依次为a、b、c,它们的离子A n+、B n-、C m-具有相同的电子层结构,且n>m,则下列关系正确的是()A.a>b>c B.a>c>bC.a=b+m+n D.a=c-n-mA.元素①位于第二周期第ⅣA族B.气态氢化物的稳定性:②>④C.最高价氧化物对应水化物的酸性:⑤>④D.元素的最高正化合价:③=⑤6.以下有关元素性质的说法不正确的是()A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4原子半径最大的是①B.具有下列最外层电子排布式的原子中,①3s23p1②3s23p2③3s23p3④3s23p4第一电离能最大的是③C.①Na、K、Rb②N、P、As③O、S、Se④Na、P、Cl,元素的电负性随原子序数增大而递增的是④D.某元素气态基态原子的逐级电离能分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+7.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是()A.由m X a+与n Y b-,得m+a=n-bB.X2-的还原性一定大于Y-C.X、Y一定不是同周期元素D.若X的原子半径大于Y,则气态氢化物的稳定性H m X一定大于H n Y【答案】B【解析】A项中m X a+与n Y b-的电子层结构相同,则m-a=b+n;C项中X、Y可以是O和F,或S和Cl;D项中X、Y形成的气态氢化物的稳定性应该是H n Y大于H m X。
8.X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X 与Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期且W不为稀有气体元素;X、Y、Z三种元素的族序数之和为16。
下列说法正确的是()A.Q与W不能形成10电子、14电子、18电子分子B.Y的最高价氧化物对应水化物的化学式只能表示为H4YO4C.Y、Z、Q分别与X化合,只能形成AB2型化合物D.X、Z、W中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性9.已知X、Y和Z三种元素的原子序数之和等于42。
X元素原子的4p轨道上有3个未成对电子,Y元素原子的2p轨道上有2个未成对电子。
X跟Y可形成化合物X2Y3,Z元素通常只可以形成正一价离子。
请回答下列问题:(1)X元素原子基态时的电子排布式为________________,该元素的符号是__________。
(2)Y元素原子的价电子的电子排布图为______________ ,该元素的名称是________。
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________。
(1)元素W的名称________,Z的原子结构示意图__________,A的电子式__________。
(2)写出D、E的化学式:D__________、E________。
(3)①已知38 g A与Y完全反应生成B、C时放出a kJ的热量,写出该反应的热化学方程式:__________________________________________________________________。
②F与水反应的化学方程式:________________________________________________。
☞三年高考题1.(2013福建卷)四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。
下列说法不正确...的是A.原子半径Z<MB.Y的最离价氧化物对应水化物的酸性比X 的弱C.X 的最简单气态氢化物的热稳定性比Z的小D.Z位于元索周期表中第2 周期、第ⅥA族【答案】B2.(2013广东卷)元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R 单质在暗处与H2剧烈化合并发生爆炸。
则下列判断正确的是A.非金属性:Z<T<XB.R与Q的电子数相差26C.气态氢化物稳定性:R <T<QD.最高价氧化物的水化物的酸性:T>Q3.(2013江苏卷)短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。
X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。
下列说法正确的是()A.原子半径的大小顺序: r(Y)>r(Z)>r(W)B.元素Z、W 的简单离子的电子层结构不同C.元素Y 的简单气态氢化物的热稳定性比Z 的强D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物【答案】D4.(2013山东卷)W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W 的气态氢化5.(2012·北京理综,9)已知33As、35Br位于同一周期。
下列关系正确的是()A.原子半径:As>Cl>PB.热稳定性:HCl>AsH3>HBrC.还原性:As3->S2->Cl-D.酸性:H3AsO4>H2SO4>H3PO4确。
6.(2012·山东理综,9)下列关于原子结构、元素性质的说法正确的是() A.非金属元素组成的化合物中只含共价键B.ⅠA族金属元素是同周期中金属性最强的元素C.同种元素的原子均有相同的质子数和中子数D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强【答案】B8.(2012·新课标全国卷,13)短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。
X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。
根据以上叙述,下列说法中正确的是()A.上述四种元素的原子半径大小为W<X<Y<ZB.W、X、Y、Z原子的核外最外层电子数的总和为20C.W与Y可形成既含极性共价键又含非极性共价键的化合物D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点10.(2011·新课标全国卷,13)短周期元素W、X、Y和Z的原子序数依次增大。
元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。
下列说法错误的是()A.元素W、X的氯化物中,各原子均满足8电子的稳定结构B.元素X与氢形成的原子比为1∶1的化合物有很多种C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成D.元素Z可与元素X形成共价化合物XZ2。
