乙烯分子空间结构
乙烯_烯烃知识点汇总(全)精编版

乙烯 烯烃知识点总结一、乙烯的组成和结构乙烯分子的结构简式:CH 2 〓 CH 2乙烯分子的结构:键角约120°,分子中所有原子在同一平面,属平面四边形分子。
二、乙烯的制法工业上所用的大量乙烯主要是从石油炼制厂和石油化工厂所生产的气体中分离出来的。
实验室制备原理及装置① 浓H 2SO 4的作用:催化剂、脱水剂。
② 浓硫酸与无水乙醇的体积比:3∶1。
配制该混合液时,应先加5 mL 酒精,再将15 mL 浓硫酸缓缓地加入,并不断搅拌。
③ 由于反应温度较高,被加热的又是两种液体,所以加热时容易产生暴沸而造成危险,可以在反应混合液中加一些碎瓷片加以防止。
(防暴沸)④ 点燃酒精灯,使温度迅速升至170℃左右,是因为在该温度下副反应少,产物较纯。
⑤ 用排水法收集满之后先将导气管从水槽里取出,再熄酒精灯,停止加热。
〖讨论〗此反应中的副反应,以及NaOH 溶液的作用①乙醇与浓硫酸混合液加热会出现炭化现象,使生成的乙烯中含有CO 2、SO 2等杂质。
SO 2也能使高锰酸钾酸性溶液和溴的四氯化碳溶液褪色,因此,检验乙烯气体之前,应该使气体先通过NaOH 溶液,除去CO 2和SO 2。
②乙醇与浓硫酸共热到140℃,乙醇发生分子间脱水,生成乙醚(C 2H 5-O-C 2H 5)三、乙烯的性质1.物理性质:无色、稍有气味、难溶于水、密度小于空气的密度。
2.化学性质(1)氧化反应a.燃烧 CH 2=CH 2+3O 2−−→−点燃2CO 2+2H 2O (火焰明亮,并伴有黑烟)b.使酸性KMnO 4溶液褪色(2)加成反应:有机物分子中双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
(溴的四氯化碳溶液的红棕色褪去)乙烯除了与溴之外还可以与H2O、H2、卤化氢、Cl2等在一定条件下发生加成反应,如工业制酒精的原理就是利用乙烯与H2O的加成反应而生成乙醇。
(见《自主学习能力测评》P633)聚合反应nCH2==CH2EMBED\*MERGEFORMAT−−−→−催化剂—其中 CH2=CH2 为单体—CH2—CH2—为链节 n为聚合度聚乙烯的分子很大,相对分子质量可达到几万到几十万。
第七章第二节课时1乙烯

溶解性 __难__溶于水
如何收集乙烯?
排水法
三、乙烯的分子结构 1.乙烯的分子结构
分子式 电子式 结构式 结构简式 球棍模型
120°
C2H4
: :
HH H :C ::C :H
H H
C=C
H H
CH2=CH2
120° 120°
空间填充 模型
2.乙烯的结构特点
(1)空间构型:平面型分子(6个原子共平面) 键角:120º
2.加成反应——烯烃的特征反应
【实验7-3】把乙烯通入溴的CCl4溶液或溴水溶液中 现象:乙烯使溴水或溴的CCl4溶液褪色
CH2=CH2 + Br2→CH2Br-CH2Br 1, 2 - 二溴乙烷 (无色液体,ρ>ρ水)
反应中量的关系: 1 mol碳碳双键消耗 1 mol Br2 n(碳碳双键)=消耗n(Br2)
点燃
C2H4 + 3O2 2CO2 + 2H2O
【思考】为什么伴有黑烟? 乙烯含碳量高,燃烧不充分
应用: 可用于鉴别CH4和C2H4
黑烟 乙烯
甲烷
(2)被酸性KMnO4溶液氧化 现象: 溶液紫红色褪去
-2
CH2=CH2
KMnO4(H+)
+4
CO2
应用: 可用于鉴别CH4和C2H4(烷烃和烯烃)
【思考】能用酸性KMnO4除去烷烃中混有的乙烯吗?
1.来源
经过分馏→裂化→裂解
石油
乙烯
乙烯的产量:衡量一个国家石油化工的发展水平
2.用途 (1)合成有机高分子材料、药物等。 (2)是植物生长的调节剂和果蔬的催熟剂。
重要的化工原料
塑料—聚乙烯PE 合成乙醇
高中化学第三节--乙烯-烯烃ppt课件

七、烯烃(单烯烃)
•1、概念: 分子里含有碳碳双键的不饱和链烃叫烯烃。
•2、烯烃的通式:CnH2n (n≥2)同环烷烃通式 最简式:CH2
结构特征: 与C=C双键相连的四个原子在同一个面上, .
其余的可能共面,也可能不共面。
3、烯烃的同分异构体
⑴ 碳链异构: 在分子中由于支键的位置不同而产生的异构。
实验1 :在空气中点燃乙烯
现象:点燃纯净的乙烯,它能在空气里 燃烧,有明亮的火焰。
有关的化学反应为:
C 2 C H 2 3 O H 2 点 燃2 C 2 2 H O 2 O ( L )
.
实验2:把甲烷通入到酸性高锰酸钾溶液中
实验3:把乙烯通入到酸性高锰酸钾溶液中
现象:甲烷不能使酸性高锰酸钾溶液褪色。乙 烯使酸性高锰酸钾溶液逐渐褪色。 说明:酸性高锰酸钾溶液具有强氧化性,乙烯 能被氧化,具有还原性,能发生氧化还原反应。 而甲烷比较稳定。 结论1:用酸性高锰酸钾溶液可以区别乙烯和 甲烷等饱和烷烃。
.
如果在某种特殊情况下,碳碳双键发生断裂 了,但又没有其它原子存在,这时会发生什 么变化呢?
CH2=CH2 CH2=CH2
―→ ―CH2 ― CH2― ―→ ―CH2 ― CH2―
…… ……
.
催化剂
nCH2=CH2
[CH2—CH2] n
乙烯聚合过程
聚合反应:分子量小的化合物分子(单体)互相 结合成分子量大的化合物(高分子化合物)
H OH
浓硫酸 170 ℃
CH2=CH2 + H2O
分子内脱水
乙醇(酒精) 注意:浓硫酸与乙醇的体积比为3:1.将浓硫酸注入乙醇, 浓硫酸作用:催化剂、脱水剂。
.
3装置:液+液→气体(乙烯)
c2h4分子结构

c2h4分子结构
C2H4是乙烯分子的分子式,也称为乙烯、乙烯烷,是一种无色、无味、易燃的气体,具有较强的反应活性,是工业上的重要原材料之一。
乙烯分子结构由两个碳原子和四个氢原子组成,属于共价键化合物。
在乙烯分子结构中,两个碳原子通过一个共价键连接,每个碳原子还
与一个氢原子通过单一共价键相连。
这样,C2H4分子结构中就有四
个单紫外共价键。
由于一个碳原子共享4个电子,而乙烯中的两个碳
原子共享4+4=8个电子。
这就形成了一对π电子云,这对电子云恰
好位于两个碳原子之间,使乙烯具有双键的性质。
这种双键结构也形
成了乙烯的反应活性,在许多化学反应中起着关键作用。
乙烯分子结构中两个碳原子的杂化形态为sp2杂化,每个碳原子上有
三个杂化轨道,其中一个为sp2杂化轨道,另外两个分别为p轨道。
两个碳原子中的sp2杂化轨道分别形成了C-C单键,而两个碳原子上未杂化的p轨道形成了π键。
这些键的结构使乙烯分子非常刚性和稳定。
在乙烯分子中,两个碳原子之间的距离为1.34Å,每个碳原子与其相
邻的氢原子之间的距离为1.09Å,比甲烷分子的结构更紧凑,因此更
具有反应性。
此外,由于其分子结构中仅含碳与氢两种元素,失去的
氢原子可以更容易地替换成其他基团,使其成为一种广泛用途的原材料。
总之,乙烯分子结构是由两个碳原子和四个氢原子组成的共价键化合物。
由于其双键结构,乙烯具有较强的反应活性以及广泛的应用前景。
此外,其分子结构的稳定和刚性也是其在工业领域得到广泛应用的原
因之一。
不饱和烃(不饱和烃乙烯与塑料)高一化学精品讲义(沪科版2020)(教师版)

7.2.2 不饱和烃-不饱和烃、乙烯与塑料学习聚焦知识精讲知识点01 乙烯乙烯1.物理性质乙烯为无色易燃气体,熔点-169℃,沸点℃,几乎不溶于水,难溶于乙醇,是石油化工最重要的基础原料。
2.乙烯的结构乙烯的分子式为C2H4,电子式为,结构式为,结构简式为CH2=CH2,球棍模型为,比例模型为,空间构型为平面形,即乙烯分子中6个原子在同一平面内,键角(键与键之间的夹角)为120°。
3.乙烯的化学性质 (1)氧化反应 ①可燃性乙烯在空气中的燃烧现象为火焰明亮并伴有黑烟。
反应的化学方程式为:CH 2=CH 2+3O 2−−−→点燃2CO 2+2H 2O 。
②与氧化剂反应 操作如右图。
现象:酸性KMnO 4溶液的紫色褪去。
结论:C 2H 4能被氧化剂KMnO 4氧化,使酸性KMnO 4溶液褪色。
(2)加成反应①概念:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应,叫做加成反应。
②乙烯的加成反应a .常温下使溴水褪色,反应的化学方程式为: CH 2=CH 2+Br 2→CH 2Br —CH 2Br ;b .与H 2加成制乙烷,反应的化学方程式为:CH 2=CH 2+H 2∆−−−→催化剂CH 3—CH 3; 乙烯水化法制乙醇,反应的化学方程式为: CH 2=CH 2+H 2O −−−−−→催化剂加热、加压CH 3CH 2OH ; 与HCl 加成制氯乙烷,反应的化学方程式为:CH 2=CH 2+HCl −−−→催化剂CH 3CH 2Cl 。
(3)聚合反应①聚合反应:由相对分子质量小的化合物分子互相结合成相对分子质量大的高分子的反应,叫聚合反应。
②加聚反应:在聚合反应中,由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物的分子,这样的聚合反应同时也是加成反应,所以这种聚合反应又叫加成聚合反应,简称加聚反应。
③乙烯的加聚反应化学方程式为:nCH 2=CH 2−−−→催化剂[CH 2—CH 2]n ,产物均称为聚乙烯。
知识讲解_乙烯(基础)
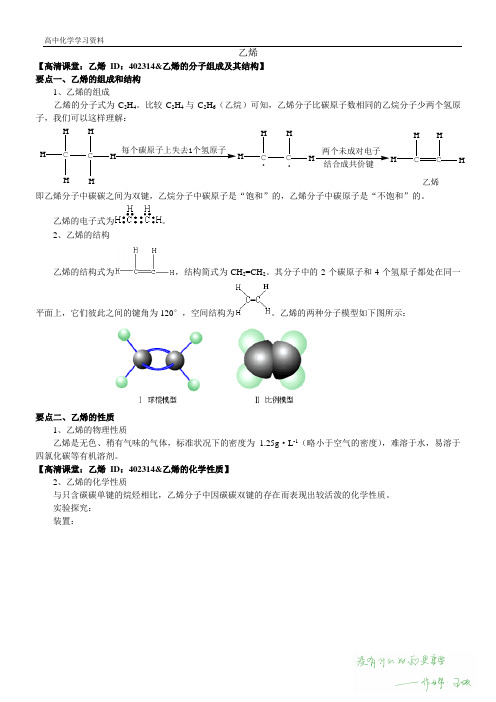
乙烯【高清课堂:乙烯ID:402314&乙烯的分子组成及其结构】要点一、乙烯的组成和结构1、乙烯的组成乙烯的分子式为C2H4。
比较C2H4与C2H6(乙烷)可知,乙烯分子比碳原子数相同的乙烷分子少两个氢原子,我们可以这样理解:CHHH C HHH每个碳原子上失去1个氢原子CHHC HH.两个未成对电子结合成共价键CHHC HH乙烯.即乙烯分子中碳碳之间为双键,乙烷分子中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
乙烯的电子式为。
2、乙烯的结构乙烯的结构式为,结构简式为CH2=CH2。
其分子中的2个碳原子和4个氢原子都处在同一平面上,它们彼此之间的键角为120°,空间结构为。
乙烯的两种分子模型如下图所示:要点二、乙烯的性质1、乙烯的物理性质乙烯是无色、稍有气味的气体,标准状况下的密度为1.25g·L-1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
【高清课堂:乙烯ID:402314&乙烯的化学性质】2、乙烯的化学性质与只含碳碳单键的烷烃相比,乙烯分子中因碳碳双键的存在而表现出较活泼的化学性质。
实验探究:装置:实验步骤与现象:实验步骤实验现象将气体通入酸性高锰酸钾溶液中溶液褪色将气体通入溴的四氯化碳溶液中溶液褪色用排水法收集气体验纯后,点燃火焰明亮,伴有黑烟结论一:石蜡油分解产生了能使高锰酸钾溶液、溴的四氯化碳溶液褪色的气态产物,由此可知产物中含有与烷烃性质(烷烃不能使酸性高锰酸钾溶液褪色)不同的烃。
结论二:研究表明,石蜡油分解的产物主要是乙烯和烷烃的混合物。
要点诠释:a.碎瓷片起催化作用。
b.高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c.酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d.酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化乙烯使酸性高锰酸钾溶液褪色的实质是乙烯被酸性高锰酸钾溶液氧化。
乙烯的化学性质

CH3-CH3 +Cl2
光
多种产物+HCl
CH2=CH2+HCl
催化剂
CH3-CH2Cl (氯乙烷)
3、乙烯的用途
⑴有机化工原料
乙烯的产量是衡量一个国家石油
化工发展水平的重要标志。
⑵植物生长调节剂、催熟剂
1、物理性质 2、结构
C=C
3、化学性质
⑴氧化反应 ⑵加成反应 ⑶加聚反应
4、用途
1、不能用于鉴别甲烷和乙烯的试剂是 ( C ) A.溴的四氯化碳溶液 B.酸性高锰酸钾溶液 C.苛性钠溶液 D.溴水 2、乙烯发生的反应中,不属于加成反应的是( D ) A.与H2反应生成乙烷 B.与水反应生成乙醇 C.与溴水反应使之褪色 D.与O2反应生成CO2和水 3、CH4中混有C2H4, 欲除去C2H4得到干燥CH4, 最好 可能生 依次通过哪一组试剂 ( C ) 成CO2 A.澄清石灰水,浓硫酸 B.KMnO4酸性溶液,浓硫酸 C.Br2水,浓硫酸 D.浓硫酸,KMnO4酸性溶液
试写出乙烯分子的电子式、结构式、结构简 式。
二、 乙烯的分子结构
分子式: C2H4
电子式: 结构式: 结构简式: CH2=CH2
CH2CH2
乙烯的空间构型
乙烯的球棍模型
乙烯的比例模型
6个原子在同一平面,平面型分子。
【实验1】点燃纯净的乙烯,观察燃烧时火焰的颜色.
【实验2】将乙烯通入盛有酸性高锰酸钾溶液的试 管中,观察试管内溶液颜色的变化。
(2)与酸性KMnO4反应
实 验 实验现象 实验结论
通入酸性KMnO4 溶液中
褪色
乙烯能被酸性 KMnO4氧化
常作什么剂?
三、乙烯的化学性质:
第三章 烯烃

电子云呈圆柱形对称分布
电子云集中于两原子核连线 分子有对称轴
对称轴上电子云密度最大
电子云呈双冬瓜形
电子云分散于分子平面上下 无对称轴,有对称面 对称轴上电子云密度为零 键能较小
键 的 性 质
键能大
成键两原子可绕键轴自由旋转
键的极化度小 较稳定,不易断裂
不能自由旋转
键易极化变形 活性高,易断裂
第二节
X
CH3CH2CH=CH2 + HBr
CH3CH2CCH3 + CH3CH2CH2CH2Br
Br
主
I
CH3CH2C=CH2 + HI
CH3
CH3CH2-C-CH3 100%
CH3
区位选择性反应:当反应的取向有可能产生几个产物 时,主要生成其中一个产物的反应。 马氏规则是世
界上第一个区 区位专一性反应:当反应中化学键的断裂有两种以上 域选择性反应 的取向,但却只有一个产物生成的反应。 烯与其它不对称试剂加成时,正性基团加到含H较多 的双键碳上,负性基团加到含H较少的双键碳上。
HO
δ
与卤水的加成→β -卤代醇
Cl
δ
3、与乙硼烷的加成
CH2=CH2 + BH3 CH2=CH2 (CH3CH2)3B CH3CH2BH2 H2O2 H2O/OHCH2=CH2 CH3CH2BHCH2CH3
3CH3CH2OH + H3BO3
不对称烯烃的加成,氢加到含氢较少的双键碳原子上
共有12个电子,其中8个电子形 成四个B—H键,在一个平面上, 平面上下有两个三中心两电子键
激发态
杂化态
sp2杂化轨道
三个sp2杂化轨道的关系
sp2杂化轨道与p轨道的关系
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙烯分子空间结构
乙烯分子是由两个碳原子和四个氢原子组成的有机分子,化学式为
C2H4。
它是一种无色、易燃的气体,具有特殊的空间结构。
乙烯分子的空间结构可以通过VSEPR理论来解释。
VSEPR理论是指分子中原子周围的电子对会排斥彼此,从而使得原子之间呈现出一定的几何形态。
在乙烯分子中,碳原子与氢原子共价键形成一个平面三角形,其中两个碳-氢键位于平面内,另外两个碳-氢键则位于平面上方和下方。
这种空间结构可以用三维模型来表示。
在三维模型中,乙烯分子呈现出扁平的形态。
其中两个碳-氢键位于平面内,夹角约为120度;另外两个碳-氢键则位于平面上方和下方,夹角约为180度。
这种构型被称为“扭曲矩形”。
乙烯分子的扭曲矩形构型使得它具有一些特殊性质。
例如,在光谱学中,乙烯分子有一个非常特殊的吸收峰,在185-200纳米处,被称为“π-π*吸收峰”。
这个吸收峰是由于乙烯分子的扭曲矩形构型所导致的。
此外,乙烯分子还具有较高的反应活性,可以进行加成反应、氧化反应等。
总之,乙烯分子的空间结构是由两个碳原子和四个氢原子组成的扭曲矩形构型。
这种特殊的构型使得乙烯分子具有一些特殊性质,在化学和物理领域中有着广泛的应用。
