(完整版)天津大学无机化学考试试卷(上册)答案
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
天津大学无机化学考试试卷(上册)答案
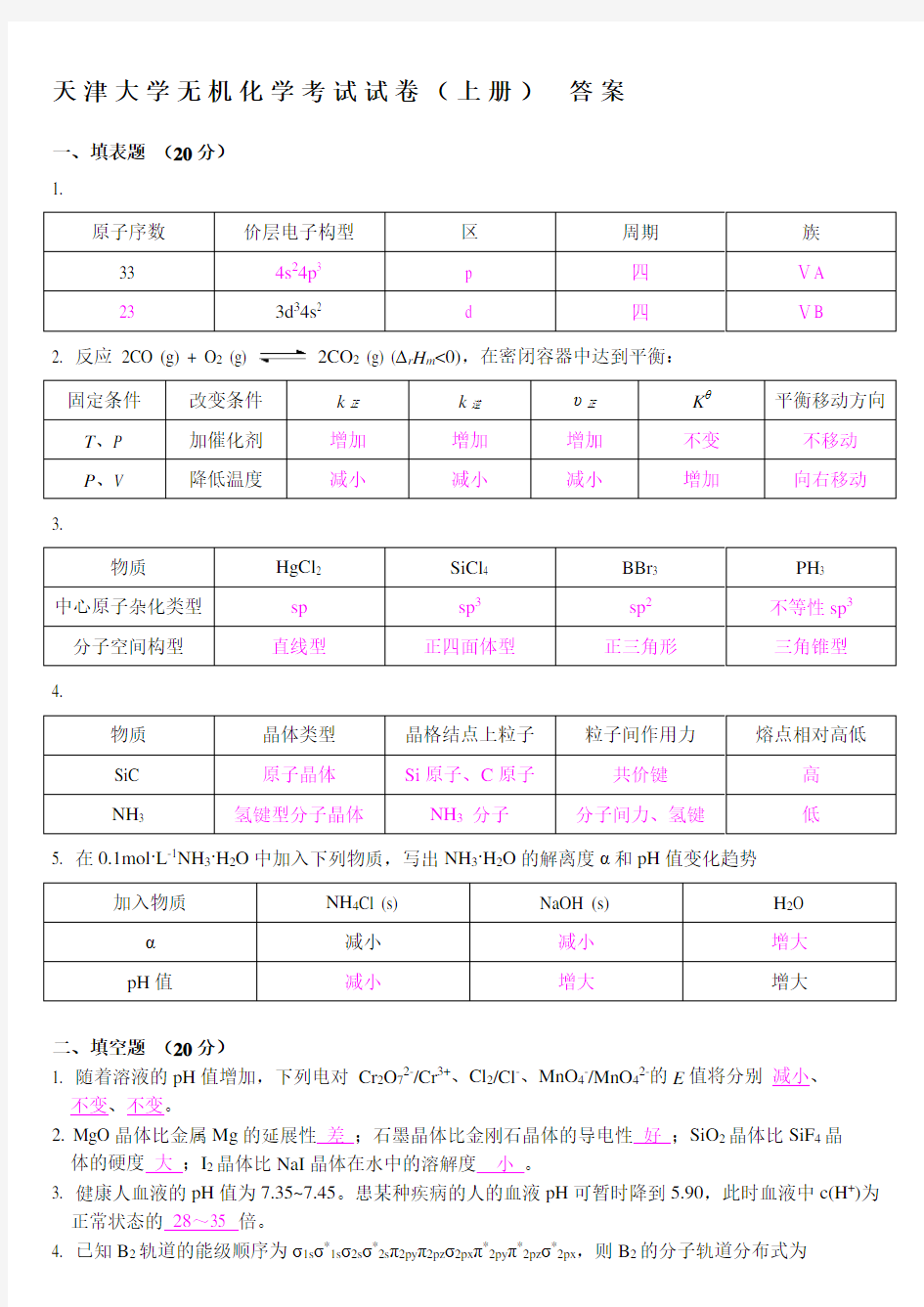
一、填表题(20分)
1.
原子序数价层电子构型区周期族
33 4s24p3 p 四ⅤA
23 3d34s2 d 四ⅤB
2. 反应2CO (g) + O2 (g) 2CO2 (g) (∆r H m<0),在密闭容器中达到平衡:
固定条件改变条件k正k逆υ正Kθ平衡移动方向T、P 加催化剂增加增加增加不变不移动P、V 降低温度减小减小减小增加向右移动3.
物质HgCl2 SiCl4 BBr3 PH3
中心原子杂化类型sp sp3sp2不等性sp3分子空间构型直线型正四面体型正三角形三角锥型
4.
物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC 原子晶体Si原子、C原子共价键高
NH3 氢键型分子晶体NH3分子分子间力、氢键低
5. 在0.1mol·L-1NH3·H2O中加入下列物质,写出NH3·H2O的解离度α和pH值变化趋势
加入物质NH4Cl (s) NaOH (s) H2O α减小减小增大
pH值减小增大增大
二、填空题(20分)
1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、
不变、不变。
2. MgO晶体比金属Mg的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶
体的硬度大;I2晶体比NaI晶体在水中的溶解度小。
3. 健康人血液的pH值为7.35~7.45。患某种疾病的人的血液pH可暂时降到5.90,此时血液中c(H+)为正常状态的28~35 倍。
4. 已知B2轨道的能级顺序为σ1sσ*1sσ2sσ*2sπ2pyπ2pzσ2pxπ*2pyπ*2pzσ*2px,则B2的分子轨道分布式为
(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(π2py )1(π2pz )1,成键数目及名称两个单电子π键,价键结构式为 。
5. 根据E θ(PbO 2/PbSO 4) >E θ(MnO 4-/Mn 2+) >E θ(Sn 4+/Sn 2+),可以判断在组成电对的六种物质中,氧化性最
强的是 PbO 2 ,还原性最强的是 Sn 2+ 。
6. 表示θ
m r H ∆=θm f H ∆(AgBr, s)的反应式为 Ag(s) + 1/2 Br 2(l) → AgBr(s) 。
7. 用电对MnO 4-/Mn 2+,Cl 2/Cl -组成的原电池,其正极反应为 MnO 4- + 8H + + 5e → Mn 2+ + 4H 2O ,负极反 应为 2 Cl - -2 e → Cl 2 ,电池的电动势等于0.15V ,电池符号为(-)Pt,Cl 2(p θ)|Cl -‖MnO 4-,Mn 2+,H +|Pt(+)。(E θ(MnO 4-/Mn 2+)=1.51V ;E θ(Cl 2/Cl -)=1.36V )
8. 下列各溶液浓度均为0.1 mol ·L -1,按pH 值从小到大顺序排列NH 4NO 3, NH 4F, NH 4OAc, KCN, Na 2CO 3。 KCN, NH 4F, NH 4OAc, NH 4NO 3, Na 2CO 3。 (已知K θ(NH 3·H 2O)=1.8×10-5, K θ(HF)=6.6×10-4,
K θ(HCN)=6.2×10-10, K θ(HOAc)=1.8×10-5, θ1K (H 2CO 3)=4.4×10-7, θ2K (H 2CO 3)=4.8×10-11)
9. 已知V E A /θ:Cr 2O 72- +1.36 Cr 3+ -0.41 Cr 2+ -0.86 Cr ,则E θ(Cr 2O 72- / Cr 2+)= 0.917 V ,Cr 2+能否发生歧化
反应 不能 。
10. 已知氨水溶液中,c(OH -)=2.4×10-3 mol ·L -1, 则此氨水的浓度为0.32 mol ·L -1。(K θ(NH 3·H 2O)=1.8×10-5) 11. 因为SnCl 2强烈水解,在配制其溶液时应加入HCl ,水解反应式为 SnCl 2+H 2O Sn(OH)Cl+HCl 。
12. K θ、θi K 、Δχ分别用来衡量 反应限度的大小、 电解质强弱 、 键的极性 。 13. HF 的沸点比HI 高,主要是由于 HF 中存在氢键 。
14. 物质NaCl 、MgO 、Na 2O 、KCl 的熔点由低到高的顺序是KCl 、NaCl 、Na 2O 、MgO 。
15. 在元素周期表中,同一主族自上而下,元素第一电离能的变化趋势是逐渐 减小 ,因而其金属性依次 增强 ;在同一周期中自左向右,元素的第一电离能的变化趋势是逐渐 增大 ,元素的金属性逐渐 减弱 。
三、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×) (10分)
1. 乙烷裂解生成乙烯:C 2H 6 (g) C 2H 4 (g) + H 2 (g) 。在实际生产中常在恒温恒压下采用加入过 量水蒸汽的方法来提高乙烯的产率,这是因为随着水蒸汽的加入,同时以相同倍数降低了p (C 2H 6)、 p (C 2H 4)、p (H 2),使平衡向右移动。………………………………………………………………………( √ )
2. 波函数ψ表明微观粒子运动的波动性,其数值可大于零,也可小于零,2
ψ表示电子在原子核外空间出现的几率密度。…………………………………………………………………………………….…..(√ )
3. 因为I - 的极化率大于Cl -,所以θsp K (AgI) <θsp K (AgCl)。
……………………………………………( √ ) 4. 在298K 时,最稳定纯态单质的θθθm
m f m f S G H ,,∆∆均为零。…………………………………….. ( × ) 5. Δr G m 代数值越小,K θ就越大,反应进行得越完全。……………………………………..…………….. ( × ) 6. 在相同温度下,纯水或0.1 mol ·L -1HCl 或0.1 mol ·L -1NaOH 溶液中,水的离子积都相同。………. ( √ ) 7. 在氧化还原反应中,如果两个电对的电极电势相差越大,反应就进行得越快。…………………. ( × ) 8. 当溶液中含有多种离子均可与沉淀剂发生沉淀反应时,溶度积小的对应离子一定先沉淀。……. ( × ) 9. 溶度积规则适用于任何难溶电解质,质量作用定律只适用于基元反应。………………………. ( √ ) 10. 偶极矩可衡量分子极性大小,极化率可衡量分子变形性大小,晶格能可衡量离子晶体的稳定性。( √ )
