细胞流式实验实验报告
细胞亚群检测实验报告

1. 了解淋巴细胞亚群检测的基本原理和方法。
2. 掌握流式细胞术在淋巴细胞亚群检测中的应用。
3. 分析实验结果,了解淋巴细胞亚群在免疫调节中的作用。
二、实验原理淋巴细胞亚群检测是利用流式细胞术对淋巴细胞进行分类、计数和功能分析的一种技术。
通过特异性抗体标记,检测淋巴细胞表面标志物,实现对不同亚群的识别。
本实验主要检测T细胞、B细胞和NK细胞亚群。
三、实验材料1. 实验试剂:抗CD3、抗CD4、抗CD8、抗CD19、抗CD16、抗CD56单克隆抗体。
2. 实验仪器:流式细胞仪、细胞培养箱、离心机、移液器等。
3. 实验样本:新鲜血液。
四、实验步骤1. 样本采集:采集受试者新鲜血液,分离外周血单个核细胞(PBMCs)。
2. 抗体标记:将分离的PBMCs与抗CD3、抗CD4、抗CD8、抗CD19、抗CD16、抗CD56单克隆抗体混合,室温孵育30分钟。
3. 洗涤:将标记好的细胞用磷酸盐缓冲盐溶液(PBS)洗涤两次。
4. 流式细胞术检测:将洗涤后的细胞上流式细胞仪,进行检测和分析。
5. 数据分析:使用流式细胞术分析软件对实验数据进行处理,计算各亚群细胞比例。
五、实验结果1. T细胞亚群:CD3+T细胞占外周血淋巴细胞的50-70%,其中CD4+T细胞占CD3+T 细胞的30-45%,CD8+T细胞占CD3+T细胞的30-45%。
2. B细胞亚群:CD19+B细胞占外周血淋巴细胞的10-20%。
3. NK细胞亚群:CD16+/CD56+细胞占外周血淋巴细胞的5-15%。
1. 实验结果表明,本实验成功检测了T细胞、B细胞和NK细胞亚群,验证了流式细胞术在淋巴细胞亚群检测中的应用价值。
2. 淋巴细胞亚群在免疫调节中发挥重要作用。
CD4+T细胞具有辅助功能,参与细胞免疫和体液免疫;CD8+T细胞具有杀伤功能,直接杀伤病毒感染细胞和肿瘤细胞;B细胞产生抗体,参与体液免疫;NK细胞具有天然杀伤功能,对病毒感染细胞和肿瘤细胞具有杀伤作用。
最新白细胞分类实验报告

最新白细胞分类实验报告
在本次实验中,我们对人类白细胞进行了全面的分类研究。
通过采用流式细胞术(Flow Cytometry)和免疫组化染色技术,我们成功地对白细胞的不同亚群进行了识别和定量分析。
首先,我们利用流式细胞术对白细胞进行了初步的分类。
通过检测细胞的前向散射(FSC)和侧向散射(SSC)参数,我们能够区分出不同类型的细胞,包括单核细胞、淋巴细胞和粒细胞。
此外,我们还使用了特定的抗体标记物,如CD45和CD14,来进一步区分这些细胞亚群。
在免疫组化染色方面,我们使用了一系列的抗体,针对不同的白细胞表面标志物进行染色。
例如,我们使用了抗CD3抗体来标记T细胞,抗CD19抗体来标记B细胞,以及抗CD14抗体来标记单核细胞。
通过这些染色,我们能够更精确地对白细胞的不同亚群进行分类和计数。
实验结果显示,在我们的样本中,淋巴细胞是白细胞中的主要亚群,占据了大约50%的比例。
其中,T细胞和B细胞的比例分别约为70%和30%。
此外,我们还发现单核细胞占白细胞总数的约10%,而粒细胞则占据了剩余的40%。
通过本次实验,我们不仅确认了白细胞的主要分类,还对它们的相对比例有了更深入的了解。
这些数据对于理解人体免疫系统的功能和疾病状态下的免疫变化具有重要意义。
未来的研究将进一步探索白细胞亚群在不同疾病背景下的作用,以及它们在免疫调节中的具体机制。
流式细胞报告单解读

流式细胞报告单解读流式细胞报告单是一种用于评估细胞表面标记物和细胞内分子的方法。
它可以提供有关细胞类型、数量和状态的信息,对于研究细胞免疫学、疾病诊断和治疗的发展至关重要。
在解读流式细胞报告单时,需要了解报告单中所包含的内容以及每一项指标的意义和临床应用。
本文将从流式细胞报告单的基本结构、常见参数及其解读开始,详细介绍如何解读流式细胞报告单,并强调其在临床诊断和治疗中的重要性。
一、流式细胞报告单的基本结构流式细胞报告单通常包括样本信息、检测项目、检测结果、参考范围和临床意义等内容。
样本信息包括检测样本的来源、采样时间等;检测项目列出了进行的各项检测指标;检测结果包括各项指标的具体数值;参考范围是对正常范围的描述,用于比较检测结果;临床意义则解释了各项指标的意义及其可能的临床意义。
二、常见参数及其解读1. 细胞表面标记物检测流式细胞报告单中常见的细胞表面标记物包括CD3、CD4、CD8、CD19等。
它们可以用来鉴定不同类型的免疫细胞,并对免疫功能进行评估。
比如CD4+ T细胞和CD8+ T细胞的比例可以反映机体的免疫功能状态,CD19+ B细胞数量的变化可以反映某些免疫相关疾病的发展。
2. 细胞内标记物检测流式细胞分析还可以用来检测细胞内分子,比如细胞因子、细胞凋亡标记物等。
这些标记物的变化可以反映细胞活性、炎症程度等,对某些疾病的诊断和监测具有重要意义。
3. 免疫表型分析通过流式细胞分析,可以进行免疫表型分析,以评估细胞亚群的分布和比例。
比如在肿瘤免疫治疗中,通过分析肿瘤微环境中免疫细胞的分布和功能状态,可以为个体化治疗方案提供重要依据。
4. 数据解读及综合分析在解读流式细胞报告单时,需要综合各项指标的变化,结合临床病史、临床表现及其他检查结果进行综合分析。
只有这样,才能更准确地评估患者的疾病状态,为临床诊断和治疗提供更有力的支持。
三、流式细胞分析在临床诊断和治疗中的重要性1. 诊断及疾病监测流式细胞分析可以帮助科研人员和临床医生对多种疾病进行诊断和监测,如各类肿瘤、免疫相关疾病、感染性疾病等。
细胞周期实验报告

细胞周期实验报告一、实验目的本实验旨在研究细胞周期的各个阶段,包括 G1 期、S 期、G2 期和M 期,以及细胞在不同阶段的生理和生化变化。
通过对细胞周期的深入了解,有助于我们更好地理解细胞生长、分裂和遗传物质传递的机制,为相关疾病的研究和治疗提供理论基础。
二、实验原理细胞周期是指细胞从一次分裂结束到下一次分裂结束所经历的过程。
细胞周期的进程受到多种因素的调控,包括细胞内的一系列信号通路和蛋白质复合物。
常用的检测细胞周期的方法是利用流式细胞术,通过对细胞内DNA 含量的测定来区分不同的细胞周期阶段。
处于 G1 期的细胞具有二倍体的 DNA 含量,S 期细胞的 DNA 含量逐渐增加,G2 期和 M 期细胞具有四倍体的 DNA 含量。
三、实验材料与方法(一)实验材料1、细胞株:选用_____细胞株。
2、试剂:胰蛋白酶、PBS 缓冲液、70%乙醇、PI 染液、RNA 酶等。
3、仪器:流式细胞仪、离心机、显微镜等。
(二)实验方法1、细胞培养将细胞接种在培养皿中,在含10%血清的培养基中,置于37℃、5% CO2 的培养箱中培养,待细胞汇合度达到 80%左右时进行实验。
2、细胞收集用胰蛋白酶消化细胞,离心收集,用 PBS 缓冲液洗涤两次。
3、固定细胞将细胞沉淀重悬于 70%乙醇中,于-20℃固定过夜。
4、染色离心去除乙醇,用 PBS 缓冲液洗涤细胞,加入 PI 染液和 RNA 酶,避光孵育 30 分钟。
5、流式细胞术检测用流式细胞仪检测细胞的荧光强度,分析细胞周期各阶段的分布比例。
四、实验结果(一)细胞周期各阶段的比例通过流式细胞术分析,得到以下细胞周期各阶段的比例:G1 期:_____%S 期:_____%G2 期:_____%M 期:_____%(二)结果分析1、 G1 期比例较高,可能表示细胞处于静止或生长缓慢的状态。
2、 S 期比例适中,说明细胞正在进行 DNA 合成,细胞的增殖活动正常。
3、 G2 期和 M 期比例相对较低,可能与细胞的生长条件或细胞本身的特性有关。
流式细胞仪结果分析报告模板

(一)分选基本原理
细胞悬液形成液流柱 压电晶体 产生机械振动
流动室振动
液流断裂成液滴
空白液滴 不充电
弃去
含细胞的液滴 充电
偏转落入收集器
流式细胞仪结果分析报告模板
(二)分选的技术要求
• 分选速度:单位时间内分选的细胞数量。与悬液中 细胞的含量成正比。 • 分选纯度:分选出的目的细胞占所有收获细胞的百 分率。 • 分选收获率:实际收获的分选细胞与设定通过测量点 的分选细胞之间的比率。与纯度成反比。 • 分选得率:从一群体细胞悬液中分辨出目的细胞的 总量,再经分选后得到目的细胞的实际得率。与 分选速度成反比。
光学系统
• 激光光源:气冷式氩离子激光器 • 分色反光镜:反射长/短波长,通过短/长波长 • 光束成形器:两十字交叉放置的透镜 • 透镜组:形成平行光,除去室内光 • 滤片:长通、短通、带通 • 光电倍增管:FS, SS(散射光), FL1, FL2, FL3, FL4(荧光)
流式细胞仪结果分析报告模板
四、流式细胞免疫学技术的质量控制
(一)单细胞悬液制备的质控
• 适当的制备方式 • 处理红细胞 • 实体组织来源标本用机械法 • 温度25~37℃,pH7.0~7.2
流式细胞仪结果分析报告模板
(二)免疫荧光染色的质控
流式细胞仪结果分析报告模板
二、数据显示方式
直分析方图
• 单参数直方图 • 双参数直方图:点图
二维等高图 假三维等高图 • 三参数直方图 • 多参数分析
设门分析:REGION和GATE设置
流式细胞仪结果分析报告模板
(一)单参数直方图
由一维参数(散射光或荧光)与颗粒计数(COUNT)构成,反映同样 散射光或荧光强度的颗粒数量的多少。
流式血细胞分析仪试验报告
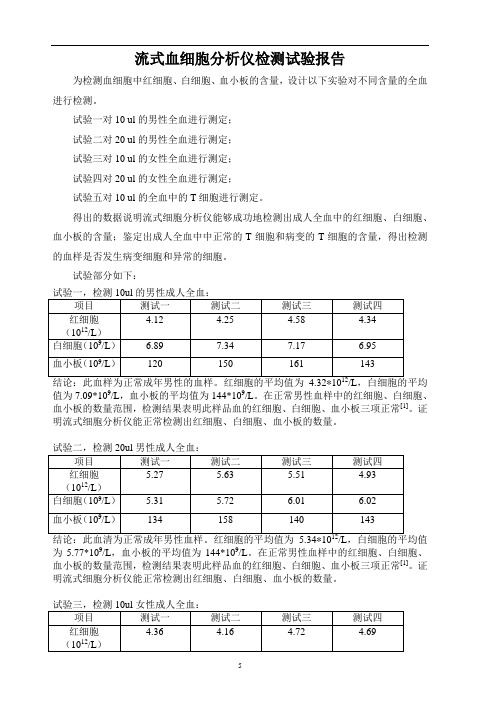
流式血细胞分析仪检测试验报告为检测血细胞中红细胞、白细胞、血小板的含量,设计以下实验对不同含量的全血进行检测。
试验一对10 ul的男性全血进行测定;试验二对20 ul的男性全血进行测定;试验三对10 ul的女性全血进行测定;试验四对20 ul的女性全血进行测定;试验五对10 ul的全血中的T细胞进行测定。
得出的数据说明流式细胞分析仪能够成功地检测出成人全血中的红细胞、白细胞、血小板的含量;鉴定出成人全血中中正常的T细胞和病变的T细胞的含量,得出检测的血样是否发生病变细胞和异常的细胞。
试验部分如下:值为7.09*109/L,血小板的平均值为144*109/L。
在正常男性血样中的红细胞、白细胞、血小板的数量范围,检测结果表明此样品血的红细胞、白细胞、血小板三项正常[1]。
证明流式细胞分析仪能正常检测出红细胞、白细胞、血小板的数量。
为5.77*109/L,血小板的平均值为144*109/L。
在正常男性血样中的红细胞、白细胞、血小板的数量范围,检测结果表明此样品血的红细胞、白细胞、血小板三项正常[1]。
证明流式细胞分析仪能正常检测出红细胞、白细胞、血小板的数量。
为7.16*109/L,血小板的平均值为199*109/L。
在成年女性正常血样中的红细胞、白细胞、血小板的数量范围,检测结果表明此样品血的红细胞、白细胞、血小板三项正常[1]。
证明流式细胞分析仪能正常检测出红细胞、白细胞、血小板的数量。
为4.94*109/L,血小板的平均值为204*109/L。
检测结果表明血样正常[1]。
证明流式细胞分析仪能检测出红细胞、白细胞、血小板的数量。
[1]备注:根据《全国临床检测操作规程》第三版规定各种细胞参考区间如下:红细胞:男性为(4.09~5.74)*1012/L;女性为(3.68~5.13)*1012/L。
白细胞:男性为(3.97~9.15)*109/L;女性为(3.69~9.16)*109/L。
血小板:男性为(85~303)*109/L;女性为(101~320)*109/L试验五,检测10ul全血中的T细胞:8 9 54 0.03 4.579 11 64 0.03 5.4211 61 59 0.18 5.0012 9 13 0.03 1.1913.1 28 39 0.08 3.5613.6 167 25 0.48 2.2814 12 9 0.03 0.8116 18 51 0.05 4.5617 149 26 0.43 2.3318 5 52 0.01 4.2318 33 9 0.10 0.7320 130 52 0.38 4.2321.3 33 17 0.10 1.3522 34 10 0.10 0.7923 159 13 0.46 1.03合计 3.88 80.35试验五:进口仪器检测对比:一:结论:CD3淋巴细胞增生以大B细胞为主,与最后诊断3级四倍体滤泡性淋巴瘤相符。
流式细胞仪结果分析 - 医迈新医学研究所

在某些淋巴细胞凋亡中,用光散射 特性检测凋亡的可靠性较好,而在肿瘤 细胞凋亡中,其可靠性就较差。
细胞凋亡时,细胞固缩,体积变小,
2.光散射特性
FSC降低;染色体降解,核破裂形成,胞 内颗粒往往增多,SSC常增加。细胞坏死
凋亡细胞形态的改变影响其光散射特 时,细胞肿胀,FSC增大;SSC亦增大,
性。前散射光(FSC)与细胞的大小有关, 故可根据FSC和侧SSC区别凋亡细胞和坏
颗粒杂质、气泡 对检测的影响
FSC:反映细胞相对大小及其表面积
外周全血细胞散射光双参数点图
SSC:反映颗粒度及细胞内细胞器的相对复杂性
(红细胞溶解后)
离线设门
在 线 设 门
对血液中淋巴细胞设门(R1)分析其免疫表型
B T
细胞分选
细胞表面标志物检测
从增殖的角度分类高等动物细胞
①连续分裂细胞,在细胞周期中连续运转因而又称为周期细胞,如表皮生发层细胞、 部分骨髓细胞。
结果解读: 纵坐标Cell Number:即计数的有效细胞数;横坐标DNA Content:即DNA含量; G0/G1期细胞占总的61.2%,DNA含量平均值为45.76。G2/M期占13.07%,DNA含量平均值 为91.43。S期占25.73%。G2/G1为2.0。细胞碎片为0.48%,细胞聚集体有0.06%。总的细 胞数(仪器检测到的)为17525个。在细胞周期中分析的细胞数为17431个(即排除了碎 片及聚集体后)。峰的变异系数为4.54%(好)------CV是变异系数。一般CV越小,峰形 越好,越尖锐。能控制在5%左右是比较好的结果,一般小于10%就可以认可了。
FL1
带通/长通透镜 530/30
适用染料 FITC
488nm蓝
流式细胞术检测T细胞亚群

三)流式细胞仪的工作原理
参数测量原理:流式细胞仪可以同时进行多参数测量, 信息主要来自特异性荧光信号和非荧光散射信号。 样品分选原理:流式细胞仪的分选功能是由细胞分选器 来完成的。 数据处理原理:FCM的数据显示方式包括单参数直方图 (histogram),二维点图(dotplot),二维高等图 (contour),假三维图(pseudo 3D)和列表模式(list mode)等。
注意染色后避光,保障细胞免疫荧光的稳定。样品制备好 后如果不能立即上机检测,须置于40C 冰箱避光保存
9,问题与思考 ① FCM的基本原理是什么?
②
如何使用FCM技术来检测一肿瘤患者的PBMC中 的T细胞组成变化? 在操作FACS时,有哪些注意事项? FCM在免疫学中,有哪些具体的运用?请举三 例说明 细胞亚群的检测有何意义?请举例说明
②
③
加入PBS缓冲液(有0.1%的NaN3)1ml洗细胞,1000rpm 离心10min,倾去上清液,加入固定液300ul重悬细胞, BD-FACBCalibur流式细胞仪检测。 细胞的吸入,将装有细胞的FACS测定管放置到机器吸 管孔处,先预检测样品,然后进行实际检测。课根据细 胞的浓度选择测定的速度(低,中或高)。所有的数据 将自动存入微机。
四,T细胞亚群的检测
1,实验内容:流式细胞术检测CD4+,CD8+T细胞。
2,实验原理(1):T淋巴细胞具有高度的异质性, 根据 其表面的标志和功能特征,可分为若干个亚 群,各亚群之间相互调节,共同发挥其免疫学功能。 因此,对淋巴细胞亚群数量的检测能反映机体的免 疫功能状态。本次实验用流式细胞术检测 CD4+,CD8+T细胞。(流式细胞术原理见前面流式细 胞术的基本原理及应用)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细胞流式实验实验报告
细胞流式实验实验报告
引言:
细胞流式实验是一种常用的细胞学技术,可以用于研究细胞表面标记物、细胞周期、细胞凋亡等多个方面。
本实验旨在探究细胞流式实验的原理、步骤以及数据分析方法。
一、实验原理
细胞流式实验是一种通过细胞悬液经过流式细胞仪进行分析的技术。
其原理基于细胞在流体中的流动性质,通过激光照射细胞并测量其散射光和荧光信号来获取相关信息。
二、实验步骤
1. 细胞样本制备:将细胞培养物离心收集细胞,用PBS洗涤细胞,然后用细胞培养基悬浮细胞。
2. 细胞固定与渗透化:向细胞悬液中加入固定液,使细胞固定,然后加入渗透化液,使细胞膜渗透。
3. 标记抗体:将待检测的抗体与细胞悬液混合,使其与细胞表面的特定分子结合。
4. 细胞染色:加入荧光染料,使细胞发出荧光信号。
5. 流式细胞仪分析:将细胞悬液注入流式细胞仪,通过激光照射细胞并测量其散射光和荧光信号。
6. 数据分析:使用流式细胞仪软件对数据进行分析,如细胞计数、细胞比例、荧光强度等。
三、实验结果
通过细胞流式实验,我们获得了以下结果:
1. 细胞计数:通过流式细胞仪软件分析,我们得到了细胞的总数。
2. 细胞比例:根据细胞表面标记物的不同,我们可以得到不同类型细胞的比例。
3. 荧光强度:荧光染料的强度可以反映细胞中特定分子的表达水平。
四、实验讨论
1. 实验优化:在实验过程中,我们可以对实验步骤进行优化,如固定液和渗透
化液的浓度、抗体的浓度、染料的浓度等。
2. 数据解读:根据细胞流式实验的结果,我们可以进一步解读细胞的特点,如
细胞表面标记物的表达情况、细胞凋亡的程度等。
3. 实验应用:细胞流式实验在生物医学研究中具有广泛的应用,如肿瘤细胞的
鉴定、免疫细胞的分析等。
五、结论
细胞流式实验是一种重要的细胞学技术,可以用于研究细胞表面标记物、细胞
周期、细胞凋亡等多个方面。
通过优化实验步骤和数据分析,我们可以获得准
确的实验结果,并进一步解读细胞的特点。
细胞流式实验在生物医学研究中具
有广泛的应用前景。
六、致谢
感谢实验室的老师和同学们对本次实验的支持和帮助。
参考文献:
[1] 陈晓峰, 王明, 陈晓明. 细胞流式技术在免疫学研究中的应用[J]. 中国实验诊断学, 2012, 16(6): 1075-1077.
[2] Robinson J P, Roederer M. Flow cytometry strikes gold[J]. Science, 2015, 350(6257): 739-740.。
