溶液PH的计算
溶液稀释后的pH计算

溶液稀释后的pH计算溶液被溶剂稀释后体积增大,而溶质的量没有变化,则浓度相应下降。
根据稀释前、后溶质的量不变的原则,可得到稀释规则:C1V1=C2V2式中C1,C2分别表示浓溶液和稀溶液的浓度(mol·L-1);V1,V2分别表示浓溶液和稀溶液的体积(L)。
对强电解质溶液,求出稀溶液的浓度,便知其H+浓度,即可计算pH。
弱电解质溶液稀释后电离度增加,必须用电离常数与浓度、电离度的关系计算H+浓度,然后求出其pH。
例1 取pH1=3的盐酸溶液1mL,加水稀释至100mL,求稀盐酸的pH2。
解 pH1=3,c1=[H+]=10-3mol·L-1,pH2=-lg[H+]=-lg10-5=5答稀盐酸的pH为5。
例2 已知醋酸的电离常数Ka=1.8×10-5,今取c=0.1mol·L-1醋酸溶液1mL,加水稀释至100mL,求溶液的pH变化。
解 c1=0.1mol·L-1,V1=10-3L,V2=0.1L,则平衡时H+浓度为x,根据方程=1.34×10-3(mol·L-1)pH=-lg[H+]=-lg1.34×10-3=2.87pH=-lg[H+]=-lg1.34×10-4=3.87答溶液的pH由2.87变到3.87。
以上的pH计算中,因水电离出的H+比酸电离出的H+少得多,均可忽略不计。
当酸的浓度小于10-7mol·L-1,10-8mol·L-1或更小时,溶液中的H+主要来自水的电离,而酸电离出的H+可忽略不计。
例如,碱溶液中的H+就是来自水的电离。
下题将说明这点。
例3 将pH1=6的盐酸溶液1mL,加水稀释至100mL,求盐酸的浓度和溶液的pH2。
解盐酸为强电解质,pH=6,[H+]=10-6mol·L-1溶液的H+来自水的电离和盐酸的电离,可粗略地认为:[H+]=10-7+10-8=1.1×10-7mol·L-1pH=-lg[H+]=-lg1.1×10-7=6.96=7答稀盐酸的浓度为10-8mol·L-1,溶液的pH约为7。
化学反应原理-PH值计算.

pH=-lg c(H+)
混合后显碱性: C(OH-)V碱- C(H+) V酸 -)= C(OH 碱过量抓 V +V 酸 碱 住氢氧根进 +)=Kw/c(OH-) C(H 行计算
pH=-lg c(H+)
强酸பைடு நூலகம்强碱混合—— 一般中和
把pH=13的NaOH溶液与pH=2的硫酸溶液混合后,所得溶 液的pH=11,则NaOH溶液和硫酸溶液的体积之比为_____。
计算方法: ①酸性溶液: c(H+)→pH=-lgc(H+) ②碱性溶液: c(OH-)→c(H+)→pH=-lgc(H+)
③中性溶液:25℃时,pH=7
已知:lg2=0.3、lg3=0.5、lg5=0.7
一、单一溶液的pH值计算: 1、25℃时,0.01mol/L盐酸的pH 、 0.5mol/L 稀硫酸的pH? 2 0 2、25℃时,10-5mol/L的NaOH的pH? c(OH-)=10-5mol/L c(H+)=10-14/10-5=10-9mol/L pH=-lgc(H+)=9
解析 可设碱与酸的体积分别为 V 碱和 V 酸,由题意可知,混 10-14-13· V碱-10-2· V酸 合后碱过量,可列等式: =10-(14-11), V酸+V碱 解之可得 V 碱∶V 酸=1∶9。
溶液pH的计算
一、单一溶液的pH
二、酸碱溶液稀释后的pH 三、混合溶液的pH 1.强酸+强酸 2.强碱+强碱 3.强酸+强碱
第三章 溶液的酸碱性和PH
第二课时 溶液pH的计算
授课人
高二化学组
[学习目标定位] 1.了解单一溶液pH求算方法 2.知道溶液稀释时pH的变化规律
pH的计算方法

1.强酸、强碱溶液的pH强酸:C——→[H+]——→pH强碱:C——→[OHˉ]——→[H+]——→pH2.弱酸、弱碱溶液pH弱酸:[H+]——→pH3.强酸与强酸混合液的pH4.强碱与强碱混合液的pH注意:不能这样计算.如果已知两种强酸或两种强碱的pH,同样用上述方法来计算,而且有如下近似规律:①两强酸等体积混合,混合液PH= pH小+0.3②两强碱等体积混合,混合液pH=pH大-0.35.强酸与强碱混合液的pH:①强酸与强碱正好完全反应,溶液呈中性,pH=7再求pH= -lg[H+]余最后求pH= -lg[H+]6.酸碱溶液用水稀释后的pH①强酸、强碱的稀释:在稀释时,当它们的浓度大于10-5mol·L-1时,不考虑水的电离;当它们的浓度小于10-5mol·L-1时,应考虑水的电离.例如:pH=6的HCl溶液稀释100倍,混合pH≈7(不能大于7);pH=8的NaOH溶液稀释100倍,混合pH≈7(不能小于7);pH=3的HCl溶液稀释100倍,混合液pH=5;pH=10的NaOH溶液稀释100倍,混合液pH=8.②弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范围.例如:pH=3的CH3COOH溶液,稀释100倍,稀释后3<pH<5;pH=10的NH3·H2O溶液,稀释100倍,稀释后8<pH<10;pH=3的酸溶液,稀释100倍,稀释后3<pH<5;pH=10的碱溶液,稀释100倍,稀释后8≤pH<10;该文章转自[榆林教学资源网]:/tbfd/hxfd/g3hx/200903/5955.shtml。
ph怎么算

ph怎么算
pH值是水溶液中氢离子活度的表示方法。
严格地说,pH值定义为氢离子活度的负对数,即pH=-logaH+,但氢离子活度却难以由实验准确测定。
在实际工作中,pH值按下式测定
pH=pHs+(E-Es)/k式中:E为含有待测溶液(pH)的原电池电动势(伏);Es为含有标准缓冲液(pHs)的原电池电动势(伏)。
k为与温度(t)有关的常数[k=0.05916+0.000198(t-25℃)]。
由于待测物的电离常数、介质的介电常数和液接界电位等诸多因素均可影响pH值的准确测量,所以实验测得的数值只是溶液的表观pH值,它不能作为溶液氢离子活度的严格表征。
尽管如此,只要待测溶液与标准缓冲液的组成足够接近,由上式测得的pH值与溶液的真实pH值还是颇为接近的。
BPH-200A型PH计广泛应用于工业、电力、农业、医药、食品、科研和环保等领域。
也可用国家标准物质管理部门发放的标示pH值准确至0.01pH单位的各种标准缓冲液校正仪器。
溶液的pH值使用酸度计测定。
水溶液的pH值通常以玻璃电极为指示电极、饱和甘汞电极为参比电极进行测定。
PH值的计算

[H+] = c HCl + [OH- ] = c HCl + Kw/[H+]
解二次方程, 解二次方程,得 [H+] = 1.6×10-7 × pH = 6.80
2、强碱 (1) (2) c NaOH≥ 10-6
, ,
[OH- ] = c NaOH [OH- ] = c NaOH + [H+]
c NaOH <
+
= 2.1×10-5 mol L-1 × pH = 4.69 2、弱酸弱碱盐 、 为例, 以NH4Ac为例,NH4+ :Ka、Ac : Ka’ 为例 PBE: [HAc] + [H+] = [NH3] + [OH ]
’ Ka[NH4 ] Kw [H+][HA] +[H+] = + + + Ka [H ] [H ] -
二、 pH值的计算 值的计算 强酸(碱 溶液 ㈠ 强酸 碱)溶液 pH的计算 的计算
1、强酸 (1) c HCl≥ 10-6
, ,
[H+] = c HCl [H+] = c HCl + [OH- ]
(2) c HCl <
溶液稀释时pH的计算
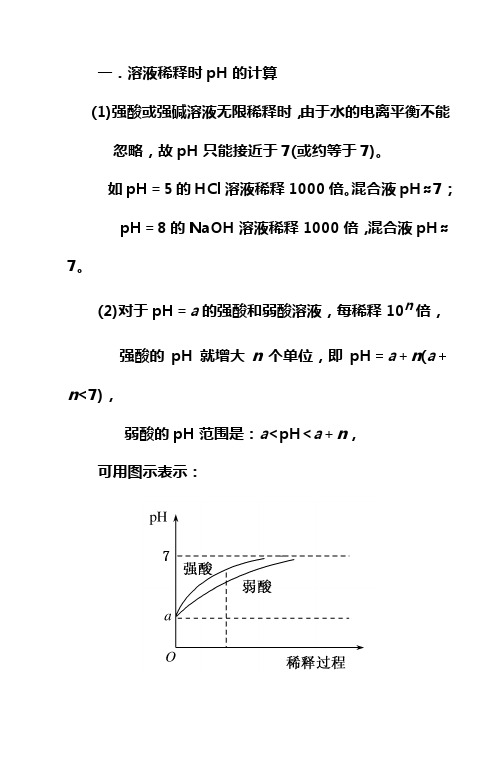
一.溶液稀释时pH的计算
(1)强酸或强碱溶液无限稀释时,由于水的电离平衡不
能忽略,故pH只能接近于7(或约等于7)。
如pH=5的HCl溶液稀释1000倍。
混合液pH≈7;
pH=8的NaOH溶液稀释1000倍,混合液pH≈7。
(2)对于pH=a的强酸和弱酸溶液,每稀释10n倍,
强酸的pH就增大n个单位,即pH=a+n(a+n<7),弱酸的pH范围是:a<pH<a+n,
可用图示表示:
从图像可以看出:
①强酸比弱酸pH改变快;
②当稀释同样倍数时,强酸pH变化大于弱酸;
③当稀释至pH相同时,弱酸稀释的倍数大。
3)对于pH =b 的强碱和弱碱溶液, 每稀释10n
倍, 强碱的pH 减小n 个单位,即pH =b -n (b -n >7), 弱碱的pH 的范围是:b -n <pH<b ,
可用图示表示。
从图像可以看出:
①强碱比弱碱pH 改变快;
②当稀释同样倍数时,强碱pH 变化大于弱碱; ③当稀释至pH 相同时,弱碱稀释的倍数大。
pH 计算记忆方法:
碱按碱,酸按酸,同强混合在中间, 异强混合看过量,无限稀释7
为限。
酸碱溶液pH的计算.
酸碱溶液 pH 计算1.溶液酸碱性与 pH氢离子浓度的负对数被称为 pH。
pH=-lg[H+] 氢氧根离子浓度的负对数被称为 pOH。
pOH=-lg[OH-]pH+pOH=pKw =14.00 295K 时,溶液的酸碱性和 pH 值的关系是:中性溶液 pH=7 酸性溶液 pH<7 碱性溶液 pH>72.酸碱溶液 pH 计算 (1)离子活度离子所表现出来的有效浓度称为离子活度,用α表示。
活度和离子浓度具有如下关系α=fcf 称为活度系数,它反映了离子在溶液中所受到的相互作用力的大小。
一般情况下, f<1,所以α<c。
在极稀的强电解质溶液和不太浓的弱电解质溶液 中, f 值逐渐接近于 1,离子活度与浓度几乎相等。
(2)强酸强碱溶液 pH 计算强酸强碱在溶液中几乎全部离解,因此 H+或 OH-的平衡浓度等于加入的强酸或强 碱的浓度。
(3)一元弱酸弱碱溶液 pH 计算对于一元弱酸,如果同时满足 c/Ka≥500 和 cKa≥10Kw 两个条件,则[H+ ] = c ⋅ Ka对于一元弱碱,如果同时满足 c/Kb≥500 和 cKb≥10Kw 两个条件,则[OH− ] = c ⋅ Kb(4)多元弱酸弱碱溶液 pH 的计算多元弱酸、多元弱碱在水溶液中是分级离解的,一级电离远大于二、三级电离。
在实际计算中,当 c/Ka1>500 时,可按一元弱酸作近似计算,即:[H+ ] = c ⋅ Ka1(5)两性物质溶液 pH 的计算两性物质如 NaHCO3、K2HPO4,浓度较高时,溶液的 H+浓度可按下式作近似计算:[H+ ] = K K⋅ a1 a2又如 NH4Ac 亦是两性物质,以 Ka 表示正离子酸(NH4+)的离解常数, Ka′ 表示负离子碱(Ac-)的共轭酸(HAc)的离解常数,这类两性物质的 H+浓度可按下式计算:[H+ ] = Ka ⋅ Ka′pH=1 2( pKa+pKa′)。
溶液中酸碱的浓度和 pH 值的计算
滴定剂的消耗:滴定剂的消耗量应根据滴定反应的性质和待测溶液的浓度进行计算。
滴定误差的定义:滴定过程中产生的误差
滴定误差的计算:根据滴定过程中产生的误差进行计算
滴定误差的来源:仪器误差、操作误差、试剂误差等
酸碱浓度和pH值的测量
酸碱指示剂法:简单易行,但精度较低
pH试纸法:操作简便,但易受温度影响
酸碱浓度的测量方法:可以使用pH计或酸碱指示剂来测量溶液的酸碱浓度
酸碱浓度的影响因素:温度、压力、溶液的组成等
溶液的pH值
pH值是衡量溶液酸碱性的指标
pH值在化学实验和工业生产中有重要应用
pH值与氢离子浓度有关,氢离子浓度越大,pH值越小,反之亦然
pH值范围在0-14之间,7为中性,小于7为酸性,大于7为碱性
定义:酸碱反应的平衡常数等于酸浓度乘以碱浓度的乘积
酸碱平衡常数:表示酸碱反应的平衡程度
酸碱平衡常数的定义:表示酸碱反应达到平衡时,酸和碱的浓度的比值
平衡常数的应用:预测酸碱反应的进行程度,判断溶液的酸碱性,指导酸碱滴定实验
平衡常数的影响因素:温度、酸碱的浓度、酸碱的性质
平衡常数的计算公式:Ka = [H+][A-]/[HA]
滴定操作:通过滴定剂的加入,逐步中和溶液中的酸或碱,直至达到终点,从而计算出溶液中酸碱的浓度和pH值
滴定剂的添加:滴定剂应缓慢添加,避免过量添加导致反应过于剧烈。
滴定剂的选择:根据待测溶液的性质和滴定反应的性质选择合适的滴定剂。
滴定剂的浓度:滴定剂的浓度应根据待测溶液的浓度和滴定反应的性质进行调整。
碱性溶液:pH值大于7
pH值范围:0-14
酸性溶液:pH值小于7
中性溶液:pH值等于7
ቤተ መጻሕፍቲ ባይዱ
关于PH值的计算
关于PH值的计算PH值是一个用来衡量溶液酸碱程度的指标。
pH值的计算是通过测定溶液中氢离子(H+)的浓度来得到的。
根据酸碱理论,酸性溶液中氢离子的浓度高,而碱性溶液中氢离子的浓度低。
pH值的取值范围是0到14,其中低于7的溶液被认为是酸性的,高于7的溶液被认为是碱性的,而等于7的溶液则是中性的。
在溶液中,水分子会自发地发生自离解反应,生成氢离子(H+)和氢氧根离子(OH-)。
在中性溶液中,氢离子和氢氧根离子的浓度是相等的。
pH值的计算是通过测定溶液中氢离子浓度的负对数来进行的。
pH = -log[H+]其中[H+]代表氢离子的浓度,log是指以10为底的对数运算。
根据这个公式,pH值与氢离子浓度成反比关系。
也就是说,氢离子浓度越高,pH值越低,溶液越酸性;氢离子浓度越低,pH值越高,溶液越碱性。
测定溶液的pH值可以使用一种叫做pH计的仪器。
在常见的pH计中,会使用一种叫做玻璃电极的传感器来测量溶液中的氢离子浓度。
玻璃电极的原理是基于玻璃与溶液中的氢离子发生反应,产生微弱的电势。
根据这个电势的变化,可以推算出溶液中的氢离子浓度,从而计算出pH值。
除了玻璃电极,还有其他类型的电极,如差减电极、非玻璃电极等,也可以用来测量pH值。
除了使用pH计进行测量,还可以通过化学指示剂的变色来判断溶液的酸碱性。
化学指示剂是一种溶液变色的物质,它能根据溶液的酸碱性发生颜色的变化。
常用的化学指示剂有酚酞、溴酚蓝、甲基橙、溴甲酚绿等。
根据化学指示剂在不同pH值下的颜色变化规律,可以快速推测溶液的酸碱性。
pH值在许多领域都有重要的应用。
例如,在生物学中,pH值对于维持生物体内部环境的稳定至关重要。
在环境科学中,pH值可以用来评估水体、土壤的酸碱程度,以及污染物的溶解、迁移和活性。
在医学和药学领域,pH值是药物的溶解度和吸收性的重要参数。
同时,pH值还在食品、饮料、农业等众多领域中起到了重要的作用。
总结起来,pH值的计算是基于溶液中氢离子浓度的负对数进行的。
化学反应中的酸碱溶液浓度计算与pH值计算
化学反应中的酸碱溶液浓度计算与pH值计算在化学实验和工业生产中,酸碱溶液的浓度和pH值是非常重要的参数。
通过准确计算酸碱溶液的浓度和pH值,我们能够更好地理解化学反应的过程和性质。
本文将介绍一些常用的方法和公式,用于计算酸碱溶液的浓度和pH值。
一、酸碱溶液浓度计算1. 摩尔浓度(mol/L)摩尔浓度是最常用的浓度单位,表示单位体积中所含物质的摩尔数。
计算酸碱溶液的摩尔浓度可以使用以下公式:浓度(mol/L)= 物质的摩尔数 / 溶液的体积(L)2. 百分比浓度(%)百分比浓度表示溶液中溶质的质量百分比。
计算酸碱溶液的百分比浓度,需根据溶质的质量和溶液的总质量,使用以下公式:浓度(%)= (溶质的质量 / 溶液的总质量) × 100%3. 体积浓度(mol/L)体积浓度是指单位体积中溶液中溶质的摩尔数。
计算酸碱溶液的体积浓度,需获得溶质摩尔数和溶液的体积,使用以下公式:浓度(mol/L)= 溶质的摩尔数 / 溶液的体积(L)二、pH值计算pH值是用来表示溶液酸碱性的指标,它是指溶液中氢离子(H+)的活动度的负对数。
计算pH值可以通过以下公式进行:pH = -log[H+]根据酸碱反应中的化学平衡原理,通过pH值可以判断溶液的酸碱性:- pH值小于7,表示溶液为酸性;- pH值等于7,表示溶液为中性;- pH值大于7,表示溶液为碱性。
三、浓度与pH值之间的关系在化学反应中,溶液的浓度与pH值之间存在着一定的关系。
以酸溶液为例,当酸溶液的浓度增加时,pH值会下降,溶液呈现更酸性的性质。
但是需要注意的是,不同酸的性质和强度不同,因此具体的计算过程和公式会有所差异。
四、酸碱溶液浓度计算和pH值计算的应用1. 实验室化学分析在实验室中,化学分析人员需要通过浓度和pH值的计算,来确定样品的性质和含量。
例如,在酸碱滴定法中,通过浓度计算可以确定滴定剂的浓度,从而计算出待测样品中酸或碱的含量。
2. 工业生产过程在工业生产中,及时准确地计算酸碱溶液的浓度和pH值非常重要。
