氧化还原反应的四大规律
氧化还原反应的规律及应用

为氮元素的中间价态,既有氧化性,又有还原性。其发生
氧化反应时,化合价要升高,所以氮元素化合价比 0价低的 NH3不可能是N2的氧化产物;(4)氧化铜具有氧化性,能够把 氨气氧化成N2,自身被还原成Cu,同时H和O结合生成水, 据此可以写出该反应的化学方程式。 答案:(1)④ (4)2NH3+3CuO (2)①④ (3)④
练习
xR2++yH++O2=mR3++nH2O 反应中,则x、y、m、n的数值 分别是多少? X=4,y=4,m=4,n=2
2、强弱规律:
相对较强氧化性的氧化剂跟较强还原性的还原剂反应,
生成弱还原性的还原产物和弱氧化性的氧化产物。
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
应用:判断某些氧化还原反应能否进行或用于比较物质间 氧化性或还原性的强弱。
在含有Cu(NO3)2、Mg(NO3)2和Fe(NO3)3 的溶 液中加入适量锌粉,首先置换出的是( ) A 、Mg B、Cu C、 Fe D、 H2
锌粉由少到多依次反应哪些反应?
3、根据与同一物质反应的难易(条件)判断 如:是否加热,温度高低,有无催化剂等
(1)实验室用二氧化锰与浓盐酸共热制取,反应方程式 为: (2)氯酸钾是常用的氧化剂,在酸性条件下,室温时即 可与浓盐酸反应制取,反应方程式为: (3)历史上,曾用“地康法”制取,这一方法是用CuCl2 作催化剂,在450℃时用空气中的O2跟HCl反应得到。 “地康法”制的化学方程式为: <1>从元素化合价的变化看,以上三程方法的共同点是 ______________。 <2>从上述反应推知,氧化性由强到弱的顺__________;
氧化反应和还原反应虽是两个不同的过程,但在同
氧化还原反应的规律总结

氧化还原反应的规律总结氧化还原反应是一种众所周知的基本化学反应,它也是化学反应中最重要的反应之一。
它可以产生二氧化碳,水,H+和OH-等物质。
本文讨论氧化还原反应的规律总结。
首先,氧化反应一般是指把某种物质中的元素和/或原子从低电子配置水平转变到较高水平,从而产生更多的电子而不是消耗电子的化学反应。
这一规律可以从下面的式子表达:Ox + ne Red + ne-其中,Ox表示被氧化的元素,ne表示消耗的电子数,Red表示被还原的元素,Ne-表示产生的电子数。
其次,还可以将氧化还原反应分为两类,一类是氧化反应,一类是还原反应。
氧化反应是指,某种物质本身或其原子中有供电子的元素,将其损失(氧化)给其他元素,使另一侧的电子构型变成负性。
氧化反应的表达式为:Ox Ox + ne还原反应,指某种物质本身或其原子中没有供电子的元素,由另一侧的电子提供的元素将其补充(还原),使另一侧的电子构型变成正性。
还原反应的表达式为:Red + ne Red最后,氧化还原反应有一些规律可以遵守,例如:一个元素只能氧化或还原,而不能同时氧化和还原;一个物质只能与另一个物质反应,且这两种物质的形态应该相似;氧化反应的产物总是少于原来的物质,还原反应的产物总是多于原来的物质;在氧化反应中,氧化剂总是原有的物质而还原剂总是新的物质;氧化反应的势能总是负的,还原反应的势能总是正的;氧化反应的反应速率总是高于还原反应,还原反应的反应速率总是低于氧化反应。
以上就是有关氧化还原反应的规律总结。
氧化还原反应对于化学反应是非常重要的,它们能够提高我们对化学反应的理解,帮助我们更好地探索和研究化学反应,为化学研究提供科学的基础。
氧化还原反应

氧化还原反应高考总复习1、氧化还原反应的基本规律(1)守恒律氧化还原反应中,电子得失总数相同(或化合价升降总数相同),可用于配平或进行某些计算。
(2)强弱律氧化还原反应若能自发进行,一般为强氧化剂与强还原剂生成弱还原剂和弱氧化剂的过程。
(3)价态律①含多种价态的元素,处于最高价时只有氧化性;处于最低价时只有氧化性;处于中间价时既有氧化性又有还原性。
②同种元素相邻价态间不发生氧化还原反应;同种元素高价化合物与低价化合物,当有中间价态时才有可能发生反应,若无中间价态,则不发生氧化还原反应。
③同种元素不同价态间的氧化还原反应,价态“只靠拢不相交”,如:KClO3+6HCl KCl+3Cl2↑+3H2O(4)顺序律同一种氧化剂遇到还原性不同的几种物质,若均能反应,则按还原性由强到弱的顺序依次反应;同一种还原剂遇到不同的几种物质,若均能反应,则按氧化性由强到弱的顺序依次反应。
(5)难易律一般来说,原子越易失电子(还原性越强),对应阳离子的氧化性越弱;原子越易得电子(氧化性越强),对应阴离子的还原性越弱。
演练1 某化学小组学习氧化还原反应规律时,讨论了以下说法,其中不正确的是()A. 由于还原性Fe2+强于Br-,把Cl2缓慢通入FeBr2溶液中时,Cl2将先氧化Fe2+B. 在反应H2S+H2SO4(浓) S↓+SO2↑+2H2O中,产物S由H2S氧化得到C. C能在高温下还原出Si:SiO2+2C Si+2CO↑,说明C的金属性比Si强D. 根据反映8HCNO+6NO2 7N2+8CO2+4H2O,消耗1molNO2时转移电子的物质的量为4mol2、判断离子方程式书写正误的方法(1)五查①查物质是否能拆成离子形式,若能拆,再看拆写是否正确。
必须记牢溶解性表,注意酸式盐离子除HSO4-外,均不能拆出H+。
②查等号、可逆号是否应用恰当。
如Fe3++3H2O Fe(OH)3(胶体)+3H+,若写成Fe3++3H2O Fe(OH)3↓+3H+,则错。
氧化还原反应规律

氧化还原反应规律
氧化还原反应的三条规律及其应用
一“优先反应”规律
例如:在FeBr2溶液入少量中通Cl2时,因为还原性Fe2+>Br-,所以Fe2+
:
先与Cl2反应。
(1)在浓度相差不大的溶液中
①同时含有几种还原剂时————加入氧化剂,将按照还原性由强到弱的顺序依次反应。
②同时含有几种氧化剂时,————加入还原剂,将按照氧化性由强到弱的顺序依次反应。
例如:在含有Fe3+,Cu2+,H+的溶液中加入铁粉,因为氧化性Fe3+,Cu2+,H+,所以铁粉先与Fe3+反应。
(2)应用:判断物质的稳定性及反应顺序。
二价态归中,“互不交叉”规律
(1)同种元素不同价态之间发生氧化还原反应时可总结为:价态相邻能共存,价态相间能归中,归中价态不交叉,价升价降只靠拢。
(2)应用:判断氧化还原反应能否发生及表明电子转移情况。
三“歧化反应”规律
“中间价”→“高价”+“低价”
具有多种价态的元素都可以发生歧化反应。
应用:判断氧化产物和还原产物及价态高低及表明电子转移情况。
氧化还原反应的相关规律

氧化还原反应的相关规律一、就近原则eg: KCIO 3 + 6HCI ===KCI + 3CI 2 f + 3H 2O反应中KCIO3中的氯元素为+5价,而HCI中的氯元素为-1加价,产物中KCI中的氯元素为-1价,Cl? 中的氯元素为0价,那么究竟是由+5到-1、还是由+5到0呢?在这里就运用了就近原则,因+5离0 比+5离-1要近,所以应为+5到0;其中+5价的氯只有一个,而0价的氯有6个,说明6个0价的氯中只有一个是由+5价得电子而转化为0价,其余的5个则必然是由-1价转化而来的。
习题:H2SO4 + H2S ===== S + SO 2? +2H2O 应为:+6价的硫T +4价的硫-2价的硫T 0价的硫转移电子总数为2个电子二、①、同种元素的不同种价态,最高价的元素只有氧化性,最低价的元素只有还原性,处于中间价态的元素既有氧化性又有还原性。
Eg:CI有-1 0 +1 +5 +7五种价态当处于-1价时则只有还原性当处于+7价是则只有氧化性而处于0 +1 +5价态是既有氧化性又有还原性*只限于兀素、而不是物质:eg: HCI中H为+1价,是氢兀素的最高价,从而导致HCI具有一定的氧化性,而氯则为-1价,处于最低价态,又致使HCI具有一定的还原性,所以HCI既有氧化性又有还原性,不能单纯的看其中某一种元素。
而在物质中某元素处于中间价态时,我们就能说这种物质既有氧化性又有还原性eg:SO2硫元素处于中间价态(+4价),既有氧化性,又有还原性。
②、0、+1、+5、+7均具有一定的氧化性(无-1价,-1价只有还原性,无氧化性)-1、0、+1、+5均具有一定的还原性(无+7价)化合价越高,该价态的元素所具有的氧化性越强;反之价态越低该元素的还原性越强也就是说氯的氧化性:+7>+5>+1>0还原性:-1>0>+1>+5*通常只适用于元素,而不是物质eg:HCIO4(高氯酸)中氯元素为+7价高于HCIO中氯元素的+1价,但氧化性却是HCIO> HCIO 4三、左大于右(氧化剂、氧化产物具有氧化性;还原剂、还原产物具有还原性)即氧化剂的氧化性强于氧化产物的氧化性还原剂的还原性强于还原产物的还原性eg:2HBr + H 2SO4(浓) Br2 + SO2? + 2H 2O氧化剂:化合价降低H2SO4(浓)氧化产物:化合价升高得到的产物Br2还原剂:化合价升高HBr 还原产物:化合价降低得到的产物SO2氧化性:H2SO4(浓)> Br2还原性:HBr> SO2习题:判断有关物质还原性强弱顺序12 + SO2 +2H 20 ==== H 2SO4 + 2HI2FeCI 2 + CI2 ====2FeCI 32FeCI 3 + 2HI =====2FeCI 2 + 2HCI + I 2- 2+ -A、I >Fe >CI >SO2-2+ -B、Cl >Fe >SO2>I2+ - -C、Fe2+>I- >Cl- >SO2- 2+ -D、SO2>I >Fe >Cl四、不同种氧化剂氧化同种还原剂时,价态变化越大,对应的氧化剂的氧化性越大eg: Fe + 2HCl ===FeCl 2 +H 2 ①2Fe + Cl2 ==== FeCl 3 ②相应的氧化性:因①式中Fe由0价到+2价,而②中是由0到+3变化了三价,所以氧化性:Cl2> HCl 还原性比较亦然。
氧化还原反应知识点总结
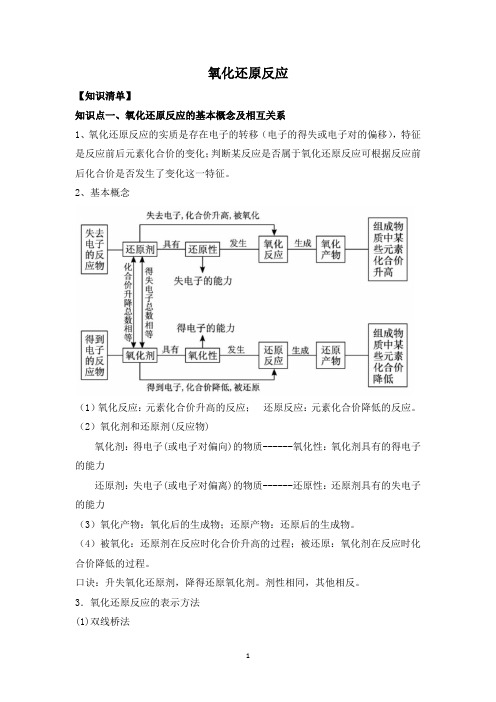
氧化还原反应【知识清单】知识点一、氧化还原反应的基本概念及相互关系1、氧化还原反应的实质是存在电子的转移(电子的得失或电子对的偏移),特征是反应前后元素化合价的变化;判断某反应是否属于氧化还原反应可根据反应前后化合价是否发生了变化这一特征。
2、基本概念(1)氧化反应:元素化合价升高的反应;还原反应:元素化合价降低的反应。
(2)氧化剂和还原剂(反应物)氧化剂:得电子(或电子对偏向)的物质------氧化性:氧化剂具有的得电子的能力还原剂:失电子(或电子对偏离)的物质------还原性:还原剂具有的失电子的能力(3)氧化产物:氧化后的生成物;还原产物:还原后的生成物。
(4)被氧化:还原剂在反应时化合价升高的过程;被还原:氧化剂在反应时化合价降低的过程。
口诀:升失氧化还原剂,降得还原氧化剂。
剂性相同,其他相反。
3.氧化还原反应的表示方法(1)双线桥法箭头必须由反应物指向生成物,且两端对准同种元素。
箭头方向不代表电子转移方向,仅表示电子转移前后的变化。
在“桥”上标明电子的“得到”与“失去”,且得失电子总数应相等。
如:(2)单线桥法箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。
箭头方向表示电子转移的方向。
在“桥”上标明转移的电子总数。
4.氧化还原反应与四种基本反应类型的关系(1)有单质参加的化合反应一定是氧化还原反应;(2)有单质生成的分解反应一定是氧化还原反应;(3)置换反应一定是氧化还原反应;(4)复分解反应一定不是氧化还原反应。
知识点二、常见的氧化剂和还原剂(1)常见的氧化剂:①活泼的非金属单质:F2、O2、O3、Cl2等;②含有高价态元素的化合物:HNO3、KMnO4、K2Cr2O7、浓H2SO4等;③某些金属元素的高价态离子:Fe3+、Cu2+等;④其它:H2O2、Na2O2、HClO等。
(2)常见的还原剂:①活泼的金属单质:K、Na、Fe、Mg等;②含有低价态元素的化合物:H2S、HI、CO2、SO2、H2SO3等;③某些非金属单质:H2、C等。
氧化还原反应基本知识.

氧化还原反应基本知识一、氧化还原反应1、氧化还原反应的判别依据:化合价变化。
2、氧化还原反应的本质3、氧化反应与电子转移的关系:还原剂—→升—→失—→氧(化反应)—→氧化产物氧化剂—→低—→得—→还(原反应)—→还原产物⎧电子得失电子转移⎨⎩电子对偏移4、氧化还原反应中的转化关系5、从氧化还原反应的角度认识四种基本类型二、氧化还原反应的基本规律及作用1、电子守恒规律还原剂失电子总数(或物质的量)=氧化剂得电子总数(或物质的量)2、表现性质规律:最低价中间价最高价只有还原性既有氧化性又有还原性只有氧化性;(金属单质只有还原性,非金属单质大多数既有氧化性又有还原性)3、由强到弱规律:4、反应先后规律:“强者先行” 即氧化性越强的氧化剂与还原性越强的还原剂优先反应5、正易逆难规律越易失去电子的物质,失去电子后就越难得到电子;越易得到电子的物质,得到电子后就越难失去电子。
6、价态归中的规律:“高价+低价→中间价” “高价+低价→较高中间价+较低中间价如:(1)铁与铁离子(2)硫酸与硫化氢的反应例1、已知KH 和H 2O 反应生成H 2和KOH ,反应中1molKH ()A .失去1mol 电子B .得到1mol 电子C .失去2mol 电子D .没有电子得失例2、已知有如下反应:KClO 3+6HCl ( =KCl +3Cl 2↑+3H 2O ,其中发生氧化反应的元素和发生还原反应的元素的质量之比为()A. 1:6B. 6:1C. 1:5D. 5:1例3.在反应5NH 4NO 3=2HNO3+4N2↑+9H2O 中,氧化产物与还原产物的物质的量之比是()。
A 、1:1B 、5:4C 、5:3D 、3:57、岐化规律:中间价态两边转,即“中间价→高价+低价”例1、制漂白液的反应是:Cl 2+2NaOH =NaCl +NaClO +H 2O ,该反应的氧化剂与还原剂之比为()A .1︰1 B.1︰2 C .2︰1 D.3︰2三、物质氧化性、还原性相对强弱判断的一般方法1、根据金属活动顺序表K Ca Na Mg Al Zn Fe Sn Pb (H )Cu Hg Ag PtAuK + Ca 2+ Na + Mg 2+ Al 3+ Zn 2+ Fe 2+ H + Cu 2+ Ag +2、根据氧化还原反应还原性:还原剂>还原产物还原剂>氧化剂氧化性:氧化剂>氧化产物氧化剂>还原剂3、根据氧化还原反应进行的难易(反应条件)的不同:例:三种方法均可以制得Cl 2 : MnO 2+4HCl(浓)△〓 MnCl 2+Cl2+2H2O2KMnO 4+16HCl(浓)= 2KCl+2MnCl2+5Cl2+8H2O三种氧化剂由强到弱的顺序是4、根据被氧化或被还原程度:例:Fe+2HCl==FeCl△2+H2 2Fe+3Cl2 〓 2FeCl 3 , 5、常见的氧化剂: (1、高价态的化合物:KMnO 4、HNO 3、浓H 2SO 4、KClO 3、K 2Cr 2O 7(2、高价态金属离子:Cu 2+、Fe 3+(3、活泼的非金属单质:X 2(X= F、Cl 、Br 、I )、O 2、S常见的还原剂: (1、活泼金属: K 、Na 、Mg 、Al 、Zn 、Fe(2、低价态的物质:H 2S 、CO 、SO 2、H 2SO 3、 Na 2SO 3、NH 3(3、某些非金属单质及其化合物如:H 2、C 、S(4、低价态离子:S 2-、I -、Br -、Cl - Fe2+巩固练习1、ClO 2是一种消毒杀菌效率高、二次污染小的水处理剂。
氧化还原反应中的规律

氧化还原反应中的规律一、表现性质规律同种元素具有多种价态时,一般处于最高价态的只具有氧化性;处于最低价态的只具有还原性;处于中间价态的则既有氧化性又有还原性。
即:高价氧化低还原,中间价态两俱全;同种元素多种变,中间价态变两头;兩头价态变中间,相邻价态不氧还。
解释:同种元素有多种价态时,中间价态变成它相邻两端的价态,如:Cl2+H2O=HCl+HClO;高价低价相互反应变成它们相邻的中间价态,如:H2S+H2SO4(浓)=S↓+SO2↑+2H2O;相邻两种价态之间不发生氧化还原反应,如:SO2不能被浓H2SO4氧化。
二、性质强弱规律1、用氧化还原反应的反应式或方程式来判断氧化还原反应可表示为:氧化剂+还原剂→氧化产物+还原产物。
利用上式可判断氧化性和还原性的强弱。
即:氧化剂的氧化性强于氧化产物的氧化性;还原剂的还原性强于还原产物的还原性。
2、同种元素不同价态氧化性与还原性强弱的判断一般说来,同一种元素从低价态到高价态氧化性逐渐增强,还原性逐渐减弱;从高价态到低价态,氧化性逐渐减弱,还原性逐渐增强。
例:NO2的氧化性比NO强:NO+NO2+2NaOH=2NaNO2+H2O注意:同种元素不同价态化合物的氧化性、还原性的强弱还与化合物的稳定性有关,如次氯酸中氯的化合价比高氯酸中氯的化合价低,但它不稳定,其氧化性比高氯酸还强。
3、不同物质间氧化性、还原性强弱的判断(1)根据元素在周期表中的位置判断,元素在周期表中越是位于左下方,其单质的还原性越强,其阳离子氧化性越弱;元素在周期表中越是位于右上方,其单质氧化性越强,其阴离子的还原性越弱。
(2)根据与同一物质反应的情况判断,不同的氧化剂与同一还原剂反应得到相同的氧化产物时,若所需条件越高,氧化剂的氧化性越弱。
由反应4HCl(浓)+MnO2=MnCl2+2H2O+Cl2↑和16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑可知KMnO4的氧化性比MnO2强。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原反应的四大规律
一、反应中氧化物收缩,还原物扩大:
当一种物质发生氧化反应,以及它所能释放出来的氧化物,就会减少,而它可以接受到的还原物就会增加。
例如,当硫化锌和氯气发生反应,硫化锌氧化为硫酸铜,其中硫化锌就会减少,而氯气则会增加。
二、反应总是把氧元素运送到还原物质:
当一种物质发生氧化反应时,它可以放出氧元素。
然而,这些氧元素的最终目的总是被运送到另一种还原物质,以完成还原反应。
例如,当硫酸铜和过氧化钠发生反应时,硫酸铜将氧化为硫化铜,而过氧化钠可以接受这些氧元素,从而发生还原反应。
三、反应通常会产生微量的碱性或酸性物质:
反应的发生是由于物质的微量碱性或酸性物质而影响的。
例如,当一种氧化物和一种还原物发生反应时,反应的本质就是碱性或酸性物质的作用。
四、氧化还原反应是水的重要部分:
水中的氧化还原反应也可以做一些很有趣的事情。
例如,氧化还原反应能够帮助鱼从水中获取有氧气,还有些藻类也可以利用氧化还原反应进行光合作用来获取能量。
虽然水中反应的含量不多,但是它们可以维持水体中的氧化还原平衡,使得水能满足生物的需要。
它们也清除了陆地中的各种有害物质,使陆地生态系统能够得到保护。
