富马酸替诺福韦酯杂质结构方式,杂质标准品
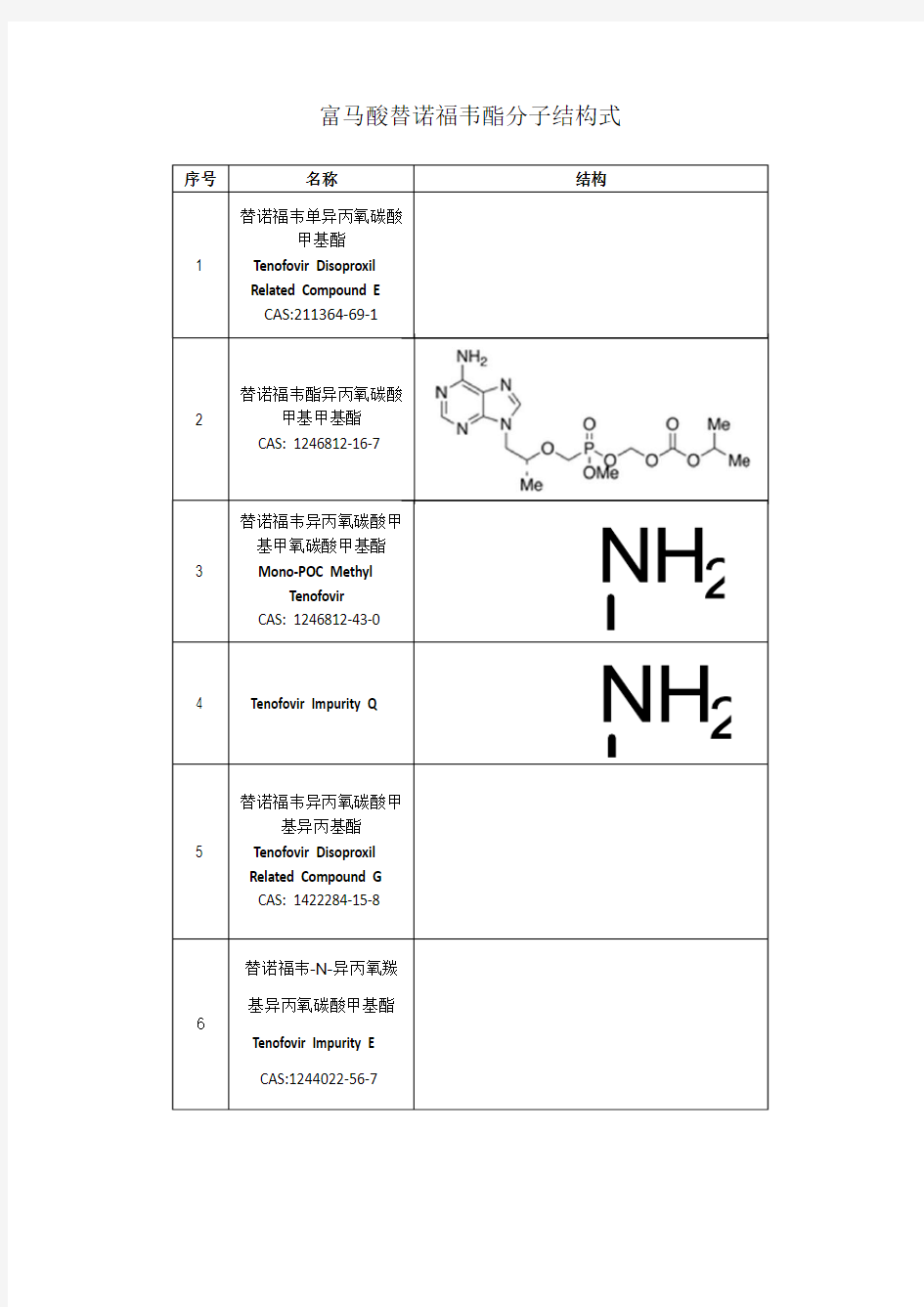
富马酸替诺福韦酯分子结构式
替诺福韦酯异丙氧碳酸
替诺福韦异丙氧碳酸甲
Diethylaminocarboxyme
160616-04-6 (free base)
(N6-CH2OH-POC PMPA)
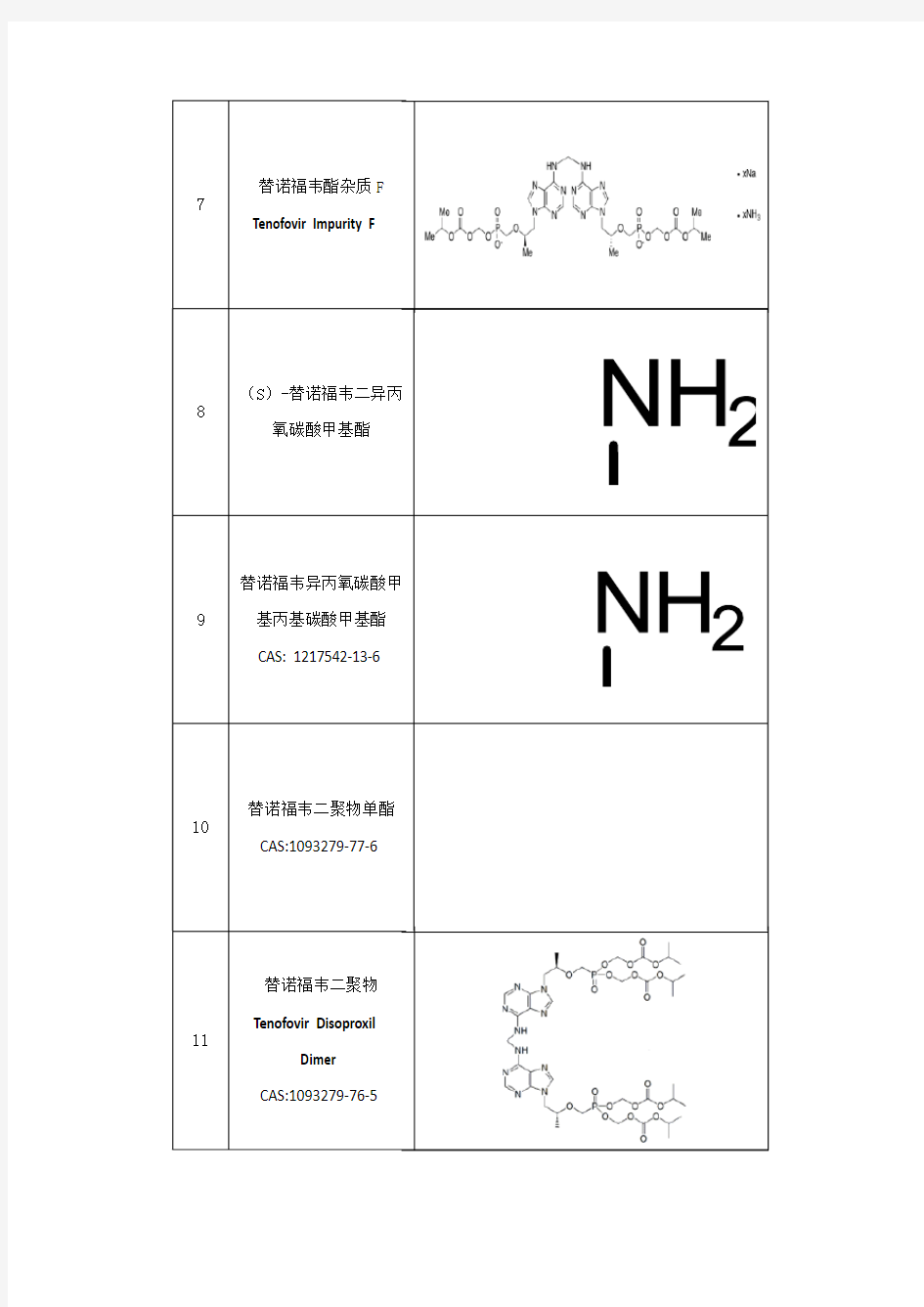
如需咨询,欢迎联系广州尤瓦化工产品:4000-868-328
标准品和对照品管理规程
目的:建立检验分析用标准品、对照品的管理规程,规范检验分析用标准品、对照品的管理,确保检验结果的准确性。 范围:适用于检验用标准品、对照品的管理。 职责:质量检验室负责人、标准品与对照品管理员对此规程的实施负责。 内容: 1. 标准品、对照品定义及类型 1.1 标准品、对照品是指国家药品标准中用于鉴别、检查、含量测定的标准物质。标准品系指用于生物检定、抗生素或生化药品中含量或效价测定的标准物质,按效价单位(或ug)计,以国际标准品进行标化,对照品除另有规定外,均按干燥品(或无水物)进行计算后使用。 1.2 企业可以选择相应的活性物质,使用法定标准品/对照品进行标化,标化后的物质作为企业自制工作标准品。 2. 标准品、对照品应用范围 标准品、对照品应用于药品鉴别、检查、含量测定等药品检验的各方面。 3. 标准品、对照品采购与接收 3.1标准品、对照品国内可以从中国药品生物制品检定所或当地药检所购买;国外购买可在国外法定认可机构的当地代理处购买或直接采购。 3.2 质量控制部门应安排有专人负责接收和管理标准品并建立标准品接收记录。 3.2.1标准品、对照品管理员应由具有一定药学或分析专业知识,熟悉标准品、对照品的性质和贮存条件,经过专门的培训合格的人员担任。 3.2.2 标准品、对照品的年度采购计划:标准品、对照品管理员每年四季度根据企业生产品种综合计划(下年度)做出品种检验计划和文字说明。内容包括:标准品及对照品名称、规格、计划购买量、价格、库存量、年需用量、检验品种、备注。由于标准品、对照品价格较贵,所以计划量要合理,做到既不浪费,又保证正常的检验工作,必须要填写标准品使用记录,并报检验室负责人审核后报质量管理部部长批准,由采购部按要求安排采购。 3.2.3 标准品、对照品的申购单,应尽量注明分子式、分子量及结构式,以免发生误购。 3.2.4 因某种原因临时需要购买标准品、对照品,经质量管理部部长批准后,标准
替诺福韦酯的产业化生产工艺
替诺福韦酯的产业化生产工艺 一:摘要 本工艺公开了一种结构如式(II)所示的替诺福韦酯的产业化生产工艺,所述生产工艺包括 下列步骤:(1)以腺嘌呤和R-碳酸丙烯酯为起始原料,制得R-9- (2- 羟基丙基)腺嘌呤; (2)所得R-9-(2-羟基丙基)腺嘌呤与对甲苯磺酰氧基磷酸二乙酯在叔丁醇镁的催化下进行缩合反应,制得R-9「2-(二乙基磷酰甲氧基)丙基」腺嘌呤;(3) 所得R-9 [2-(二乙基磷酰甲氧基)丙基」腺嘌呤水解得到替诺福韦;(4)所得替诺福韦在三乙胺催化下与氯甲基碳酸异丙酯缩合,制得替诺福韦酯。本工艺连续时间最快23小时,质量收率高达69%,产品质量好,适合于产业化生产。 二:四大步骤 1.一种结构如式(II)所示的替诺福韦酯的生产工艺,所述生产工艺包括下列步骤: (1)以结构如式(VII)所示的腺嘌呤和结构如式(VIII)所示的R一碳酸丙烯酯为起始 原料,制得结构如式(VI)所示的R-9- (2- )} 2-羟基丙基)腺嘌呤; (腺嘌呤VII) (R-碳酸丙烯酯VIII) (R-9- (2- )} 2-羟基丙基)腺嘌呤VI) (2)所得R-9- (2-羟基丙基)腺嘌呤与结构如式(V)所示的对甲苯磺酰氧基磷酸二乙 酯在叔丁醇镁的催化下进行缩合反应,制得结构如式(IV)所示的R-9- [2-(二乙基磷酰甲氧基)丙基〕腺嘌呤; 对甲苯磺酰氧基磷酸二乙酯缩写
DESMP (V) (IV) (3)所得R-9- [2-(二乙基磷酰甲氧基)丙基〕腺嘌呤水解得到式(III)所示的替诺福韦; (III) (4)所得替诺福韦在弱碱性物质催化下与氯甲基碳酸异丙酯缩合,制得结构如式(II) 所示的替诺福韦酯; 1.1步骤(1)所述的替诺福韦酯的生产工艺,其特征在于所述步骤(1)具体包括:腺嘌呤和R一碳酸丙烯酯在碱性催化剂下缩合反应,充分反应后分离得到粗品,粗品经精制得到R-9-(2-羟基丙基)腺嘌呤。 1.2所述的R-9- (2-羟基丙基)腺嘌呤的生产工艺,其特征在于所述步骤(l)中:在充N2保护下,R一碳酸丙烯酯和腺嘌呤的摩尔比例为1. 25:1。腺嘌呤和碱性催化剂的摩尔比例为10:1;反应以二甲基甲酰胺(DMF)或二甲基亚砜(DMSO)为反应溶剂,所述的碱性催化剂为氢氧化钠或氢氧化钾;反应温度控制在100一130℃;具体包括:腺嘌呤和R一碳酸丙烯酯在碱性催化剂下缩合反应,充分反应10hrs后,用HPLC监控反应的进行,通过原料含量的变化确定反应终点。将反应物母液分离得到含有R-9- (2- )} 2-羟基丙基)腺嘌呤的粗品,粗品精制采用的精制溶剂为甲醇或乙醇和甲苯的混合物,其中甲苯在混合物中的体积含量不超过30%(乙醇:甲苯=75:25)。粗品经精制得到R-9- (2-羟基丙基)腺嘌呤。
标准品与对照品的区别
如题,请大家谈谈标准品和对照品有什么不同! 关键词:标准品区别对照品 收藏分享评分 jackcong回复于:2008-10-21 15:32:59 原文由maddog发表: 简单的说: 标准品是有国家法定标准,发出的每一份产品都带有自己的统一编号以及质量控制文件和含量指标的。 对照品多是在某一各行业内约定俗成的一类起参比对照作用的物质~也有自己的编号,但每一个独立包装中没有质控文件及含量指标。 总结得很好,标准品是有国家标准确定制作而成。 对照品可以用标准品,也可以不用标准品。 lhj63回复于:2008-10-21 16:39:07 在药检领域,对照品指能准确测知含量并以此衡量供试品的标准物质,无需量值溯源;标准品指不能准确测知含量,或仍需溯源至国际标准品以获得实际效价的标准物质。 douzi15回复于:2008-10-23 12:30:23 对照品是对相互验证的产品的称呼,两个不同厂家的标准品就可以互称为对照品。wangboxzzjs回复于:2008-10-21 12:18:17 国家药品标准品、对照品系指国家药品标准中用于鉴别、检查、含量测定、杂质和有关物质检查等标准物质,它是国家药品标准不可分割的组成部分。国家药品标准物质是国家药品标准的物质基础,它是用来检查药品质量的一种特殊的专用量具;是测量药品质量的基准;也是做为校正测试仪器与方法的物质标准;在药品检验中,它是确定药品真伪优劣的对照,是控制药品质量必不可少的工具。 目前,中国药品生物制品检定所已能提供各类国家标准物质1242种,其中中药化学对照品288种,对照药材400种,两者占总数的一半以上,国家标准品及生物参考品系指用于鉴别、检查含量或效价测定的标准物质,其制备与标定应符合“生物制品国家标准物质制备和标定规程”要求,并由国务院药品监督管理部门指定的机构分发。企业工作标准品或参考品必须经国家标准品或参考品标化后方能使用。 对照品系指用于生物制品理化等方面测定的特定物质,由生产单位采用与制品生产工艺相同的方法制备。对照品应尽可能与制品原液配方一致,稳定性较差的,可加不含对测定有干扰物质的适宜的稳定剂。对照品由国家药品检定机构审查认可,其标准应不低于制品的质量标准。 (3)标准品、对照品:是指用于鉴别、检查、含量测定的标准物质,均由国务院药品监督管理部门指定的单位制备、标定和供应。标准品系指用于生物测定、抗生素或生化药品中含量或效价测定的标准物质,一国际标准品进行标定;对照品出另有规定外,按干燥进行计算后使用。标准品和对照品均附有使用说明书,质量要求,有效期和装量等。
瑞戈非尼杂质标准品对照品产品详情对照表
产品信息: 中文名:瑞戈非尼杂质A 英文名:Regorafenib impurity A 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质B 英文名:Regorafenib impurity B 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质C 英文名:Regorafenib impurity C 规格:25mg和50mg 纯度大于99% 随货提供COA H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质D 英文名:Regorafenib impurity D 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质E 英文名:Regorafenib impurity E 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 基本信息: 产品ID117412 产品中文名称瑞戈非尼 产品英文名称Regorafenib 产品中文异名瑞格非尼; 产品英文异名Stivarga; CAS号755037-03-7 分子式C21H15ClF4N4O3
用于经标准治疗依然发生转移的结直肠癌患者。获批时间:9月(美国) 相关信息: 拜耳(Bayer)于2014年7月30日宣布,抗癌药Stivarga(regorafenib,瑞戈非尼)获欧盟委员会(EC)批准,用于既往经2种酪氨酸激酶抑制剂【格列卫(Gleevec,通用名:imatinib,伊马替尼),索坦(Sutent,通用名:sunitinib,舒尼替尼)】治疗后病情恶化或不耐受的不可切除性或转移性胃肠道间质瘤(GIST)患者的治疗。此前,Stivarga已于2013年8月获欧盟批准用于转移性结直肠癌(mCRC)的治疗。 Stivarga GIST新适应症的获批,是基于关键III期GRID研究的数据。数据显示,与安慰剂+最佳支持疗法(BSC)相比,Stivarga+BSC组合疗法使无进展生存期(PFS)取得了统计学意义的显著改善(4.8个月vs0.9个月,p<0.0001)。 目前,Stivarga已获美国、欧盟、日本批准,用于转移性结直肠癌(mCRC)的治疗。同时,该药已获美国和日本批准用于治疗胃肠道间质瘤(GIST)。Stivarga是FDA批准的第三个治疗胃肠道间质瘤(GIST)的药物,另2个药物为诺华的格列卫(Gleevec)、辉瑞的索坦(Sutent)。 胃肠道间质瘤(GIST)是癌细胞发生在胃肠道的一种肿瘤,患者多为老年人。GIST,由于其极具侵略性的特点,目前依然是尚未满足的医疗需求,同时治疗的选择也很有限,相关临床研究数据表明,Stivarga有望为那些经标准治疗后复发的患者提供一种重要的治疗方案。 Stivarga是一种口服多激酶抑制剂,在临床前研究中,regorafenib能够抑制数个促血管生成VEGF受体酪氨酸激酶,这些激酶在肿瘤的血管生成中发挥着重要作用。该药还可以抑制癌和肿瘤微环境中的多种激酶,包括VEGFR1-3,KIT,RET,PDGFR及FGFR。Stivarga由拜耳开发,由拜耳和Onyx制药联合推广。
标准品及对照品管理制度
重庆多普泰制药有限公司GMP文件Array 分发范围
目的:规定标准品及对照品的管理制度。 范围:适用于标准品及对照品的管理。 责任:物料供应部、质量控制室全体人员、质量管理部部长。 相关术语: 相关文件: 程序: 1.标准品及对照品的采购计划 1.1质量控制室主管根据企业生产品种综合计划(提前三个月)做出各品种检验所需标准品及对照品的计划。申购内容包括:标准品及对照品的名称、规格、数量、用途。由于其价格较贵,所以计划量要合理,做到既不浪费,又保证正常的检验工作,报质量管理部部长审核,再经厂部负责人批准。 2. 标准品及对照品的购买 2.1 标准品及对照品的采购计划经质量管理部部长审核,厂部负责人批准后,交物料供应部进行采购。 2.2 标准品及对照品的采购一般由采购员向中国药品生物制品检定所邮购。 2.3 因某种原因临时需要使用的标准品及对照品,经质量管理部部长审核,再经厂部负责人批准,可临时申购。 3. 标准品及对照品的接收 3.1 收到标准品及对照品,检查外包装是否完好、洁净、封口是否严密、标签是否完好、清楚。 3.2 复核与申购单的一致性,确保准确无误。 3.3 填写标准品及对照品的入库记录。内容包括:名称、规格、数量、购进日期、来源等。 4. 标准品及对照品的贮存 4.1 不同的标准品及对照品应根据其理化性质、贮存要求的不同选择适宜的贮存条件。 5. 标准品及对照品的管理 5.1 标准品及对照品的管理人员应由质量控制室指定专人负责管理。 5.1.1 管理人员每日(工作日)检查1次温度、湿度并记录。凡不符合规定要求的,应及
时采取必要措施并记录。 6. 标准品及对照品的发放 6.1 管理人员负责发放。 6.1.1 领用人员填写领用记录。内容包括:品名、规格、数量、领用日期、领用者。 6.1.2 管理人员检查即将发放的标准品与领用记录登记品种的一致性,无误后发放。 7. 标准品及对照品的剩余退库和销毁 7.1 标准品及对照品按需取用,已取出的标准品严禁倒回原瓶中。 7.2 剩余的标准品及对照品需密闭并按照标准品及对照品的储存要求进行保存。 7.3 超过有效期的标准品及对照品应申请销毁。 7.3.1 销毁申请:由管理员填写销毁申请单。内容:品名、规格、数量、销毁原因、申请人、日期等。 7.3.1 质量控制室经理根据销毁原因做必要的调查和鉴定试验,做出拒绝或批准决定并签名。质量管理部部长审核确认。 7.3.2 批准销毁的,对环境无污染的,直接处理;腐蚀性强的,经规定的程序处理;毒性强的、按毒品销毁办法执行,执行销毁应由质量保证处指派监督执行。 7.3.3 销毁应填写销毁记录,内容同销毁申请单,销毁人、监督执行人、分别签名以示负责。 8. 管理员有权对标准品及对照品的领用用途及用量等问题提出质疑,有权复核领用者的每次使用量,如果不符合要求,管理员有权拒绝其领用,并上报。 9. 任何人在使用标准品及对照品时不得人为浪费,一经发现,即按购进价的200%处以罚款。 10. 除管理员提供给本公司技术人员外,其余未经厂部负责人及质量管理部部长同意,任何人不得提供给他人使用或变卖到其他地方。违者一经发现,将按购进价的5倍处以罚款,并通报批评。情节严重者将予以开除。 记录 记录名称保存部门保存时间 附件 本规程附件四份:
奥司他韦杂质标准品列表
奥司他韦杂质 ——孟成科技(上海)有限公司 名称 信息 结构式奥司他韦杂质Oseltamivir Impurity 分子式/Molecular Formula : C14H22O4 分子量/Molecular Weight : 254.33 CAS#:1266663-89-1奥司他韦杂质 Oseltamivir Impurity 分子式/Molecular Formula :C14H22O4分子量/Molecular Weight : 254.33 CAS#:347378-74-9 奥司他韦杂质 Oseltamivir Impurity 分子式/Molecular Formula :C14H22O4分子量/Molecular Weight : 254.33 奥司他韦杂质 Oseltamivir Impurity 分子式/Molecular Formula :C14H22O4分子量/Molecular Weight : 254.33 CAS#:1234858-94-6 奥司他韦杂质 Oseltamivir Impurity 分子式/Molecular Formula :C22H32N2O6分子量/Molecular Weight : 420.51
奥司他韦杂质 Oseltamivir Impurity 分子式/Molecular Formula :C22H38N2O9分子量/Molecular Weight : 474.55 奥司他韦杂质 Oseltamivir Impurity 分子式/Molecular Formula :C22H36N2O4分子量/Molecular Weight : 392.54 奥司他韦杂质 Oseltamivir Impurity 分子式/Molecular Formula :C22H36N2O4分子量/Molecular Weight : 392.54 奥司他韦杂质 Oseltamivir Impurity 分子式/Molecular Formula :C26H44N2O4分子量/Molecular Weight : 448.65 奥司他韦杂质 Oseltamivir Impurity 分子式/Molecular Formula :C26H44N2O4分子量/Molecular Weight : 448.65 奥司他韦杂质 Oseltamivir Impurity 分子式/Molecular Formula :C26H44N2O4分子量/Molecular Weight : 448.65
替诺福韦酯报告
替诺福韦酯报告 一.基本情况 本品是一种新型核苷酸类逆转录酶抑制剂。以与核苷类逆转录酶抑制剂类似的方法抑制逆转录酶,从而具有潜在的抗HIV-1活性。替诺福韦的活性成分替诺福韦双磷酸盐可通过直接竞争性地与天然脱氧核糖底物相结合而抑制病毒聚合酶,及通过插人DNA中终止链。 中文通用名: 替诺福韦酯 别名: 替诺福韦,替诺福韦酯富马酸盐 英文名: Tenofov ir Disoprox 药品性质: 处方药 适应症 用于治疗HIV、HBV感染。本品和其他逆转录酶抑制剂合用于HIV-1感染、乙肝的治疗 药代动力学 替诺福韦几乎不经胃肠道吸收,因此进行酯化、成盐,成为替诺福韦酯富马酸盐。替诺福韦酯具有水溶性,可被迅速吸收并降解成活性物质替诺福韦,然后替诺福韦再转变为活性代谢产物替诺福韦双磷酸盐。给药后1~2h内替诺福韦达血药峰值。替诺福韦与食物服时生物利用度可增大约40%。
替诺福韦双磷酸盐的胞内半衰期约为10h,可1天给药1次。由于该药不经CYP450酶系代谢,因此,由该酶引起的与其他药物间相互作用的可能性很小。该药主要经肾小球过滤和主动小管转运系统排泄,约70%~80%以原形经尿液排出体外。用法用量 口服每日1次,每次300mg,与食物同服。 不良反应 1.全身无力 2.胃肠道反应轻至中度的胃肠道不适,常见的有腹泻、腹痛、食欲减退、恶心、呕吐和胃肠胀气、胰腺炎。 3.代谢系统低磷酸盐血症(1%发生率);脂肪蓄积和重新分布,包括向心性肥胖、水牛背、末梢消瘦、乳房增大、库兴综合征。 4. 可能引起乳酸中毒、与脂肪变性相关的肝肿大等。 5. 神经系统头晕、头痛。 6. 呼吸系统呼吸困难。 国家政策 替诺福韦在国家免费艾滋病抗病毒药物治疗手册(第二版)中被列为二线治疗方案的组成药物。
标准品、工作对照品标准管理规程
1.目的 本管理规程规定了检验分析工作中使用的标准品、工作对照品的基本要求和管理办法,以确保检验、分析的精准,从而保证产品的质量。 2.适用围 本规程适用于检验分析所用标准品、工作对照品。 3.职责 3.1.QC主管:负责制定标准品、对照品的购买计划,负责标准品、对照品的接收、发 放、保管工作。 4.容 4.1.标准品、对照品应由QC主管负责管理,该人员应具有一定药学或分析专业知识, 熟悉标准品、对照品的性质和贮存条件。 4.2.购买 4.2.1.标准品、对照品 一般应在每年的四季度由QC主管组织本部门相关人员,依据下年度的生产计划预测标准品、对照品的用量,制定采购计划。采购计划报质量管理部部长批准后,即可组织购买。 每年的三季度,可根据生产的实际情况提出标准品、对照品的追加计划。 4.2.2.国购买一般到当地药检所或中检所购买或邮购;国外购买可在当地代理处购 买或直接求购。 4.2.3.标准品、对照品购买单应标明名称、数量、分子式、分子量及结构式等必要信 息。 4.3.标准品、对照品的接收 4.3.1.购回后,QC主管应认真核对名称,检查外包装、标签完好、清楚。复核与购买 单的一致性。 4.3.2.准确无误后填写对照品入库.使用记录。容:对照品购进日期、名称、编号、 批号、购进数量及来源。(见附表1) 4.4.工作对照品 4.4.1.工作对照品是指日常检验用的标准品(对照品),其来源可以是自制或市售的。 4.4.2.自制或购买来的样品,首先应按照法定标准(或注册标准)进行全检;全检合
格的,方可被选为工作(标准品)对照品。 4.4.3.标定采用双人标定,标定方法一般采用与该标准品(对照品)对应样品的药典 标准(或注册标准)中含量项下的方法,标定时,只标定其含量。 4.4.3.1.标定和复标应分别做三分平行操作,相对误差≤0.1%;标定与复标两者之间 的相对误差≤0.1% 。 4.4.3.2.工作对照品(标准品)的最终标定含量以6份含量(含初标与复标)的均值(有 关水分、残留溶剂或干燥失重均不带入结果的计算)计。 4.4.4.标定完毕后,将标定的工作对照品(标准品)分装于适当的容器中,密封并贴上 标签(标明品名、批号、标定含量、数量、标定日期、有效期)。 4.4. 5.出具工作对照品(标准品)的标定报告;报告经质量负责人批准后,工作对照品 (标准品)方可用于实际检验工作中。 4.5.标准品、对照品的贮存期 标准品、对照品贮存期限以新的标准品购进上年度标准品到贮存期;工作对照品(标准品)的标定有效期为一年,有效期到期后可以进行再次标定,但累计有效期不得超过工作对照品(标准品)其本身的有效期。 4.4 贮存管理 4.4.1.标准品、对照品一般置于干燥器或冰箱中有序存放,特殊品种应按其规定妥善保 存。 4.4.2.标准品、对照品用多少取多少,已取出的标准品、对照品严禁倒回原瓶中。及 时填写领用记录。(见附表1) 4.5.使用和退回 检验人员应按需领取标准品、对照品。剩余的标准品、对照品应密封好,方可放回原处并填写领用记录。
国产替诺福韦说明书
【商品名】倍信富马酸替诺福韦二吡呋酯片 【通用名】富马酸替诺福韦二吡呋酯片 【英文名】Teno fovirDisoproxilFumarate Tablets 【汉语拼音】FuMaSua nTiNuoFuWeiErBiFuZhiPia n 【主要成份】本品主要成分为富马酸替诺福韦二吡呋酯,其化学名称为9-[(R)-2-[[双[[(异 丙氧基羰基)氧基]甲氧基]氧膦基卜丙基]腺嘌呤富马酸盐(1:1)。 【性状】本品为淡蓝色杏仁状薄膜衣片,除去包衣显白色。 【适应症】HIV-1感染 富马酸替诺福韦二吡呋酯适用于与其它抗逆转录病毒药物联用,治疗成人HIV-1感染。 使用富马酸替诺福韦二吡呋酯开始治疗HIV-1感染时,应考虑一下几点: 富马酸替诺福韦二吡呋酯不应与含有替诺福韦的固定剂量复方制剂联用,包括: ?依非韦伦/恩曲他滨/富马酸替诺福韦二吡呋酯; ?利匹韦林/恩曲他滨/富马酸替诺福韦二吡呋酯; ?艾维雷韦/克比司特/恩曲他滨/富马酸替诺福韦二吡呋酯; ?恩曲他滨替诺福韦。 【用法用量】HIV-1的治疗:剂量为每次300mg (—片),每日一次,口服,空腹或与食物同时服用。 成人肾功能损害患者使用剂量的调整 在中至重度肾功能损害的受试者中给予富马酸替诺福韦二吡呋酯时,药物暴露显著增加(参 见【药代动力学】)。对基线肌酐清除率v 50mL/分钟的患者,应按照表1调整富马酸替诺福 韦二吡呋酯的给药间期。 在此推荐的给药间期是根据在不同肾功能损害级别的非HIV和非HBV感染受试者,包括需 要血液透析的晚间肾病的患者中单次给药的药代动力学数据模型得出。 在中度至重度肾功能损害的患者中,尚未对这些给药间期调整建议的安全性和疗效进行临床 评价,因此在这些患者中应当密切监测对治疗的临床反应和肾功能(参见【注意事项】)。对轻度肾功能损害(肌酐清除率50-80mL/分钟)的患者,无需调整剂量。在这些患者中应 定期监测计算出来的肌酐清除率和血清磷。(参见【注意事项】)。 表1对肌酐清除率发生改变患者的剂量调整 1?使用理想(偏瘦)体重计算。 2?—般每周一次(假定每周三次血液透析,每次大约持续4小时)。富马酸替诺福韦二吡呋 酯应当在完成透析后给药。 在肌酐清除率v 10mL/分钟的非血液透析患者中,尚未对替诺福韦的药代动力学进行评价,所以对这些患者没有给药建议。 尚无肾功能损害儿童患者的给药建议数据。 【药理毒理】 微生物学
标准品与对照品管理程序
标准品与对照品管理程序 1.范围。 检验用标准品、对照品的管理。 2.职责 标准品管理员:按标准品与对照品管理程序进行管理。 QC室负责人:监督、检查执行情况。 3.内容 3.1.标准品(对照品)保管员:药品分析实验室必须设专人负责标准品的管理,该人 员应由具有一定药学或分析专业知识,熟悉标准品的性质和贮存条件。 3.2.标准品和对照品的年度计划:标准品管理员每年第四季度根据企业下年度生产品 种综合计划,作出品种检验用标准品(对照品)计划和文字说明,报QC室负责人批准。内容包括:标准品(对照品)名称、规格、数量、库存量、检验品种名称。由于标准品价格较贵,所以计划量要合理,做到既不浪费,又保证正常的检验工作。 3.2.1.标准品(对照品)的购买 3.2.2.标准品(对照品)使用计划批准后,按《物资采购管理程序》规定进行购买。 3.2.3.国内购买一般到当地药检所或中国药品生物制品检定所直接购买或邮购。 3.2. 4.请购单应尽量注明分子式、分子量及结构式,标准品(对照品)编码,以免发生 误购。 3.3.标准品(对照品)的接收 3.3.1.标准品、对照品购回后,检查外包装完好、封口严密、标签完好、清楚。 3.3.2.复核与请购单的一致性,准确无误。 3.3.3.对所买标准品、对照品编号(此编号要独一无二,便于管理)。 3.3. 4.填写标准品台帐,内容包括名称、规格、数量、购进日期、编号等。 3.4.标准品(对照品)的贮存 3.4.1.不同的标准品、对照品应根据其理化性质、贮存要求的不同选择适宜的贮存环境 和条件,分别置于规定的位置。 3.4.2.贮存环境:贮存室应尽量设置空调设施,保证室内阴凉、干燥、避光、通风,温
工作标准品 对照品 标定管理规程
工作标准品(对照品)标定管理规程 目 的: 对自制的工作标准品进行标定,保证工作标准品(对照品)与基准标准品(对照品)的等效性,从而确保检测结果的可靠性、准确性。 适用范围:鉴别、有关物质和含量检测过程中所用的工作标准品(对照品)。 责任人:质量控制部负责执行,质量保证部负责对执行情况的监督。 1.定义 1.1.基准标准品是指EP、BP、CP、USP等药典规定的现行(有效)批号的法定标准品(对照品)。 1.2.工作标准品是指日常检验用的标准品(对照品);其来源可以是自制或市售的。 2.工作标准品的选择与标定 2.1.自制或购买来的样品,首先应按照法定标准(或注册标准)进行全检。全检合格的,方可有资格被选为工作标准品(对照品)。 2.2.全检合格后,被选为工作标准品(对照品)后须进行标定。 2.3.标定采用双人标定(参照标准溶液的标化程序),标定方法一般采用与该标准品(对照品)对应样品的药典专论(或注册标准)中含量项下的方法;标定时,只标定其含量。 2.3.1.初标:法定标准品(对照品)2份;待标定的工作标准品(对照品)3份,按法定方法(或注册方法)进行检测。如检测方法是高效液相色谱法(HPLC),进样顺序一般为系统适用性试验溶液1针,法定标准品(对照品)溶液(1)3针(其三针峰面积的RSD应不大于0.41%),法定标准品(对照品)溶液(2) 1针,每份待标定的工作标准品(对照品)溶液各进样2针[3份工作标准品(对照品)标定的含量的RSD应不大于0.85%]。 2.3.2.复标:方法同初标,由另一人执行,要求与初标相同。 2.3.3.初标含量与复标含量的相差的绝对偏差不得超过0.5个百分点。 2.3.4.工作标准品(对照品)的最终标定含量以6份含量(含初标与复标)的均值(有关水分、残留溶剂量或干燥失重均不带入结果的计算)计。
替诺福韦说明书
【中文通用名】替诺福韦 【别名】泰诺福韦,替诺福韦酯富马酸盐,富马酸替诺福韦酯Tenofovir, Tenolo-Vir disoproxil Fumarate, Viread . TDF 【英文TNN 名】Tenofov ir Disoprox 【药品性质】处方药 【药品分类】国外最新药品-> 抗微生物新药 【药理毒理】本品是一种新型核苷酸类逆转录酶抑制剂。以与核苷类 逆转录酶抑制剂类似的方法抑制逆转录酶,从而具有潜在的抗HIV-1 活性。替诺福韦的活性成分替诺福韦双磷酸盐可通过直接竞争性地与天然脱氧核糖底物相结合而抑制病毒聚合酶,及通过插人DNA中终止链。 【药代动力学】替诺福韦几乎不经胃肠道吸收,因此进行酯化、成盐, 成为替诺福韦酯富马酸盐。替诺福韦酯具有水溶性,可被迅速吸收并降解成活性物质替诺福韦,然后替诺福韦再转变为活性代谢产物替诺福韦双磷酸盐。给药后1?2h内替诺福韦达血药峰值。替诺福韦与食物服时生物利用度可增大约40%。替诺福韦双磷酸盐的胞内半衰期约为10h,可1天给药1次。由于该药不经CYP450酶系代谢,因此,由该酶引起
的与其他药物间相互作用的可能性很小。该药主要经肾小球过滤和主动小管转运系统排泄,约70%?80%以原形经尿液排出体外。 【适应症】用于治疗HIV、HBV感染。本品和其他逆转录酶抑制剂合用于HIV-1感染、乙肝的治疗。 【用法用量】口服:每日1次,每次300mg,与食物同服。 【不良反应】1?全身无力2?胃肠道反应轻至中度的胃肠道不适,常见的有腹泻、腹痛、食欲减退、恶心、呕吐和胃肠胀气、胰腺炎。 3.代谢系统低磷酸盐血症(1%发生率);脂肪蓄积和重新分布,包括向心性肥胖、水牛背、末梢消瘦、乳房增大、库兴综合征。 4.可能 引起乳酸中毒、与脂肪变性相关的肝肿大等。 5.神经系统头晕、头痛。6.呼吸系统呼吸困难。7.皮肤药疹。 【规格】300mg*30颗/瓶 【生产厂商】:美国Glead /印度Cipla 排行榜
艾曲波帕杂质结构式整理-标准品
艾曲波帕杂质 ——孟成科技(上海)有限公司 名称信息 结构式艾曲波帕杂质Eltrombopag Impurity 分子式/Molecular Formula : C25H21ClN4O5 分子量/Molecular Weight : 492.91艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C21H19NO5 分子量/Molecular Weight : 365.39 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C21H23NO9 分子量/Molecular Weight : 433.42 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C31H30N4O11 分子量/Molecular Weight : 634.59 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C25H21ClN4O4 分子量/Molecular Weight : 476.92
艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C32H28N4O4 分子量/Molecular Weight : 532.60 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C25H21N5O5 分子量/Molecular Weight : 471.47 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C28H29N5O4 分子量/Molecular Weight : 499.57 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C13H11NO3 分子量/Molecular Weight : 229.24 CAS#:376592-93-7 艾曲波帕杂质 Eltrombopag Impurity 分子式/Molecular Formula :C12H14N2O 分子量/Molecular Weight : 202.26 CAS#:277299-70-4
对药品注册中对照品(标准品)有关技术要求的几点思考
发布日期20050522 栏目化药药物评价>>化药质量控制 标题对药品注册中对照品(标准品)有关技术要求的几点思考 作者张哲峰 部门 正文内容 审评三部张哲峰 摘要:本文说明了标准品(对照品)在药品研发中的重要性,并对其标定工作初步提出一些观点,以期与业界同仁一起探讨、交流;并希望在药品研 发过程中,研制单位应注意及时与中检所联系制备与标定事宜,以保证研发 工作的连续性。 标准品、对照品系指用于药品鉴别、检查、含量测定的标准物质,即药品标准中使用的具有确定的特性或量值,用于对供试药品赋值、定性、评价测 定方法或校准仪器设备的物质,其中标准品系指用于生物检定、抗生素或生 化药品中含量或效价测定的标准物质。《药品注册管理办法》规定“中国药品 生物制品检定所负责标定和管理国家标准物质”,“申请人在申请新药生产时, 应当向中国药品生物制品检定所提供制备该药品标准物质的原材料,并报送
有关标准物质的研究资料”。但在新药研究中,普遍存在对照品(标准品)的应用超前于中检所制备和标定的情况,鉴于新药研究的连续性以及标准物质在新药研究中涉及量值溯源、产品定性、杂质控制及其在药品质量控制中的重要性,标准物质的制备和标定与药品的质量研究、稳定性研究乃至药理毒理学研究中剂量的确定等临床前基础研究间存在密切关系,因此,药品对照品(标准品)的研究(制备与标定)也是药品审评的一项重要内容。《药品注册管理办法》附件二对申报资料项目11明确规定“提供的标准品或对照品应另附资料,说明其来源、理化常数、纯度、含量及其测定方法和数据”。但目的申报资料中,此部分内容未得到足够重视,研究水平参差不齐,甚至忽视,为切实做好药品注册的整体评价工作,尤其临床前基础研究的整体评价,提出几点思考,希望与业界同仁一起探讨、交流。 1.所用对照品(标准品)中检所已经发放提供(可参阅中国药典2000年版二部附录ⅩⅤG),且使用方法相同时,应使用中检所提供的现行批号对照品(标准品),并提供其标签和使用说明书,说明其批号,不应使用其他来源者;如使用方法与说明书使用方法不同(如定性对照品用作定量用、效价测定用标准品用作理化测定法定量、UV法或容量法对照品用作色谱法定量等),应采用适当方法重新标定,并提供标定方法和数据;若色谱法含量测定用对照品用作UV法或容量法,定量用对照品用作定性等,则可直接应用,不必重新标定。 2.申报临床研究时,如中检所尚无供应,为不影响注册进度,可先期与中检所接洽制备和标定,申报时提供标定报告、标签(应标明效价或含量、批
国产替诺福韦说明书
国产替诺福韦说明 书
【商品名】倍信富马酸替诺福韦二吡呋酯片 【通用名】富马酸替诺福韦二吡呋酯片 【英文名】Tenofovir Disoproxil Fumarate Tablets 【汉语拼音】FuMaSuanTiNuoFuWeiErBiFuZhiPian 【主要成份】本品主要成分为富马酸替诺福韦二吡呋酯,其化学名称为9-[(R)-2-[[双[[(异丙氧基羰基)氧基]甲氧基]氧膦基]-丙基]腺嘌呤富马酸盐(1:1)。 【性状】本品为淡蓝色杏仁状薄膜衣片,除去包衣显白色。 【适应症】HIV-1感染 富马酸替诺福韦二吡呋酯适用于与其它抗逆转录病毒药物联用,治疗成人HIV-1感染。 使用富马酸替诺福韦二吡呋酯开始治疗HIV-1感染时,应考虑一下几点: 富马酸替诺福韦二吡呋酯不应与含有替诺福韦的固定剂量复方制剂联用,包括: ·依非韦伦/恩曲她滨/富马酸替诺福韦二吡呋酯; ·利匹韦林/恩曲她滨/富马酸替诺福韦二吡呋酯; ·艾维雷韦/克比司特/恩曲她滨/富马酸替诺福韦二吡呋酯; ·恩曲她滨替诺福韦。 【用法用量】HIV-1的治疗:剂量为每次300mg(一片),每日一次,口服,空腹或与食物同时服用。 成人肾功能损害患者使用剂量的调整
在中至重度肾功能损害的受试者中给予富马酸替诺福韦二吡呋酯时,药物暴露显著增加(参见【药代动力学】)。对基线肌酐清除率<50mL/分钟的患者,应按照表1调整富马酸替诺福韦二吡呋酯的给药间期。 在此推荐的给药间期是根据在不同肾功能损害级别的非HIV和非HBV感染受试者,包括需要血液透析的晚间肾病的患者中单次给药的药代动力学数据模型得出。 在中度至重度肾功能损害的患者中,尚未对这些给药间期调整建议的安全性和疗效进行临床评价,因此在这些患者中应当密切监测对治疗的临床反应和肾功能(参见【注意事项】)。 对轻度肾功能损害(肌酐清除率50-80mL/分钟)的患者,无需调整剂量。在这些患者中应定期监测计算出来的肌酐清除率和血清磷。(参见【注意事项】)。 表1 对肌酐清除率发生改变患者的剂量调整 1.使用理想(偏瘦)体重计算。 2.一般每周一次(假定每周三次血液透析,每次大约持续4小时)。富马酸替诺福韦二吡呋酯应当在完成透析后给药。 在肌酐清除率<10mL/分钟的非血液透析患者中,尚未对替诺福韦的药代动力学进行评价,因此对这些患者没有给药建议。
GMP标准品与对照品管理程序
标准品与对照品管理程序 分发单位 1.适用范围 检验用标准品、对照品的管理。
2.职责 管理员:按该程序进行标准品、对照品的管理。 QC室负责人:监督、检查执行情况。 3.内容 3.1.标准品(对照品)管理员:药品分析实验室必须设专人负责标准品(对照品)的管理。 该人员应具有一定药学或分析专业知识,熟悉标准品(对照品)的性质和贮存条件。 3.2.标准品(对照品)的年度计划:管理员每年第四季度根据企业下年度生产品种综合计 划,制订品种检验用标准品(对照品)计划和文字说明,报QC室负责人批准。内容包括:标准品(对照品)名称、规格、数量、库存量、检验品种名称。计划量要合理,做到既不浪费,又能保证正常的检验工作。 3.2.1.标准品(对照品)的购买 3.2.2.标准品(对照品)使用计划批准后,由物流部按《物资采购管理程序》规定进行购买。 3.2.3.国内购买一般到当地药检所或中国药品生物制品检定所直接购买或邮购。 3.2. 4.请购单应尽量注明分子式、分子量及结构式,标准品(对照品)编码,以免发生误购。 3.3.标准品(对照品)的接收 3.3.1.标准品、对照品购回后,检查外包装完好、封口严密、标签完好、清楚。 3.3.2.复核与请购单的一致性,准确无误。 3.3.3.对所买标准品、对照品编号(此编号要独一无二,便于管理)。 3.3. 4.填写标准品(对照品)台帐,内容包括名称、规格、数量、购进日期、编号等。 3.4.标准品(对照品)的贮存 3.4.1.不同的标准品、对照品应根据其理化性质、贮存要求选择适宜的贮存环境和条件,分 别置于规定的位置。 3.4.2.贮存环境:贮存室应保持阴凉、干燥、避光、通风,温度在20±5℃,相对湿度在50~ 75%为宜。特殊品种要求严格按照规定的贮存条件妥善保存。 3.4.3.标准品、对照品应放在干燥器或其它适宜容器中保存,每一个干燥器或容器外应有区 别于标准品编号的特殊编码,以示存放位置。 3.4.4.干燥器置于加锁的柜中,依次排列整齐。 3.4.5.贮存期:一般按该品的规定贮存期限执行,没有期限的原则上化学提纯物标准品为3 年,生物试剂和不稳定的以6—12个月为宜。 3.4.6.管理员在日常工作中应根据气候条件调节贮存室温度、湿度,每周记录1次温度、湿 度。高温、多雨季节要增加检查频次。
WHO-富马酸替诺福韦Tenofovir disoproxil fumarate质量标准
Monographs: Pharmaceutical substances: Tenofoviri disoproxili fumaras - Tenofovir disoproxil fumarate C19H30N5O10P,C4H4O4 Relative molecular mass. 635.5 Chemical name. 1,1'-bis(1-methylethyl) 1,1'-[({[(1R)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl}phosphonoyldioxy)dimet hyl] dicarbonate (ester) hydrogen (2E)-but-2-enedioate (salt); CAS Reg.No. 202138-50-9. Description. White to almost-white, crystalline powder. Solubility. Slightly soluble in water, soluble in methanol, very slightly soluble in dichloromethane. Category. Antiretroviral (Nucleotide Reverse Transcriptase Inhibitor). Storage. Tenofovir disoproxil fumarate should be kept in a tightly closed container, protected from light, and stored at a temperature between 2 and 8°C. Additional information. Tenofovir disoproxil fumarate may exhibit polymorphism. Requirements Definition. Tenofovir disoproxil fumarate contains not less than 98.5 percent and not more than 101.0 percent of tenofovir disoproxil fumarate (C19H30N5O10P,C4H4O4), calculated with reference to the anhydrous substance. Manufacture. The production method is validated to ensure that the substance, if tested, would comply with: - a limit of not more than 5 ppm for the mutagenic impurity 9-(prop-1-enyl)-9H-purin-6-amine (impurity K), which may be a synthesis related substance, using a suitable method, and - a limit of not more than 1.0% for the tenofovir disoproxil (S)-enantiomer (impurity G), using a suitable chiral chromatographic method. Identity tests
标准品和对照品的区别
对照品系指用于鉴别、检查、含量测定和校正检定仪器性能的标准物质. 标准品系指用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示。 国家药品标准品、对照品系指国家药品标准中用于鉴别、检查、含量测定、杂质和有关物质检查等标准物质,它是国家药品标准不可分割的组成部分。国家药品标准物质是国家药品标准的物质基础,它是用来检查药品质量的一种特殊的专用量具;是测量药品质量的基准;也是做为校正测试仪器与方法的物质标准;在药品检验中,它是确定药品真伪优劣的对照,是控制药品质量必不可少的工具。标准品、对照品:是指用于鉴别、检查、含量测定的标准物质,均由国务院药品监督管理部门指定的单位制备、标定和供应。标准品系指用于生物测定、抗生素或生化药品中含量或效价测定的标准物质,一国际标准品进行标定;对照品出另有规定外,按干燥进行计算后使用。标准品和对照品均附有使用说明书,质量要求,有效期和装量等。1 定义生物制品标准物质系指用于生物制品效价、活性或含量测定的或其特性鉴别、检查的生物标准品或生物参考物质。2 标准物质的种类生物制品标准物质分为二类。国家生物标准品系指用国际标准品标定的,或我国自行研制的(尚无国际生物标准品者)用于定量测定某一制品效价或毒性的标准物质,其生物活性以国际单位(IU)或以单位(U)表示。国家生物参考品系指用国际参考品标定的,或我国自行研制的(尚无国际参考品者)用于微生物(或其产物)的定性鉴定或疾病诊断的生物试剂、生物材料或特异性抗血清;或指用于定量检测某些制品的生物效价的参考物质,如用于麻疹活疫苗滴度
或类毒素絮状单位测定的参考品,其效价以特定活性单位表示,不以(IU)表示。1 对照品与标准品概念不清对照品与标准品是2个不同的概念,中国药典凡例中已有明确的定义:对照品系指用于鉴别、检查、含量测定和校正检定仪器性能的标准物质,而标准品系指用于生物检定、抗生素或生物药品中含量或效价测定的标准物质,以效价单位(U)表示。文献中常将2种概念混淆,认为对照品就是标准品,是1种物质2种提法而已[1,2],造成错误的原因,可能是有的药品既有对照品,又有标准品。例如,当用微生物法测定头孢克罗效价时,用头孢克罗标准品,用HPLC或UV法测定时,则用对照品;非那西丁当用作熔点校准物质时,用熔点标准品,测定含量时,用对照品。即使是同一种物质的标准品和对照品,它们的规格、标定方法以及用途都可能是不同的。 2 对照品或标准品混用对照品或标准品混用,即将对照品或标准品用于不是其标定方法的含量测定,是药品检验中经常出现但未引起重视的一个问题[3]。尽管同一批对照品不同标定方法的含量有很好的相关性,但并不完全相同,有时差别会很大。如英国Glaxo公司提供的头孢呋肟酯对照品,HPLC标定为96.9%,供含量测定用;UV为98.8%,供溶出度测定。虽然中国药典凡例明确规定卫生部所发对照品仅用于正文中所规定的分 析方法。但由于:(1)卫生部提供的对照品使用说明书不够详尽,大多无对照品质量要求及标定方法; (2)对对照品或标准品的正确使用缺乏认识; (3)日常科研中极难找到相应的对照品; (4)中国药典正文中也常存在对照品混用的问题,如常将含量测定用的标准品或对照品用于溶出度检查,而含量测定方法与溶出度分析方法又不同,故极易引起混用。
