CAST(钙蛋白酶抑制蛋白酶)功能缺失(LOF)的突变,导致皮肤缺损白甲病、肢体末端点状角质化口唇炎指关节垫

CAST(钙蛋白酶抑制蛋白酶)功能缺失(LOF)的突变,导致皮肤缺损、白甲病、肢体末端点状角质化、口唇炎、指关
节垫
一:研究背景
皮肤剥落综合征(PSS)一种皮肤角质层持续的脱落症状,从婴幼儿时发病持续终生,皮肤脱落可伴有红斑、水泡和其它外胚层组织病变,比如脱发、异常指甲。PSS可分为两种临床类型:肢端PSS(APSS)和广泛性PSS(GPSS)。APSS患者发生在手足部位的手掌面、足底、背面,和谷氨酰胺转氨酶-5突变有关。此外,导致常染色隐性遗传病鱼鳞病的半胱氨酸蛋白酶抑制酶-A(CSTA)的基因突变也和APSS有关;GPSS个体和角膜黏连蛋白突变(CDSN)有关;山姆综合征(一种严重皮炎)和桥粒心黏连蛋白-1(GSD1)突变有关;Exampl…….。然而,一些APSS 病人的遗传机制尚不清楚。
CSAT基因突变为常染色隐性遗传,大量APSS患者该突变基因型为纯合子,临床表现白甲、肢体末端点状角质化、口唇炎、指关节垫,疾病缩写“PLACK”。通过显子测序和Sanger测序,证实了在三个互相隔离的家庭成员PLACK患者中,不同的纯合子的CSAT功能缺失。
二:研究目的
验证CSAT在表皮稳态中的作用。
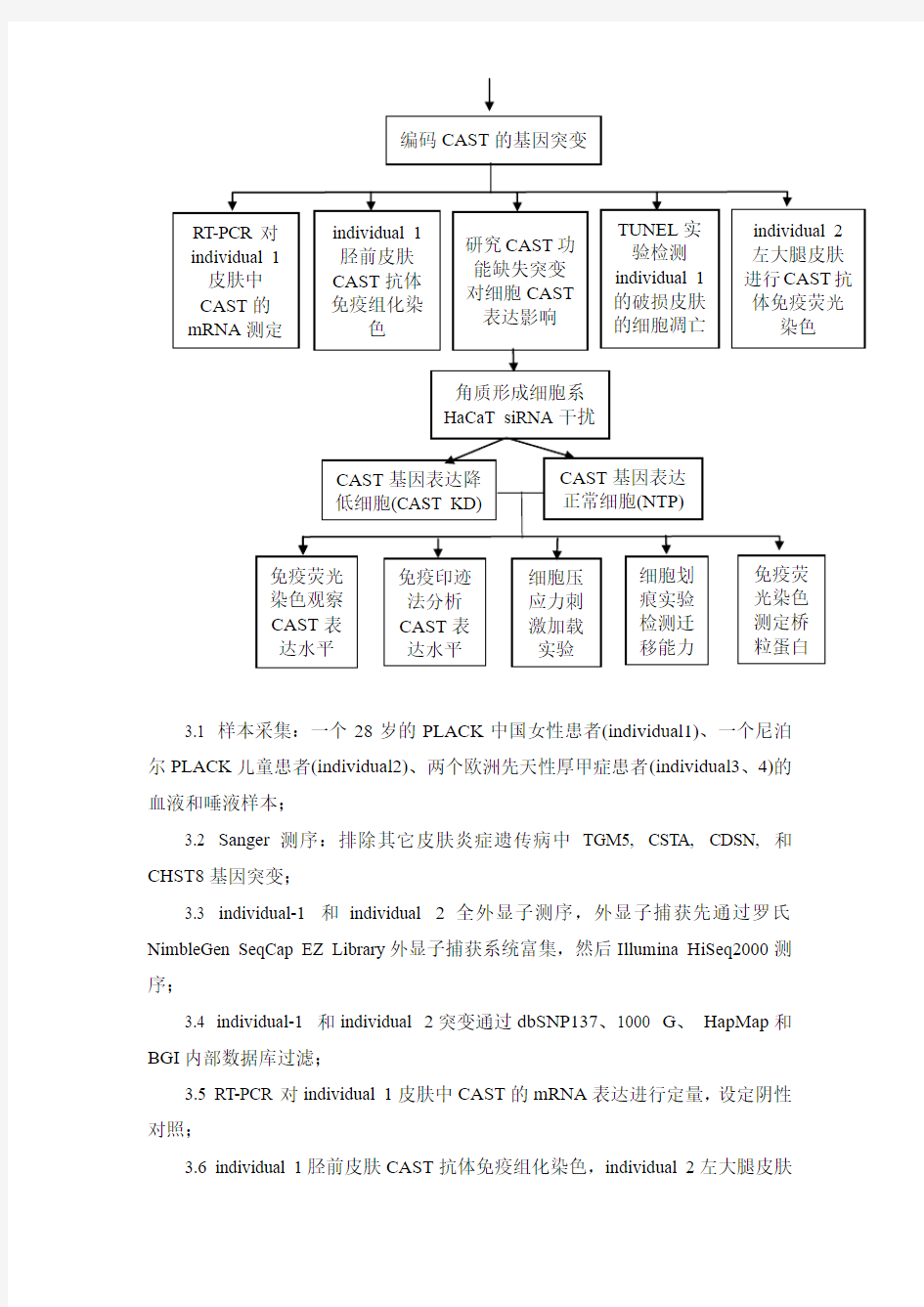
3.1 样本采集:一个28岁的PLACK中国女性患者(individual1)、一个尼泊尔PLACK儿童患者(individual2)、两个欧洲先天性厚甲症患者(individual3、4)的血液和唾液样本;
3.2 Sanger测序:排除其它皮肤炎症遗传病中TGM5, CSTA, CDSN, 和CHST8基因突变;
3.3 individual-1 和individual 2全外显子测序,外显子捕获先通过罗氏NimbleGen SeqCap EZ Library外显子捕获系统富集,然后Illumina HiSeq2000测序;
3.4 individual-1 和individual 2突变通过dbSNP137、1000 G、HapMap和BGI内部数据库过滤;
3.5 RT-PCR对individual 1皮肤中CAST的mRNA表达进行定量,设定阴性对照;
3.6 individual 1胫前皮肤CAST抗体免疫组化染色,individual 2左大腿皮肤
进行CAST抗体免疫荧光染色,同时设置阴性对照;
3.7 通过TUNEL实验(原位细胞凋亡检测试剂盒)检测individual 1的破损皮肤的细胞凋亡情况,荧光显微镜观察基底层上层细胞,对总细胞和凋亡细胞计数,健康人皮肤为对照,;
3.8 研究CAST功能缺失突变对细胞CAST表达影响:
选择角质形成细胞系HaCaT进行研究,使用siRNA介导的CAST基因低表达技术处理(CAST KD cells),对照组不进行靶基因siRNA干扰(NTP cells);
3.8.1免疫荧光染色镜下观察两组细胞CAST表达水平;
3.8.2免疫印迹法分析两组细胞CAST蛋白表达水平;
四:研究结果
4.1 全外显子测序结果:
4.1.1 individual-1 148个纯合子突变,15个在外显子区和剪接区,CAST 基因上发现一个核苷酸重复(c.607dup)导致移码突变,使蛋白合成终止。改突变为为纯合子类型,在她家人中为杂合子;
4.1.2 individual 2,CAST基因上点突变(c.424A>T);
4.1.3 individual 3和4 ,CAST基因上一位点G碱基缺失(c.1750delG)。
这个突变在很多数据库中都没有记录。
4.2 RT-PCR结果:
individual 1皮肤中CAST的mRNA含量非常低;
4.3 individual 1免疫组化和individual 2免疫荧光结果
4.3.1 CAST含量在individual 1和2的皮肤中明显低于正常人皮肤中含量。
4.3.2 individual 1破损的皮肤免疫组化结果显示:兜甲蛋白、角蛋白-1、角蛋白-10表达微量上调(表皮破损的代偿作用);于此相反的,individual 1和individual 2其皮肤丝聚蛋白、紧密连接蛋白-1含量与对照无明显差别(无代偿)。
4.4 细胞凋亡荧光显微镜及电镜结果:
破损皮肤凋亡细胞数明显多于健康人(Fig3A、B),其超微结构观察,细胞间隙增大(Fig3D),染色质聚缩、边集(Fig3E)。
4.5 CAST功能缺失突变对细胞CAST表达影响:
4.5.1 免疫荧光染色镜下观察结果:NTP细胞CAST表达量(绿色荧光染色)显著高于CAST KD细胞(Fig4A\B);
4.5.2 免疫印迹法蛋白表达检测结果:NTP细胞CAST表达明,CAST KD 细胞CAST蛋白含量很弱(Fig4C);
4.6 压应力刺激加载实验:
CAST KD细胞在拉伸后细胞间连接断裂,相反,对照组细胞间角蛋白纤维伸长,无明显断裂发生(Figures4D–4G)。
4.7 角质形成细胞迁移能力检测:
CAST KD cells和NTP cells无明显区别。
4.8 CAST在角质形成细胞间黏附机制研究结果:
1号和2号病人皮肤细胞桥粒上桥粒芯斑蛋白,含量明显增加(Fig4H/I)。五讨论:
钙蛋白酶/钙蛋白酶抑制酶(CAST)在存在于非溶酶体蛋白系统中,广泛存在于哺乳动物细胞中。钙蛋白酶催化靶蛋白水解,同时在不同细胞活动中起重要作用,比如细胞的增殖、分化、迁移及细胞周期性变化;同时,活化的钙蛋白酶也能促进细胞凋亡。钙蛋白酶抑制酶基因上发生突变,使其丧失了抑制钙蛋白酶作用,因此引起角质细胞凋亡增加,TUNEL(凋亡细胞测定)和TEM(投射显微镜)结果显示了这种作用。过量的角质形成细胞凋亡会导致皮肤角质化,其临床表现为:肢端皮肤点状角质化、指结垫、白甲。
之前报道研究,钙蛋白酶促进细胞间黏附蛋白水解,我们的CAST KD实验(CAST进行siRNA干扰使其表达下调)证实了钙蛋白酶/钙蛋白酶抑制酶系统可能在细胞间黏中起重要作用。由于CAST活性丢失的突变导致钙蛋白酶活性增加,从而使某些细胞桥粒中蛋白水解过多,引起桥粒功能减弱,使表皮细胞抗拉伸能力降低,引起表皮脱落等症状。这种猜测在PLACK综合征和其它伴随桥粒功能降低的遗传性疾病中进一步得到验证,包括GPSS、SAM综合征、内瑟顿综合征等。
在两个病人皮肤中角质形成细胞内增加的桥粒斑蛋白,可能是因为桥粒中蛋白水解的一种代偿机制。尽管CSAT在神经系统、肌肉骨骼组织、眼组织中起着不同的生理作用,但我们观察的病人并没有明显相关的症状,需要进一步研究
在这些器官组织中是否有其它的钙蛋白酶水解系统。
值得注意的是CSAT-基因敲除小鼠,其钙蛋白酶活性增加,但在正常环境下没有疾病表现,在刺激环境下,也仅有轻微的行为改变。这些表型的差异说明了在人和小鼠体内钙蛋白酶/钙蛋白酶抑制酶系统具有不同的生理功能。
六研究结论:
PLACK 综合征是一种纯合子的CAST功能缺失突变, 由于CAST含量降低引起,而CAST是唯一的已知的钙蛋白酶抑制因子。
蛋白酶抑制因子突变能够引起皮肤性疾病。比如Netherton 综合征由SPINK5突变引起,长岛型掌跖角化症SERPINB7突变,我们的研究拓展了皮肤蛋白水解机制的研究思路。
常见蛋白酶抑制剂
当前位置:生物帮 > 实验技巧 > 生物化学技术 > 正文 蛋白酶及蛋白酶抑制剂大全 日期:2012-06-13 来源:互联网 标签: 相关专题:解析蛋白酶活性测定聚焦蛋白酶研究新进展 摘要: 破碎细胞提取蛋白质的同时可释放出蛋白酶,这些蛋白酶需要迅速的被抑制以保持蛋白质不被降解。在蛋白质提取过程中,需要加入蛋白酶抑制剂以防止蛋白水解。以下列举了5种常用的蛋白酶抑制剂和他们各自的作用特点,因为各种蛋白酶对不同蛋白质的敏感性各不相同,因此需要调整各种蛋白酶的浓度 恩必美生物新一轮2-5折生物试剂大促销! Ibidi细胞灌流培养系统-模拟血管血液流动状态下的细胞培养系统 广州赛诚生物基因表达调控专题 蛋白酶抑制剂 破碎细胞提取蛋白质的同时可释放出蛋白酶,这些蛋白酶需要迅速的被抑制以保持蛋白质不被降解。在蛋白质提取过程中,需要加入蛋白酶抑制剂以防止蛋白水解。以下列举了5种常用的蛋白酶抑制剂和他们各自的作用特点,因为各种蛋白酶对不同蛋白质的敏感性各不相同,因此需要调整各种蛋白酶的浓度。由于蛋白酶抑制剂在液体中的溶解度极低,尤其应注意在缓冲液中加人蛋白酶抑制剂时应充分混匀以减少蛋白酶抑制剂的沉淀。在宝灵曼公司的目录上可查到更完整的蛋白酶和蛋白酶抑制剂表。 常用抑制剂 PMSF 1)抑制丝氨酸蛋白酶(如胰凝乳蛋白酶,胰蛋白酶,凝血酶)和巯基蛋白酶(如木瓜蛋白酶); 2)10mg/ml溶于异丙醇中; 3)在室温下可保存一年; 4)工作浓度:17~174ug/ml(0.1~1.0mmol/L); 5)在水液体溶液中不稳定,必须在每一分离和纯化步骤中加入新鲜的PMSF。 EDTA 1)抑制金属蛋白水解酶; 2)0.5mol/L水溶液,pH8~9;
钙蛋白酶抑制蛋白(Calpastatin)的研究进展
读书报告 钙蛋白酶抑制蛋白研究进展 汪超钟正泽杨飞云周晓蓉曹兰 (重庆市畜牧科学院重庆荣昌402460) 摘要:钙蛋白酶在宰后肉类成熟过程中通过降解肌肉蛋白质而提高肉嫩度,钙蛋白酶抑制蛋白是在细胞内广泛表达的、高效的、专一性抑制钙蛋白酶活性的蛋白质,因此引起了广大研究者的广泛关注。本文阐述了钙蛋白酶抑制蛋白的结构,生物学作用,营养等因素对钙蛋白酶抑制蛋白的影响及其活性测定方法。 关键词:钙蛋白酶抑制蛋白结构生物学作用活性测定 Research Progress of Calpastatin W ang chao, Zhong zhengzhe, Y ang feiyun, Zhou xiaorong ,Cao lan (Chongqing Academy of Animal Science,Rongchong 402460 ) Abstact: Calpain make a contribution to Meat Tenderization by degradation of protein in the postmortem meat tenderization process. Calpastatin , a special endogenous inhibitor expressed extensively in cell , has a special inhibition to calpain. Therefore ,This paper review the structure ,biologic function, influenced factors , separation and activity assay of calpastatin. Key words: Calpastatin. Structure , Biologic function, influenced factors , activity assay 钙蛋白酶(Calpain)是一种钙激活中性半胱氨酸内肽酶,分布于所有脊椎动物的肌细胞内部。钙蛋白酶家族包括μ-钙蛋白酶,m-钙蛋白酶和钙蛋白酶抑制蛋白(Calpastatin)等。钙蛋白酶在骨骼肌中通过涉及生肌细胞分化、激发肌原纤维蛋白周转来调控生长,同时在宰后肉类成熟过程中通过降解肌肉蛋白质而提高肉嫩度。钙蛋白酶被钙离子和钙蛋白酶抑制蛋白调控[1]。钙蛋白酶抑制蛋白是一种有着多种功能的内源抑制剂,它通过抑制钙蛋白酶而发挥作用。本文综述了钙蛋白酶抑制蛋白的结构、生物学作用、营养等因素对钙蛋白酶抑制蛋白的影响及其分离与活性检测方法等。 1 钙蛋白酶抑制蛋白的结构 肌肉组织中钙蛋白酶抑制蛋白的分子量为77 KDa,斯托克半径为6.8nm,含
CAST(钙蛋白酶抑制蛋白酶)功能缺失(LOF)的突变,导致皮肤缺损白甲病、肢体末端点状角质化口唇炎指关节垫
CAST(钙蛋白酶抑制蛋白酶)功能缺失(LOF)的突变,导致皮肤缺损、白甲病、肢体末端点状角质化、口唇炎、指关 节垫 一:研究背景 皮肤剥落综合征(PSS)一种皮肤角质层持续的脱落症状,从婴幼儿时发病持续终生,皮肤脱落可伴有红斑、水泡和其它外胚层组织病变,比如脱发、异常指甲。PSS可分为两种临床类型:肢端PSS(APSS)和广泛性PSS(GPSS)。APSS患者发生在手足部位的手掌面、足底、背面,和谷氨酰胺转氨酶-5突变有关。此外,导致常染色隐性遗传病鱼鳞病的半胱氨酸蛋白酶抑制酶-A(CSTA)的基因突变也和APSS有关;GPSS个体和角膜黏连蛋白突变(CDSN)有关;山姆综合征(一种严重皮炎)和桥粒心黏连蛋白-1(GSD1)突变有关;Exampl…….。然而,一些APSS 病人的遗传机制尚不清楚。 CSAT基因突变为常染色隐性遗传,大量APSS患者该突变基因型为纯合子,临床表现白甲、肢体末端点状角质化、口唇炎、指关节垫,疾病缩写“PLACK”。通过显子测序和Sanger测序,证实了在三个互相隔离的家庭成员PLACK患者中,不同的纯合子的CSAT功能缺失。 二:研究目的 验证CSAT在表皮稳态中的作用。
3.1 样本采集:一个28岁的PLACK中国女性患者(individual1)、一个尼泊尔PLACK儿童患者(individual2)、两个欧洲先天性厚甲症患者(individual3、4)的血液和唾液样本; 3.2 Sanger测序:排除其它皮肤炎症遗传病中TGM5, CSTA, CDSN, 和CHST8基因突变; 3.3 individual-1 和individual 2全外显子测序,外显子捕获先通过罗氏NimbleGen SeqCap EZ Library外显子捕获系统富集,然后Illumina HiSeq2000测序; 3.4 individual-1 和individual 2突变通过dbSNP137、1000 G、HapMap和BGI内部数据库过滤; 3.5 RT-PCR对individual 1皮肤中CAST的mRNA表达进行定量,设定阴性对照; 3.6 individual 1胫前皮肤CAST抗体免疫组化染色,individual 2左大腿皮肤
蛋白酶抑制剂选择指南
蛋白酶抑制剂选择指南 1 蛋白酶抑制剂选择指南 抑制剂 工作浓度 分子量 抑制蛋白酶种类 稳定性 AEBSF终浓度1mM MW:239.5不可逆的丝氨酸蛋白酶抑制剂,抑制胰蛋白酶,糜 蛋白酶,纤溶酶,凝血酶及激肽释放酶. 可溶于水,其pH7的水溶液在4o C可保持稳定1-2个月,在pH>8的情况下会发生缓慢水解 Aprotinins 抑肽酶终浓度2ug/ ml MW:6512 可逆的丝氨酸蛋白酶抑制剂,可抑制纤溶酶,激肽 释放酶,胰蛋白酶,糜蛋白酶,但不抑制凝血酶和 Factor Xa。 非常稳定,当pH>12.8时失去活性,可溶于 水(10mg/ml),-20o C下可长期保存 Bestatin终浓度10uM MW:308.4 可逆的丙氨酰-氨基肽酶抑制剂, 工作液可保存一天,1mM的甲醇贮存液在 -20o C可保存至少一个月 E-64 Protease Inhibitor终浓度10uM MW:357.4 不可逆的半胱氨酸酸蛋白酶抑制剂,抑制半胱氨酸 酸蛋白酶而不会影响其他酶的半胱氨酸残基,与小 分子量的巯基醇如beta-巯基乙醇不会产生反应, 具有高度特异性。工作液在正常pH值下可保持稳定数天,1mM的水溶液在-20o C可保存几个月 EDTA, 4Na终浓度10mM MW:380.2 金属蛋白酶的可逆性螯合物,可能同时影响其他金 属依赖性生物过程。其水溶液很稳定,其贮存液(pH8.5的0.5M 水溶液)在4o C可保存数月 Leupeptin, 半硫酸盐 亮抑酶肽(亮肽素) 终浓度100uM MW:493.6 可逆的丝氨酸及半胱氨酸蛋白酶制剂,可抑制胰蛋 白酶样蛋白酶及一些半胱氨酸蛋白酶如:Lys-C内 切蛋白酶,激肽释放酶,木瓜蛋白酶,凝血 酶,Cathepsin B及胰蛋白酶。 工作液的稳定期为数小时,贮存液(10mM 水溶液)在4o C时稳定期为一周,-20o C时 稳定期为一个月 Pepstatin A 终浓度1uM MW:685.9 可逆的天冬氨酸蛋白酶,可抑制胃蛋白 酶,Cathepain B&L,血管紧张肽原酶(renin)及以1mg/ml溶于甲醇,搅拌过夜可以 1mg/ml溶于乙醇,333mg/ml溶于6N的
钙蛋白酶系统研究进展_梅承君
钙蛋白酶系统研究进展 梅承君1,庞辉2,康相涛1*,孙桂荣1(1.河南农业大学,河南郑州450000;2.河南省公安厅,河南郑州450000)摘要阐述了钙蛋白酶系统的分类、结构,并且综述钙蛋白酶系统的一般生物学功能及影响因素。 关键词钙蛋白酶;钙蛋白酶抑制蛋白;钙蛋白酶激活蛋白;嫩度 中图分类号Q55文献标识码A文章编号0517-6611(2006)22-5774-03 Research Adva nce in C alpain System MEI C heng-jun et al(Hen an Agricul tu ral University,Zhen gzh ou,Henan450000) Abstract This paper revie wed th e classi ficati on and structu re of cal pain sys tem,the general biological function and its affecting factors. Key w ords C alp ain;Cal pas tatin;Calpain activator;Tenderness 钙蛋白酶是1964年由Guroff首次发现,1972年Bush等首先在骨骼肌中确认,1976年Da yton等对其进行纯化。钙蛋白酶被鉴定、纯化后,其名称有钙活化中性蛋白酶(Calcium a ctiva te d ne utra l prote ase,Calcium ac tiva ted ne utral SH prote ase, c alpain)简写为CANP(EC,3,4,22,17)、钙激活酶(Ca2+-a ctiva t-ed enzy me)、钙激活中性蛋白酶(Calcium a ctiv ate d ne utral pro-te ase)等。1983年Go ll等提出钙蛋白酶在骨骼肌肌丝蛋白降解过程中起关键作用[1]。目前,已证明它广泛地分布于绝大多数动物的细胞中。在一定浓度的钙离子作用下,钙蛋白酶主要作用于细胞骨架蛋白、蛋白激酶和磷酸酶,还参与细胞内的信号传递[2]。 1钙蛋白酶系统 1.1钙蛋白酶的分类Calpain中的Cal代表钙调蛋白(Ca-l moclulin),pain代表木瓜蛋白酶(Pa pain)。Calpain由钙调蛋白和木瓜蛋白酶两者以非共价键结合而成。钙蛋白酶系由多种同工酶构成。根据分布特点可将其分为组织特异性和非组织特异性蛋白酶两大类[3]。目前研究比较深入的是非组织特异性蛋白酶,已知的2种非组织特异性同工酶是Ca-l pain1和Ca lpain2。Ca lpain1可被L mol水平的钙离子激活,又称L-Calpain;Ca lpain2可被mmol水平的钙离子激活,又称m-Calpain。除活化时需要的钙离子浓度不同和结构略有差别以外,这2种同工酶生化和催化的性质几乎完全相同。红细胞内仅含有Calpain1,其余的哺乳动物细胞中均含有2种形式的钙蛋白酶。由于细胞内钙离子的波动在微摩尔(L mol)浓度水平以下,所以Ca lpain1很可能在正常生理条件下发挥功能,而Calpain2则可能在病理情况(细胞内钙超载条件)下才能激活[4]。 1.2钙蛋白酶系统的结构[5] 1.2.1钙蛋白酶的结构。钙蛋白酶系中L-Calpain和m-Ca-l pain由不均一的二聚体蛋白构成,其大、小亚基的分子量分别为80和30kD。Calpain3、8a、9、11、12和13也都分别由大、小2个亚基构成。大亚基具有催化活性,L-Ca lpain和m-Ca-l pain的大亚基分别由CANP1和CAN P2基因编码;小亚基具有调节功能。尽管L-Calpain和m-Calpain大亚基氨基酸 基金项目国家/8630计划资助项目(2002AA242021);河南省重大科技攻关项目(022*******,0322010600);河南省高校杰出科研人才 创新工程项目(2000KY CX005)。 作者简介梅承君(1979-),女,河南焦作人,硕士研究生,研究方向:家禽育种。*通讯作者。 收稿日期2006-08-09序列有明显差异,但是其高级结构基本相同,都由4个结构域组成,从N端起分别命名为?、ò、ó、?结构域。在大亚基中,结构域?由1~80位氨基酸残基组成,约占全部分子的10%,在蛋白酶激活的情况下很容易发生自溶,由此推测其可能起钙蛋白酶的活性调节作用,L-Calpain和m-Ca lpain仅在结构域?中不同;结构域ò含有81~330位氨基酸残基,约占全部分子的35%,是表现钙蛋白酶水解活性的关键部位,在未被激活的条件下含有2个次级区域[6];结构域ó由331~560位氨基酸残基组成,约占全部分子的35%,其功能为结合钙离子和磷脂,与蛋白酶调控亚基或其他调控蛋白有关;结构域?由561~705位氨基酸残基组成,占全部分子的20%,是结合钙离子的部位,含有4个钙结合蛋白所特有的EF-手型结构(1个EF-手型结构包含2个与钙离子结合环相连的氨基酸螺旋)[7]。L-Ca lpain、m-Calpain、Ca lpain9的小亚基含有2个结构域,这2个结构域由一段富含脯氨酸的序列相连,其中结构域ò与大亚基的结构域?相同,含有4个可以结合钙的EF-手型结构,故也具有结合钙的活性[8]。在其他钙蛋白酶中,如Calpain3、8a、11、12、13,尽管其大亚基也有结构域?,但其大、小亚基之间并没有相互联系。Ca lpain5、6、7、8b、10、15为非典型的钙蛋白酶,其部分结构域缺失或被取代,没有结构域?,因此推测其大、小亚基间也不存在联系。 1.2.2钙蛋白酶抑制蛋白的结构。钙蛋白酶抑制蛋白(Ca-l pastatin)是细胞内专一抑制钙蛋白酶活性的蛋白质。通过抑制钙蛋白酶活性,可抑制肌肉内蛋白质降解,参与肌肉生长过程中蛋白质的更新。在屠宰后的动物体内,它可抑制钙蛋白酶的活性,从而明显影响肉的嫩度。它可以识别钙蛋白酶与钙结合引起的构象变化,并与之特异性结合。钙蛋白酶抑制蛋白通过抑制钙蛋白酶的自溶作用而发挥作用,且该抑制作用不受pH值的影响。钙蛋白酶抑制蛋白共由5个部分(?、ò、ó、?、?)组成,其中4个是钙蛋白酶抑制蛋白的活性中心。当钙蛋白酶被钙离子激活后,如果附近有钙蛋白酶抑制蛋白存在,则将迅速与之结合而抑制蛋白酶活性,从而保证钙蛋白酶对底物只进行局部的特定位点的水解。 目前对钙蛋白酶抑制蛋白的生化性质了解的还不十分清楚。根据钙蛋白酶抑制蛋白在SDS电泳中的行为,可将其分为70和110kD两种类型。70kD类型主要存在于红细胞中,110kD类型存在于肝、心脏和其他组织中。虽然这2种钙蛋白酶抑制蛋白分子大小不同,但它们的功能性质相似。 安徽农业科学,Jou rnal of Anh ui Agri.S ci.2006,34(22):5774-5776责任编辑刘月娟责任校对孙能森
钙调磷酸酶抑制剂
钙调磷酸酶抑制剂 (一)器官移植排斥反应 1、移植排斥反应 人体的免疫系统对各种致病因子有着非常完善的防御机制,能够对细菌、病毒、异物、异体组织、人造材料等“异己成分”进行攻击、破坏、清除,这种复杂的免疫学反应是人体非常重要的一种保护机制。受者进行同种异体组织或器官移植后,外来的组织或器官等移植物作为一种“异己成分”被受者免疫系统识别,后者发起针对移植物的攻击、破坏和清除,这种免疫学反应就是移植排斥反应(transplant rejection)。移植排斥反应是影响移植物存活的主要因素之一。 移植排斥反应是非常复杂的免疫学现象,涉及细胞和抗体介导的多种免疫损伤机制,发生原因主要是受体和移植物的人类白细胞抗原HLA(human leucocyte antigen)不同。因此,供者与受者HLA的差异程度决定了排异反应的轻或重。除同卵双生外,二个个体具有完全相同的HLA 系统的组织配型几乎是不存在的,因此在供受者进行配型时,选择HLA配型尽可能地接近的供者,是减少异体组织、器官移植后移植排斥反应的关键 2、发病机制 排斥反应的发生机制主要包括细胞免疫和体液免疫两个方面。临床最常见的急性排斥反应主要由细胞免疫介导,而超急性排斥反应和慢性排斥反应主要由体液免疫介导。 (1)细胞介导的排斥反应 细胞免疫在急性排斥反应发生发展过程中起主导作用。移植物中供体的淋巴细胞和树突状细胞具有丰富的HLA-Ⅰ和Ⅱ类抗原,是诱发排斥反应的主要致敏原。在移植物植入受体后,随着移植物的血液循环重建,供者的HLA-Ⅰ和Ⅱ类抗原不可避免的暴露于受者的免疫系统,受者的免疫细胞识别外来抗原后,即可引发下述一系列免疫反应: CD8+细胞毒性T细胞前体细胞与供者HLA-Ⅰ类抗原结合后活化增殖为成熟的细 胞毒性T细胞,对移植物产生攻击效应;CD4+T辅助细胞识别供体HLA-Ⅱ类抗原,促使抗原递呈细胞释放IL-I,后者可促进T辅助细胞增殖和释放IL-2,IL-2可进一步促进T辅助细胞增殖并为细胞毒性T细胞的分化提供辅助信号;除了IL-2之外,TH
常见蛋白酶抑制剂
蛋白酶及蛋白酶抑制剂大全 标签: 相关专题:解析蛋白酶活性测定聚焦蛋白酶研究新进展 摘要: 破碎细胞提取蛋白质的同时可释放出蛋白酶,这些蛋白酶需要迅速的被抑制以保持蛋白质不被降解。在蛋白质提取过程中,需要加入蛋白酶抑制剂以防止蛋白水解。以下列举了5种常用的蛋白酶抑制剂和他们各自的作用特点,因为各种蛋白酶对不同蛋白质的敏感性各不相同,因此需要调整各种蛋白酶的浓度 恩必美生物新一轮2-5折生物试剂大促销! Ibidi细胞灌流培养系统-模拟血管血液流动状态下的细胞培养系统 广州赛诚生物基因表达调控专题 蛋白酶抑制剂 破碎细胞提取蛋白质的同时可释放出蛋白酶,这些蛋白酶需要迅速的被抑制以保持蛋白质不被降解。在蛋白质提取过程中,需要加入蛋白酶抑制剂以防止蛋白水解。以下列举了5种常用的蛋白酶抑制剂和他们各自的作用特点,因为各种蛋白酶对不同蛋白质的敏感性各不相同,因此需要调整各种蛋白酶的浓度。由于蛋白酶抑制剂在液体中的溶解度极低,尤其应注意在缓冲液中加人蛋白酶抑制剂时应充分混匀以减少蛋白酶抑制剂的沉淀。在宝灵曼公司的目录上可查到更完整的蛋白酶和蛋白酶抑制剂表。 常用抑制剂 PMSF 1)抑制丝氨酸蛋白酶(如胰凝乳蛋白酶,胰蛋白酶,凝血酶)和巯基蛋白酶(如木瓜蛋白酶); 2)10mg/ml溶于异丙醇中; 3)在室温下可保存一年; 4)工作浓度:17~174ug/ml(0.1~1.0mmol/L); 5)在水液体溶液中不稳定,必须在每一分离和纯化步骤中加入新鲜的PMSF。 EDTA 1)抑制金属蛋白水解酶; 2)0.5mol/L水溶液,pH8~9; 3)溶液在4℃稳定六个月以上;
4)工作浓度:0.5~1.5mmol/L. (0.2~0.5mg/ml); 5)加入NaOH调节溶液的pH值,否则EDTA不溶解。 胃蛋白酶抑制剂(pepst anti n) l)抑制酸性蛋白酶如胃蛋白酶,血管紧张肽原酶,组织蛋白酶D和凝乳酶; 2)1mg/ml溶于甲醇中; 3}储存液在4℃一周内稳定,-20℃稳定6个月; 4)1作浓度:0.7ug/ml(1umol/L) 5)在水中不溶解。 亮抑蛋白酶肽(leupeptin) 1)抑制丝氨酸和巯基蛋白酶,如木瓜蛋白酶,血浆酶和组织蛋白酶B; 2)lOmg/ml溶于水; 3)储存液4℃稳定一周,-20℃稳定6个月; 4)工作浓度0.5mg/ml。 胰蛋白酶抑制剂(aprotinin) 1)抑制丝氨酸蛋白酶,如血浆酶,血管舒缓素,胰蛋白酶和胰凝乳蛋白酶; 2)lOmg/ml溶于水,pH7~8 3}储存液4℃稳定一周,-20℃稳定6个月; 4)工作浓度:0.06~2.0ug/ml(0.01~0.3umol/L); 5)避免反复冻融: 6)在pH>12.8时失活。 蛋白酶抑制剂混合使用 35ug/ml PMSF…………………………………丝氨酸蛋白酶抑制剂 0.3mg/ml EDTA…………………………………金属蛋白酶抑制剂 0.7ug/ml胃蛋白酶抑制剂(Pepstatin)…………酸性蛋白酶抑制剂 0.5ug/ml亮抑蛋白肽酶(Leupeptin)……………广谱蛋白酶抑制剂
钙蛋白酶系统与肌肉增长及嫩度的关系
收稿日期:2002-05-16 作者简介:金海丽(1979-),女,浙江义乌人,浙江大学华家池校区饲料所在读硕士生,主要从事动物营养与饲料科学研究。 浙江农业学报Acta Agriculturae Zhejiangensis 14(6):354~359,2002 钙蛋白酶系统与肌肉增长及嫩度的关系 金海丽,许梓荣 (浙江大学饲料科学研究所,浙江杭州310029) 摘 要:钙蛋白酶系统主要由钙蛋白酶(μ-calpain ,m-calpain ) 及钙蛋白酶抑制蛋白(calpastatin )组成,calpain 是存在于细胞质中的依赖于Ca 2+的中性蛋白酶,calpastatin 是钙蛋白酶的内源抑制蛋白。近年的研究表明,calpain 是细胞质中主要的蛋白水解酶,在肌原纤维蛋白降解中起着重要的作用。肌肉增长和宰后嫩度的变化与蛋白质水解程度密切相关。因此,钙蛋白酶系统的活性会影响畜禽肌肉增长和肉的嫩度。本文综述了钙蛋白酶系统各种酶的结构、作用、活性调节及与肉质的关系。关键词:钙蛋白酶系统;结构功能;活性调节;肌肉增长;嫩度中图分类号:S813.24 文献标识码:A 文章编号:1004-1524(2002)06-0354-06 The relationship between calpain system and muscle growth and meat tenderness :JIN Hai-li ,XU Zi-rong (Feed Science Institute ,Zhejiang University ,Hangzhou 310029,China ) Abstract :Calpain system consists of μ-calpain ,m-calpain ,the calcium-dependent neutral proteases ,and their endogenous inhibitor ,calpastatin.Calpain system is probably the major proteolytic in protein degradation ,which plays an important role in myofibrillar protein degradation.The muscle growth and postmortem tenderiza-tion of meat are highly related to the degree of proteolysis ,so the activity of calpain system has an effect on muscle growth and meat tenderness.This paper reviews the structure ,function and regulation of calpain system and the relationship between calpain system and muscle growth and meat tenderness . Key words :calpain system ;structure and function ;activity regulation ;muscle growth ;tenderness 提高家畜瘦肉率和产出对畜牧业来说具有非常重要的经济意义。肌肉蛋白质的增加取决于肌肉蛋白合成速度和降解速度。研究发现,过量calpain 表达可引起成肌细胞肌原纤维的降解,而calpastatin 表达量的增加会抑制肌肉蛋白质水解。骨骼肌蛋白降解的途径有三条:溶酶体组织蛋白酶途径、依赖钙的蛋白酶途径和依赖ATP 的蛋白质途径。在肌 肉组织中,钙蛋白酶系统控制着肌纤维蛋白 的降解,是肌肉蛋白质降解的限速步骤[1]。 因此,钙蛋白酶系统有可能在肌肉发育中起着调控作用。 肉的嫩度是肉品质的一个重要方面。影响肌肉间肉嫩度的主要因素有肌节的长度、结缔组织的含量及肌肉结构蛋白的水解敏感 性 [2] 。目前研究主要集中在第3个因素,宰后肌肉嫩度与肌肉蛋白质的降解量密切相 关,具有水解蛋白的特性钙蛋白酶系统毫无疑问会影响宰后肉嫩化,除此之外嫩度还与畜禽的遗传因素和肉的种类等因素有关。研
src激酶抑制剂综述
Src(sarcoma gene)受体激酶家族抑制剂 研究综述 药学0703班 U200717953 周俊
Src(sarcoma gene)受体激酶家族抑制剂研究综述 摘要;本文介绍了src的组成,作用以及与相关疾病的作用,总结了近几年研究src激酶家 族的方向,以src激酶家族作为靶点寻找抗癌药物中的一些进展和成果,并逐一分析比较有代表性的药物,如喹啉衍生物,嘧啶衍生物等等化合物,最后总结近期成果,指出现有工作的不足和未来的研究方向。 关键词鸡肉瘤病毒基因(src)酪氨酸蛋白激酶抑制因子ATP结合位点 引言: sarcoma gene(鸡肉瘤病毒基因,以下简称src)的组成 Src是一类癌基因,其表达产物主要是酪氨酸蛋白激酶类。Src在许多组织细胞中表达,在癌症发病机制中处于重要的地位,是肿瘤,癌症分子表达途径的重要的激酶。Src家族是研究最早最深入的家族,包括Blk, Brk, Fgr, Frk,Fyn, Hck, Lck, Lyn, c-Src, Srm,c-Yes等成员。根据氨基酸序列,可以分为两个亚族:一族是Src, Fyn, Yes and Fgr并且广泛在不同的组织中表达,Lck, Blk, Lyn and Hck和造血细胞有关.研究表明,Src与其他众多酶类可联合在一起促进多个细胞反应进程。Src 与多种激酶受体偶联,包括酪氨酸激酶受体,整合单白受体,G蛋白偶联受体等。.通过偶联作用影响细胞生长,发育,乃至转移扩散。最好的例子就是与EGFR(一种有关细胞生长的受体)的结合,Src可以使EGFR自身磷酸化,降低EGFR 的中间体的调节与胞吞作用。 除了牵涉到细胞内的反应,Src可能也在初级肿瘤细胞的转移中扮演着一个重要的角色。实际上Src转移细胞的存在减少了ECM反应以及组织反应的损失。分子调节这些过程的机理建立在Src和FAK的反应的基础上。Src与粘附分子有关。Src的磷酸化使得在粘附分子上的整联蛋白受体接收的黏着性与转移信号得以传播。 Src的作用靶点 一般来说就目前的研究而言,src的作用靶点有以下几类: 第一种是以src激酶为作用靶点。到目前为止还没有被批准的src激酶抑制剂,但是新的分子,有选择性的有潜力的化合物已经在被合成。设计测试更加有效的抑制剂,运用分子模型筛选技术,组合化学研发新的药物已经成为趋势。一般而言,一个抑制剂的选择性应该严格作用于癌细胞而不干扰正常细胞的生长进程,抑制剂也应间接作用于酶合成这样的在癌细胞进程中也会发生的物质。 第二种就是以SH2和SH3区域为靶点的药物,该药物是很多疾病的重要靶点,如癌症cardiovascular ,restenosis。这些分子阻断src和其他蛋白底物作用属于信号阻断途径,一般而言,SH2区域识别特殊的多肽包括一个磷酸化的酪氨酸残基。SH2的抑制剂分子设计基于氨基酸特定的排列顺序。在许多例子中,多肽库中产生的第一代配体给与了重要的信息以成功设计连接无受体的src的SH2的受体。而SH3的抑制剂则是基于与该区域作用的分子的多肽,其配体能够和SH3区域的酪氨酸富集区作用,但是一般而言这种作用是很弱的,因为形成的离子键和氢键数量有限。因此SH3抑制剂KI值在微摩尔范围内很低。尽管合成此种抑制剂的效果已经显现,但只有少量例子在文献中出现。 Src激酶家族的作用 Src酪氨酸激酶联系的受体对细胞的生长和分裂是非常重要的,它具有双重作用,既可以
胰蛋白酶抑制剂的测定.doc - NY
NY 中华人民共和国农业行业标准 NY/T1103.2-2006 转基因植物及其产品食用安全检测 抗营养素第2部分:胰蛋白酶抑制剂的测定 Safety assessment of genetically modified plant and derived products Part 2: assay of anti-nutrients pancreatic typsin inhibiter 2006-07-10发布2006-10-01实施 中华人民共和国农业部发布
前言 本标准由中华人民共和国农业部提出。 本标准由全国农业转基因生物安全管理标准化技术委员会归口。 本标准起草单位:中国疾病预防控制中心营养与食品安全所、农业部科技发展中心、中国农业大学、天津市卫生防病中心。 本标准主要起草人:杨月欣、王竹、韩军花、李宁、汪其怀、黄昆仑、刘克明、刘培磊、连庆。 本标准首次发布。
转基因植物及其产品食用安全检测 抗营养素第2部分:胰蛋白酶抑制剂的测定 1 范围 本标准规定了转基因植物及其产品中胰蛋白酶抑制剂的测定方法。 本标准适用于转基因大豆及其产品、转基因谷物及其产品中胰蛋白酶抑制剂的测定。其他的转基因植物,如花生、马铃薯等也可用该方法进行测定。 2 术语和定义 下列术语和定义适用于本标准。 2.1 转基因植物genetically modified plant 指利用基因工程技术改变基因组构成,用于农业生产或者农产品加工的植物。 2.2 转基因植物产品products derived from genetically modified plant 指转基因植物的直接加工产品和含有转基因植物的产品。 3 原理 胰蛋白酶可作用于苯甲酰-DL-精氨酸对硝基苯胺(BAPA),释放出黄色的对硝基苯胺,该物质在410 nm下有最大吸收值。转基因植物及其产品中的胰蛋白酶抑制剂可抑制这一反应,使吸光度值下降,其下降程度与胰蛋白酶抑制剂活性成正比。用分光光度计在410 nm 处测定吸光度值的变化,可对胰蛋白酶抑制剂活性进行定量分析。 4 试验材料 转基因植物及其产品、受体植物及其产品。如果对转基因植物产品中的胰蛋白酶抑制剂进行测定,转基因植物产品和受体植物产品的处理条件应相同。 上述材料的水分含量和种植环境应基本一致。
蛋白酶体抑制剂和免疫调节剂对骨髓瘤骨病的治疗作用
USA,2005,102(39):13944-13949. [15]M u raka m iY,Y asud a T,Saigo K,et a.l Co m prehens i ve ana l ysis of m i cro RNA exp ress i on patt erns i n hepatocell u l ar carci no m a and non -t um orous tiss ues[J].On cogene,2006,25(17):2537-2545. [16]Ku tay H,B ai S,Datta J,et a.l Down regulati on ofm i r-122i n t h e roden t and hu m an hepatocell u l ar carci no m as[J].J C ell B io- ch e m,2006,99(3):671-678.[17]C i afre SA,Gal ard i S,M ang i ola A,et a.l E xtensive m odu l ati on of a s et ofm icro RNA s i n pri m ary gliob l ast oma[J].B ioche m B i ophys R es Co mm un,2005,334(4):1351-1358. [18]Chan J A,Krichevs ky A M,K os i k KS.M icro RNA-21i s an ant-i apoptotic f act or i n hum an gli ob l ast o m a cells[J].C ancer Res, 2005,65(14):6029-6033.(编校:田媛) 蛋白酶体抑制剂和免疫调节剂对骨髓瘤骨病的治疗作用 于亚平 The effect of proteaso m e i nhi bitor and i m muno modulatory drugs on m yel o ma bone disease YU Ya-p i n g D e p ar t m ent of H e matology,N anjing GeneralH osp it a l of N anjing M ilit ary Comm and,PLA,N anj i ng210002,China. =Ab stract>M ulti p l e m yelo m a is character i zed by ex tensive bone destructi on w it h little o r no new bone for m ation.O ve r the last decade,nove l agents hav e been used in the m anage m ent o fMM.I mm uno m odulato ry drugs(I M i D s),such as tha li dom i de and lena lidom ide and pro teaso m e i nh i b itor,bortezom i b,have s hown s i gnificant anti-m yelo m a acti v ity i n both new ly diagnosed and re lapsed/refracto ry MM.Besides t he ir po ten t e fficacy ag ainst m ye l om a ce lls,these agents m odify t he i nteracti ons bet w een m ali gnant plas ma ce ll and bone m arro w m icroenv iron m ent,and alter abno r m al bone m etabo li s m i n MM.T h i s rev ie w summ arizes av ail able da ta for t he effect o f I M i D s and borte zo m i b on bone re m ode ling o fMM pa ti ents and t he ir possible role i n t he m anagem ent o fm ye l om are lated bone disease. =K ey w ords>m yelo m a;thali do m i de;lena li do m i de;proteasom e inh i bito r M odern O nco logy2009,17(02):0376-0380 =指示性摘要>多发性骨髓瘤(MM)以广泛骨破坏而少有新骨形成为特点。过去的10余年中,以沙利度胺和 来那度胺为代表的免疫调节药和以硼替佐咪为代表的蛋白酶体抑制剂等新型治疗方法引入临床,这类药物 在对初治和复发/难治MM发挥强效抗肿瘤作用的同时,尚能改变恶性浆细胞和骨髓微环境间的相互反应, 从而影响MM的异常骨代谢,对骨髓瘤骨病发挥有益的治疗作用。本文综述此类新药对MM病人骨重塑的 影响及在骨髓瘤骨病治疗中可能的作用。 =关键词>骨髓瘤;沙利度胺;来那度;蛋白酶体抑制剂 =中图分类号>R733.3=文献标识码>A=文章编号>1672-4992-(2009)02-0376-05 骨髓瘤骨病(m ye l om a bone d i sease,M BD)是骨破坏增加,但没有新骨代偿性形成的结果。约80%的多发性骨髓瘤(MM)病人在病程中并发M BD,表现为骨痛,溶骨性病变,病理性骨折和高钙血症。溶骨性破坏是骨髓瘤病人最为痛苦的表现,严重影响病人的生活质量。即使无病生存数年的病人,其骨髓瘤相关的溶骨性病变亦不会修复,是MM治疗中的主要难题之一。 1M BD的发病机制 M BD是骨髓瘤细胞与破骨细胞和成骨细胞间复杂的相 =收稿日期> 2008-03-26 =作者单位> 南京军区南京总医院血液科,江苏南京210002 =作者简介> 于亚平(1963-),男,湖南岳阳人,博士,主任医师,主要从事内科血液病专业。互作用所致。组织形态学定量研究发现,骨髓瘤细胞促进破骨细胞的骨吸收作用,而抑制成骨细胞活性,从而造成骨吸收和形成间的平衡失调,此为M BD的主要特点[1]。 正常情况下,核因子J B配体受体活化剂(receptor ac t-i va t o r o f nuc lear factor-kappa B li gand,RANKL)和其诱饵受体护骨素(osteoprotegerin,O PG)调节破骨细胞的形成、活性和骨吸收。骨髓瘤细胞通过增加RANKL的表达和降低O PG 的表达而破坏两者间的平衡,RANK L的增加有利于破骨细胞的形成和激活,从而使骨吸收增加。应用OPG或可溶性RANK结构以改变上述平衡能防止B M D的发生[2]。除了RANKL和OPG外,骨髓瘤细胞还能产生巨噬细胞炎症蛋白-1A(m acrophage i nfla mm a t o ry prote i n-1A,M IP-1A)和M IP -1B,两者均能促进破骨细胞的骨吸收。M IP-1A以依赖RANKL的方式发挥作用。其它能增强破骨细胞形成和活性
蛋白酶抑制剂技术原理和选择指南
蛋白酶抑制剂技术原理和选择指南 当细胞破碎的时候,蛋白水解酶就会被释放出来或被激活,使电泳结果复杂化,影响最终结果分析。为了避免这些情况的出现,建议在样品制备时尽可能在低温下进行。此外,许多蛋白酶在PH9以上就失活了,因此Tris碱,碳酸钠或碱性载体两性电解质往往能抑制蛋白水解。但是有些蛋白酶在上述条件下仍然保持着活性,此时应当使用蛋白酶抑制剂。因此对于我们想要研究的蛋白来说,选择性和有效的抑制这些蛋白酶对于蛋白纯化路线设计来说显得尤为重要。 蛋白酶抑制剂与蛋白酶一样,都是纷繁复杂的,通常使用许多化学物质作为蛋白酶抑制剂,如PMSF 和leupeptin。而且由于一种蛋白酶抑制剂只对某一类蛋白酶起作用,因此通常建议复合使用蛋白酶抑制剂,如广谱蛋白酶抑制剂“鸡尾酒”,见下表(来自《蛋白质电泳实验技术》)。 蛋白酶抑制剂有效抑制的酶 PMSF(Pheylmethylsulfonyl fluoride)是很常见的抑制剂,使用 浓度为1mmol/L 不可逆抑制丝氨酸水解酶和一些半胱氨酸水解酶。 AEBSF 丝氨酸抑制剂,使用浓度为 4mmol/L AEBSF的抑制活性与PMSF相近,但它更易溶于水而且 毒性低 EDTA,EGTA,使用浓度为1mmol/L 通过鳌合蛋白酶维持活性所必需的金属离子来抑制金 属蛋白酶。 多肽蛋白酶抑制剂,使用浓度为 2-20ug/ml 亮肽素(Leupeptin)能抑制多种丝氨酸和半胱氨酸蛋白酶;抑肽素(pepstatin)抑制天冬氨酸蛋白酶;抑肽酶(aprotinin)能抑制许多丝氨酸蛋白酶;苯丁抑制剂(bestatin)能抑制氨基酸多肽酶 TLCk,TPCK,使用浓度为 0.1-0.5mmol/L 不可逆的抑制丝氨酸和半胱氨酸的蛋白酶 苄脒(Benzamidine)使用浓度为 1-3mmol/L 抑制丝氨酸蛋白酶 但是这样配置溶液进行处理,有时也是颇为麻烦,而且效果可能并不好,目前有一些厂家试剂在简便操作,和抑制效果方面有不俗的表现,可以考虑在实验中选用,节约时间和便于结果分析。
