AgCl溶度积的测定
卤化银的溶度积大小顺序及原因

卤化银的溶度积大小顺序及原因1. 卤化银的基本认识1.1 首先,什么是卤化银呢?简单来说,就是银和卤素(像氯、溴、碘等)结合形成的化合物。
比如,氯化银(AgCl)、溴化银(AgBr)和碘化银(AgI)。
这些家伙在化学世界里可是非常有名的,尤其是在摄影和化学实验中,简直是个“小明星”。
1.2 你知道吗?这些卤化银的溶度积(Ksp)就像是它们的“名片”,能告诉我们在一定条件下,它们能溶解多少。
溶度积越大,说明在水中能溶解得越多;反之,溶度积小,那就只能默默无闻地待在沉淀里,真是有些可怜。
2. 溶度积的大小顺序2.1 现在我们来看看卤化银的溶度积大小顺序,基本上是:Ksp(AgCl) > Ksp(AgBr) > Ksp(AgI)。
哎呀,听上去好像是个“大小排队”的游戏!简单来说,氯化银的溶度积最大,意味着它在水里最容易溶解。
然后是溴化银,最后才是碘化银。
2.2 这其中的原因就有点意思了。
氯离子的半径比溴离子和碘离子小,所以它们之间的相互作用力也比较强。
想象一下,就像是打羽毛球时,羽毛球轻松飞过去,而一个大气球就得慢慢飘,那感觉截然不同!氯化银的溶解度就像羽毛球那样,轻松多了。
3. 为什么有这种顺序呢?3.1 除了离子半径,另一个重要因素就是晶格能。
晶格能越大,说明离子间的吸引力越强,溶解就越困难。
比如说,碘化银的晶格能比氯化银高,没办法,它就得乖乖待在沉淀里,别想太多。
3.2 总结一下,卤化银的溶度积大小顺序不仅仅是数字游戏,背后还有离子半径和晶格能的故事。
要是你在实验室里,看到这些卤化银的沉淀,就像看到了不一样的“人生选择”,有的活跃,有的则沉默,真是有趣!所以,卤化银的溶度积大小顺序和原因就像是化学世界的小秘密,让我们在探索中不禁莞尔。
学化学也可以轻松幽默嘛!希望这些小知识能让你在学习的路上少些枯燥,多些乐趣!。
物理化学思考题

1.电动势法测定AgCl的溶度积Ksp1.本实验可否使用KCl盐桥?为什么实验中不能使用自来水淋洗盐桥?答:本实验不能使用KCl 盐桥,选用盐桥的首要条件是盐桥不与溶液反应,溶液中含有Ag+,会于Cl-反应沉淀。
实验中不能用自来水淋洗盐桥,制备盐桥的首要条件是盐桥中正,负离子迁移速率相近,自来水中含有Ca2+,Mg2+等离子,用其冲洗盐桥,会使盐桥正,负离子迁移相近的条件受到破坏,从而给本实验的测定带来误差。
2. 为什么不能用伏特计直接测定电池电动势?答:电池电动势的测定必须在电流接近于零的条件下进行,倘若用伏特表直接测定,虽然伏特计的内阻非常大,远远大于电池电阻,但用伏特计测定时其电流远大于零,消耗在电池内阻上的电流是不可忽视的。
即使说实验误差偏大,所得实验值与真实值偏大。
3.使用UJ-25型直流电位差计时,长时间按下按钮接通测量线路,对标准电池电动势的标准性以及待测电池电动势的测量有无影响?答:标准电池是高度可逆电池,其工作条件是通过的电流无限大,长时间按下按钮接通测量线路,在电流非无限的条件,会破坏标准电池的可逆性。
标准电池作为标准,受到破坏后,其电动势就变了,再以EX/EN=Ac′/Ac公式计算时,其EN还用原值,从而待测电动势的测量就不准确。
4.使用UJ-25型直流电位差计时,在测定过程中,若检流计光标总往一个方向偏转,可能是哪些原因引起的?答:(1)电池(包括工作电池、标准电池和待测电池)的正负极接反了;(2)电路中的某处有断路;(3)标准电池或待测电池的电动势大于工作电池的电动势,超出了测量范围2.碳钢在碳酸氢铵溶液中极化曲线的测定1.阳极极化曲线对实施阳极保护有什么指导意义?答:分析研究极化曲线,是解释金属腐蚀的基本规律、揭示金属腐蚀机理和探讨控制腐蚀途径的基本方法之一。
2.恒电流法和恒电位法俩种方法所测绘出的极化曲线有何异同?答:恒电流法是恒定电流测定相应的电极电位,恒电位法是恒电位测定相应的电流。
关于溶度积的计算
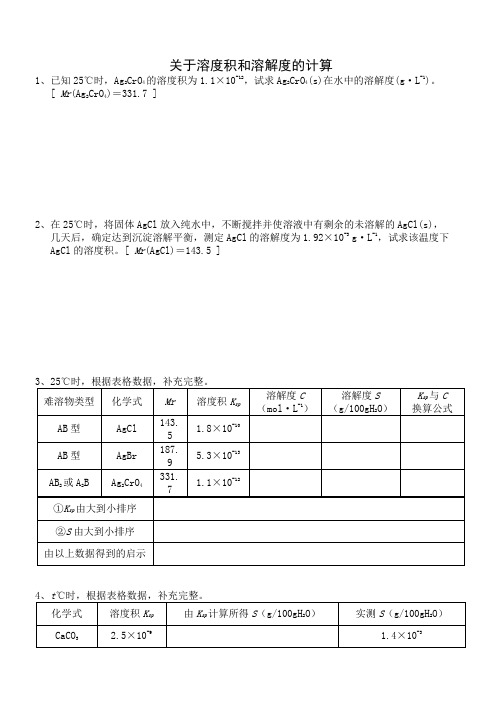
关于溶度积和溶解度的计算1、已知25℃时,Ag2CrO4的溶度积为1.1×10-12,试求Ag2CrO4(s)在水中的溶解度(g·L-1)。
[ Mr(Ag2CrO4)=331.7 ]2、在25℃时,将固体AgCl放入纯水中,不断搅拌并使溶液中有剩余的未溶解的AgCl(s),几天后,确定达到沉淀溶解平衡,测定AgCl的溶解度为1.92×10-3g·L-1,试求该温度下AgCl的溶度积。
[ Mr(AgCl)=143.5 ]34开始形成CaSO4沉淀?通过计算说明,当c(SO42-)为多少时,CaCO3可以完全转化为CaSO4沉淀?可能吗?(不考虑水解)[ K sp(CaCO3)=2.5×10-9,K sp(CaSO4)=9×10-6 ]6、已知t℃时,K sp (AgCl) =1.8×10-10,K sp (AgBr) =4.9×10-13。
在该温度下:(1)饱和AgBr溶液中,c(Br-)=。
向该饱和AgBr溶液中加入NaCl(s),当c(Cl-)达到多少时可以开始形成AgCl沉淀?。
(2)AgCl(s)若要在NaBr溶液中开始转化为AgBr沉淀,则c(Br-)不应低于。
(3)0.1 mol AgBr(s) 若要在1 L NaCl溶液中转化为AgCl(s),则c(Cl-)应大于;若要将此0.1 mol AgBr(s) 完全转化AgCl(s),则原NaCl溶液中c(Cl-)应大于,据此,你认为该0.1 mol AgBr(s) 能完全转化为AgCl(s) 吗?。
[饱和NaCl溶液中c(Cl-)约为5mol/L ](4)0.1 mol AgCl(s) 若要在1 L NaBr溶液中完全转化为AgBr(s),则原溶液中c(Br-)应大于。
7、25℃时,部分氢氧化物的溶度积如下表,按要求完成表格。
保留一位有效数字(pH数值到0.1)(请将计算过程写在对应空格内)参考答案:1、2.2×10-2g·L-12、1.80×10-103、4、5、c(SO42-)>0.14mol/L时开始形成沉淀;c(SO42-)>3600mol/L时转化完全,溶解度不可能达到。
氯化铅溶度积常数的测定实验报告

氯化铅溶度积常数的测定实验报告一、实验目的1、掌握用沉淀重量法测定氯化铅溶度积常数的原理和方法。
2、学习重量分析的基本操作,包括沉淀的生成、过滤、洗涤、干燥和称重。
3、进一步练习分析天平的使用。
二、实验原理氯化铅(PbCl₂)在水溶液中存在溶解平衡:PbCl₂(s) ⇌ Pb²⁺(aq) + 2Cl⁻(aq)其溶度积常数表达式为:Ksp = Pb²⁺Cl⁻²在一定温度下,通过测定饱和氯化铅溶液中铅离子和氯离子的浓度,即可计算出氯化铅的溶度积常数。
本实验采用重量法测定。
向已知体积的饱和氯化铅溶液中加入过量的硝酸银(AgNO₃)溶液,使氯离子完全沉淀为氯化银(AgCl):Cl⁻+ Ag⁺ → AgCl↓将沉淀过滤、洗涤、干燥后称重,根据氯化银的质量计算出氯离子的浓度,进而计算出饱和氯化铅溶液中铅离子的浓度,最终求得氯化铅的溶度积常数。
三、实验仪器和试剂1、仪器分析天平、漏斗、滤纸、玻璃棒、烧杯、移液管(25 mL、50 mL)、容量瓶(250 mL)、恒温槽。
2、试剂氯化铅固体、硝酸银溶液(01000 mol/L)、硝酸溶液(1 mol/L)。
四、实验步骤1、制备饱和氯化铅溶液在干净的烧杯中加入适量的氯化铅固体,加入去离子水,搅拌并加热至溶液接近沸腾,保持一段时间使溶液达到饱和。
冷却至室温后,将上层清液用玻璃砂芯漏斗过滤至干燥的容量瓶中备用。
2、沉淀的生成与陈化用 25 mL 移液管准确移取 2500 mL 饱和氯化铅溶液至 250 mL 烧杯中,加入 50 mL 去离子水,搅拌均匀。
然后,边搅拌边逐滴加入 5000 mL 01000 mol/L 的硝酸银溶液,生成氯化银沉淀。
继续搅拌 5 分钟,使沉淀反应充分进行,然后将溶液静置陈化 30 分钟。
3、沉淀的过滤与洗涤用倾斜法将沉淀上层清液通过预先处理好的滤纸过滤至另一个干净的烧杯中。
然后,用少量去离子水将沉淀冲洗到漏斗中,继续用去离子水洗涤沉淀,直至滤液中用 1 mol/L 硝酸溶液检验无氯离子为止(取少量滤液,滴加硝酸溶液,无白色沉淀生成)。
实验十四氯化银溶度积的测定--电位法

实验目的: 一.实验目的 实验目的 1.电位法测定难溶电解质的溶度积的原 理; 2.酸度计(电位仪)的使用。
实验原理
(-)Ag,AgX|X-(C)||KCl(饱和)|HgCl2,Hg(+)
AgX/Ag = θ AgX /Ag-
1.数据记录
2.数据处理 用E对lgCCl-作图,从直线在纵坐标上的截距求出Kθsp 。
θ
实验仪器与试剂
仪器:酸度计、饱和干汞电极、银电极、 电子天平、移液管(50.00mL)、移液管 ( 1 . 0 0 mL)、 烧 杯 ( 1 0 0 mL)、 容 量 瓶 (50mL)。 药品:KCl(分析纯)、KBr(分析纯)、KI(分 析纯)、AgNO3(0.1molL-1)、HNO3(6molL-1)
+
RT ln C X /Cθ nF
T = 298.15K时,
AgX/Ag = θ AgX /Ag- 0.0592 lg C Xห้องสมุดไป่ตู้/Cθ
+ -
AgX/Ag =
θ
AgX /Ag
+
- 0.0592 lgK sp , AgX
+
θ
又因为,E = 甘汞- AgX/Ag 截距 = 甘汞-
θ
AgX /Ag
实验步骤
1.溶液的配制 用50mL容量瓶配制0.2000molL-1的KCl(或KBr,或 KI)溶液。 2.电极的活化 将银电极插入6molL-1HNO3溶液中,当银电极表面 有气泡产生且呈银色时,将银电极取出,先用自来水 冲洗,再用蒸馏水洗净,滤纸吸干备用。 3.原电池电动势的测定 (1)将银电极和饱和干汞电极安装在电极架上,银电极 接负极,甘汞电极接正极。 (2)在100mL干燥烧杯中,准确加入50.00mL蒸馏水, 再用吸量管移入1.00mL0.2000molL-1的KCl(或KBr, 或KI)溶液,滴入1滴0.1molL-1AgNO3 溶液,摇均后, 将电极放入该溶液中,测定其电位差E1,并记录于下 表中。
盐分检测三种方法原理分析及检测要点

10 1 . 8 10 6 1 [Cl ] 3 . 6 10 mol L [ Ag ] 5.0 105
K SP ( AgCl )
pCl=5.44
12
突跃范围的大小与溶液 中卤化物的 原始浓度 及 沉淀物的 溶解度有关。
浓度越大,溶解度越小, 则突跃范围越 大
2、滴定开始至化学计量点前 假设加入19.98mL AgNO3,此时
20.00 19.98 [Cl ] 0.1000 5.0 10 5 mol L1 20.00 19.98
pCl=4.30
10
3、化学计量点
[Cl-]=[Ag+]
[Ag+][Cl-]=KSP(AgCl)=1.8×10-10
(CO32-、SO32-、S2-、C2O42-)不干扰测定。
但强氧化剂、铜盐、汞盐都能与SCN-作用,对测定 有干扰,应预先除去。
25
法扬司法Fajans ——吸附指示剂
一、基本原理
常用的吸附指示剂大多是有机弱酸,它的阴离子易被吸附 在沉淀表面,导致其结构发生改变而引起颜色变化。
用AgNO3标准溶液滴定Cl-时,用荧光黄(HFL)作吸附指示剂
[ Ag ] [Cl ] K SP ( AgCl ) 1.8 10
pCl=4.89
10
1.3 10 mol L
5
1
11
4、化学计量点后 加入AgNO3 20.02mL,此时
20.02 20.00 [ Ag ] 0.1000 5.0 10 5 mol L1 20.00 20.02
NH4SCN: 以AgNO3标液, Volhard 法标定.
32
AgCl溶度积的测定

AgCl溶度积的测定—目1/ 学会用电池电动势法测宦氯化银的溶度积。
2、加深对液接电势概念的理解及学会消除液接电势的方法。
二、实验原理电池电动势法是测立难溶盐溶度积的常用方法之一。
测定氯化银的溶度积,可以设il•下列电池:Ag(s), AgCl(s) | KCl(al) II AgNO3(a2) | AgCl(s),Ag(s)Ag-AgCl电极的电极电动势可用下式表示(18-1)由于AgCl的溶度积Ksp为Ksp=aAg+ ・ aCl- (18-2)将(19・2)式代入(19・1)式得(18-3)电池的电动势为电极电势之差。
整理后得lg Ksp= -EE2303RT+ lg aAg+ uCl・(18-4)若已知银离子和氯离子的活度,测左了电池的电动势值就能求出氯化银的溶度积。
三、仪器和试剂电势差计及附件1套;超级恒温水浴1套:粗试管2支:烧杯(50ml ) 2只:Ag-AgCl电极2只:饱和氯化钾盐桥2支:KC1(饱和):AgNO3(本实验所用试剂均为分析纯,溶液用重蒸水配制。
四、操作步骤1、电极的制备(好像不用)制备Ag-AgCl电极,将表而经过淸洁处理的钳幺幺电极作为阴极,把经过金相砂纸打磨光洁的银丝电极作为阳极,在镀银溶液中镀银匚电流控制在5mA左右,40分钟后在钳丝上镀上紧密的银层•制好的银电极用蒸懈水仔细冲洗。
然后用它作阳极,另用一钳线作阴极,用0.1mol/L的HC1溶液电解,电流同前。
通电20分钟,在银层上形成Ag-AgCl镀层(紫褐色九制成的电极不用时放在含AgCl沉淀的HC1中,暗处保存。
镀银液配方:分别将AgNO3(35・45g)、KS2O5(3545g)、NaS203(200-250g)溶于300mL 蒸憾水中,然后,混和前2种溶液,并不断搅拌,生成白色的焦亚硫酸银沉淀,再加入NaS2O3, 不断搅拌,直到沉淀消失,加水到lOOOmJ新配制的镀银溶液略呈黄色,或略混浊或沉淀,放置数日后,经过滤可得非常澄淸的镀银液。
氯化银溶度积常数的测定

氯化银溶度积常数的测定一、实验目的1.了解难溶电解质溶度积常数的测定方法及原理;2.学会电导率仪的使用;3.掌握电导法测定难溶电解质的溶度积常数。
二、实验原理氯化银是难溶电解质,其饱和溶液中存在沉淀–溶解平衡:AgCl Ag+ + Cl–若难溶电解质AgCl在纯水中的溶解度为c(AgCl),则其溶度积常数可表示为:K sp(AgCl) = [Ag+]·[Cl–] = [c(AgCl)]2不难看出,只需测出[Ag+]、[Cl–]、c(AgCl) 中的任何一个,即可求出AgCl的溶度积常数K sp(AgCl)。
由于AgCl的溶解度很小,其饱和溶液可看作无限稀释的溶液,离子间的影响可忽略不计。
这时,溶液的摩尔电导率Λm为极限摩尔电导率Λm∞,而极限摩尔电导率可通过查资料得知(表1为25℃时无限稀释溶液中离子的极限摩尔电导率)。
表1 无限稀释溶液中离子的极限摩尔电导率(25℃)由于摩尔电导率Λm与电导率k及溶液浓度c之间存在关系式:Λm= k/c,这样通过测AgCl饱和溶液的电导率求得c(AgCl),进而可计算出K sp(AgCl)。
需要注意的是:实验测得的AgCl饱和溶液的电导率包括水的电导率,计算时应扣除。
三、实验仪器及试剂烧杯、量筒、电导率仪、恒温水浴锅0.1 mol⋅L–1 AgNO3溶液、0.1 mol⋅L–1HCl溶液四、实验内容1.AgCl饱和溶液的制备0.1 mol⋅L–1 AgNO3溶液、0.1 mol⋅L–1 HCl溶液各取10 mL,在不断搅拌的情况下,将AgNO3溶液慢慢滴加到HCl溶液中,然后将盛有沉淀的烧杯置于沸水浴中加热,搅拌10 min,静置冷却20 min,去掉上清液,用近沸的蒸馏水洗涤沉淀至少5次,最后向沉淀中加40 mL蒸馏水,煮沸3~5 min,并不断搅拌,冷却至室温。
2.AgCl溶度积常数K sp(AgCl) 的测定1)用电导率仪测定蒸馏水的电导率。
2)用电导率仪测定制得的AgCl饱和溶液的电导率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
AgCl溶度积的测定
一、实验目的
1、学会用电池电动势法测定氯化银的溶度积。
2、加深对液接电势概念的理解及学会消除液接电势的方法。
二、实验原理
电池电动势法是测定难溶盐溶度积的常用方法之一。
测定氯化银的溶度积,可以设计下列电池:
Ag(s), AgCl(s)┃KCl(a1)‖AgNO3(a2)┃AgCl(s),Ag(s)
Ag-AgCl电极的电极电动势可用下式表示 (18-1)
由于AgCl的溶度积Ksp为
Ksp=aAg+ ·aCl- (18-2)
将(19-2)式代入(19-1)式得(18-3)
电池的电动势为电极电势之差。
整理后得lg Ksp= -EF/2.303RT+ lg aAg+ •aCl- (18-4)
若已知银离子和氯离子的活度,测定了电池的电动势值就能求出氯化银的溶度积。
三、仪器和试剂
电势差计及附件1套;
超级恒温水浴1套;
粗试管 2支;
烧杯(50ml) 2 只;
Ag-AgCl电极2只;
饱和氯化钾盐桥2支;
KCl(饱和) ;
AgNO3(0.1000mol.L-1)。
本实验所用试剂均为分析纯,溶液用重蒸水配制。
四、操作步骤
1、电极的制备
(好像不用)
制备Ag-AgCl电极,将表面经过清洁处理的铂丝电极作为阴极,把经过金相砂纸打磨光洁的银丝电极作为阳极,在镀银溶液中镀银。
电流控制在5mA左右,40分钟后在铂丝上镀上紧密的银层。
制好的银电极用蒸馏水仔细冲洗。
然后用它作阳极,另用一铂丝作阴极,用0.1mol/L的HCl溶液电解,电流同前。
通电20分钟,在银层上形成Ag-AgCl镀层(紫褐色)。
制成的电极不用时放在含AgCl沉淀的HCl中,暗处保存。
镀银液配方:分别将AgNO3(35-45g)、KS2O5(35-45g)、NaS2O3(200-250g)溶于300mL蒸馏水中,然后,混和前2种溶液,并不断搅拌,生成白色的焦亚硫酸银沉淀,再加入NaS2O3,不断搅拌,直到沉淀消失,加水到1000mL。
新配制的镀银溶液略呈黄色,或略混浊或沉淀,放置数日后,经过滤可得非常澄清的镀银液。
制得的Ag-AgCl电极电势之差不得大于5×10-4V。
2、电池的组合
将Ag-AgCl电极按图18-1所示,组合成下列电池:
Ag(s), AgCl(s)┃KCl(a1)‖AgNO3(a2)┃AgCl(s),Ag(s)
3、池电电动势的测量
用UJ-25型电势差计测量25。
C时电池电动势值。
电池电动势的测定可将电池置于25。
C 的超级恒温槽中进行。
测定时,电池电动势值开始时可能不稳定,每隔一定时间测定一次,到测定得稳定值为止。
五、数据记录和处理
1、记录上述电池的电动势值。
2、已知25。
C时0.1000mol/kg硝酸银溶液中银离子的平均活度系数为0.731, 0.1000mol/kg 氯化银溶液中氯离子的平均活度系数为0.769,并将测得的电池电动势代入(19-4)式,求出氯化银的溶度积。
3、将本实验测得的氯化银的溶度积与文献值比较
六、实验注意事项
1.实验用水应为重蒸馏水,以免水中的Cl-的影响。
2.实验应在恒温条件下进行测量。
七、思考讨论题
1、试分析有哪些因素影响实验结果?
2、简述消除液接电势的方法
八、进一步的建议
为消除液接是电势和避免平均活度系数代替银离子和氯离子活度系数计算所引起的误差,可以设计下列电池:
Ag(s),AgCl(s) KCl(x) KNO3(m) Ag NO3(m) AgCl(s),Ag(s)
KNO3(m-x) KNO3(m-x)
溶液1 溶液2 溶液3
在上面电池中。
必须使三种溶液中的盐的总浓度等于m。
推导得下式:
E-2klgx=-klgKsp+klgγAg+γCl-+Ej (18-5)
式中:E是电池的电动势;K=2.303RT/F=59.58V;Ksp是AgCl的溶度积;γAg+、γCl-分别是Ag+、Cl-的活度系数;Ej是溶液1与溶液2的液接电势加上溶液2 与溶液3 之间的液接电势之和。
保持m一定,配制四个不同x浓度的KCl、Ag NO3溶液。
分别测得其电池的电动势值。
当x接近0时,由于溶液1、2、3的组成几乎一致,液接电位接近于0,即Ej 接近于0。
所以(19-5)式可写成:
E-2lgx=-klgKsp+klgγAg+γCl-
以E-2lgx对X作图,外推到X=0时的值,表示体系的离子强度等于m时的-klgKsp+klgγAg+γCl-。
变化m,按同样方法,求得不同m时的-klgKsp+klgγAg+γCl-的值。
以-klgKsp+klgγAg+γCl-对m作图,外推到m=0时,得到-klgKsp的值,从而求得离子强度等于0时的浓度积。
