流式细胞仪检测细胞周期操作步骤
流式细胞仪检测细胞周期

流式细胞仪细胞周期测定步骤
1)将细胞以1×106接种于60mm培养板,80%汇合后转染。
2)24小时后在新鲜培养液中加入适当的抗生素(真核表达载体上的抗性标记)进行培养(该步可选)。
3)48-72小时后用胰酶消化收集细胞,PBS洗两遍,弃上清,加入1ml 70%预冷乙醇中,吹打均匀,4℃固定12小时以上。
4)PBS洗涤去乙醇,1000rpm, 5min,洗两遍。
5)0.5mlPBS重悬细胞,加入PI和 RNaseA至终浓度50µg/ml,37℃ 温浴30 min。
6)用流式细胞仪测定周期。
PI:碘化丙啶,以PBS配成1mg/ml,4℃保存。
RNaseA:10mg/ml
应用:通过流式细胞仪分析各时期的细胞百分数,可检测细胞的增殖、凋亡。
流式细胞仪细胞周期测定经验:1.在测定细胞周期的时候(以BD公司的Calibur为例),除了设置好获取数据的模版外,另外设置以FL3为横坐标的直方图,测量模式为对数(log),调整放大倍数,使二倍体峰出现在横坐标10*3的位置,就很容易的找到了二倍体峰和细胞周期个时相细胞的分布情况。
根据它再调节FL2(线性模式下)的放大倍数,使二倍体峰在10*2的位置即可。
流式细胞术检测细胞周期的技术流程

流式细胞术检测细胞周期的技术流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!流式细胞术检测细胞周期的技术流程详解流式细胞术是一种强大的生物学分析技术,广泛应用于细胞周期的研究。
细胞周期的流式检测方式技巧
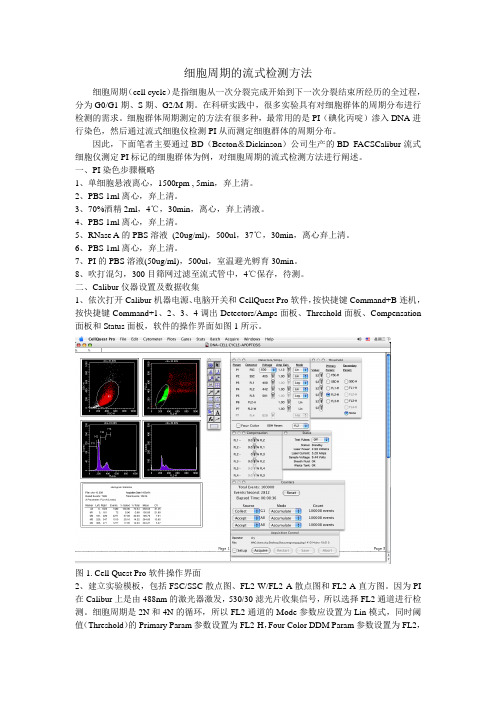
细胞周期的流式检测方法细胞周期(cell cycle)是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,分为G0/G1期、S期、G2/M期。
在科研实践中,很多实验具有对细胞群体的周期分布进行检测的需求。
细胞群体周期测定的方法有很多种,最常用的是PI(碘化丙啶)渗入DNA进行染色,然后通过流式细胞仪检测PI从而测定细胞群体的周期分布。
因此,下面笔者主要通过BD(Becton&Dickinson)公司生产的BD FACSCalibur流式细胞仪测定PI标记的细胞群体为例,对细胞周期的流式检测方法进行阐述。
一、PI染色步骤概略1、单细胞悬液离心,1500rpm , 5min,弃上清。
2、PBS 1ml离心,弃上清。
3、70%酒精2ml,4℃,30min,离心,弃上清液。
4、PBS 1ml离心,弃上清。
5、RNase A的PBS溶液(20ug/ml),500ul,37℃,30min,离心弃上清。
6、PBS 1ml离心,弃上清。
7、PI的PBS溶液(50ug/ml),500ul,室温避光孵育30min。
8、吹打混匀,300目筛网过滤至流式管中,4℃保存,待测。
二、Calibur仪器设置及数据收集1、依次打开Calibur机器电源、电脑开关和CellQuest Pro软件,按快捷键Command+B连机,按快捷键Command+1、2、3、4调出Detectors/Amps面板、Threshold面板、Compensation 面板和Status面板,软件的操作界面如图1所示。
图1. Cell Quest Pro软件操作界面2、建立实验模板,包括FSC/SSC散点图、FL2-W/FL2-A散点图和FL2-A直方图。
因为PI 在Calibur上是由488nm的激光器激发,530/30滤光片收集信号,所以选择FL2通道进行检测。
细胞周期是2N和4N的循环,所以FL2通道的Mode参数应设置为Lin模式,同时阈值(Threshold)的Primary Param参数设置为FL2-H,Four Color DDM Param参数设置为FL2,如图2、图3所示。
流式分析细胞周期

流式分析细胞周期
最近在做加药物的细胞周期,做了好几次,出现如下图的流式拟合图,师姐们都说你这样的拟合是强行的拟合,s期不明显,需要重新做,可是做了好多次还是这样的结果。
望专家教教我是哪里出错。
做细胞周期的步骤是:
1. 先铺板,2E5/孔。
过夜培养后加药(24h)
2. 再经过24h后可以进行测量。
3. 收集上清,并用PBS洗涤,再用胰酶消化,接着用PBS再洗一遍(在15ml管子中进行)
4. 1500转离心,小心去除上清,加入1ml的预冷PBS(记得要冲洗一下管壁),混匀后吸到1.5ml管中,再次在大厅中的离心机1500转4-5min(经过这样的一遍洗涤即可)
固定
5. 用枪吸走上清,剩余50ul左右,切勿吸走细胞,随后➕300ul 预冷PBS(用左手拿着EP管小拇指抵住涡旋震荡仪,右手拿住吸有700ul的乙醇的枪)缓慢打入其中,(这个过程尽量要慢)
6. 置于-20°冰箱中20min(有的说1h),若是过夜要要置于4°(有的说4h以上)
7. 1500转离心3-5min,小心吸上清
8. 加入1ml预冷PBS,重悬
9. 1500转离心3-5min,吸取上清,轻弹
染色
10. 0.5ml/管的碘化丙锭染色液(PI)缓慢加入,并充分的混匀
11. 37°避光30min
先配好染色的溶液
12. 4°避光存放2h
13. 上流式仪。
BD-FACSCalibur 流式细胞仪-细胞周期-操作步骤

BD/FACSCalibur流式细胞仪检测细胞周期操作步骤1、先给鞘液桶接超纯水。
2、把鞘液桶装上,拧紧。
3、开左边开关,从右向左依次打开,即总电源插头-交流稳定电压-插板-稳定输出电源。
(关机时从左向右关)。
4、按流式细胞仪开关。
换上新的已装超纯水的流式管。
5、将减压阀调至“run”(水缸旁边的黑色按钮)。
6、排气:将白色的手动排气阀从小头向大头移动,排气,2-3次,至无气泡。
最后停至小头。
自动排气:开始时是“低速”“standby”,调至“低速”“prime”,待排气完成会自动跳到“standby”,如此循环,到流式管内无气泡为止。
7、插电脑白色插头,打开电脑。
8、到无气泡时候调到“hign”“run”。
9、输入开机密码,打开电脑桌面上的“CELLQuest”(第四个图标)启动软件。
File→open Document→date→先找到打开自己之前的文件(cell dw 2018LSD)→Acquire→Connect to Cytometer→Acquisition面板中点击“change”修改文件名和日期,count改成1,即从第一个开始。
10、Acquire→counters→点击下面Acquisition control面板中的Acquire,看是否正常。
11、上样。
使仪器处于low run状态,样品管支架左移,上样品管后支架回位。
确认Acquisition control 窗口中Setup前需打勾(即不收集数据,用于仪器设置),点击Acquire。
仪器设置完成后,取消Setup前的“√”,点击Acquire 正式开始收集数据。
调界面操作:Cytometer → Detectors/Amps出现 Detectors/Amps 界面后,调FSC和SSC和FL2和FL2-W。
FSC调节的是门内(R1)细胞位置的左右,FSC的“Voltage”调到“E-1”,“E-1”是指个体很大细胞;“Amo Gain”的值调节门内(R1)细胞位置的宽度。
流式检测细胞周期和凋亡实验步骤

流式细胞技术检测细胞周期分布1) 已转染miRNA mimics的细胞培养达到85%融合时,用胰酶消化细胞。
1000 rpm,离心5min,收集细胞沉淀;2) 已消毒的PBS重悬细胞,1000 rpm/min,离心5 min,收集细胞。
重复此步骤2次,以除去胰酶;3) 加入预冷的70%乙醇固定细胞过夜;4) 第二天1000rpm,离心5 min,收集细胞沉淀,PBS重悬两次,以除去乙醇;5) 离心后加入500ul PBS重悬细胞,加入碘化丙锭(PI)染色液(含50mg/L PI,1g/L Triton X-100,100g/L RNase)混匀,4℃避光孵育30min。
6)流式细胞仪FACStar (美国BD公司) 检测。
接收的信号经Cellquest软件处理,对检测细胞的荧光强度进行分析。
实验重复3次。
2.11流式细胞技术检测细胞凋亡水平1) 已转染BART6-3p mimics的细胞培养达到85%融合时,将上清培养液收集至离心管内;常常2)PBS清洗贴壁细胞3次,用胰酶消化细胞(注意:消化时不可过度),收集于第一步的离心管内;3) 1000 rpm离心5min,弃上清收集细胞,PBS轻轻重悬后,加入195 ulAnnexin V-FITC结合液,吹打混匀,重悬细胞,加入5ul Annexin V,轻轻混匀。
避光室温孵育15min;4) 加入10 ul PI染色液,轻轻混匀,避光孵育;空白:Annexin V—FITC结合液200ul双染:185ul结合液+5 ulAnnexin V—FITC+10ul PI单染:195ul结合液+5ul Annexin V—FITC190ul结合液+10PI5) 进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。
整理)流式细胞检测细胞周期

流式细胞检测细胞周期一、所需试剂1、细胞周期检测试剂盒(1)PI:Propidium Iodide,碘化丙啶,是一种可对DNA染色的细胞核染色试剂,它是一种溴化乙啶的类似物,在嵌入双链DNA后释放红色荧光,如果自己买,那就10mg用200mlPBS 溶解,4℃避光保存(0.05mg/ml)(2)RNAase:PI既能与DNA结合,又能与RNA结合,所以要用RNase降解,如果自己买,那就100mg用20mlPBS溶解,200μl分装-20℃避光保存(5mg/ml)2、预冷70%-75%酒精:可用无水乙醇和纯水配制3、预冷PBS4、流式管:可以去医研中心拿二、实验步骤<一>、细胞处理1、种板处理等同功能实验(保证细胞有2-5×10*5个)2、消化细胞,离心(1000r/300g 5min)收集细胞沉淀。
3、用预冷的PBS清洗细胞1-2次。
4、离心(1000r/300g 5min)收集细胞沉淀5、固定细胞:用0.2ml预冷的PBS重悬细胞沉淀,使细胞充分悬浮成单细胞,再将重悬细胞加入2ml预冷70-75%酒精,震荡,4℃固定过夜。
(直接向细胞加入酒精容易使细胞成团,震荡不要过猛,容易使细胞破碎)<二>、细胞染色和检测1、离心(1000r/300g 5min)收集固定的细胞2、2mL的预冷PBS洗细胞一次,离心再次获取细胞沉淀3、染色:加入50μlRNA酶和250μl-450μl PI染色剂(用量根据试剂盒说明书),避光染色5-10min(一般加300μl,保证适当细胞浓度,浓度太高检测速度太快,结果不准;浓度太低检测速度太慢,时间太长)4、上机检测三、注意事项1、流式细胞仪原理看ppt非荧光信号(1)前向角散射光(FSC Forward scatter)细胞相对大小及其表面积(2)侧向角散射光(SSC side scatter)细胞颗粒度及细胞内细胞器的相对复杂性2、PI(碘化丙啶)不能通过活细胞膜,但却能穿过破损的细胞膜而对核染色。
流式检测细胞周期实验步骤

以标准程序用流式细胞仪检测,一般计数2~3万个细胞,结果用细胞周期拟和软件ModFit分析。
2. 细胞固定:
800rpm离心5min,收集细胞沉淀,弃上清,用预冷PBS洗涤两次,加入预冷75%乙醇,于4℃固定4h以上。
3. 细胞染色:
1500rpm离心5min,弃上清,以3mL的PBS洗涤一次,加入400uL的CCAA溶液(PI染液,engreen),100ul RNase A(100ug/mL ),4℃避光孵育30min。
取对数生长期的细胞按1106cellsml以1ml接种24孔板或2ml接种于6孔板内进行所需的处理比如加入药物特定时间后终止培养进行下一步的实验
流式检测细胞周期实验步骤
1. 细胞培养:
取对数生长期的细胞,按1×106cells/ mL以1mL接种24孔板或2mL接种于6孔板内,进行所需的处理(比如加入药物),特定时间后终止培养,进行下一步的实验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
流式细胞仪检测细胞周期操作步骤
取对数生长期的A549细胞,按1×106 cells/ mL以1mL接种于100mm培养皿内
↓
24h后,进行所需的处理(比如加药,照射)
↓
特定时间后终止培养,进行下一步的实验
↓
收集原培养液,洗后的PBS和消化后的细胞,将三者混匀放入15ml
离心管中
↓
1000rpm离心5min(短时低速离心)
↓
弃上清,用1.5ml预冷PBS,1000rpm离心5min后去除PBS和细胞
悬液内的细胞碎片
↓
加入1.5ml预冷PBS,在涡旋状态下加入3.5ml无水乙醇,混匀后,于4℃固定30min,或-20℃长期保存。
↓
1000r/min,离心5min
↓
将乙醇吸除,加PBS清洗混匀
↓
1000r/min,5min再离心一遍,将残留在细胞上的乙醇除去
↓
吸除离心管内PBS,加入200ul PBS和2ul的RNA酶(0.25mg/ml)(37℃下孵育30min)
↓
加入0.5ml的50ug/ml的PI溶液室温下避光染色30min
↓
将离心管内的细胞过滤(300um尼龙网膜)至含有PBS的EP管中(PI 具有很强的粘附性,容易使细胞聚团),标记EP管
↓
提前一天网上预约
↓
开机(先开仪器后开软件)
↓
流式细胞仪的结构一般分为5部分:①流动室及液流驱动系统;②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。
↓
检测前先涡旋使细胞混匀悬浮呈单个细胞,然后插入流式细胞仪上
↓
流动室内充满鞘液,细胞排成单列由喷嘴中心喷出,形成细胞液柱
↓
液柱与激光束相交,细胞上的荧光染料被激发产生荧光(488nm激
发光源)
↓
荧光信号变成电信号输出到计算机,软件分析(荧光染料和细胞DNA分子特异性结合,可以检测出细胞周期各时相细胞比例)
↓
在用第三方软件分析之前,将流式结果按如下所示导出
结果分析——Modfit软件分析
——Flowjo
软件分析
图片拷贝:直接Ctrl+C
FCM-DNA 量分析 1 个细胞增殖群时,可将DNA 含量分布组方图分为三部分,即 G0/1、S、G2M。
G0/1和G2M 细胞峰的 DNA 分布均为
正态分布,S 期可以认为是一个加宽的正态分布
↓
检测结果刻录光盘保存
↓
关机(先关软件后关仪器,关机前需清洗)
正常细胞DNA含量:2n-4n
凋亡细胞:核内DNA断裂,乙醇固定后膜通透性增加,小片段DNA 穿膜丢失,胞内DNA含量减少。
PI染色后,荧光强度减小而形成一个DNA含量小于2n的分布区(亚G1峰)。
1、纵坐标Cell Number:即计数的有效细胞数;
2、横坐标DNA Content:即DNA含量;
3、G1、G2、S三期在图中已经标示;
4、右侧数字含义:Dip G1-53.84% at 55.56,即G1期DNA含量平均值为55.56;53.84%即G1期细胞数占总数的53.84%;Dip G2-5.64% at 107.72,即G2期DNA含量平均值为107.72,5.64%即G2期细胞数占总数的5.64%;
Annexin V-EGFP/PI双染法检测细胞凋亡
基本原理:
磷脂酰丝氨酸(PS)能与连接素Ⅴ(AnnexinⅤ)发生特异结合;PI是核酸荧光染料,不能透过正常细胞膜,只能进入已经破损的细胞膜,在嵌入双链DNA后释放红色荧光,荧光强度与PI结合量呈良好的线性关系。
正常细胞:膜完整,PS不外翻——PI-/AnnexinⅤ-
凋亡早期:膜完整,PS翻转——PI-/AnnexinⅤ+
凋亡晚期:PS外翻,膜通透性增加——PI+/AnnexinⅤ+
坏死细胞:膜严重破损,PS不外翻——PI+/AnnexinⅤ+ 几乎不存在膜结构——PI+/AnnexinⅤ-
实验步骤:
取对数生长期的细胞,按1×106 cells/ mL以1mL接种于培养皿内
↓
24h后,进行所需的处理(比如加入药物)
↓
特定时间后终止培养,进行下一步的实验
↓
细胞用0.25%胰酶37℃消化5min(胰酶消化时间不易过长,以防引起假阳性)
↓
加入PBS制成细胞悬液(移液枪吹打6-8次)
↓
倒置显微镜下观察细胞状态(单个分离悬浮)
↓
将细胞悬液移入15ml离心管中
↓
2000rpm离心5min,PBS吸除
↓
用PBS 清洗细胞2次(2000rpm,离心5min收集细胞)
↓
用400ul 1×Binding Buffer 悬浮细胞(浓度大约为1×106
cells/ml)
↓
在细胞悬液中加入5ul Annexin V-EGFP,轻轻混匀后于2-8℃避光
条件下孵育15 min
↓
加入10ul PI 后轻轻混匀,于2-8℃避光条件下孵育5 min
↓
.
在1 h内用流式细胞仪检测
流式细胞仪激发光波长采用Ex.= 488nm双波长激发,Em.= 510 nm检测EGFP荧光(FL1 channel)和>575 nm的发射波长检测PI。
细胞应可分成三个亚群:活细胞仅有很低的荧光强度,凋亡细胞有较强的绿色荧光,坏死细胞(包括极晚期凋亡细胞)有绿色和红色荧光双重染色。
在流式细胞术双参数散点图上左下象限显示活细胞,为
(Annexin V-/PI-);右上象限是非活细胞,即坏死细胞,
为Annexin V +/PI+;而右下象限为凋亡细胞,显现
Annexin V +/PI-。
11 / 11'.。
