流式细胞仪试验方法
流式细胞检测步骤

流式细胞检测步骤
流式细胞检测是一种常用的细胞分析方法,其步骤主要包括样品制备、细胞染色、细胞分析和数据分析等。
下面是流式细胞检测的一般步骤:
1. 样品制备:对待检测的细胞进行处理,如细胞培养、组织切片、外周血单个核细胞的分离等,得到单细胞悬浮液或细胞悬浊液。
2. 细胞染色:选择相应的细胞染色方法,如细胞膜荧光染色、核酸染色、细胞器标记等,以准确检测感兴趣的细胞亚群或分子表达。
3. 流式细胞仪设置:根据具体实验需求,设置流式细胞仪的参数,如激光波长、光源强度、挡光镜、滤光片等。
4. 样品注射:将细胞悬浮液或细胞悬浊液注入流式细胞仪,以逐个细胞通过检测通道。
5. 细胞分析:流式细胞仪以高速流体力学原理将细胞单个通过探测器,并同时记录细胞的光学参数,如细胞大小、形状、颜色等,以及某些特定标记的荧光信号。
6. 数据分析:根据实验需求,利用流式细胞仪软件或数据分析软件对收集的数据进行处理和分析,如细胞计数、亚群比例、荧光强度等。
7. 结果解读:根据数据分析的结果,进行相应的统计分析、结果解读和图形展示,得出实验结论。
需要注意的是,不同的实验目的和细胞类型可能需要略有差异的具体实验步骤和参数设置。
最详细的流式细胞仪实验方法

最详细的流式细胞仪实验方法流式细胞仪(Flow cytometry)是一种高精度的细胞分析技术,可用于快速鉴定和分离多种类型的细胞。
本文将介绍一种常用的流式细胞仪实验方法,包括样品准备、细胞染色、细胞分析和数据分析等步骤。
一、样品准备1.收集细胞:制备单细胞悬液,如细胞培养物等。
2.细胞计数:使用细胞计数器或血细胞计数板等工具,计算细胞密度。
3. 调整浓度:根据流式细胞仪系统的要求,将细胞悬液的浓度调整至适当的浓度(一般建议在1×10^5至1×10^6个细胞/ ml之间)。
二、细胞染色1.封闭非特异结合位点:为了减少非特异性结合,可使用FBS(胎牛血清)或BSA(牛血清蛋白)等以阻断非特异位点。
2.添加荧光染料:选择合适的染料,如草酰胺(CFSE)、丙酮染料(ATTO)或FITC等。
按照厂家说明书中建议的浓度将染料添加到样品中,好洗脱或者可用来鉴定细胞的抗体,如表面标记、核酸染色剂或功能性抗体。
3.染色溶液:在4°C下孵育细胞悬液至少30分钟(具体时间根据实验需要决定)。
4.洗涤:向样本管中加入足够的缓冲液,使细胞悬液稀释五倍,并离心沉积细胞。
5.弃去上清液:将上清液弃去,然后用足够的缓冲液再次洗涤沉积的细胞。
6.重悬:向样品管中加入适量的缓冲液,使细胞形成合适的细胞密度。
三、设置流式细胞仪1.打开仪器:确保仪器已开启并运行正常,各通道和检测器已连接好,并预热至适当温度。
2.校正:根据仪器的手册,对流式细胞仪进行校正和标定,以确保流式细胞仪的准确性和稳定性。
3.样品管固定:将样品管插入到流式细胞仪中相应的槽中,以确保准确读取。
4.设置参数:在计算机或流式细胞仪仪器的界面上设置所需参数,如细胞个数、细胞染色等。
四、细胞分析1.利用流式细胞仪:启动流式细胞仪软件,并确保硬件与软件连接正常。
2.定位细胞:在细胞分析开始前,调整激光位置和侦测器的灵敏度,以确保对准确获取细胞。
最详细的流式细胞仪实验方法

流式细胞仪实验方法一、实验准备1.标本制备:2.最小化非特异性结合:二、凋亡1.凋亡的检测方法:网站和其它2.PI染色法3.Annexin V 法4.TUNNEL法三、细胞因子1.激活的细胞因子2.CBA四、血小板1.活化2.活化检测3.网织血小板五、红细胞1.网织红细胞2.PNH3.胎儿红细胞六、肿瘤学1.DNA 细胞周期2.蛋白3.多药耐药4.微小残留白血病第一部分标本处理一、流式细胞术常规检测时的样品制备(一)直接免疫荧光标记法取一定量细胞(约1X106细胞/ml),在每一管中分别加入50μl的HAB,并充分混匀,于室温中静置1分钟以上(),再直接加入连接有荧光素的抗体进行免疫标记反应(如做双标或多标染色,可把几种标记有不同荧光素的抗体同时加入),。
孵育20-60分钟后,用PBS(pH7.2—7.4)洗1-2次,加入缓冲液重悬,上机检测。
本方法操作简便,结果准确,易于分析,适用于同一细胞群多参数同时测定。
虽然直标抗体试剂成本较高,但减少了间接标记法中较强的非特异荧光的干扰,因此更适用于临床标本的检测。
(二)间接免疫荧光标记法取一定量的细胞悬液(约1X106细胞/ml),先加入特异的第一抗体,待反应完全后洗去未结合抗体,再加入荧光标记的第二抗体,生成抗原—抗体—抗抗体复合物,以FCM检测其上标记的荧光素被激发后发出的荧光。
本方法费用较低,二抗应用广泛,多用于科研标本的检测。
但由于二抗一般为多克隆抗体,特异性较差,非特异性荧光背景较强,易影响实验结果。
所以标本制备时应加入阴性或阳性对照。
另外,由于间标法步骤较多,增加了细胞的丢失,不适用测定细胞数较少的标本。
二、最小化非特异性结合的方法1.荧光标记的抗体的浓度应该合适,如果浓度过高,背景会因为非特异性的相互作用的增加而增加。
2.在使用第一抗体之前,将样品与过量的蛋白一起培育,如小牛血清蛋白(BSA),脱脂干奶酪,或来自于同一寄主的正常血清来作为标记的第二抗体。
流式细胞仪常用的几种检测方法

流式细胞仪常用的几种检测方法1.细胞计数和生存率检测:流式细胞仪可以通过测定细胞的大小、形状和胞内染色物来实现细胞计数和生存率的检测。
通过自动聚焦和自动获取图像的功能,可以对大量的细胞进行计数和分析,并得出生存率数据。
2.表面标记检测:流式细胞仪可以利用荧光染料或荧光标记抗体对细胞表面的蛋白质、糖类或其他生物分子进行检测。
这种检测方法主要用于检测细胞表面标记的数量和分布情况,例如测定细胞表面特定抗原的表达水平。
3.细胞周期分析:流式细胞仪可以通过染色剂或荧光标记抗体对细胞进行染色,然后分析细胞在不同细胞周期阶段的比例。
这种检测方法可以用于研究细胞的增殖能力、细胞周期调控机制以及细胞周期与疾病发展的关系。
4.细胞凋亡检测:流式细胞仪可以利用染色剂或荧光标记抗体对细胞凋亡的标志物进行检测。
凋亡是细胞死亡的一种形式,通过测定凋亡细胞的数量和凋亡标志物的表达水平,可以研究细胞凋亡的调控机制以及细胞凋亡与疾病的关系。
5.细胞功能检测:流式细胞仪可以通过检测细胞内Ca2+浓度、ROS (活性氧物种)水平、蛋白质磷酸化等细胞功能指标来研究细胞的信号转导和功能活性。
例如,利用荧光染料可以测定细胞内钙离子的浓度变化,以研究细胞响应外界刺激的机制。
此外,流式细胞仪还可以进行细胞分选、多色细胞分析和细胞细胞间相互作用的研究。
细胞分选功能可以根据细胞标记物的表达水平将细胞分离出来,用于研究特定功能细胞的特性。
多色细胞分析可以用于同时检测多种标记物的表达水平,以揭示不同细胞类型的分子特征。
细胞间相互作用的研究可以通过检测细胞间的共聚或共表达标记物来研究细胞间的相互作用和相互影响。
总的来说,流式细胞仪是一种功能强大的实验室设备,常用于细胞生物学和疾病研究。
通过不同的检测方法,可以在细胞水平上研究细胞的数量、表面标记、周期、凋亡、功能以及细胞间相互作用等方面的特征。
流式细胞仪检测细胞周期操作步骤
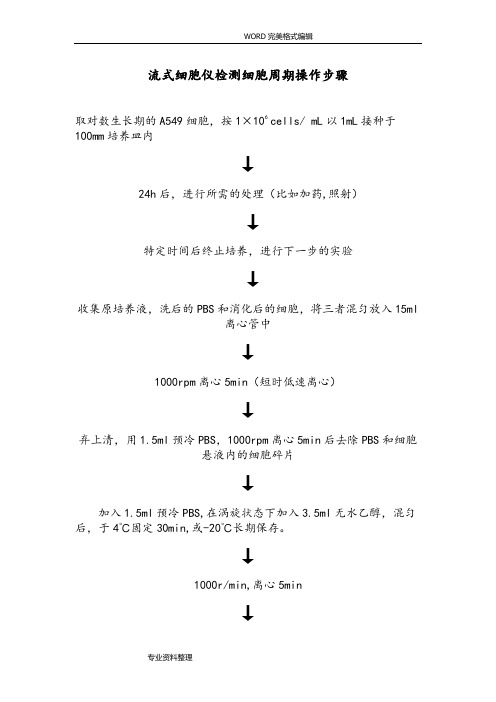
流式细胞仪检测细胞周期操作步骤取对数生长期的A549细胞,按1×106 cells/ mL以1mL接种于100mm培养皿内↓24h后,进行所需的处理(比如加药,照射)↓特定时间后终止培养,进行下一步的实验↓收集原培养液,洗后的PBS和消化后的细胞,将三者混匀放入15ml离心管中↓1000rpm离心5min(短时低速离心)↓弃上清,用1.5ml预冷PBS,1000rpm离心5min后去除PBS和细胞悬液内的细胞碎片↓加入1.5ml预冷PBS,在涡旋状态下加入3.5ml无水乙醇,混匀后,于4℃固定30min,或-20℃长期保存。
↓1000r/min,离心5min↓将乙醇吸除,加PBS清洗混匀↓1000r/min,5min再离心一遍,将残留在细胞上的乙醇除去↓吸除离心管内PBS,加入200ul PBS和2ul的RNA酶(0.25mg/ml)(37℃下孵育30min)↓加入0.5ml的50ug/ml的PI溶液室温下避光染色30min↓将离心管内的细胞过滤(300um尼龙网膜)至含有PBS的EP管中(PI 具有很强的粘附性,容易使细胞聚团),标记EP管↓提前一天网上预约↓开机(先开仪器后开软件)↓流式细胞仪的结构一般分为5部分:①流动室及液流驱动系统;②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。
↓检测前先涡旋使细胞混匀悬浮呈单个细胞,然后插入流式细胞仪上↓流动室内充满鞘液,细胞排成单列由喷嘴中心喷出,形成细胞液柱↓液柱与激光束相交,细胞上的荧光染料被激发产生荧光(488nm激发光源)↓荧光信号变成电信号输出到计算机,软件分析(荧光染料和细胞DNA分子特异性结合,可以检测出细胞周期各时相细胞比例)↓在用第三方软件分析之前,将流式结果按如下所示导出结果分析——Modfit软件分析——Flowjo 软件分析图片拷贝:直接Ctrl+CFCM-DNA 量分析 1 个细胞增殖群时,可将DNA 含量分布组方图分为三部分,即 G0/1、S 、G2M 。
流式细胞仪试验方法2

第四部分流式细胞术分析血小板流式细胞术分析血小板血栓性疾病、出血性疾病、心血管疾病以及自身免疫性血小板减少症等疾病的病理生理过程与血小板相关。
血小板功能检测包括黏附、聚集和活化功能试验。
使用流式细胞仪检测全血中血小板表面相关标志物是一种新技术,它拓宽了血小板相关疾病的诊断与功能研究方法,丰富了血小板功能评估指标。
一、流式细胞仪血小板分析应用范围1.通过分析信号传递、细胞骨架结构、颗粒释放、糖蛋白构形、膜磷脂、与抗凝因子的结合和微粒形成,分析血小板活化,血小板对刺激物的反应性。
2. 通过分析受激后表面结合蛋白触发凝血链式反应和表面糖蛋白缺陷检测,分析血小板止血功能的获得性和遗传性缺陷。
3. 结合血小板大小,检测血小板RNA含量,分析血小板成熟度,计数网织血小板。
4. 发现血小板抗体,做定性和定量分析。
二、血小板分析的临床意义1. 血栓性疾病:活化血小板的检测能预测冠状血管成形术后发生急性缺血事件的危险性,非风湿性心房纤颤患者栓塞和栓塞前期均有血小板活化,胰岛素依赖性糖尿病,子痫前期,外周血管疾病等均可测出血小板活力增加和(或)循环中存在活化血小板,而早产儿的血小板对凝血酶、二磷酸腺苷(ADP)、TXA2的体外激活能力降低。
2. 血小板缺陷性疾病:全血法流式细胞术提供了一个简单、迅速的方法来诊断血小板膜糖蛋白缺陷性疾病,如巨大血小板综合征,血小板无力症等。
前者是由于GPIb-IX复合物先天缺陷所致的血小板形态巨大,功能异常的出血性疾病。
后者由于GPⅡb/Ⅲa复合物先天缺陷,导致血小板聚集功能障碍3. 贮存池疾病:原发性贮存池疾病(δ-SPD)常规用血小板聚集法检测,但特异性和灵敏度均不理想。
检测血小板致密颗粒的阿的平荧光显微镜法,主观性大,操作繁琐,而且一次检测的血小板数目有限。
全血法流式细胞术为δ-SPD的诊断提供了一个简单、迅速的方法,一次能定量检测5 000个以上阿的平染色的血小板。
与正常人相比,δ-SPD患者阿的平染色显著下降(从49%降至15%)。
流式细胞仪实验方法
流式细胞仪实验方法以下是流式细胞仪实验的一般步骤:1.预实验准备:a.准备所需样本:收集需要分析的细胞样本,如血液、细胞培养物等。
b.确定实验设计:根据实验目标确定分析的参数、染色方法和控制组设置。
2.打开仪器:a.打开流式细胞仪,并按照仪器说明书进行操作。
b.等待仪器预热,并确保仪器处于正常工作状态。
3.样本处理:a.预处理样本:根据实验需求,进行必要的样本预处理,如细胞培养、离心、洗涤等。
b.细胞染色:根据需要,对细胞样本进行染色。
例如,使用荧光标记的抗体来标记感兴趣的细胞表面标记物。
c.染色控制组:设置相应的染色控制组,用于确定背景噪音和染色特异性。
d.染色时间和温度:对于染色的时间和温度进行优化,确保获得最佳标记效果。
e.后续处理:根据实验需求,进行必要的后续处理,如溶解细胞红外染料、染色通道校准等。
4.仪器设置:a.确定分析参数:根据实验目标,选择合适的参数设置,如激光波长、增益和门限等。
b.检查仪器设置:检查仪器设置是否正确,如流速、流式细胞仪通道是否已校准等。
c.校准仪器:根据仪器说明书,进行仪器的标定和校准。
5.获得数据:a.导入样本:将染色的细胞样本装入流式细胞仪的样本装载仓,并设置相关参数。
b.数据获取:根据设置的参数,运行仪器开始数据采集。
收集细胞事件的信息,如散射光强度和荧光强度。
c.数据保存:将获得的数据保存为FCS格式。
d.检查数据质量:检查数据的质量,排除可能的仪器漂移和背景信号差异。
e.数据分析:使用流式细胞仪软件对数据进行分析和解读。
6.数据分析:a.数据清洗:根据需要,清洗数据,并删除可能的噪音和非特异信号。
b.数据解读:根据实验目标,解读数据并分析感兴趣的细胞亚群。
c.统计分析:使用统计方法对数据进行分析和比较。
7.结果呈现:a.数据可视化:使用合适的图表或图像软件绘制结果图,如直方图、散点图或流式图。
b.结果解读和讨论:根据结果进行解读和讨论,进一步分析结果的意义和潜在的影响。
流式细胞术实验技巧及数据分析
流式细胞术实验技巧及数据分析一、实验技巧1.细胞样本的准备在进行流式细胞术之前,首先需要准备好细胞样本。
对于悬浮细胞,可以通过离心分离获得单细胞悬浮液;对于贴壁细胞,需要利用胰酶等方法将细胞从培养皿上剥离。
样本的细胞浓度需要适当调整,以保证在实验过程中细胞数目在仪器检测范围内。
2.细胞标记与染色3.样本的处理与染色控制为了减少噪音和误差,需要进行相应的样本处理和染色控制。
常用的处理包括细胞固定、膜破裂和核酸溶解等。
另外,对照组的设置也非常重要,包括负对照、单标对照和血细胞淋巴细胞控制等,以校正仪器和标记的相关性。
4.流式细胞仪的设置与操作流式细胞仪是进行流式细胞术的关键仪器,需要正确设置和操作。
首先,要校准仪器的激发光源、滤光片和检测器等参数,以确保获得准确的荧光信号。
其次,要根据标记物的激发光和发射光波长选择合适的检测通道。
最后,通过检测标记物阳性细胞的信号强度和分布,调整仪器的敏感度和流速,以获得符合实验要求的数据。
二、数据分析1.数据获取与记录在流式细胞术实验结束后,需要用相应的软件(如FlowJo、CellQuest等)获取和记录仪器所产生的原始数据。
这些数据包括细胞整体的荧光信号和散点图等。
2.质量控制与后处理对于数据质量的控制,首先需要排除掉背景信号。
通过设置负对照,根据荧光信号的阈值来确定阳性细胞的比例。
另外,还需要剔除激活的、死亡的和颗粒干扰的细胞等。
3.数据可视化通过制作直方图、散点图和轮廓图等,可以直观地展示细胞的其中一种特定特征(如表达一些蛋白质、细胞周期等)在整个细胞群体中的分布情况。
从图形中可以得出相应的统计结果,并可以进一步比较不同样本之间的差异。
4.数据统计与分析对于一些研究问题,需要计算不同细胞亚群的百分比、中位数、平均值和标准差等。
此外,还可以利用双参数散点图,通过计算相关系数(如Pearson相关系数)来分析两个特征之间的相关性。
总结:流式细胞术作为一种快速、高通量和灵敏的细胞分析技术,对于研究细胞标记物的表达和功能等提供了有力的手段。
流式细胞术操作规程
流式细胞术操作规程流式细胞术是一种常用的细胞分析技术,它可以用来检测和分析细胞表面标记物、细胞数量、细胞分布等信息。
以下是一份流式细胞术操作规程,详细介绍了该技术的操作步骤和注意事项。
一、实验前准备1. 准备所需的实验材料,包括流式细胞仪、标记抗体、孵育培养基、样本组织、显微镜片等。
2. 检查流式细胞仪的功能是否正常,确认仪器能够正常运行。
3. 清洁实验台面,确保操作环境干净整洁。
4. 准备所需的试剂和溶液,如PBS缓冲液、抗体染色溶液等。
二、样本处理1. 准备样本组织,将其转移到离心管中,并添加适量的孵育培养基使其完全浸泡。
2. 使用离心机将样本离心,去除上清液。
3. 重悬样本,将其转移到离心管中,并加入足够的PBS缓冲液进行洗涤。
4. 重复洗涤过程,直到样本完全洗净。
三、标记抗体染色1. 取出经过洗涤的样本,将其转移到离心管中,并加入足够的标记抗体溶液。
2. 在黑暗条件下孵育样本,使其与标记抗体充分结合。
3. 静置反应15-30分钟,确保充分染色。
4. 在光线和温度适宜的条件下冰冻样本,避免抗体的结合。
5. 根据实验需求,可以选择单标记或多标记抗体。
四、样本准备1. 取出经过标记抗体染色的样本,将其转移到离心管中,并加入足够的PBS缓冲液进行洗涤。
2. 将样本离心并去除上清液。
3. 重悬样本,并根据实验需要加入适量的PBS缓冲液进行稀释。
4. 检查样本的细胞数目和活性是否符合实验要求,如有必要,可以使用显微镜进行观察和计数。
五、流式分析1. 打开流式细胞仪,并确认仪器的设置和参数是否符合实验要求。
2. 调整仪器的流速和灵敏度,使其适应样本的特性。
3. 将样本转移至流式细胞仪的样本管中。
4. 开始流式细胞分析,记录并保存实验数据。
5. 根据实验需要,可以进行不同的数据分析和处理,包括细胞分布、细胞数量、表面标记物的表达等。
六、实验后处理1. 关闭仪器,清洁工作台和操作区域。
2. 处理和储存实验数据,可以使用相应的图像科学软件进行数据处理和结果分析。
流式测actin操作方法
流式测actin操作方法
流式测actin操作方法涉及以下步骤:
1. 细胞的制备:首先,细胞需要经过适当的处理来保持其形状和完整性。
这包括使用缓冲液洗涤和悬浮细胞,将细胞固定以保持其结构,并使用渗透剂使细胞透明。
2. 标记actin:现在,将使用荧光标记将actin可视化。
这通常涉及使用荧光标记的抗体来识别actin,并通过与这些抗体结合的二抗来传递荧光信号。
3. 流式细胞术:准备好的细胞悬液将通过流式细胞仪进行分析。
这涉及将细胞单个传送到流式细胞仪中的流体流中。
流体流使细胞一个接一个通过检测器通过。
4. 激光束照射:通过使用激光束与细胞交互,可以激发荧光标记的actin并产生荧光信号。
具体要求仪器配置和激光设置以获取最佳结果。
5. 数据采集和分析:由于流式细胞仪能够快速记录细胞中荧光信号的数量和强度,因此能够收集大量数据。
这些数据可以用于进一步的分析和解释actin的动态行为。
需要注意的是,流式测actin的具体操作方法可能因流式细胞仪型号和实验目的的不同而有所不同。
因此,在进行实验之前,建议参考相关的仪器操作手册和文
献以获取详细的操作步骤和建议。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
流式细胞仪实验方法一、实验准备1.标本制备:2.最小化非特异性结合:二、凋亡1.凋亡的检测方法:网站和其它2.PI染色法3.Annexin V 法4.TUNNEL法三、细胞因子1.激活的细胞因子2.CBA四、血小板1.活化2.活化检测3.网织血小板五、红细胞1.网织红细胞2.PNH3.胎儿红细胞六、肿瘤学1.DNA 细胞周期2.蛋白3.多药耐药4.微小残留白血病第一部分标本处理一、流式细胞术常规检测时的样品制备(一)直接免疫荧光标记法取一定量细胞(约1X106细胞/ml),在每一管中分别加入50μl的HAB,并充分混匀,于室温中静置1分钟以上(),再直接加入连接有荧光素的抗体进行免疫标记反应(如做双标或多标染色,可把几种标记有不同荧光素的抗体同时加入),。
孵育20-60分钟后,用PBS(pH7.2—7.4)洗1-2次,加入缓冲液重悬,上机检测。
本方法操作简便,结果准确,易于分析,适用于同一细胞群多参数同时测定。
虽然直标抗体试剂成本较高,但减少了间接标记法中较强的非特异荧光的干扰,因此更适用于临床标本的检测。
(二)间接免疫荧光标记法取一定量的细胞悬液(约1X106细胞/ml),先加入特异的第一抗体,待反应完全后洗去未结合抗体,再加入荧光标记的第二抗体,生成抗原—抗体—抗抗体复合物,以FCM检测其上标记的荧光素被激发后发出的荧光。
本方法费用较低,二抗应用广泛,多用于科研标本的检测。
但由于二抗一般为多克隆抗体,特异性较差,非特异性荧光背景较强,易影响实验结果。
所以标本制备时应加入阴性或阳性对照。
另外,由于间标法步骤较多,增加了细胞的丢失,不适用测定细胞数较少的标本。
二、最小化非特异性结合的方法1.荧光标记的抗体的浓度应该合适,如果浓度过高,背景会因为非特异性的相互作用的增加而增加。
2.在使用第一抗体之前,将样品与过量的蛋白一起培育,如小牛血清蛋白(BSA),脱脂干奶酪,或来自于同一寄主的正常血清来作为标记的第二抗体。
这个步骤通过阻断第一抗体和细胞表面或胞内结构的非特异性的交互作用来降低背景。
3.在使用第一抗体之后,将样品与5%至10%的来自于同一寄主的正常血清和作为标记的第二抗体一起培育。
这个步骤会减少不必要的第二抗体与第一抗体、细胞表面或胞内结构之间的交互作用。
通过用来自于同样的样品的血清稀释标记过的抗体可以略过此步骤。
此步骤适用于很多方面,但有时候它也会导致已标记的第二抗体和正常血清中的免疫球蛋白的免疫复合体的形成。
这种复合体会优先与一些细胞结构进行结合,或者它们最终会导致期望得到的抗体活性的丢失。
4.使用F(ab’)2片段会使背景决定于第一或第二抗体与FC受体的全分子结合。
大多数的第二抗体的F(ab’)2片段容易利用。
而第一抗体的F(ab’)2片段一般是不能利用或很难制作。
因此,在NaN3存在的条件下,将新鲜组织或细胞与正常血清一起培育应选择优先加入第一抗体。
在此情况下,即使在随后的步骤中用完所有的抗体分子,FC受体决定的背景影响已不再重要。
5.其它:已标记的抗体和其他一些内在的免疫球蛋白或加入实验系统中的其它物质的交叉反应也可能会有背景影响。
为了降低背景,在多重标记过程中,所有的已标记的抗体应被吸附,避免其他种类蛋白的交叉反应。
第二部分细胞因子细胞内细胞因子的流式细胞仪检测一、简介随着研究的进展,仅仅对细胞进行定量和活性的检测已不能满足需要。
在单细胞水平研究细胞因子的表达能力对研究细胞因子在疾病中的作用越来越显的重要无比。
目前检测单个细胞特定细胞因子的表达手段包括:ELIspot、原位杂交、免疫细胞化学、限制性稀释分析(limiting dilution analysis,LDA)和单细胞PCR,应用原位杂交技术和免疫组化方法观察细胞因子蛋白表达及mRNA表达可以识别Th1和Th2细胞,此方法可获得较强的细胞内信号,但此方法工作量大、主观性强,难以进行大样本检测,且人肉眼识别能力有很大的局限性,而ELISPOT及单细胞PCR技术,技术性强、劳动强度大,难以进行广泛推广。
随着多标记及胞内细胞因子标记流式细胞技术的出现,使对细胞内细胞因子的研究推向了一个新的阶段。
下面主要对胞内细胞因子流式细胞技术作以介绍。
早期细胞因子表达与细胞功能相关性研究是基于特定克隆细胞的激活。
尽管研究应用T淋巴细胞克隆证明了不同细胞因子的合成,如TH1(IL-2,IFN-)与TH2(IL-4,IL-5,IL-10),但这些研究很难外推,因为T细胞克隆与体内T细胞功能相关性还未被揭示。
近来,Jung与Picker采用了monensin、PMA等药物预孵,用Brefeldin(BFA)、Monensin阻断了胞内高尔基体介导的转运的方法使得细胞因子聚集,蓄积,增强细胞因子信号可被流式细胞仪检测。
因为自然状态下,T淋巴细胞产生少量的细胞因子,通常要对T淋巴细胞体外活化进行研究。
在体外刺激过程中,T淋巴细胞产生的细胞因子已释放出来,胞内细胞因子信号较弱,难以进行检测。
这一方法可检测单个细胞内多个细胞因子,并可区分表达特定细胞因子的细胞亚群。
在细胞水平该方法证明了人与鼠的淋巴细胞都存在1型与2型分化,且这些分化在特定细胞因子增强时可被逆转。
且这些研究清楚地证明,只有激活的细胞亚群可以表达细胞因子,静止的正常淋巴细胞(T、B、NK)不能分泌细胞因子。
胞内流式分析法是用抗细胞因子抗体与细胞表面或胞内特定亚群标志组合,即可检测不同细胞亚群细胞因子的分泌,同时采用特殊的化学与抗体选择,确保静止与无细胞因子分泌细胞的最小荧光背景。
具有其它方法难以比拟的优点:快速:流式定量检测细胞内细胞因子可在一天内完成,实验流程需6-8小时,实际操作时间为1-2小时,快速简便;简便:无需组织培养,可以全血分析,无需分离PBMCs;灵敏度高:高度灵敏的荧光标记与检测系统;高效:可以在同一个细胞内同时检测两种或更多种细胞因子,也可根据细胞免疫表型区分分泌细胞因子的细胞的亚型,进行多参数相关分析;安全:减少样本处理与生物源性污染接近生物体的分析条件:全血检测保留细胞及生化微环境更准确反映了体内状况。
二、所需仪器1. 流式上样管及细胞培养皿或板2. 25%CO2,37℃孵箱3. 混匀振荡器4. 离心机5. 加样器、Tips6. 流式细胞仪三、常用的标本类型和处理方法全血:使用肝素钠抗凝的真空采血管采血,不易采用肝素锂、EDTA和ACD抗凝剂,血样在8小时内分析,超过8小时会导致活性的损失,一般细胞因子阳性细胞会减少5%。
如不能在8小时之内检测,应将真空采血管水平室温放置。
自身血浆中外周血单个核细胞(PBMCs):使用肝素钠抗凝的采血后,分离PBMCs,24小时内分析。
组织培养基中的外周血单个核细胞(PBMCs):用Ficoll分离PBMCs,将细胞重悬于含10%热灭活胎牛血清(FBS)的RPMI-1640培养基中,调节细胞浓度为2×106细胞/ml。
细胞系与T细胞克隆:调节细胞浓度2×106细胞/mL于新鲜培养基中。
冰冻全血与PBMCs:使用1×红细胞裂解液处理活化的外周血或者PBMCs,用PBS漂洗,并用含1%的BSA及10%的DMSO的PBS重悬,-70℃冻存。
溶化后细胞置于染色管中,加上2~3mL的洗液,离心5分钟后,用破膜剂对细胞进行破膜和染色。
四、所需试剂1、细胞表面染色的荧光标记的单抗试剂依据实验需要选择特殊表面标志CD45圈定所有淋巴细胞CD3 圈定T淋巴细胞CD4 圈定T辅助淋巴细胞亚群CD8 圈定T抑制淋巴细胞亚群CD19/或CD20圈定B淋巴细胞CD56圈定NK淋巴细胞CD14圈定单核细胞2、荧光标记的细胞因子抗体:R&D提供FITC、PE和APC标记的细胞因子抗体3、溶血素:用外周全血检测时需使用溶血素(R&D目录号WL1000用于人或者WL2000用于小鼠;eBioscience目录号00-4333)溶解红细胞4、激活剂①Phorbol 12-Myristate 13 Acetate(PMA)(Alexis,目录号ALX-445-004-M001)A. D MSO中调节浓度0.1mg/mLB. 分装(20L),-20℃储存。
勿反复冻融C.每次实验用无菌无叠氮钠PBS 1:100稀释储存液D.PMA终浓度25ng/mL细胞悬液②Ionomycin (Alexis,目录号ALX-450-006-M001)A. 于乙醇中配制成浓度0.5mg/mLB. -20℃储存C. 每次实验用无菌无叠氮钠PBS 1:10稀释储存液D. Ionomycin终浓度1g/mL细胞悬液③Staphylococcal enterotoxin B(SEB) (Sigma,Catalog No.S-4881)A. 无菌无叠氮钠PBS调节浓度0.5mg/mLB. 4℃储存C. SEB终浓度10g/mL细胞悬液④CD3:包被在培养板中,在蛋白转运抑制剂存在下活化未稀释的血液细胞⑤CD28:加速不同刺激剂(包括SEB、CD3等)的活化效应,浓度一般为10ug/ml5、阻断剂阻断高尔基体介导的转运作用,使得刺激细胞表达的细胞因子聚集在胞浆内①Brefeldin-A(BFA) (eBioscience,目录号00-4506)A. 于DMSO中调节浓度5mg/mLB. 分装(20L),-20℃储存。
勿反复冻融。
C. 每次实验用无菌无叠氮钠PBS 1:10稀释储存液D. 激活最后4-5小时BFA终浓度10g/mL细胞悬液。
注意:BFA过度孵育会导致细胞活力下降②Monensin (eBioscience,目录号00-4505)6、不含谷氨酰胺的RPMI-16407、固定剂:细胞在体外刺激后需要对细胞进行固定。
固定的目的在于通过蛋白的交联和变性一方面使细胞因子固定在细胞内,另一方面避免细胞表面抗原丢失。
含4%的多聚甲醛PBS溶液(eBioscience,目录号00-8222)8、破膜剂:含1%皂甙、0.05%叠氮化钠的Hanks溶液(HBBS)(eBioscience,目录号00-8333)将细胞膜穿孔,已利于荧光标记的细胞因子抗体进入细胞内,于相应的细胞因子结合9、其它试剂:无菌无叠氮钠PBS,乙醇,含1%多聚甲醛的PBS,4℃储存。
五、细胞培养和刺激的基本方法细胞活化的最终结果是产生细胞因子,根据检测指标和标本的不同,研究人员需要选择不同的刺激剂和刺激时间,以获得最佳的实验结果。
下表提供了检测一些常用细胞因子的推荐的活化方法。
表1、细胞内细胞因子流式检测推荐的阳性对照活化方法人TNF-人IL-小鼠小鼠TNF-为防止细胞内细胞因子分泌到胞外,在培养的最后4-6个小时,需要使用蛋白转运抑制剂(如3uM monensin,10mg/ml的BFA)方法1: 只使用转染细胞检测方法2: 人的PBMCs使用PMA (10 ng/ml) 和Ionomycin (1 uM) 刺激4-24 小时.方法3: 人的PBMC 使用LPS (0.5 - 1 ug/ml) 刺激24 小时.方法4: 人的PBMCs或者纯化的CD4+细胞在包被人CD3抗体的培养板中,使用含有重组人的IL-2(10 ng/ml,目录号202-IL-010)和IL-4(10 ng/ml,目录号204-IL-005)的培养基培养两天;细胞洗涤后在含有重组人IL-2和IL-4的培养基中继续培养2天;最后收获细胞,使用PMA (10 ng/ml) 和Ionomycin (1 uM)刺激6小时方法5: CD4+ T 细胞使用PHA (10 ng/ml) 刺激4 days方法6: T 细胞使用抗CD3 的单抗、抗CD28的单抗和重组人的IL-1β (Lorre, et al., 1994, Clin Immuno Immunopath 70:1)方法7: 使用PMA (50 ng/ml) 和Ionomycin (500 ng/ml)刺激方法8: PBMCs细胞使用重组人,目录号285-IF-100) 刺激2 小时,然后使用(10 ng/ml) + LPS (1 ug/ml) 刺激22小时或者使用相同的方法刺激THP-1 细胞.方法9: EL4 在包被抗小鼠CD3抗体(25 ug/ml) 的培养板中,使用抗CD28 抗体(2 ug/ml) + PMA (5 ng/ml) + Ionomycin (500 ng/ml) 刺激6小时方法10: CD4+T细胞在包被小鼠CD3(25 ug/ ml)抗体的培养板中,使用含有抗小鼠的CD28(2 ug/ml)的抗体,重组小鼠的IL-2(10 ng/ml,目录号402-ML-020)和IL-4(50 ng/ml,目录号404-ML-005)的培养基培养两天;然后在含有重组小鼠IL-2和IL-4的培养基中继续培养3天;最后收获细胞,使用PMA(5 ng/ml)、Ionomycin(500 ng/ml)和monensin刺激6小时。
