不饱和羧酸和取代羧酸
羧酸与取代羧酸

伯醇和仲醇成酯以“酰氧键断裂的机理”:
O CH3 C
-H2O
消除
OH
H+
+ OH HOC2H5
CH3 C OH
CH3
OH C OH
亲核加成 H O+C2H5
Ⅰ
Ⅱ
+ OH
-H+
CH3 C OC2H5
O CH3 C OC2H5
Ⅳ
Ⅴ
OH
+
CH3 C OH2 OC2H5
Ⅲ
11-28
伯醇和仲醇与酸成酯反应的特点: ①反应总的结果是亲核试剂醇分子中的-OR基取代了羧基中的羟基,是羧基的 亲核取代反应。 ②空间位阻对酯化反应的速度影响很大。 上述反应的中间体(Ⅱ)和 (Ⅲ)都是四面体结构,比较拥挤,如果羧酸和醇的α碳上连接的基团越多, 越大,这些中间体越不稳定,酯化反应越难进行。 酸或醇的烃基体积小、数目少,速度快。反应活性顺序如下:
11-13
问题11-2 分离苯甲酸、苯甲醇和苯酚的混合物。
COOH OH CH2OH
NaOH水溶液
水层 通CO2
溶液 H+ 晶体(苯甲酸) 晶体(苯酚)
醇层(苯甲醇)
羧酸酸性的应用: 分离、鉴别羧酸与酚
在制药工业中将羧酸制成钾盐、钠盐增加 药物的水溶性,提高药效
11-14
问题11-3 乙酸中也含有CH3CO基团,但不发生碘仿反应。为 什么?
AC
OH
性增强
O
当D为推电子基团, 酸
D C O H 性减弱
11-15
(1) 诱导效应
酸性排列顺序
HCOOH > CH3COOH >CH3CH2COOH
pKa 3.77
南昌大学有机化学16 不饱和羧酸和取代羧酸

戴延凤博士 yfdai@
1
16.1 不饱和羧酸
一、不饱和羧酸的制法 芳醛的缩合反应
PhCHO + CH2(COOH)2
吡吡, 六六吡吡 回回
phCH
CHCO2H
PhCHO + (CH3CO)2O
PhCHO + CH3COOEt
CH3CO2Na 180 C
16.9 碳酸衍生物
20
练习: 练习: CH2COOH 1. 以丙二酸二乙酯为原料,合成 以丙二酸二乙酯为原料,
CH2COOH
T.M
(1) EtONa EtOH CH(CO Et) (1) NaOH 分 2 2 CH2(CO2Et)2 (2) ClCH2COOC2H5 CH COOC H (2) H O + 析 3
O CH2CH2OC2H5OC C COOC2H5 CH CH O2 2
C2H5ONa
CH2(CO2Et)2 O
EtONa 0.5 C
o
o
phCH
CHCO2H
5h
phCH
2h
CHCO2Et
2
二、α,β-不饱和羧酸的反应 不饱和羧酸的反应 1,4-加成(共轭体系) 加成(共轭体系) 加成
CH2 CHCOOH
狄尔斯-阿德尔反应(亲双烯体系) 狄尔斯 阿德尔反应(亲双烯体系) 阿德尔反应
三、α,β-不饱和羧酸的用途 不饱和羧酸的用途 甲基丙烯酸甲酯: 甲基丙烯酸甲酯:有机玻璃的原料 丙烯腈 丙烯腈:合成纤维原料
2 2 5
2.以丙二酸二乙酯为原料,合成 CH2CH2COOH 以丙二酸二乙酯为原料, 以丙二酸二乙酯为原料
CH2CH2COOH
胡勇-有机化学教学第十一章羧酸和取代羧酸

(常用的催化剂有盐酸 、硫酸、苯磺酸等)
定义:羧酸与醇在酸的催化作用下失去一分子水而生成酯的反应称为酯化反应。
酯化反应的机制
*
1 加成--消除机制
双分子反应一步活化能较高
质子转移
加成
消除
四面体正离子
H2O
H+
按加成--消除机制进行反应,是酰氧键断裂
1OROH,2OROH酯化时按加成--消除机制进行,且反应速率为: CH3OH>RCH2OH>R2CHOH
一元羧酸 二元羧酸 三元羧酸
按羧基所连接的烃基种类
(2) 羧酸的命名
*
俗名——根据天然来源(蚁酸(甲酸)、醋酸(乙酸)等)
*
系统命名法 (1)选择含有羧基的最长碳链为主链(母体); (2)碳链编号时,从羧基的碳原子开始; (3)酸前要冠以官能团位置的数字(编号最小); (4)其它同烷烃的命名规则
苯二甲酸
二元羧酸的酸性 羧基是吸电子基——pKa2 > pKa1
氰基的水解
01
二元羧酸的制备
02
工业制法 酸的α-H卤代
03
乙二酸(草酸)
*
加热分解
氧化
使KMnO4溶液褪色!
酸性较甲酸及其他二元酸强
5(COOH)2+2KMnO4+3H2SO4 K2SO4+2MnSO4+10CO2+ 8H2O
01
羧酸显示酸性的原因——羧酸根负离子的稳定性
02
3 取代基对羧酸酸性的影响
*
(1)电子效应的影响: 吸电子取代基使酸性增大,给电子取代基使酸性减少. HCOOH C6H5-COOH CH3COOH pka 3.37 4.20 4.73
不饱和羧酸和取代羧酸

CH 3
• 2.芳醛的缩合反应(普尔金和脑文格反应)
• 三. a,β-不饱和羧酸的反应 • a,β-不饱和羧酸及其衍生物分子中含有共轭双键体系,与 a,β-不饱和醛酮相似,容易起1,4-加成反应。例如:
OHCCOOH
乙醛酸能形成稳定的水合物 (HO) 2CHCOOH
• 丙酮酸由相应的腈水解得到,能还原土伦试剂,用硝 酸氧化则生成草酸,与稀硫酸加热脱酸生成乙醛,与 浓硫酸加热则生成乙酸,这是a-酮酸的特性反应.
O O O
CH 3CCl
O
NaCN
CH 3CCN
H3O+
CH 3CCOOH
Ag(NH3)2+
O H3C C O H CH2 CH3COH + CO2 O H3C O H O CH3CCH3 + CO2 O O
有的多环β –酮酸加热时不脱羧,可能是由于脱羧生成的烯 醇含有张力很大的桥头双键,不容易生成。 β –酮酸酯是稳 定的。
• 三. γ-酮酸 • 4-戊酮酸是最简单的γ-酮酸,加热容易脱水:
2-羟基丙酸 羟基丙酸 乳酸
COOH OH
2-羟基苯甲酸 邻羟基苯甲酸 水杨酸
COOH HO OH OH
3,4,5-三羟基苯甲酸 没食子酸
COOH CHOH CHOH COOH
2,3-¶¶¶¶¶¶ ¶ ù á , '¶¶¶¶¶¶ ¶ ù á ¶¶á ¶
COOH CHOH CH2 COOH
2-¶¶¶¶¶ ¶ù á ¶¶¶¶¶ ¶ù á ¶¶¶ á
CH2COOH HO-C-COOH CH2COOH
第十四章 羧酸盐

CH3-C-COOH O
9
5. β−酮酸的反应: 比α−酮酸更易脱羧。 酮酸更易脱羧。 酮酸的反应:
丁酮酸只在低温下稳定, β −丁酮酸只在低温下稳定,在室温以上即脱羧。 微热
CH3-C-CH2COOH CH3-C-CH3 + CO2 O O O H OH O O -CO2 R—C R—C R—C—CH3 C=O CH2 CH2
+ CH3CH2COCHCOOC2H5 CH3 B
CH3CH2CH2COCHCOOC2H5 CH2CH3 A
+ CH3CH2CH2COCHCOOC2H5
+ CH3CH2COCHCOOC2H5
C
CH3
D
CH2CH3
19
2、如果其中一个酯没有 、如果其中一个酯没有a-H,则可以得到单一产物。 其中一个酯没有 ,则可以得到单一产物。 例如:使用甲酸酯、苯甲酸酯、草酸酯( 例如:使用甲酸酯、苯甲酸酯、草酸酯(P.637)
酸性较强 等摩尔量的碱
不可逆
15
2、若酯只有一个 ,则需用更强的碱如ph3CNa、 、 酯只有一个α-H,则需用更强的碱 用更强的碱如 、
LDA、NaH和KH作催化剂。 、 作催化剂。 和 作催化剂
(CH3)2CHCOOC2H5 + (C6H5)3C- Na+ pKa ~ 25
Et2O
Na+ (CH3)2C- COOC2H5 + (C6H5)3CH pKa ~ 31.5
C2H5ONa(cat. amount) C2H5OH, 1800C C2H5ONa(cat. amount) C2H5OH 2CH3COOC2H5
CH3COCH2COOC2H5 O CH3 (CH3)2CH C C COOC2H5 CH3
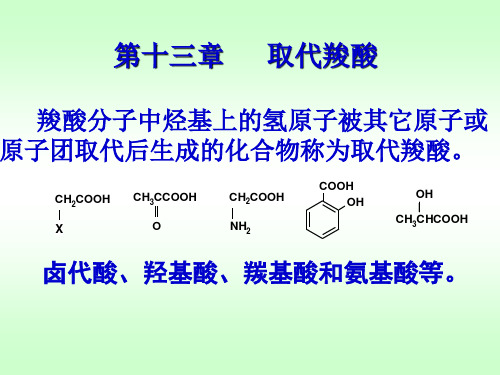
有机化学第十三章 取代羧酸
C HO 浓NaOH CH2OH COOH ’ COOH C anniz z aro 反 应 COOH + COOH
三
丙酮酸: 最简单的α -酮酸
CH3
O C COOH
CH3 CH3
O 浓 H2SO4 CO + CH3 COOH(脱羰) C COOH O 稀 H2SO4 CO + CH CHO (脱羧) 2 3 C COOH
OH O C6H5C=CHCCH 3 90.0%
2 乙酰乙酸乙酯的分解反应 稀OH-
O O CH3C-CH 2-COC 2H5
浓OH-
O CH3CCH3
酮式分解
O CH3C-OH + 其余 酸式分解
3 α-H的活性:被取代
O O CH3C-CH2-COC 2H5
RONa
O Na+ O CH3C-CH--COC 2H5
稀 OH -
CH3COCHC 2H5 CH3
1. 合成甲基酮 经乙酰乙酸乙酯合成:
引入基团
引入基团
CH3 CH3CO CHCH 2CH 3
CH3CO CH 2CH 3
分析:(1) 产物为甲基酮,合成时一定要经过酮式分解。 (2) 将TM的结构与丙酮进行比较,确定引入基团。 (3) 最后确定合成路线。
O C COOH
CO2
RCHO O
CO2
R
C
CH 3
四 醇酸的制备 1 α-羟基酸 羟基腈水解( “醛的化学性质”)
O R-C-R(H) + HCN
2 β-羟基酸(酯)
OH R-C-R(H) CN
H3O
+
OH α R-C-R(H) COOH
不饱和羧酸和取代羧酸
4
C
3
C
2
OH
+ HL
1,4 加成
OH C L C C C OH L CH C
O OH
HX
XCH2CH2COOH
卤代
H2O CH2 CH COOH HCN
OHCH2CH2COOH
羟基 氰基 氨基
CNCH2CH2COOH
NH3
NH2CH2CH2COOH
CH2
CH COOH + HN(CH2CH2COOH)2
方法改进: 碱性强,位阻大的LDA使烯醇化完全,而其本身又不与酯反应
O CH3COEt + [(CH3)2CH]2NLi
-+
THF
OLi CH2 C OEt
+ [(CH3)2CH]2NH
二异丙氨基锂(LDA) Li
O (CH3)2C CH2
OH
+
O C OEt OLi
O (CH3)2CCH2COEt H2O
3. 羟基睛的水解 分子中同时含有-OH 和-CN, 如何制备?
O CH3CH2CCH3 NaHSO3, NaCN
CH3 CH3CH2C CN OH
H+ CH3 CH3CH2C COOH OH
CH2 CH2 NaCN OH Cl
CH2 CH2 H+ OH CN
CH2CH2COOH OH
4. Reformatsky 反应
COOH OH
COOH
COOH
COOH
>
OH
>
H O O C
>
OH
pKa = 2.69
OH COOH
-
羟基和羧基邻位效应;共轭
第十五章不饱和羧酸和取代羧酸分析
COOH
cyclohexa-1,4-diene-1,2-dicarboxylic acid
华中农业大学理学院
第十五章不饱和羧酸和取代羧酸
三、 卤代酸 halocarboxylic acid
• 1、 卤代酸的制备: • 1)酰氯与HX NBS催化,再水解得α-卤酸; • 卤素红磷催化制备α-卤代酸。
2、卤代羧酸的性质 1)卤代羧酸的酸性 • 卤原子吸电子,酸性增强。 2)亲核取代反应(类似于卤代烃)
Br O NuR OH R OH Nu O
• Nu = 氢氧根、氰根、胺基。
华中农业大学理学院
第十五章不饱和羧酸和取代羧酸
3)用卤代羧酸制备其它取代羧
• 用不同试剂取代可以制备不同的取代羧酸。
Br O HO R Br OH O CN R Br OH O NH3 R OH R OH R H2N OH O
O HBr H5 C6 Cl NBS H5 C6 Cl Br O
H2O
Br
O
H5 C6
OH
O
Br
O
Br Br
H 5 C6 OH
P
H 5 C6
OH
华中农业大学理学院
第十五章不饱和羧酸和取代羧酸
2)β—位卤代酸的制备 α ,β-不饱和羧酸与卤化氢加成。
R HBr Br
OH O
R
OH
O
华中农业大学理学院
O
Br CH3
OH
O
AgO H2O
δ-hexanoic lactone
CH3
CH3
O O AgO H2O OH
O
ε-庚内酯 ε-heptanoic lactone
华中农业大学理学院
不饱和羧酸和取代羧酸
不饱和羧酸和取代羧酸
(Unsaturated carboxylic acid and Substituted carboxylic acid )
第十六章
不饱和羧酸和取代羧酸 (Unsaturated carboxylic acid and Substituted carboxylic acid )
H+ HO( CH2)5COO H
ε– 羟基己酸
K2CO 3
Br(CH 2)10COOH CH3COOE t
Br(CH 2)10COO
ω–卤代酸 (碳数在9以上)
O
C
(CH2)10 O
在极稀的溶液中进行
85%
大环内酯
24
2). 达让(Darzer)反应 指α-卤代酸酯在醇钠或氨基钠作用下与醛酮发生的 羟醛缩合反应,产物为αβ-环氧酸酯。
C6H5CHC Cl
ROH
Br
O
C6H5CHC OR
Br
20
2). β– 卤代酸
ቤተ መጻሕፍቲ ባይዱ
O
CH2 CH C OH + HX
CH2 CH2 COOH X
3). γ, δ 等卤代酸用二元羧酸的单酯发生汉斯狄克反应
O
AgNO 3 , KOH
O
ROC CH 2 n COOH
ROC CH 2 n COOA g
Br2 , CCl4
C6H5
H
CC
H
COOH
(E )–3–苯基丙烯酸 (肉桂酸)
H
H
CC
C6H5
COOH
(Z )–3–苯基丙烯酸
(异肉桂酸)
3
CH3(CH2)7CH CH( CH2)7COOH
有机化学讲义--第十三章羧酸和取代羧酸
羧酸和取代羧酸
羧酸(carboxylic acids):分子中含有羧基 (carboxyl)(-COOH)的有机化合物。羧酸 的官能团是羧基,除甲酸( HCOOH)外,都 可以看作烃中的氢被羧基取代的烃衍生物。
取代羧酸(substituted carboxylic acids): 羧酸分子中的烃基上的氢被其他原子或原子 团取代后的化合物。
一、分类和命名
羧酸是由烃基和羧基两部分构成。
1 、按照与羧基相连的烃基不同:脂肪酸、脂环酸和 芳香酸
2 、按照羧基数目不同:一元酸、二元酸和多元酸
3 、按照烃基饱和程度不同:饱和酸和不饱和酸;不 饱和酸又可分为烯酸和炔酸。 4 、取代羧酸包括卤代酸、羟基酸、氧代酸(羰基酸) 和氨基酸等。各类取代羧酸又可根据取代基和羧基的 相对位置,分为α-,β-,γ-,δ-等取代羧酸。
多官能团化合物的优先次序为: (优先,作母体)羧酸 > 磺酸 > 酸酐 > 酯 > 酰卤 > 酰胺 > 腈 > 醛>酮>醇>酚>胺>醚>烃 (后者作取代基)。
二、羧酸的制备
1、醇、醛的氧化:KMnO4, CrO3, 子中其他不饱和键没有影响) Ag2O(用于醛且对分
( O ) R C H O H R C O O H 2 ( O ) R C H O R C O O H
+ ( O H )
O R C O H+H L
H R C N R C O O H H O 2
三、物理性质
溶解性:丁酸以下与水混溶,5-11碳部分溶解;羧酸盐 溶解性好(表面活性剂)。 熔点呈锯齿状上升,偶数碳原子的熔点比它前后相邻两 个奇数碳原子同系物的熔点高,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十六章 不饱和羧酸和取代羧酸§1. 不饱和酸酸1. α,β-不饱和羧酸的制法⑴ 卤代酸去卤化氢α-卤代酸酯在碱性试剂存在下脱去卤化氢,生成α,β-不饱和羧酸酯。
例如:CH 3(CH 2)92CH 3CH 3Br160~170C H 3C(H 2C)9HC 2CH 3CH 3⑵ 芳香醛的缩合①Knoevenagel反应:芳醛在含少量的六氢吡啶的吡啶催化下,与丙二酸一起回流,直接得到α,β-不饱和羧酸。
C 6H 5CHO + CH 2(CO 2H)2pyridinepiperidine,110C,1hC 6H 5HC CHCO 2H + CO 2 + H 2O②Perkin 反应:C 6H 5CH=O +O O H 3C OCH 332-+C 6H 5HC CHCO 2H2. α,β-不饱和羧酸的反应① 1,4-加成H 2C CHCOHOO2CH 2CO 2H)2② 与共轭二烯烃反应+CO 2CH 2CH 3§2 卤代酸1. 卤代酸的制法①α-卤代酸用郝尔-沃耳霍德-泽林斯基反应制备,例如:CH 2OCHCCl O CHCOR O②β-卤代酸由α,β-不饱和羧酸与卤代氢的加成得到:RHC CHCOH O+ HXRCHCH 2COOH2. 卤代酸的反应α-卤代酸及其衍生物中路原子在羰基的影响下,活性增强,容易与各种亲核亲核试剂起反应,生成α-取代羧酸。
ClCH 2O+ Nu -NuCH 2COR O+ Cl -Nu - = HO - ,-CN , -NHR'§3. 醇 酸羧酸分子中饱和碳原子上有羟基的称谓醇酸。
一般根据其来源命名 如:CH 3CH(OH)COOHC 6H 5CH(OH)COOH HOOCH(OH)CH2COOHHOOCCH(OH)CH(OH)COOHHOOCCH 2COH(COOH)CH 2COOH乳酸扁桃酸苹果酸酒石酸柠檬酸1. 醇酸的性质和反应:醇酸分子中含有两个或两个以上的能参与氢键形成的官能团。
它们一般能溶于水,疏水支链或碳环的存在则使水溶性降低。
醇酸兼有醇和羧酸的反应,羟基与羧基的相对位置不同,还产生一些特殊的反应: (1) 脱水CH 3OHO22CH 3CHCOHOCOCH(OH)CH 3O- H OH 3CHC CO3C O O O 3,6-dimethyl-1,4-dioxane-2,5-dione如α-羟基所在的碳原子为叔碳原子,则在加热时生成α,β-不饱和羧和铜的混合物:R 1H 2CCC R 2OHOOHR 1HC C R 2COH O+O C R 2R 1H 2Cβ-醇酸在加热时容易脱水生成不饱和羧:OC RHCH 2C HORHC CH OOH + H 2Oγ-醇酸极易脱水变为环状的内酯:HOCH 2CH 2CH 2COHOCO + H 2OOγ-内酯为稳定的中性化合物,但遇热碱变为γ-醇酸盐:CO O + NaOHHOCH 2CH 2CH 2CO 2-Na +<2)与醛反应:α-和β-醇酸与醛一起加热,都生成环状化合物:RCHCOH O OH+ R'CHORHC CH O C OR'<3)α-和β-醇酸的降解:RR'CCOHO OH 24C OR'R + CO + H 2ORR'CCOHO OH242C OR'R + HCO 2H利用这个反应,可以从羧酸经过α-溴代酸合成高级醛:RCH 2O32RCHCOH O BrH ORCHCOH O OHH SO RCHO2. 醇酸的制法:(1) 一般法 醇酸可由二元醇的控制氧化或二元酸的还原得到:HOCH 2CH 2OH HNO 3,H 2O HOCH 2OHO 2C(CH 2)nCOOR催 化 剂HOCH 2(CH 2)nCOOR(2) 氰醇水解:C 6H 5CHO NaHSO ,NaCNC 6H 5CHCNHCl,H 2O C 6H 5CHCO 2HHOCH 2CH 2ClHOCH 2CH 2CNHPCH 2CH 2CO 2H(3> 环氧酮的氧化:OCH 3OOO H CH 3(1)NaOH,C H OH 3+CH 3CH(CH 2)4OOH§4 酚酸1. 水杨酸水杨酸在工业上有苯酚钠在加压下与二氧化碳反应,得到水杨酸钠,酸化后生成水杨酸:O -Na +OHCO 2Na3+OHCOOH水杨酸为无色晶体,微溶于水,与铁离子显红色,其酸性较强,可能是因为它的共轭碱能生成分子内氢键,其酸性增强:OHCOOHOO -O H+ H +加热时脱羧:OHCOOHOH+ CO 2溴化时,羧基被溴取代:OHCOOH2OHBrBr乙酰水杨酸即阿匹斯林<止痛药)的制备:OHCOOH+ (CH 3CO)2OC H NOCOCH 3COOH2. 对羟基苯甲酸对羟基苯甲酸在工业上由苯酚钾在190~200℃和加压下与二氧化碳反应得到:OK2(3)H 3O OHCOOH 对羟基苯甲酸在硝化时生成2,4,6-三硝基苯酚:OHCOOH+ HNO 3H SO NO 2O 2NNO 2OH+ CO 2§5.醛酸和酮酸<自学)§6.β-酮酸酯β-酮酸酯分子中羰基和酯基之间的亚甲基,受两个吸电子基团的影响而有很高的反应活性,称为活性亚甲基。
活性亚甲基上起烃化和酰化反应,从而转变为多种类型的化合物,在有机合成上有重要用途。
1.β-酮酸酯的合成 <1)Claisen 合成法:CH 32O 322CH 3CCH 2COEt O O + CH 3CH 2OH CH 3CH 2COCH 2CH 3O322O CH 3CH 2CCCOCH 2CH 3O O CH 3反应历程为:CH 3O+ CH 3CH 2O-CH 2O+ CH 3CH 2OHOOOCH 22CH 32CH 3OCH 3CCH 2COEt O O+ EtO-(2> Dieckmann 缩合法: 分子内的酯缩合反应。
H 2C CH 2CO 2CH 2CH 3C OOCH 2CH 3CH CH O -H 2C CHCO 2CH 2CH 3C O OCH 2CH 3CHCOOCH 2CH 3C-OOCH 2CH 3CH CH O -H 2CCH O COOCH 2CH3-2CH 32CH 3<3)酮和酯的缩合 :有α-H 的酮所产生的烯醇盐可以同没有α-H 的酯缩合:CH 3CH 22CH 3O+O(1)NaOH (2)H 2OOCOCH 2CH 3O如用别的没有α-H 的酯和酮缩合,则得到β-二酮:OOCH 2CH 3+OH 3C O CH 2O§7 乙酰乙酸乙酯和丙二酸酯在合成中的应用一、乙酰乙酸乙酯1.乙酰乙酸乙脂的互变异构现象: 实验事实:①乙酰乙酸乙酯与羰基试剂<苯胺 羟氨等 )反应,说明含有羰基。
②可与金属钠反应放出氢气,生成钠盐,说明分子中含有活性氢。
③可使溴的四氯化碳溶液褪色,说明分子中含有不饱和键。
④与三氯化铁呈紫色反应,说明分子中具有烯醇式结构。
若尔<L.Knorr)把乙酰乙酸乙酯冷到-78℃得到一种结晶形的化合物,熔点为-39℃,不和溴发生加成反应,不和三氯化铁发生颜色反应,但有酮的加成反应,这个化合物是酮式。
将乙酰乙酸乙酯与钠生成的化合物在-78℃用稍不足量的盐酸分解,将得到另一种结晶化合物,不和羰基试剂反应,使溴水褪色,这个化合物是烯醇式。
Knorr证明了酮式或烯醇式在低温时互变的速度很慢。
因此在低温时,纯的酮式或烯醇式可以保留一个时期。
另外,乙酰丙酮,因为氢原子的转移,也存在着酮式和烯醇式的互变。
它们之所以能形成稳定的烯醇型结构,一方面是因为两个羰基使亚甲基的氢特别活化,容易转移。
另一方面是因为烯醇型可以通过分子内氢键形成较稳定的六元环,使体系能量降低。
事实上酮类也有这样的互变异构的倾向,但烯醇型不稳定,平衡强烈的偏于酮的一方。
丙酮中仅含2.5×10-4 %的烯醇型。
2.乙酰乙酸乙酯在合成上的应用:乙酰乙酸乙酯的亚甲基很活泼,可以被其他基团取代,另一方面乙酰乙酸乙酯在不同的反应条件下可以分解成酸或酮。
因为以上特点,它成为有机合成的重要试剂。
用稀碱时,OH—较少,它只与酯基作用生成ß—羰基酸,ß--羰基酸和丙二酸相似,对热不稳定,要脱羧成甲基酮。
用浓碱时,OH-较多,他除了和酯基作用外,还和酮基作用,这样使乙酰乙酸乙酯在酮基处破裂生成两分子羧酸盐。
因为酸式水解时往往伴随着一些酮式水解,因此,合成羧酸最好是丙二酸酯合成法,乙酰乙酸乙酯合成法主要用于制甲基酮。
a> 亚甲基的取代i. 与卤代烷例:ii.与酰卤③与α--卤代酮④Robinson成环反应:⑤制甲基二酮<或二元酸)二、丙二酸二乙酯1.制法:2.丙二酸二乙酯在合成上的应用:其与乙酰乙酸乙酯类似,亚甲基上的氢可被醇钠所取代,本身水解后生成丙二酸不稳定,易于脱羧,这两条件使丙二酸二乙酯在合成各种类型的羧酸中有广泛的应用。
<1>与RX反应:*RX最好是伯卤代物,用仲卤代物时产量低,因为这里是负碳离子对卤代物进行亲核取代反应<S N2)乙酰乙酸乙酯制备长链酸,一般来说酸的产率是好的,但按成本计,丙二酸酯用于合成长链酸更为合算,<《科学技术百科全书》第8卷P323)<2>与α-卤代酸酯反应:<3>与α,ω-二卤代物反应:例1:2mol丙二酸酯于1molα,ω-二卤代物反应。
例2:等mol的丙二酸酯与α,ω-二卤代物作用只用于三、四元环化合物的制备。
<4>Michacl加成<5>与水杨醛反应香豆素由perkin synthesis制得。
<6>丙二酸酯的镁盐与酰氯作用丙二酸二乙酯的酰基化常用镁代替钾、钠,反应在非质子溶剂<苯、乙醚)中进行。
这是因为乙醇镁和活泼亚甲基化合物形成的镁盐都可溶于这些溶剂中。
<7>丙二酸酯钠盐与I2 作用总结:它们和相应的亲电试剂<)反应,可得到相应的丙酮取代物和乙酸取代物。
三、 C-烷基化和O-烷基化前面提到的乙酰乙酸乙酯烷基化反应主要发生在碳上。
实际上,无论简单的羰基化合物还是1,3-二羰基化合物,在进行烷基化时,C-烷基化和O-烷基化都有可能。
若<i)和<ii)都是稳定的,彼此不能互变,二者的产量比例取决于二者的反应速度,动力学控制。
如果二者可以互变,产物比例取决于二者的相对稳定性,稳定性高的为主要产物,热力学控制。
影响C-烷基化和O-烷基化的几个因素<动力学控制):1.溶剂化效应<溶剂和分子或离子通过静电力而结合的作用称为溶剂化效应)一个负离子的亲核性在很大程度上决定与溶剂化作用程度,溶剂化程度较低的亲核体的活性比溶剂化程度较高的要强。
