(周玉娟)物料守恒
化学中物料守恒的概念教案

化学中物料守恒的概念教案化学中的物料守恒是指在化学反应中,化学物质的质量不会产生净变化的原理。
它是化学反应中的一个重要基本原理,对于分析和预测反应结果具有重要的意义。
本文将详细介绍化学中物料守恒的概念、相关实验和应用方面的内容。
一、物料守恒的概念物料守恒是指在化学反应中,参与反应的各种化学物质的质量总和在反应前后保持不变。
换言之,在封闭环境中的化学反应中,反应物的质量等于产物的质量。
这是基于质量守恒定律的一个推论。
例子:如氢气与氧气反应生成水,反应方程式为:2H2(g) + O2(g) →2H2O(l)。
反应前后,氢气和氧气的质量分别为20g和40g,根据质量守恒定律,反应后水的质量应为60g。
因此,在实验中我们可以通过称量反应前的物质质量以及分析反应后物质的质量来验证物料守恒的原理。
二、实验验证物料守恒的方法1. 气体反应的验证:可以通过收集反应气体的方法来验证质量守恒。
例如,将一个精确称量的气球气体与另一个气球气体反应,在气体反应完成后,再重新称量两个气球的质量,通过对比质量变化来验证质量守恒。
需要注意的是,实验中要保证反应发生在封闭的容器中,以确保反应中没有外部物质的进入或流失。
2. 溶液反应的验证:可以通过经典的滴定反应来验证溶液反应的物料守恒。
例如,反应中两种溶液的体积(或浓度)之比为化学方程式中对应物质的系数之比。
通过控制反应前后溶液体积或浓度的变化,再结合滴定时的指示剂反应等实验方法,可以验证物料守恒。
三、物料守恒在化学实验中的应用物料守恒在化学实验中具有广泛的应用。
以下列举几个常见的应用场景:1. 反应物质的浓度计算:在化学实验中,我们常常需要计算反应物质的浓度。
通过物料守恒的概念,我们可以利用质量守恒定律来计算反应物质的浓度。
例如,在酸碱滴定实验中,通过反应前后酸碱溶液的体积变化和质量守恒的原理,可以计算出反应物的浓度。
2. 反应的理论产量计算:在化学反应中,理论产量是指在理想条件下,反应物完全转化为产物时的产物质量。
物料守恒例子

物料守恒例子
(原创实用版)
目录
1.物料守恒的概念
2.物料守恒的例子
3.物料守恒的实际应用
正文
【1.物料守恒的概念】
物料守恒是指在一个封闭系统中,物质的数量不会发生变化。
也就是说,在一个封闭系统中,物质的进入和离开必须保持平衡,系统中的总物质量保持不变。
【2.物料守恒的例子】
我们可以通过一个简单的例子来理解物料守恒。
假设我们有一个封闭的容器,里面装有 100 克的水。
现在,我们向容器中加入了 50 克的盐。
在这个过程中,虽然容器中的物质种类发生了改变,但是总物质量仍然是100 克。
最后,容器中的盐水总质量为 150 克,其中水的质量为 100 克,盐的质量为 50 克。
可以看出,容器中的物质总量没有发生变化,这就是物料守恒的体现。
【3.物料守恒的实际应用】
物料守恒在生产和生活中有着广泛的应用。
例如,在化工厂生产过程中,需要对原料、半成品和成品的物料流量进行监控,以保证生产过程的物料守恒。
如果某个环节的物料流量出现问题,可能会导致生产过程的紊乱,甚至产生安全隐患。
因此,物料守恒对于化工厂的正常生产具有重要意义。
此外,物料守恒在农业生产中也具有重要应用。
合理施肥、灌溉和耕
作,可以保持土壤中的营养物质平衡,保证农作物的产量和质量。
总之,物料守恒是自然界普遍存在的规律,对于人类社会的生产和生活具有重要意义。
化学守恒法在2008年高考中的应用

电荷守恒在高考中的应用安庆石化一中孙远征在化学解题中,守恒法是基本方法之一。
最基础的一个是质量守恒定律,也就是从宏观上来说,在化学反应前后,反应物和生成物的质量之和相等;从微观上来说,反应前后,原子的种类和个数不变。
除了质量守恒定律之外,我们还会接触和应用到能量守恒、电子守恒、电荷守恒、化合价守恒、元素守恒等,守恒法的应用使得我们对问题的分析更加轻松、快捷、准确。
在众多的守恒法中,电荷守恒无疑是质量守恒定律之外,在高中化学学习中最常用的守恒法之一。
在2008年的高考中,各地的高考题中几乎都有电荷守恒的题目。
一、电荷守恒的基本内容在离子化合物(或溶液)中,阴离子所带负电荷总数=阳离子所带正电荷总数。
根据这一基本内容,它可以根据物质中正负电荷的物质的量,计算出阴、阳离子的物质的量之间的关系式;它也可以根据单位体积溶液中电荷的物质的量求算出阴、阳离子的物质的量浓度之间的关系式。
二、高考中电荷守恒的应用1、溶液中阴、阳离子浓度的关系判断[例1](08广东卷)盐酸、醋酸和碳酸氢钠是生活中常见的物质。
下列表述正确的是()A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO 2和OH-3 B.NaHCO3溶液中:e(H+)+e(H2CO3)=c(OH-)C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同解析:根据电荷守恒:C(H+)+C(Na+)=C(HCO3-)+2C(CO32-)+C(OH-)物料守恒:C(Na+)=C(HCO3-)+ C(CO32-)+C(H2CO3)两式相减得:C(H+)+C(H2CO3)=C(CO32-)+C(OH-) 所以B错误。
答案:C[例2](08天津卷)醋酸溶液中存在电离平衡CH3COOH错误!未找到引用源。
物料守恒例子

物料守恒例子物料守恒是化学领域的基本原理之一,它描述了在化学反应中,质量在封闭系统中的总量保持不变的规律。
这意味着在反应中,反应物的质量将转化为产物的质量,而总质量保持不变。
本文将通过两个具体的例子,来解释和展示物料守恒的原理和应用。
例子一:燃烧木材燃烧木材是一个典型的物料守恒的例子。
当我们点燃一块木材时,它会燃烧并产生火焰和烟雾。
观察这个过程,我们可以发现木材在燃烧前后的质量没有发生变化。
首先,我们将一块木材放在天平上称重,记为m1。
然后将木材点燃,直至完全燃烧。
在燃烧过程中,木材逐渐被氧气氧化,生成二氧化碳和水蒸气,造成木材的质量减少。
当火焰熄灭后,我们再次将残余物称重,记为m2。
通过计算可得燃烧过程中木材质量的变化量△m = m1 - m2。
接下来,我们将注意力转向了产生的烟雾。
我们会注意到,在燃烧过程中产生的烟雾往往比木材本身还要重。
这是因为燃烧过程中木材的一部分质量被转化为了烟雾,导致了总体质量的增加。
这再次验证了物料守恒的原则。
以上例子清楚地展示了物料守恒的原理。
在这个过程中,木材在燃烧前后的总质量保持不变,其中一部分被转化为烟雾而增加,而另一部分被氧气氧化为二氧化碳和水蒸气而减少。
例子二:铁的氧化另一个物料守恒的例子是铁的氧化。
当生铁(铁的一种形态)暴露在空气中时,会与氧气发生反应,生成氧化铁。
我们首先将一块生铁放在天平上称重,记为m1。
然后将生铁暴露在空气中,观察一段时间后再次称重,记为m2。
通过计算可得铁的质量变化量△m = m1 - m2。
观察结果发现,在生铁暴露在空气中,质量的减少量与氧气中的氧气质量相等。
这是因为铁原子与氧气反应,形成氧化铁。
这个过程再次证明了物料守恒的原理,质量在化学反应中保持不变。
通过这两个例子,我们可以清楚地理解和应用物料守恒的原理。
无论是燃烧木材还是铁的氧化,反应中质量的变化量都符合物料守恒的规律。
这个原理不仅在化学实验中有着广泛的应用,也在日常生活中提供了重要的指导作用。
守恒法在高中化学解题中的应用———以化学反应与能量为例

A. H2 的键能为 436 kJmol - 1
B. O 2 的 键 能 大 于 H 2 O 2 中 氧 氧 单 键 的 键 能
C. 解离氧氧单键所需能量:HOO < H2 O2
1 键能守恒
例题 1 (2022 年浙江卷 18 题) 标准状态下ꎬ
H2 O
可根据 HO( g) + HO( g) H2 O2 ( g) 计算出
218 kJmol
-1
就 能 够 得 到 H2
的 键 能 为
Ⅱ. CO(g) + H2 O(g)
CO2 (g) + H2 (g)
①下列操作中ꎬ能提高 CH4 (g) 平衡转化率的是
218 kJmol - 1 × 2 = 436 kJmol - 1 ꎬ所 以 选 项 A 正
(填编号).
就可以 知 道 O2 的 键 能 是 为 249 kJ mol - 1 × 2 =
理化解题研究ꎬ2021(28) :112ꎬ封 3.
中学生数理化( 教与学) ꎬ2021(1) :94.
H2 Oꎬ所以电极的反应式为
— 144 —
Copyright©博看网. All Rights Reserved.
[ 责任编辑:季春阳]
(上接 48 页) 长为 30 的正三角形ꎬ所以外接圆的半
径为 3 . 以港口为极点建立极坐标系( 如图 11) . 所
.
4
所以 当 θ = -
75 ( 3 + 2 )
.
的2 倍
进行分析.
O2
D. H2 O( g) + O( g)H2 O2 ( g)
ΔH = - 143 kJmol - 1
收稿日期:2023 - 02 - 05
质量守恒定律的习题

有关质量守恒定律的理解和应用陕西洋县马畅中学周云英质量守恒定律是最基本的化学规律,它从量的方面研究化学反应。
初中化学的学习是从质量守恒定律开始,由定性的了解走向定量的研究。
命题形式主要有以下几个方面:1、根据质量守恒定律解释有关化学反应现象,常以简答题形式出现。
2、利用反应前后原子的种类和数目守恒推断化学式,多以选择题或推断题形式出现。
3、根据反应前后元素质量守恒确定物质的组成元素。
4、根据质量守恒定律进行物质质量的计算。
近几年中考命题中还出现了以质量守恒定律为内容的探究性试题和以研究质量守恒为内容的跨学科试题。
一知识点回顾:1、质量守恒定律的内容:参加化学反应的各物质的,等于反应后生成的各物质的,这个规律叫做。
2、质量守恒定律的实质:化学反应的过程就是参加反应的原子而生成其他物质的过程。
在化学反应中原子的没有改变,没有增减,也没有改变,所以化学反应前后必然相等。
3、理解质量守恒定律,抓住:“五个不变”、“两个一定改变”,“两个可能改变”五个不变:宏观:物质总质量不变元素种类不变微观:原子种类不变原子数目不变原子质量不变两个改变:宏观:物质的种类一定改变微观:分子种类一定改变两个可能变:宏观:元素的化合价可能改变微观:分子总数可能改变5、运用质量守恒定律解释现象的一般步骤:(1)说明化学反应的反应物和生成物;(2)根据质量守恒定律摆出参加反应的和生成的各物质的质量关系;(3)与题目中实验现象相联系,说明原因。
二、基本题型:(一)质量守恒定律内容和实质的考查1、在反应A+B→C+D中,A与B参加反应的质量比为4∶3,生成的C和D的质量和为2.8g,则参加反应的B的质量为()。
A.0.3 g B.0.9g C.1.2g D 1.6g2、化学反应遵循质量守恒定律的原因是,反应前后()A.分子种类没有改变B.分子数目没有改变C.原子种类和数目没有改变D.物质种类没有改变3、宣传科学知识,揭露“伪科学”是我们的义务。
物料守恒知识点总结

物料守恒知识点总结一、物料守恒的基本概念物料守恒是指在一个封闭系统中,系统内的物质总量在任何过程中都会保持不变。
在一个封闭系统中,物质是不允许从系统内逸出的,因此系统的总物质量必须保持恒定。
物料守恒是能量守恒原理的延伸,能量守恒原理指的是在封闭系统中,系统的能量总量也是保持不变的。
物料守恒原理适用于各种物质系统,包括气体、液体和固体等不同状态的物质。
在物料守恒的原理下,可以得出一个经典的物料守恒方程,即质量守恒方程。
质量守恒方程描述了一个封闭系统中物质的流动和转化过程。
这个方程可以表示为:\[\frac{dM}{dt} = \sum_{i}(\dot{m_i})_{in} - \sum_{i}(\dot{m_i})_{out} + \dot{m_{gen}}\]式中,\(\frac{dM}{dt}\)是系统中物质质量随时间的变化率,\((\dot{m_i})_{in}\)表示物质i的流入速率,\((\dot{m_i})_{out}\)表示物质i的流出速率,\(\dot{m_{gen}}\)表示物质的产生速率。
这个方程说明了,在任何封闭系统中,系统中的物质质量变化率等于流入物质的总量减去流出物质的总量再加上物质的产生速率。
这个方程的体现了物料守恒原理,即系统中的总物质量是恒定的。
在实际应用中,这个方程可以用来对生产过程进行分析和优化,对工程系统进行设计和改进,以及对环境问题进行评估和控制。
二、物料守恒方程的应用物料守恒方程是工程系统分析和设计中的基本工具之一。
在许多工程领域,都需要对物质的流动和转化过程进行分析和控制,这时物料守恒方程就显得非常重要。
物料守恒方程可以应用于很多不同的领域,下面将就一些典型的应用来进行介绍。
1. 化工工程在化工工程中,物料守恒方程通常用于对化工过程进行分析和设计。
化工过程涉及到许多不同的物质的流动和转化,如化学反应、溶解、气体吸收与脱附等。
对于这些过程,物料守恒方程可以描述不同物质的流入流出及转化过程,从而可以对工艺参数进行优化和控制。
变化中的守恒守恒中的变化
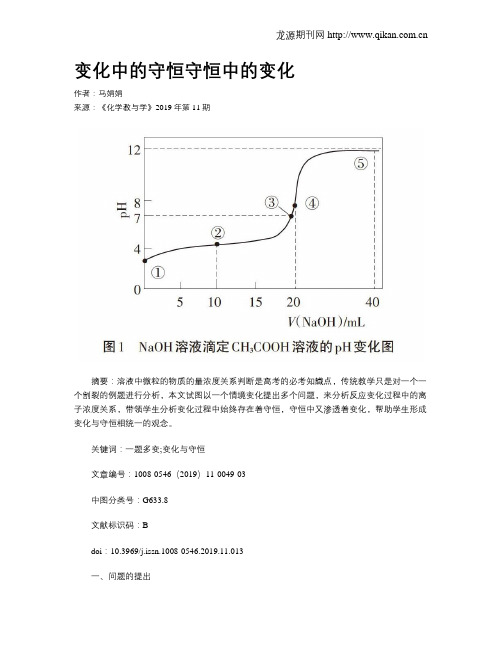
变化中的守恒守恒中的变化作者:马娟娟来源:《化学教与学》2019年第11期摘要:溶液中微粒的物质的量浓度关系判断是高考的必考知識点,传统教学只是对一个一个割裂的例题进行分析,本文试图以一个情境变化提出多个问题,来分析反应变化过程中的离子浓度关系,带领学生分析变化过程中始终存在着守恒,守恒中又渗透着变化,帮助学生形成变化与守恒相统一的观念。
关键词:一题多变;变化与守恒文章编号:1008-0546(2019)11-0049-03中图分类号:G633.8文献标识码:Bdoi:10.3969/j.issn.1008-0546.2019.11.013一、问题的提出在近几年的高考化学试卷中,溶液中微粒的物质的量浓度关系判断已然成为一个必考的知识点,这也是学生学习电解质溶液中离子浓度的一个难点。
此类传统题型的试题,涉及到了电离理论、水解理论、守恒思想、平衡思想、元素观、微粒观、定量观等理论知识和化学核心观念,自从实施新课程以来,便赋予了新课程的特色,此类题可以有效地测试学生的综合应用能力和处理图表信息能力。
以往,大部分老师在进行这部分教学时,都是对相关的知识点进行总结归纳(两个理论、三个守恒),然后根据不同的电解质溶液类型,举相关的一个例题进行讲解说明。
其实对于大多数学生而言,单一溶液中的微粒大小关系和守恒关系很容易判断,难就难在反应过程中的离子浓度变化分析。
本文试图通过对一个反应在变化过程中离子浓度大小进行分析,发现即使是变化的反应中始终存在着守恒,守恒中又渗透着变化。
以一个情境变化提出多个问题,一题多变来帮助学生提升析题解题的能力,帮助学生形成变化与守恒相统一的观念。
二、“一题多变”的设计原则“一题多变”相信对于许多教师而言,都是极为熟悉的词语。
特别是理科教师运用得最为广泛和得心应手。
一题多变重点在于对某个问题进行多层次、多角度、多方位的探索。
一题多变对培养学生发散思维有极大的帮助,是学生创新思维的必备前提,也是一种良好的学习品质。
