物理化学上册简单状态变化的熵变课件PPT
合集下载
基础化学教学课件:3.4.2 熵和热力学第三定律

S
2
S
m,Cl 2 (g)
m,HCl(g)
2 (g)
= 130.68+223.07-2×186.7
= -19.65( J·mol−1 ·K−1)
推动反应自发进行的因素
一、系统能量降低的趋势
二、系统混乱度增大的趋势
孤立系统,没有能量交换
混乱度增大,熵增加。
熵增原理
在孤立系统中发生的自发过程总是向熵增大的方向进行,平衡时达到最大值,又
熵和热力学第三定律
推动反应自发进行的因素
一、能量降低的趋势
二、混乱度增大的趋学热力学
具有广延性质的状态函数
熵表示系统中微观粒子运动混乱度(有序性
的反义词)的热力学函数。
用“S”表示
单位:J·K-1
熵的基本规律
系统的混乱度越大,熵值就越大;系统内越有序,熵值就越小。
< S (l ) < S (g)
一、同一种物质的不同聚集状态
S (s)
二、同一种物质的相同聚集状态
S 低温 < S高温
三、绝对零度时,任何纯物质完美晶体的熵值等于零
不可能达到
不存在
S高压 < S 低压
热力学第三定律
混乱
熵
无序
复杂
生命过程
熵增
环境破坏
熵增
环境治理
熵变的计算
熵是状态函数
• 熵变 ∆S 的大小只取决于系统的始态和终态,与变化的途径无关。
θ
2HCl(g) = H2(g) + Cl2(g)
解:根据公式得
Δ rSθm (T ) ν BSθm (生成物 ) - ν BSθm (反应物 )
查表得
S mθ (J K 1 mol1 )
物理化学课件-第2章 热力学第二定律

T2 T1 R T2
2.卡诺热机的效率只与热源温度有关,而与工作 介质无关。
证明卡诺定理1:
卡诺定理
熵
熵变计算 自由能 热力学关系
G计算
习题课
11
反证法 假定I > R 则W’ > W T2 使卡诺热机R逆转,并与 Q2 热机I联合运行 即可实现从单一热源吸 W ' I 热而连续不断做功的第 Q1 ' 二类永动机,但这是不 可能的。所以I < R T
卡诺定理 熵 熵变计算 自由能 热力学关系 G计算 习题课
21
一、简单状态变化
1. 任何物质 p、V、T变化 dU = Q + W = Qr + Wr (设计可逆过程) = Qr –pdV (只做体积功) Qr = dU + pdV = dH- Vdp dS = Qr /T = dU/T +(p/T)dV = dH/T-(V/T)dp ( )V dS =(dU)V/T= nCV,mdT/T ( )p dS =(dH)p/T= nCp,mdT/T
卡诺定理 熵 熵变计算 自由能 热力学关系 G计算 习题课
三、热传导过程
20
求算S的依据:
1.熵是系统的状态性质, S只取决于始终态,
而与变化途径无关;
2.无论是否是可逆过程,在数值上
dS =Qr/T; (Qr=TdS)
因此需设计可逆过程,求Qr
3.熵是容量性质,具有加和性。
S=SA +SB
根据卡诺定理,I R
Q1 Q2 + 0 T1 T2
V
Qi 则 S A B T
或 dS
Qi
T
卡诺定理
各种熵变的计算 PPT课件PPT文档59页

60、人民的幸福是至高无个的法。— —西塞 罗
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 ቤተ መጻሕፍቲ ባይዱ 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
各种熵变的计算 PPT课件
56、极端的法规,就是极端的不公。 ——西 塞罗 57、法律一旦成为人们的需要,人们 就不再 配享受 自由了 。—— 毕达哥 拉斯 58、法律规定的惩罚不是为了私人的 利益, 而是为 了公共 的利益 ;一部 分靠有 害的强 制,一 部分靠 榜样的 效力。 ——格 老秀斯 59、假如没有法律他们会更快乐的话 ,那么 法律作 为一件 无用之 物自己 就会消 灭。— —洛克
55、 为 中 华 之 崛起而 读书。 ——周 恩来
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 ቤተ መጻሕፍቲ ባይዱ 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
各种熵变的计算 PPT课件
56、极端的法规,就是极端的不公。 ——西 塞罗 57、法律一旦成为人们的需要,人们 就不再 配享受 自由了 。—— 毕达哥 拉斯 58、法律规定的惩罚不是为了私人的 利益, 而是为 了公共 的利益 ;一部 分靠有 害的强 制,一 部分靠 榜样的 效力。 ——格 老秀斯 59、假如没有法律他们会更快乐的话 ,那么 法律作 为一件 无用之 物自己 就会消 灭。— —洛克
55、 为 中 华 之 崛起而 读书。 ——周 恩来
物理化学03章_热力学第二定律(二)

Ssys = 19.14 J K
Ssur = 0
1
(系统未吸热,也未做功)
Siso = Ssys + Ssur = 19.14 J K 1 > 0
(2)为不可逆过程.
例2:在273 K时,将一个 22.4 dm3 的盒子用隔板一分为二,
0.5 mol 0.5 mol O2 (g) N2 (g)
p1 V1 p2 V2 T2 p2 V2 ∵ = ∴ = T1 T2 T1 p1V1
V2 p2V2 ∴ S = nR ln + nCV ,m ln V1 p1V1
V2 p2 V2 = nR ln + nC V ,m ln + nC V ,m ln V1 p1 V1
p2 V2 ∴ S = nCV ,m ln + nC p ,m ln p1 V1
因为在可逆相变中压力恒定,所以可逆热即为相 因为在可逆相变中压力恒定, 变焓.又由于温度一定,所以, 变焓.又由于温度一定,所以,物质 B 由 α 相态 转化为 β 相态
p ,T B (α ) → B ( β )
的相变熵为: 的相变熵为:
β α H β α S = T
用上式,可计算正常熔点下的熔化熵, 用上式,可计算正常熔点下的熔化熵,正常 沸点下的蒸发熵等等. 沸点下的蒸发熵等等.
= TC S > 0
Q W
热源
R2
TC
1
W2
Q W2
TB热源做功能力低于TA
TB热源做功能力低于TA
其原因是经过了一个不可逆的热传导过程 功变为热是无条件的,而热不能无条件 地全变为功. 热和功即使数量相同,但"质量"不等, 功是"高质量"的能量. 高温热源的热与低温热源的热即使数量相 同,但"质量"也不等,高温热源的热"质量" 较高,做功能力强. 从高"质量"的能贬值为低"质量"的能 是自发过程.
物理化学第五版第三章课件

2
相邻两个卡诺曲线可以相互抵消 当曲折线趋于无穷小时:
1
b
O
V
∑
δ Qi
Ti
= ∫
δ Qr
T
=0
∫
δ Q T
r
= 0 =
∫
1
⎛ δQ ⎜ ⎝ T
r
⎞ ⎟ + ⎠a
∫⎜ ⎝
2
1
⎛ δQ T
r
⎞ ⎟ = 0 ⎠b
把此状态函数定义为熵,用S表示。
∴
∫⎜ ⎝
1
2
⎛ δQ T
r
⎞ ⎟ = − ⎠a
2
∫⎜ ⎝
熵函数的引出最形象的方法是由卡诺定理推出。 (1)卡诺(Carnot): 法国工程师, 于1824年发表了《关于火的动 力之见解》一书, 书中介绍了一种在两个热源间工作的可逆 热机, 即卡诺热机, 并提出卡诺热机的效率最大, 此效率与 工作物质无关, 只与两热源的温度有关, 此书的基本结论即 为卡诺定理. (2)卡诺当时是用热质论来证明卡诺定理的, 后来 Kelvin 和 Clausius对卡诺的工作进行了修正, 用热力学第二定律重新 证明了卡诺定理.
由于可逆过程进行时,系统时时处 于无限接近的平衡状态,因此等式 可以看作是已达到平衡态的标志
1→ 2
∑
δ Q ir
T
=
2
∫ 1
(
δ Q ir
T
)α <
( ∫ 1
δ Qr
T
)β = ∆ S
可逆
2 克劳修斯 不等式
封闭 系统
则:
δQ ∆S ≥ ∫ T 1
> 不可逆 =可 逆
δQ dS ≥ T
> 不可逆 =可 逆
相邻两个卡诺曲线可以相互抵消 当曲折线趋于无穷小时:
1
b
O
V
∑
δ Qi
Ti
= ∫
δ Qr
T
=0
∫
δ Q T
r
= 0 =
∫
1
⎛ δQ ⎜ ⎝ T
r
⎞ ⎟ + ⎠a
∫⎜ ⎝
2
1
⎛ δQ T
r
⎞ ⎟ = 0 ⎠b
把此状态函数定义为熵,用S表示。
∴
∫⎜ ⎝
1
2
⎛ δQ T
r
⎞ ⎟ = − ⎠a
2
∫⎜ ⎝
熵函数的引出最形象的方法是由卡诺定理推出。 (1)卡诺(Carnot): 法国工程师, 于1824年发表了《关于火的动 力之见解》一书, 书中介绍了一种在两个热源间工作的可逆 热机, 即卡诺热机, 并提出卡诺热机的效率最大, 此效率与 工作物质无关, 只与两热源的温度有关, 此书的基本结论即 为卡诺定理. (2)卡诺当时是用热质论来证明卡诺定理的, 后来 Kelvin 和 Clausius对卡诺的工作进行了修正, 用热力学第二定律重新 证明了卡诺定理.
由于可逆过程进行时,系统时时处 于无限接近的平衡状态,因此等式 可以看作是已达到平衡态的标志
1→ 2
∑
δ Q ir
T
=
2
∫ 1
(
δ Q ir
T
)α <
( ∫ 1
δ Qr
T
)β = ∆ S
可逆
2 克劳修斯 不等式
封闭 系统
则:
δQ ∆S ≥ ∫ T 1
> 不可逆 =可 逆
δQ dS ≥ T
> 不可逆 =可 逆
大学无机化学之化学熵页PPT文档

体系有趋向于最大混乱度的倾向,系 统混乱度增大有利于反应自发地进行。
体系的混乱度热力学上以物理量“熵”来表示。 2.熵和微观状态数
熵是表示体系中微观粒子混乱度的一个 热力学函数,其符号为S。
体系的混乱度愈大,熵愈大。 熵是状态函数。 熵的变化只与始态、终态有关,而与途 径无关。
微观状态数:
3 分子(3位置)
△ rHm= 178.32kJ·mol-1 H2O(l) 10 0 CH2O(g)
△ rHm= 44.0kJ·mol-1 焓变只是影响反应自发性的因素之一,
但不是唯一的影响因素。
1.5.3 混乱度、熵和微观状态数
1.混乱度 许多自发过程有混乱度增加的趋势。
• 冰的融化 • 建筑物的倒塌
在所有温度下,反应正 能向进行。 ② H0, S0 高温时,反应正向进行 。 ③ H0, S0 低温时,反应正向进行 。 ④ H0, S0
在所有温度下反应不正 能向进行。
广西大学化学化工学院
在标准态下,当:
无 △G<0 反应正向自发;
机
△G>0 反应正向非自发,但逆向自发;
Gibbs 函 数(变)判据: 在定温定压下,任何自发变化总是
系统的Gibbs 函数减小。 G0 反应是自发的,进能行正;向
G0 反应是非自发的向,进能行逆 G0 反应处于平衡状态。
G受温度的影响
G=H-TS 定 温 变 化 : G H T S
① H 0 , S 0 , G 0
r G m r H m 2K 9 T r 8 S m 2K 98
当rGm 0时,
T转rrH Sm m2299K 8K 8
例:
已知298.15K时的热力学数据如下:
体系的混乱度热力学上以物理量“熵”来表示。 2.熵和微观状态数
熵是表示体系中微观粒子混乱度的一个 热力学函数,其符号为S。
体系的混乱度愈大,熵愈大。 熵是状态函数。 熵的变化只与始态、终态有关,而与途 径无关。
微观状态数:
3 分子(3位置)
△ rHm= 178.32kJ·mol-1 H2O(l) 10 0 CH2O(g)
△ rHm= 44.0kJ·mol-1 焓变只是影响反应自发性的因素之一,
但不是唯一的影响因素。
1.5.3 混乱度、熵和微观状态数
1.混乱度 许多自发过程有混乱度增加的趋势。
• 冰的融化 • 建筑物的倒塌
在所有温度下,反应正 能向进行。 ② H0, S0 高温时,反应正向进行 。 ③ H0, S0 低温时,反应正向进行 。 ④ H0, S0
在所有温度下反应不正 能向进行。
广西大学化学化工学院
在标准态下,当:
无 △G<0 反应正向自发;
机
△G>0 反应正向非自发,但逆向自发;
Gibbs 函 数(变)判据: 在定温定压下,任何自发变化总是
系统的Gibbs 函数减小。 G0 反应是自发的,进能行正;向
G0 反应是非自发的向,进能行逆 G0 反应处于平衡状态。
G受温度的影响
G=H-TS 定 温 变 化 : G H T S
① H 0 , S 0 , G 0
r G m r H m 2K 9 T r 8 S m 2K 98
当rGm 0时,
T转rrH Sm m2299K 8K 8
例:
已知298.15K时的热力学数据如下:
大学化学课件:熵变与过程(反应)的方向

当固体升温至熔点时,结构粒子运动在很大程度上 克服了它们之间的引力而发生一次剧烈变化,即由晶格 点上的振动变成无固定位置的自由流动,混乱度也经历 了一个突变,液体状态比固体状态有更大的混乱度,继 续加热,液体中结构粒子运动加剧,混乱度也有相应的 渐变。
待液体升温至沸点时,又发生一次突变,即结构粒 子获得足够的能量,基本完全克服它们之间的引力而进 入完全无秩序的气态分子混乱运动状态。同一物质三态 中,气体状态具有最大的混乱度。
2. 同一种聚集态的同类型分子,分子结构越复杂,熵 值越大。
比如,由相同原子组成的分子中,分子中原子数 目越多,熵值越大。
3. 同一种物质,S(高温) > S(低温)。
4. 对气态物质,S(低压) >S(高压)。
在恒定T下,且各组分均处于标准状态下, 某反应0=∑νBB的熵变,即温度T时该反应的标 准摩尔反应熵。
r
H
O m
(298.15K)
yH
O m
(Y, g, 298.15K)
zH
O m
(Z,s, 298.15K)
aH
O m
(A,
g,
298.15K)
bH
O m
(B,
s,
298.15K)
【例2-8】 试求下面两个化学反应的熵变。
Hg(l)
1 2
O2
(g)
HgO(s)
(1)
Zn(s) + 2H+(aq) Zn2+(aq)+H2(g),
r
H
m
(298.15K)
-517513..696kJ
·mol-11
H2O(s)=H2O(l), ∆H>0 101.325 kPa和高于273.15 K时,冰可以自发变
大学物理热力学——熵(课件)
1b 2
0
P
1a 2
1b 2
1 a
b
2
1
d Q 与过程无关,意味着系统存 在一个态函数,将该态函数 T 称为熵。
O
2
V
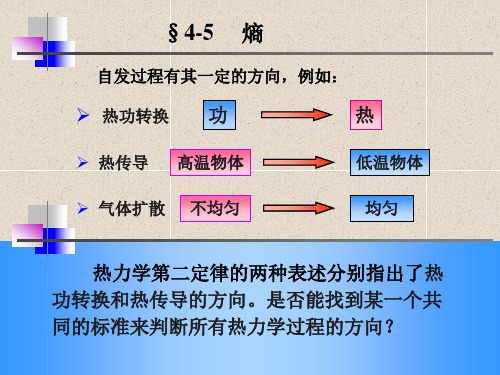
§4-5
熵
以 S1、S2 分别表示系统在状态1 和状态2 的熵, 系统由状态1变到状态2 ,熵的增量等于沿连接初态 和终态的任一可逆过程热温比的积分
S 2 S1
2
§4-5
三、熵增量的计算
熵
(2)0 ℃ 的水被加热到100 ℃,熵的变化 设计一个可逆过程:系统与一系列温差无限 小的热源依次接触,无限缓慢升温。
S3 S2
2
3d
Q
T
2
3
3 mc
dT
T
4 . 18 10
373
dT T
373 273 1 . 30 10 (J/K)
3
273
2 T T T ( S 2 S1 ) ( S 3 S 2 )
1
3
dQ
1
2
dQ
3d Q
2 .52 10 (J/K)
3
§4-5
熵
dQ d E P d V
三、熵增量的计算 方法2:熵是态函数,与过程无关,可通过设计中 间状态,用等值过程热温比的积分来求熵变。 例4-7 1mol理想气体从(V1、 T1 )到(V2 、T2)求熵变。 (V1、T1 )
1
2
( V1、P1、T、S1) ( V2、P2、T、S 2)
设计一个等温膨胀过程连接状态1、2
S 2 S1
2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
S3
n H2O
(l, 100℃, 101325 Pa)
S2
n H2O
(g, 100℃, 101325 Pa)
S S1 S2 S3
1.平衡温度、压力下的相变化过程
平衡温度、压力下的相变化是可逆的相变化过程。 定温、定压、且W′= 0 定温可逆 S nH m
Qp H
T
2.非平衡温度、压力下的相变化过程 设计可逆途径进行计算。
16
【例】
n H2O
(l, 90℃,101325 Pa)
S1
S =?
n H2O
(g, 90℃, 101325 Pa)
V2 1 S系 nR ln 57.6 J K V1 V2 S环 nR ln 57.6 J K 1 T V1 S隔 S系 S环 0
6
Qsy
10mol理想气体由298K、1dm3定温膨胀到2dm3, 计算系统、环境和隔离系统的熵变。设为:(1)可
逆膨胀;(2)向真空膨胀。 解:(2)向真空膨胀
V2 S系 nR ln 57.6 J K 1 V1 S环 Qsy T 1 S隔 S系 S环 57.6 J K >0
7
0
2. 定压变温过程
无论过程是否可逆,都可以按定压可逆途径计算。
δQp dH nCp , mdT S δQp T
VA VB S B nB Rln VB
VA VB VA VB mix S nA Rln nB Rln VA VB
13
理想气体定温、定压下的混合过程
A nA T, p,VA
B nB T, p,VB
A+B nA+ nB T, p, VA+VB
VA VB VA VB mix S nA Rln nB Rln VA VB
S p nC p ,m ln T 2 T1
S S p ST
p1 ST nR ln p2
12
理想气体定温、定压下的混合过程
A nA T, p,VA
B nB T, p,VB
A+B nA+ nB T, p, VA+VB
mix S SA SB
VA VB S A nA Rln VA
作
业
二、计算题及证明(推导)题
P83:1-1 1-2 1-3
P84:1-6 1-r dS T S
B A
δQr T
热力学第二定律的数学表达式
δQ 不可逆 δQ 不可逆 S 或 dS A T Tsu 可逆 su 可逆
B
熵增原理
不可逆 S绝热 0 可逆 或 不可逆 dS绝热 0 可逆
10
4. p、V、T都改变的过程
(1)先定温后定容
V2 T2 S nR ln nCV ,m ln V1 T1
p
p1
A(p1,V1, T1 )
(2)先定温后定压
p1 T2 S nR ln nC p ,m ln p2 T1
p2
B(p2 ,V2 , T2 )
(3)先定压后定容
V2 p2 S nC p ,m ln nCV ,m ln V1 p1
时进行定温定压混合,设H2和CH4都可视为理想气 体,求混合熵△mixS。
解:
mix
S nA RlnyA nB RlnyB
0.041 yA 0.66 0.041+0.021 yB 1 yA 0.34 mix S 0.33J K 1
15
相变化过程熵变的计算
4
一.简单状态变化的熵变
1.定温过程 无论过程是否可逆,都按定温可逆途径计算。 理想气体 U 0
Q W
δQ r δW dS T T V2 p1 S nR ln nR ln V1 p2
5
【例】
10mol理想气体由298K、1dm3定温膨胀到2dm3,
计算系统、环境和隔离系统的熵变。设为:(1)可 逆膨胀;(2)向真空膨胀。 解:(1)定温可逆膨胀
VA VB yA, yB VB VA VA VB mix S R nBlnyB
mix S nA RlnyA nB RlnyB
14
【例】
mix S R nBlnyB
0.041 molH2(g)和0.021 molCH4(g)在298K,101kPa
2
熵判据
自发 S隔离 0 平衡 或 自发 dS隔离 0 平衡
S隔离 S系 S环 0 dS隔离 dS系 dS环 0
环境熵变的计算
Ssu
Qsy Tsu
3
系统熵变的计算
S
B
可逆过程
A
δQr T
终态
始态
不可逆过程?
S
设计可逆过程
9
4. p、V、T都改变的过程
pV nRT
一定量理想气体从 A(p1,V1,T1)改变到 B(p2,V2,T2) 这种情况用一步无法计算,要由两种可逆过程的 加和求得。
V2 T2 (1)先定温后定容 S nR ln nCV ,m ln V1 T1 p1 T2 (2)先定温后定压 S nR ln nC p ,m ln p2 T1 V2 p2 (3)先定压后定容 S nC p ,m ln nCV ,m ln V1 p1
T1
V1
T2
V2
V
11
【例】
0.5molO2气体从293K冷却到193K,同时压力从100kPa
升高到 6MPa,求系统熵变ΔS。 已知Cp,m(O2) = 29.36J· K-1· mol-1。 解: 0.5 mol O 2
293K,100kPa ΔSp 0.5 mol O2 193K,100kPa ΔS 0.5 mol O2 193K,6MPa ΔST
T2 T1
nCp , mdT T
若将Cp,m视为常数
T2 S nC p ,m ln T1
8
3. 定容变温过程
无论过程是否可逆,都可以按定容可逆途径计算。
δQV dU nCV ,m dT
T 2 nCV ,m dT δQV S T1 T T
若将CV,m视为常数
T2 S nCV ,m ln T1
n H2O
(l, 100℃, 101325 Pa)
S2
n H2O
(g, 100℃, 101325 Pa)
S S1 S2 S3
1.平衡温度、压力下的相变化过程
平衡温度、压力下的相变化是可逆的相变化过程。 定温、定压、且W′= 0 定温可逆 S nH m
Qp H
T
2.非平衡温度、压力下的相变化过程 设计可逆途径进行计算。
16
【例】
n H2O
(l, 90℃,101325 Pa)
S1
S =?
n H2O
(g, 90℃, 101325 Pa)
V2 1 S系 nR ln 57.6 J K V1 V2 S环 nR ln 57.6 J K 1 T V1 S隔 S系 S环 0
6
Qsy
10mol理想气体由298K、1dm3定温膨胀到2dm3, 计算系统、环境和隔离系统的熵变。设为:(1)可
逆膨胀;(2)向真空膨胀。 解:(2)向真空膨胀
V2 S系 nR ln 57.6 J K 1 V1 S环 Qsy T 1 S隔 S系 S环 57.6 J K >0
7
0
2. 定压变温过程
无论过程是否可逆,都可以按定压可逆途径计算。
δQp dH nCp , mdT S δQp T
VA VB S B nB Rln VB
VA VB VA VB mix S nA Rln nB Rln VA VB
13
理想气体定温、定压下的混合过程
A nA T, p,VA
B nB T, p,VB
A+B nA+ nB T, p, VA+VB
VA VB VA VB mix S nA Rln nB Rln VA VB
S p nC p ,m ln T 2 T1
S S p ST
p1 ST nR ln p2
12
理想气体定温、定压下的混合过程
A nA T, p,VA
B nB T, p,VB
A+B nA+ nB T, p, VA+VB
mix S SA SB
VA VB S A nA Rln VA
作
业
二、计算题及证明(推导)题
P83:1-1 1-2 1-3
P84:1-6 1-r dS T S
B A
δQr T
热力学第二定律的数学表达式
δQ 不可逆 δQ 不可逆 S 或 dS A T Tsu 可逆 su 可逆
B
熵增原理
不可逆 S绝热 0 可逆 或 不可逆 dS绝热 0 可逆
10
4. p、V、T都改变的过程
(1)先定温后定容
V2 T2 S nR ln nCV ,m ln V1 T1
p
p1
A(p1,V1, T1 )
(2)先定温后定压
p1 T2 S nR ln nC p ,m ln p2 T1
p2
B(p2 ,V2 , T2 )
(3)先定压后定容
V2 p2 S nC p ,m ln nCV ,m ln V1 p1
时进行定温定压混合,设H2和CH4都可视为理想气 体,求混合熵△mixS。
解:
mix
S nA RlnyA nB RlnyB
0.041 yA 0.66 0.041+0.021 yB 1 yA 0.34 mix S 0.33J K 1
15
相变化过程熵变的计算
4
一.简单状态变化的熵变
1.定温过程 无论过程是否可逆,都按定温可逆途径计算。 理想气体 U 0
Q W
δQ r δW dS T T V2 p1 S nR ln nR ln V1 p2
5
【例】
10mol理想气体由298K、1dm3定温膨胀到2dm3,
计算系统、环境和隔离系统的熵变。设为:(1)可 逆膨胀;(2)向真空膨胀。 解:(1)定温可逆膨胀
VA VB yA, yB VB VA VA VB mix S R nBlnyB
mix S nA RlnyA nB RlnyB
14
【例】
mix S R nBlnyB
0.041 molH2(g)和0.021 molCH4(g)在298K,101kPa
2
熵判据
自发 S隔离 0 平衡 或 自发 dS隔离 0 平衡
S隔离 S系 S环 0 dS隔离 dS系 dS环 0
环境熵变的计算
Ssu
Qsy Tsu
3
系统熵变的计算
S
B
可逆过程
A
δQr T
终态
始态
不可逆过程?
S
设计可逆过程
9
4. p、V、T都改变的过程
pV nRT
一定量理想气体从 A(p1,V1,T1)改变到 B(p2,V2,T2) 这种情况用一步无法计算,要由两种可逆过程的 加和求得。
V2 T2 (1)先定温后定容 S nR ln nCV ,m ln V1 T1 p1 T2 (2)先定温后定压 S nR ln nC p ,m ln p2 T1 V2 p2 (3)先定压后定容 S nC p ,m ln nCV ,m ln V1 p1
T1
V1
T2
V2
V
11
【例】
0.5molO2气体从293K冷却到193K,同时压力从100kPa
升高到 6MPa,求系统熵变ΔS。 已知Cp,m(O2) = 29.36J· K-1· mol-1。 解: 0.5 mol O 2
293K,100kPa ΔSp 0.5 mol O2 193K,100kPa ΔS 0.5 mol O2 193K,6MPa ΔST
T2 T1
nCp , mdT T
若将Cp,m视为常数
T2 S nC p ,m ln T1
8
3. 定容变温过程
无论过程是否可逆,都可以按定容可逆途径计算。
δQV dU nCV ,m dT
T 2 nCV ,m dT δQV S T1 T T
若将CV,m视为常数
T2 S nCV ,m ln T1
