高中化学放电顺序表
高中化学:电解池知识点

高中化学:电解池知识点一. 电解池工作原理及其应用1. 原电池、电解池的判定先分析有无外接电源:有外接电源者为电解池,无外接电源者可能为原电池;然后依据原电池、电解池的形成条件、工作原理分析判定。
2. 电解电极产物的判断:要判断电极反应的产物,必须掌握离子的放电顺序。
判断电极反应的一般规律是:(1) 在阳极上①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不容易在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时,溶液中阴离子的放电顺序是:S2->I->Br->Cl->OH->含氧酸根>F-(2) 在阴极上:无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。
阳离子在阴极上放电顺序是:Ag+ > Fe3+ > Cu2+ > H+(酸)> Pb2+> Sn2+> Fe2+> Zn2+ > H+(水)> Al3+> Mg2+>……3. 用惰性电极进行溶液中的电解时各种变化情况分析二. 电解原理在工业生产中的应用1.电解精炼反应原理(电解精炼铜)阳极(粗铜,含Fe、Zn、C等):Cu-2e—=Cu2+,阴极(纯铜):Cu2++2e—=Cu工作一段时间后,溶液中电解质的成分CuSO4、ZnSO4、FeSO4,Cu2+的浓度减小。
2.电镀池:镀铜反应原理阳极(纯铜):Cu-2e—=Cu2+,阴极(镀件):Cu2++2e—=Cu溶液中的Cu2+浓度保持不变。
3.氯碱工业反应原理↑,阳极:2Cl—-2e—=Cl2阴极:2H++2e—=H↑2三. 电化学计算的基本方法原电池和电解池的计算包括两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数测定的计算、根据电荷量求产物的量与根据产物的量求电荷量等的计算。
不论哪类计算,均可概括为下列三种方法:(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路中转移的电子数相等。
电解时离子放电顺序

电解时离子放电顺序一、放电的概念放电:阴离子失去电子而阳离子得到电子的过程叫放电。
二、离子放电顺序1、决定离子放电顺序的因素:①离子得失电子的能力②离子的浓度③电极材料多种阴阳离子分别移向阴极阳极时,优先放电的是:氧化性、还原性强的离子2、电极反应(1)阴极:(阳离子得电子)Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+(2)阳极:(阴离子失电子)若阳极是活泼金属(金属活动顺序表Ag以前),溶液中的阴离子一律不放电,而是电极材料失电子。
注:电解题优先看阳极材料若阳极是惰性(Pt、Au、石墨),则放电顺序如下:S2->I->Br->Cl->OH->含氧酸根离子3、电解规律(用惰性电极电解时)⑴、电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液时,实质上是电解水。
如电解H2SO4、HNO3、NaOH、Na2SO4等溶液时其电极反应式为:阳极:4OH--4e-=2H2O +O2↑阴极:4H+ +4e-=2H2 ↑总反应:2H2O =O2↑ +2H2↑电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可。
⑵、电解无氧酸溶液(氢氟酸除外)、不活泼金属的无氧酸盐溶液时,实质上是电解质本身被电解。
如电解盐酸、CuCl2溶液等时。
电解盐酸阳极:2Cl --2e-=Cl2↑阴极:2H+ +2e-=H2 ↑总反应:2HCl =Cl2↑ + H2↑电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的溶质(通入一定量的HCl气体)。
⑶、电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解,如电解CuSO4溶液、AgNO3溶液等。
电解CuSO4溶液阳极:4OH--4e-=2H2O +O2↑阴极:2Cu2+ +4e-=2Cu总反应:2CuSO4 +2H2O =2Cu+O2↑ +2H2SO4电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。
电解时离子放电顺序

电解时离子放电顺序一、放电的概念放电:阴离子失去电子而阳离子得到电子的过程叫放电。
二、离子放电顺序1、决定离子放电顺序的因素:①离子得失电子的能力②离子的浓度③电极材料多种阴阳离子分别移向阴极阳极时,优先放电的是:氧化性、还原性强的离子2、电极反应(1)阴极:(阳离子得电子)Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+(2)阳极:(阴离子失电子)若阳极是活泼金属(金属活动顺序表Ag以前),溶液中的阴离子一律不放电,而是电极材料失电子。
注:电解题优先看阳极材料若阳极是惰性(Pt、Au、石墨),则放电顺序如下:S2->I->Br->Cl->OH->含氧酸根离子3、电解规律(用惰性电极电解时)⑴、电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液时,实质上是电解水。
如电解H2SO4、HNO3、NaOH、Na2SO4等溶液时其电极反应式为:阳极:4OH--4e-=2H2O +O2↑阴极:4H+ +4e-=2H2 ↑总反应:2H2O =O2↑ +2H2↑电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可。
⑵、电解无氧酸溶液(氢氟酸除外)、不活泼金属的无氧酸盐溶液时,实质上是电解质本身被电解。
如电解盐酸、CuCl2溶液等时。
电解盐酸阳极:2Cl --2e-=Cl2↑阴极:2H+ +2e-=H2 ↑总反应:2HCl =Cl2↑ + H2↑电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的溶质(通入一定量的HCl气体)。
⑶、电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解,如电解CuSO4溶液、AgNO3溶液等。
电解CuSO4溶液阳极:4OH--4e-=2H2O +O2↑阴极:2Cu2+ +4e-=2Cu总反应:2CuSO4 +2H2O =2Cu+O2↑ +2H2SO4电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。
高中化学经常用到的规律
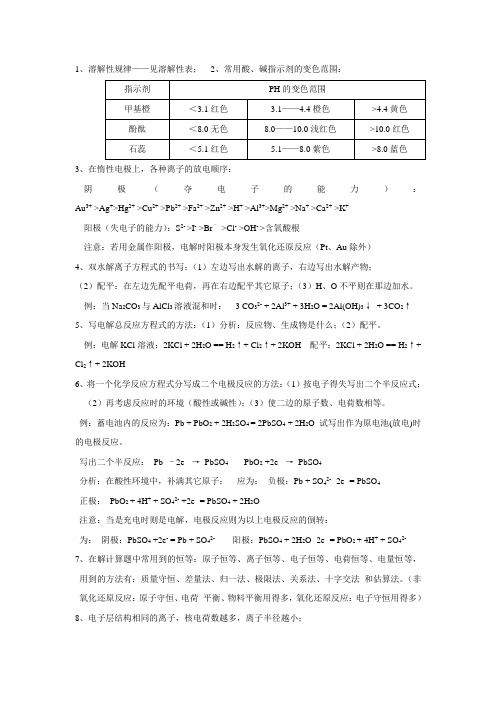
1、溶解性规律——见溶解性表;2、常用酸、碱指示剂的变色范围:3、在惰性电极上,各种离子的放电顺序:阴极(夺电子的能力):Au3+ >Ag+>Hg2+ >Cu2+ >Pb2+ >Fa2+ >Zn2+ >H+ >Al3+>Mg2+ >Na+ >Ca2+ >K+阳极(失电子的能力):S2- >I- >Br–>Cl- >OH- >含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)4、双水解离子方程式的书写:(1)左边写出水解的离子,右边写出水解产物;(2)配平:在左边先配平电荷,再在右边配平其它原子;(3)H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时: 3 CO32- + 2Al3+ + 3H2O = 2Al(OH)3↓+ 3CO2↑5、写电解总反应方程式的方法:(1)分析:反应物、生成物是什么;(2)配平。
例:电解KCl溶液:2KCl + 2H2O == H2↑+ Cl2↑+ 2KOH 配平:2KCl + 2H2O == H2↑+ Cl2↑+ 2KOH6、将一个化学反应方程式分写成二个电极反应的方法:(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O 试写出作为原电池(放电)时的电极反应。
写出二个半反应:Pb –2e- →PbSO4 PbO2 +2e- →PbSO4分析:在酸性环境中,补满其它原子:应为:负极:Pb + SO42- -2e- = PbSO4正极:PbO2 + 4H+ + SO42- +2e- = PbSO4 + 2H2O注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:为:阴极:PbSO4 +2e- = Pb + SO42-阳极:PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42-7、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。
高中化学规律知识点总结

高中化学规律知识点总结 化学是一门非常有趣的学科,有很多都是贴近生活的。
在生活中的应用是非常的广泛的。
下面小编整理了高中化学规律知识点总结,希望对你有帮助。
高中化学知识点归纳总结--规律 1、溶解性规律——见溶解性表;2、常用酸、碱指示剂的变色范围:指示剂PH的变色范围甲基橙;4.4黄色酚酞;10.0红色石蕊;8.0蓝色3、在惰性电极上,各种离子的放电顺序:阴极(夺电子的能力):Au3+ >;Ag+>;Hg2+ >;Cu2+ >;Pb2+ >;Fa2+ >;Zn2+ >;H+ >;Al3+>;Mg2+ >;Na+ >;Ca2+ >;K+阳极(失电子的能力):S2- >;I- >;Br– >;Cl- >;OH- >;含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)4、双水解离子方程式的书写:(1)左边写出水解的离子,右边写出水解产物;(2)配平:在左边先配平电荷,再在右边配平其它原子;(3) H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时:3 CO32- + 2Al3+ + 3H2O = 2Al(OH)3↓ + 3CO2↑ 高中化学知识点归纳总结--规律 1、写电解总反应方程式的方法:(1)分析:反应物、生成物是什幺;(2)配平。
例:电解KCl溶液:2KCl + 2H2O == H2↑ + Cl2↑ + 2KOH配平:2KCl + 2H2O == H2↑ + Cl2↑ + 2KOH2、将一个化学反应方程式分写成二个电极反应的方法:(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O 试写出作为原电池(放电)时的电极反应。
人教版高中化学选修4-化学反应原理:象限法理解电解池的放电顺序

总反应式:CuCl2
Cu+Cl2 ↑
知识点探索---以惰性电极电解的基本类型
Ⅱ
Ⅰ
Ag+>Hg2+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+
S2->I->Br->Cl->OH->SO42->NO3->F-
知识点探索---以惰性电极电解的基本类型
Ⅱ
Ⅰ
Ag+>Hg2+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+
S2->I->Br->Cl->OH->SO42->NO3->F-
Ⅲ
Ⅳ
思考:
1、由Ⅱ 、 Ⅳ象限的离子组成的电解质
溶液,如CuSO4、AgNO3,在电解时阴、阳离 子分别应该是哪些离子放电?
Ⅲ
Ⅳ
思考:
1、由Ⅰ 、Ⅲ象限的离子组成的电解质溶 液,如NaCl、KBr,在电解时阴、阳离子分别 应该是哪些离子放电?
2、试写出其电极反应式和总反应式。
电解池电极反应式
以惰性电极电解的类型及电极反应式:
Ⅱ
Ⅰ
Ag+>Hg2+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+
Ⅲ
Ⅳ
知识点探索---以惰性电极电解的基本类型
Ⅱ
Ⅰ
Ag+>Hg2+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+
高中化学知识点总结 高考必背化学规律

高中化学知识点总结高考必背化学规律 化学是一门非常有趣的学科,有很多都是贴近生活的。
在生活中的应用是非常的广泛的。
对于理科生来说化学是理综里面的一部分,是非常重要的一门学科,对于文科生来说,最低要求就是及格了,下文是小编整理的高中化学知识点总结,看看高中化学有哪些必背的规律,仅供大家参考。
高中化学知识点规律总结1、溶解性规律——见溶解性表;2、常用酸、碱指示剂的变色范围:指示剂PH的变色范围甲基橙;4.4黄色酚酞;10.0红色石蕊;8.0蓝色3、在惰性电极上,各种离子的放电顺序:阴极(夺电子的能力):Au3+ >;Ag+>;Hg2+ >;Cu2+ >;Pb2+ >;Fa2+ >;Zn2+ >;H+ >;Al3+>;Mg2+ >;Na+ >;Ca2+ >;K+阳极(失电子的能力):S2- >;I- >;Br– >;Cl- >;OH- >;含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)4、双水解离子方程式的书写:①左边写出水解的离子,右边写出水解产物;②配平:在左边先配平电荷,再在右边配平其它原子;③H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时:3 CO32- + 2Al3+ + 3H2O = 2Al(OH)3↓ + 3CO2↑5、写电解总反应方程式的方法:①分析:反应物、生成物是什幺;②配平。
例:电解KCl溶液:2KCl + 2H2O == H2↑ + Cl2↑ + 2KOH配平:2KCl + 2H2O == H2↑ + Cl2↑ + 2KOH6、将一个化学反应方程式分写成二个电极反应的方法:①按电子得失写出二个半反应式;②再考虑反应时的环境(酸性或碱性);③使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O 试写出作为原电池(放电)时的电极反应。
电解池放电顺序

第3节 电解池
第2课时 放电顺序
一、课前回忆
1.电解的含义
2.以CuCl2为例说明电解的原理
还原反应
←e— ←e— 负极 正极
↓e—
↑e—
阴极 石墨||石墨 阳极
氧化反应
阳离子电解质溶液阴离子
Cu2++ 2e-=Cu
2Cl--2e-=Cl2↑
学一学练一练
写出电解水时阴阳极的 电极反应式
加油
减 小
增 大
通入 适量
HCl(g)
2.电解Na2SO4溶液
阳极
阴极
氧
氢
气
气
实例
电极反应
浓度 pH
复原
Na2SO4
阴极(H+、Na+) :4H ++ 4e- = 2H2↑
阳极(OH-、 SO42-): 4OH-- 4e- = 2H2O+O2↑
变 大
不 变
加 H2O
通电
2H2O == 2H2 ↑+O2 ↑
阳极:还原性强的离子先失电子(氧化反应)
金属(Pt、Au除外)>S2- >I- >Br- >Cl->OH-(水)>NO3>SO42- >F-
金属阳极先放电,离子后放电
我来挑战
写出用碳棒做电极,电解硝酸银溶液
的阴阳极反应式
1.分析溶液中的阴阳离子
Ag+、H+、NO3-、OH-
2.根据放电顺序确定反应的离 子 Ag+、OH-
3.电解NaOH溶液
阳极
阴极
氧
氢
气
气
实例
电极反应
