中科院考研物理化学乙2007-2009真题(附答案)
中科院2003-2009物化试题

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:物理化学(甲)考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
下列一些基本常数供解题时参考:普朗克常数h = 6.626 × 10-34 J·S;玻兹曼常数k B = 1.381× 10-23 J·K-1;摩尔气体常数R = 8.314 J·mol-1·K-1;法拉第常数F = 96500 C·mol-1一、是非题(每小题1分,共15分)(判断下列各题是否正确,正确用“√”表示,错误用“×”表示)1、气体的压力是在单位时间内撞击在单位表面上的分子所发生的动量的变化。
2、公式PVγ=常数,适用于理想气体的绝热可逆变化。
3、一定量的某实际气体,向真空中绝热膨胀以后,系统的P和V的乘积变小,温度降低,则此过程的ΔU < 0,ΔS > 0 。
4、将低沸点的A和高沸点的B两种纯液体组成液态完全互溶的气液平衡体系。
在一定温度下,将液体B加入体系中时,测得体系的压力增大,说明此系统具有最大正偏差。
5、水的三相点就是水的冰点。
6、溶剂服从拉乌尔定律、溶质服从亨利定律的溶液,称为理想稀溶液。
7、当反应A(s)→B(s)+D(g)达到化学平衡时,系统的自由度f = 3。
8、在合成氨反应中,惰性气体的存在不影响平衡常数,但影响平衡组成。
9、能量零点选择不同,则内能的值也不同。
10、无论是定位系统或非定位系统,最概然分布的公式是一样的。
11、对任一种有液接的浓差电池,加盐桥比不加盐桥的电动势大。
12、反应A + B = 2 C + 2 D 不可能是基元反应。
13、在同一温度下的同一基元反应,随着不同浓度单位,k (速率常数)有不同数值,从)exp()exp(RTH R S h T k k m r m r B θθ≠≠Δ−Δ=看,主要是因所取的标准态不同所引起的。
中科院中科大试题及答案

中国科学院——中国科学技术大学2003年招收攻读硕士学位研究生入学考试试题试题名称:物理化学一、选择题(共5题,10分)1.(2分)理想气体在恒定外压p 下,从10dm3膨胀到16dm3,同时吸热126J,计算此气体的△U. ( )(A)-284J (B)842J (C)-482J (D)482J2.(2分)下列宏观过程:()(1)p ,273K下冰融化为水;(2)电流通过金属发热;(3)往车胎内打气(4)水在101325Pa,375K下蒸发可看作可逆过程的是:(A)(1),(4)(B)(2),(3)(C)(1),(3)(D)(2),(4)3.(2分)298K时两个级数相同的反应Ⅰ,Ⅱ,活化能E I=E∏,若速率常数k1=10k∏,则两反应之活化熵相差:( )(A)0.6J·K-1·mol-1(B)10 J·K-1·mol-1(C)19 J·K-1·mol-1(D)190 J·K-1·mol-14.(2分)有人在不同pH的条件下,测定出牛的血清蛋白在水溶液中的电泳速度,结果如下:()pH 4.20 4.56 5.20 5.65 6.30 7.00 泳速/(μm2/s·V)0.50 0.18 -0.25 -0.65 -0.90 -1.25由实验数据可知:(A)该蛋白质的等电点pH>7.00 (B)该蛋白质的等电点pH<4.20(C)该蛋白质的等电点pH<7.00 (D)从上述实验数据不能确定等电点范围5.(2分)吸附理论主要用来描述:()(A)均相催化(B)多相催化(C)酸碱催化(D)酶催化二、填空题6.(2分)理想气体等温(T=300K)膨胀过程中从热源吸热600J,所做的功仅是变到相同终态时最大功的1/10,则体系的熵变△S = J·K-1。
7.(2分)在300K时,48.98dm3的理想气体从100kPa变到500KPa,体系的吉布斯自由能变化为kJ.8.(2分)从微观角度面言,熵具有统计意义,它是体系的一种量度。
2007考研 中科院《普通化学》真题

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:普通化学(甲)考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
一、选择题:(共42分;其中11,12,18每小题4分;其余每小题2分)1.在电解质的饱和溶液中,加入与原电解质含有共同离子的另外一种( )会使原来电解质的( )下降。
这是关于多相离子平衡的共同离子效应。
(A) 强电解质,溶解度;(B)易溶强电解质,溶解度:(C)电解度,解离度2.下列各个含氧酸中,属于二元酸的是( )。
(A)H 3PO 4; (B )H 3BO 3; (C )H 3PO 2; (D)H 3PO 3 3. 一个电子排布式1s 22s 22p 63s 23p 1 的元素最可能的价态是( )。
(A )+1; (B )+2; (C) +3; (D) -1; (E) -24. 如果NH 4OH 的电离常数为1.8×10-5, 0.1M NH 4OH 溶液中OH - 的浓度是多少(mol/L)?(A) 1.80×10-6 (B) 1.34×10-3 (C) 4.20×10-3 (D) 5.00×10-25.尼龙是哪两种物质的共聚物?(A)尿素和甲醛;(B)苯酚和甲醛;(C)1,6己二胺和己二酸; (D)氯乙烯和乙烯醇6. 假定NH 基呈平面的,并具有三个等价的氢原子,那么成键电子是如何杂化的?+3(A ) sp3; (B ) sp ; (C ) sp2; (D )sd 27. 某一反应在高温下不能自动进行,但在低温下能自动进行.则该反应的和为m r S Δm r H Δ (A) 0,0>Δ<Δm r m r S H ; (B) 0,0>Δ>Δm r m r S H ; (C) 0,0<Δ<Δm r m r S H ;(D)0,0<Δ>Δm r m r S H 8. 在多电子原子中,分别可用下列各组量子数表示相关电子的运动状态。
中科院07普通化学(乙)试题

2007年招收攻读硕士学位研究生入学统一考试试题辅导科目名称:普通化学(乙)课考生须知:正门对面1.本试卷满分为150分,全部考试时间总计180分钟。
业2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
研3.可以使用无字典存储和编程功能的电子计算器。
共一、济选择题(36分,每题2分) 48号共1.测量各种温度下0.1M KC2H3O2 溶液的pH值时发现,pH值随温度上升而增加。
据此,下述推论中哪个是正确的?彰武(A)高温下KC2H3O2的溶解度很小;(B)随着温度的升高KC2H3O2蒸发加剧;(C)KC2H3O2水解反应是一个吸热反应;(D)KC2H3O2水解反应是一个放热反应48号2.如果把醋酸钠固体加到醋酸的稀溶液中,则pH值将:辅导(A)升高;(B)不受影响;(C)下降;(D)先下降后升高;(E)先升高后下降kaoyantj3.下面列出了五种元素原子的电子构型,哪种构型的氧化态之一在水溶液中是无色的?辅导(A) 2 8 18 1; (B) 2 8 14 2; (C) 2 8 16 2; (D) 2 8 18 2 共济4.通常当聚合物分子的什么性质较强时,塑料有较高的强度和硬度?课(A)多晶型性;(B)无定形性;(C)无规立构性;(D)结晶度共济5.镧系收缩是指同济(A)镧系元素的离子半径;(B)镧系元素的核质量;(C)镧系元素的价电子:(D)镧系元素的电负性专6.碱金属和卤素生成的化合物具有最可能正确的预测性质是同济大学四平路(A)有一个低熔点;(B)难溶于水;(C)在固体中导电;(D)在熔融时导电7. 0.1N NaHCO3的pH值最接近下列哪个值( )。
(A)5.6; (B) 7.0; (C) 8.4; (D) 13.0; (E) 4.08.在实验室中,氢气通过下面哪种化合物管子时最容易被干燥?(A)CaCO3; (B) Ca3(PO4)2; (C) CaCl2; (D) Ca(OH)2; (E) MgCl29.用下列哪种轨道符号表示19K39?(A)1s22s22p62d102f1 (B) 1s22s22p63s23p9 (C) 1s22s22p63s23p6 4p1 (D) 1s22s22p63s23p64s1——————————————————————————————————————————————普通化学(乙)第 1 页共4 页10.固体溶于水时,其溶解热与下列哪两种能量的相对值有关?(A) 解离能和电离能;(B)晶格能和振动能;(C)解离能和水合能;(D)晶格能和电离能;(E)晶格能和水合能11.一种化合物含有54.6%的碳,9.1%的氢和36.6%的氧,化合物的实验式(最简单的)为(A)C3H6O; (B) C4H9O2; (C) C4H8O2; (D) C5H9O12. pH = 2的溶液比pH = 6的溶液酸性高多少倍?(A)4倍;(B)12倍;(C)400倍;(D)10000倍13.下列化合物中哪种酸性最强?(A)CH3COOH; (B) CH3CH2OH; (C) CH2ClCOOH; (D) CHCl2COOH; (E) CCl3COOH14. 完全中和30毫升2M 的磷酸需要45毫升的氢氧化锂,氢氧化锂的摩尔浓度为多少?(A)1.3;(B)2.7;(C)5.0;(D)4.015.结晶热在数值上与下列哪一种热相等?(A)生成热;(B)溶解热;(C)蒸发热;(D)熔融热;(E)升华热16.原子的电子构型为1s22s22p63s23p6 3d104s24p5时,它的最可能的价态为:(A)-1;(B)-3;(C)+1;(D)+3;(E)+517.在开发新能源的探索中,氢被认为是一种理想的二级能源.目前认为,最有发展前途的制氢方法是(A)电解水制氢(B)水煤气制氢;(C)太阳光光解水制氢;(D)硅与苛性钠作用制氢;18.对于电子波动性的正确理解是下面哪些?(A)物质波;(B)电磁波;(C)机械波;(D)概率波;二、填空题(50分)1.(6分)高熔点金属是指熔点等于或者高于()的熔点(K)的金属,这些金属都集中在d区的( )、( )、( )、( )族中。
2007年中国科学院研究生院高分子化学与物理考研试题

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:高分子化学与物理考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
高分子化学部分一、 名词解释(共10分,每小题2分)1遥爪聚合物2悬浮聚合3聚合物立构规整度4活性聚合反应5. 接枝反应效率二.选择题(每题选一最佳答案,每小题2分,共20分)1.下列烯烃能通过自由基聚合获得高分子量聚合物的是。
a. CH3CH=C(CN)COORb. CH2=CH-CH3c. CF2=CF2d. CH2=C(C6H5)22. 甲基丙烯酸甲酯在25℃进行本体自由基聚合当转化率达到20%时出现了自动加速现象这主要是由于所致。
a. 链段扩散速度增大因而增长速率常数kp值增大b. 长链自由基运动受阻使终止速率常数k值明显减小c. 增长速率常数kp值的增加大于终止速率常数k值的减小d. 时间的延长3. 聚苯乙烯具有的特点。
a. 不透明b. 抗冲性能差c. 加工困难d. 不易着色4. 乳液聚合中,如果选用软脂酸钠(C15H31COONa)为乳化剂,其三相平衡点为62℃则聚合反应应该选择条件下进行。
a. 低于62℃b. 62℃c. 高于62℃5. 茂金属催化剂催化烯烃聚合具有的特点。
a. 多活性中心催化活性高b. 单活性中心聚合产品具有很好的均一性c. 多活性中心催化共聚能力优异d. 单活性中心对极性单体具有较好的催化活性科目名称:高分子化学与物理第1页共4页6. 在适当引发剂存在的条件下,引发下列单体的自由基聚合反应属于非均相聚合的是a. 水相中丙烯腈的溶液聚合b. 苯乙烯的本体聚合c. 二甲基甲酰胺中丙烯腈的溶液聚合d. 苯中苯乙烯的溶液聚合7.以C 4H 9Li 为引发剂分别选用THF 和甲苯为溶剂引发苯乙烯聚合实验发现,在THF 中苯乙烯聚合反应速率要大为了提高甲苯中苯乙烯的聚合速率,可加入a. BF 3b. SnCl 4c. TiCl 4d. 18-冠醚-68. 下列环状单体中容易进行开环聚合的是a.环戊烷b. 四氢呋喃c. 1,4-二氧六环d. 八甲基环四硅氧烷9. 在-78℃条件下以三氟化硼-乙醚引发体系使乙烯基丁基醚聚合最为合适的溶剂是a. 丙酮b. 乙酸乙酯c. 乙醚d. 氯甲烷10. 当线性聚酯化反应进行到95%以后若继续进行反应则会是 a. 分子量分布变窄 b. 聚合度迅速增大c. 反应程度迅速增大d. 产生大量低分子量副产物三、问答题(共25分)1.试述传统自由基聚合反应的主要优点与主要缺点写出一种目前较为成功的活性/可控自由基聚合方法的名称。
中国科学院大学2007年硕士研究生入学考试《物理化学(乙)》试题

中国科学院研究生院2007 年招收攻读硕士学位研究生入学统一考试试题科目名称:物理化学(乙)考生须知:1.本试卷满分为 150 分,全部考试时间总计 180 分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
下列一些基本常数供解题时参考:普朗克常数 h = 6.626 × 10-34J·S;玻兹曼常数 k B = 1.381× 10-23 J·K-1;摩尔气体常数 R = 8.314 J·mol -1·K-1;法拉第常数 F = 96500 C·mol-1一、是非题(每小题 1 分,共 10 分)(判断下列各题是否正确,正确用“√”表示,错误用“⋅”表示)1.由理想气体混合物组成的体系属于独立子体系。
2.若电池反应12 H 2( p H2)+12 Cl2( p H2)= H +(a H+)+ Cl −(a Cl−)的标准电动势为Eθ,则电池反应 H2( p H2)+ Cl2( p H2)=2H +(a H+)+2Cl −(a Cl−)的标准电动势为2Eθ。
3.反应级数一定是简单的正整数。
4.体系的同一状态不能具有不同的体积。
5. 某理想气体进行绝热自由膨胀,其热力学能的变化U = 0,H = 0。
6.在封闭体系内发生任何绝热过程的 S 一定大于零。
7.多相多组分系统达到相平衡时,每个组分在各相的化学势相等。
8.对于一理想溶液,μA<μA*。
9.C Hθm (C2 H5OH, g) = C Hθm(C2H5OH, l)+vap Hθm(C2H5OH)10.粒子的半径大于入射光波长时可观察到丁铎尔效应。
二、选择题(60 分)(1-24 题为单选题,每小题 2 分,共 48 分;25-28 题为多选题,每小题 3 分,共 12 分)1.“封闭系统恒压过程中系统吸收的热量 Qp 等于其焓的增量 H”,这种说法(A)正确;(B)需加无非体积功的条件;(C)需加可逆过程的条件;(D)需加可逆过程和无非体积功的条件;2.下列过程中系统的 G≠0 的是:(A)水在0℃、常压下结成冰;(B) 水在其正常沸点汽化(C)NH4Cl(s) → NH3(g)+HCl(g)(D)100℃、大气压下液态水向真空蒸发为同温同压下的气态水3.理想气体从同一始态出发,分别经(1)绝热可逆膨胀,(2)多方膨胀,达到同一终态体积 V2,则熵变 S(1)和 S(2)之间的关系为(A)S(1)>S(2)(B)S(1)<S(2)(C)S(1) =S(2)(D)S(1)与S(2)无确定关系4.对于反应物和生成物都是理想气体的化学反应,其△H 与△U 的关系如何?(A) △H >△U(B) △H<△U(C) △H =△U(D) 不能确定5.质量分数为 0.58%的 NaCl 水溶液的沸点接近于下列哪个溶液的沸点?(A) m B=0.2 mol·kg-1的蔗糖水溶液;(B) 0.58%的萄糖水溶液(C) m B=0.01 mol·kg-1的葡萄糖水溶液;(D) 0.58%的蔗糖水溶液6. 气体反应 CO + H2O=CO2 + H2 ,设各气体皆为实际气体,此反应的r G m和r G θm与体系总压有何关系?(A)r G m和r G θm皆与体系总压无关(B) r G m和r Gθm皆与体系总压有关(C)r G m与体系总压有关,r G θm与总压无关(D)r G m与体系总压无关,r G θm与总压有关7. 在 732K 时,反应 NH4Cl(s) = NH3(g) + HCl(g) 的r G θm为-20.8kJ/mol ,r Hθm为154 kJ/mol,则反应的r Sθm为:(A) 239 J·K-1(B) 0.239 J·K-1(C) 182 J·K-1(D) 0.182 J·K-18.下列说法中,哪一种比较准确?相律可应用于(A) 封闭体系(C) 非平衡开放体系(B) 开放体系(D) 已达平衡的多相开放体系9.CuSO4与水可生成 CuSO4·H2O, CuSO4·3H2O, CuSO4·5H2O 三种水合物, 则在一定压力下和 CuSO4水溶液及冰共存的含水盐有:(A) 3 (C) 1种种(B) 2 种(D) 不可能有共存的含水盐10.下面哪组热力学性质的配分函数表达式与体系中粒子的可别与否无关:(A) S、G、A、C V(B) U、H、P、C V(C) G、A、H、U(D) S、U、H、G、11.当熵值 S 增大 1 J·K-1·mol-1时,体系的微观态数Ω增大的倍数为:(A) 6.02⋅1023倍(B) exp(6.02⋅1023)倍(C) exp[(1/1.38) ⋅1023]倍(D) (1/1.38) ⋅1023倍12. 破坏臭氧的反应机理为:NO + O3→ NO2 + O2NO2 + O → NO + O2在此反应机理中,NO 是(A)总反应的产物(B)总反应的反应物(C)催化剂(D)上述都不是13.在化学反应动力学中,质量作用定律只适用于(A)反应级数为正整数的反应(C)恒温、恒容反应(B)基元反应(D)理想气体反应14.在光化反应中, 光所起的主要作用是:(A) (C)催化作用活化反应物分子(B) 增加体系的吉氏自由能(D) 增加传递能量的速度15.对峙反应 A + BC + D;加入正催化剂后, 那么:(A)k1增大,k-1增大,k1/ k-1增大(B)k1增大,k-1减小,k1/ k-1增大(C)k1增大,k-1增大,k1/ k-1不变(D)k1增大,k-1增大,k1/ k-1减少16.下列哪一对电解质溶液,可用界面移动法测量离子迁移数:(A)HCl 与 CuCl2(B)HCl 与 CdSO4(C) HCl 与 CuSO4(D) KOH 与 CdCl217. 已知 18℃时Λm∞ [(1/2)Ba(OH) 2],Λm∞ [(1/2)BaCl2]和Λm∞ [NH4Cl] 分别为 0.02288、0.01203和 0.01298 S·m·mol,则Λ[NH3·H2O](S·m·mol )为:(A) 0.01841;(B) 0.02193;(C) 0.02383;(D) 0.0368118.下列叙述不正确的是:(A)原电池中电势高的极为正极,电势低的极为负极(B)发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极(C)电解池中阳极与电源正极相联,阴极与电源负极相联(D)原电池中正极是阳极,负极是阴极19.在 298K时,电池 Ag|Ag (a) Ag (a)|Ag 的电动势 E 为正值,必有:(A) a> a,Eθ>0(B) a= a,Eθ>0(C) a< a,Eθ=0(D) a> a,Eθ=020.已知φθ(Cd/Cd)=-0.402 V,电流密度为 10 A·m-2时,氢在镉电极上的超电势约1V,当以镉为阴极电解CdSO4溶液[ (Cd)=1],下列叙述正确的是:(A) (C)在阴极析出氢气;氢和镉同时析出;(B) 在阴极析出镉;(D) 当(H+)=1 时在阴极析出氢气21.0.5 F 的电量通过硫酸铜溶液后,在阴极上质量增加多少克?(铜的原子量为 64)(A) 16(B) 32(C) 64(D) 8022.溶胶的基本特性之一是:(A)热力学上和动力学上皆属于稳定体系(B)热力学上和动力学上皆属不稳定体系(C)热力学上不稳定而动力学上稳定体系(D)热力学上稳定而动力学上不稳定体系23.均匀的牛奶是悬浮液,从其中沉淀脂肪和蛋白质的方法是:(A) (C)加入一些酒精过滤(B)(D)将牛奶静置加入酸24.将大分子电解质 NaR 的水溶液用半透膜和水隔开,达到 Donnan 平衡时,膜外水的 pH(A) 大于 7(B) 小于 7(C) 等于 7(D) 不能确定25.下列判断正确的是:(A)任一循环过程 S 体=0, S 环=0;(B)可逆循环过程 S 体=0, S 环=0;(C)不可逆循环过程 S 体>0, S 环>0, S 总>0;(D)不可逆循环过程 S 体=0, S 环>0, S 总>0;(E)不可逆循环过程 S 体=0, S 环=0, S 总=0。
中国科技大学2009年考研物理化学试题及答案

中国科学技术大学2009年硕士学位研究生入学考试试题(物理化学)一、选择题(共66分,每题3分):在下列各题中有一个答案是正确的,请选择之。
1. 某低压下的气相反应,在 T =200 K 时K p =8.314×102 Pa ,则K c /mol·cm -3是:(A) 5×102 (B) 14×106 (C) 14×103 (D) 0.52. (1) 溶液的化学势等于溶液中各组分的化学势之和(2) 对于纯组分,则化学势等于其Gibbs 自由能(3) 理想溶液各组分在其全部浓度范围内服从Henry 定律(4) 理想溶液各组分在其全部浓度范围内服从Raoult 定律上述诸说法正确的是:(A) (1),(2) (B) (2),(3) (C) (2),(4) (D) (3),(4)3. 理想溶液具有一定的热力学性质。
在下面叙述中哪个是错误的。
(A)mix ΔV =0 (B) mix ΔF =0 (C)mix ΔH =0 (D) mix ΔU =04. 理想气体在等温条件下,经恒外压压缩至稳定,此变化中的体系熵变∆S 体及环境熵变∆S 环应为:(A) ∆S 体> 0 , ∆S 环< 0 (B) ∆S 体< 0 , ∆S 环> 0(C) ∆S 体> 0 , ∆S 环= 0 (D) ∆S 体< 0 , ∆S 环= 05. 300 K 时,某分子的基态能量是6.21×10-21 J ,其玻耳兹曼因子为:(A) 1.5 (B) -1.5 (C) 0.223 (D) 4.486. 在 298 K 时,向甲苯的物质的量分数为0.6的大量的苯-甲苯理想溶液中,加入1 mol 纯 苯,这一过程苯的 ΔG , ΔH , ΔS 为:ΔG /J ΔH /J ΔS /J·K -1(A) 0 0 0(B) -1266 0 4.274(C) -2270 0 7.618(D) -542.6 0 1.8217. 将氧气分装在同一气缸的两个气室内,其中左气室内氧气状态为p 1 = 101.3kPa ,V 1 = 2 dm 3,T 1 = 273.2 K ;右气室内状态为p 2 = 101.3 kPa ,V 2 =1 dm 3,T 2 =273.2 K ;现将气室中间的隔板抽掉,使两部分气体充分混合。
中科院2007考研有机化学真题及答案
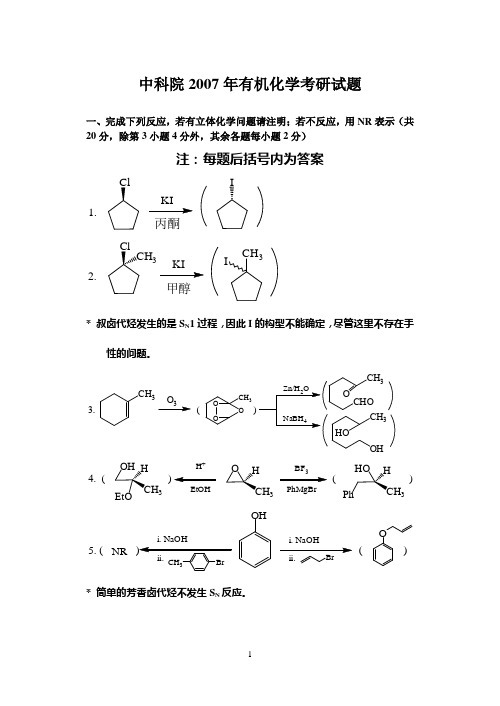
中科院2007年有机化学考研试题一、完成下列反应,若有立体化学问题请注明;若不反应,用NR 表示(共20分,除第3小题4分外,其余各题每小题2分)注:每题后括号内为答案1.丙酮I2.甲醇3CH 3I* 叔卤代烃发生的是S N 1过程,因此I 的构型不能确定,尽管这里不存在手性的问题。
3.()3CH3CH 3OO O334.()()H +EtOHBF PhMgBr3335.(()i.NaOHOHi.NaOHONR* 简单的芳香卤代烃不发生S N 反应。
6.+ClAlCl 37.OH OH CH 3CH 324O8.EtOHO OOEtOO* 逆Dieckmann 缩合。
9.Br 2H 2O二、为下列转变提供所需的试剂,必要时注明用量。
有的转变可能需要不止一步反应,请分别写出每步反应所需的试剂(20分,每小题2分)1.Br解:1 NaCN ; 2 H 3O +或 1 Mg/乙醚;2 CO 2;3 H 3O +2.OHOH O解:1 SOCl 2; 2 LiAlH(t-BuO)3; 3 H 3O + 或1 LiAlH 4;2 H 3O +; 3 CrO 3/Py3.()n -BuOHO-Bu3O解:1 SOCl 2;2 Me 2Cd 或 与过量的MeLi 反应后水解4.()NHOO解:1 NH 2OH/H +;2 H 2SO 4或PCl 5,Beckmann 重排。
5.()HO2O解:NaNO 2/HCl6.PhOPhO()解:1 LDA (1mol );2 MeI ;必须用强碱,否则易导致自身缩合。
7.O OBr解:Br 2(1mol )/HAc8.解:1 B 2H 6;2 H 2O 2/OH -9.()n -Bu2On -Bu CN解:P 2O 5或POCl 310.EtBrEt-NH 2解:1 NaN 3;2 LiAlH 4; 3 H 3O +三、判断题(共28分。
1、2两个小题各5分;3、4两个小题各9分) 1.指定下列各化合物手性中心的绝对构型(R/S )。
