预灌封注射器用氯化丁基橡胶活塞
预灌封注射器在标准YBB001120042015中有哪些检测项目
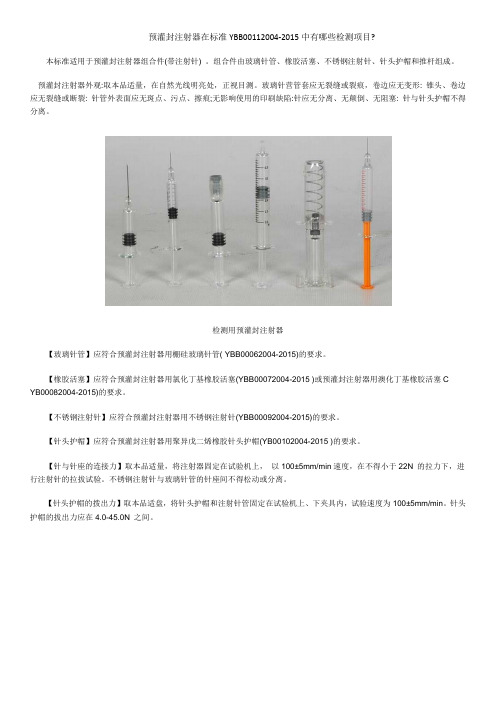
预灌封注射器在标准YBB00112004‐2015中有哪些检测项目?本标准适用于预灌封注射器组合件(带注射针) 。
组合件由玻璃针管、橡胶活塞、不锈钢注射针、针头护帽和推杆组成。
预灌封注射器外观:取本品适量,在自然光线明亮处,正视目测。
玻璃针营管套应无裂缝或裂痕,卷边应无变形: 锥头、卷边应无裂缝或断裂: 针管外表面应无斑点、污点、擦痕;无影响使用的印刷缺陷:针应无分离、无颠倒、无阻塞: 针与针头护帽不得分离。
检测用预灌封注射器【玻璃针管】应符合预灌封注射器用棚硅玻璃针管( YBB00062004-2015)的要求。
【橡胶活塞】应符合预灌封注射器用氯化丁基橡胶活塞(YBB00072004-2015 )或预灌封注射器用澳化丁基橡胶活塞CYB00082004-2015)的要求。
【不锈钢注射针】应符合预灌封注射器用不锈钢注射针(YBB00092004-2015)的要求。
【针头护帽】应符合预灌封注射器用聚异戊二烯橡胶针头护帽(YB00102004-2015 )的要求。
【针与针座的连接力】取本品适量,将注射器固定在试验机上,以100±5mm/min速度,在不得小于22N 的拉力下,进行注射针的拉拔试验。
不锈钢注射针与玻璃针管的针座间不得松动或分离。
【针头护帽的拨出力】取本品适盘,将针头护帽和注射针管固定在试验机上、下夹具内,试验速度为100±5mm/min。
针头护帽的拔出力应在4.0-45.0N 之间。
预灌封注射器测试仪器【活塞与推杆的配合性】(仅适用于带螺纹的活塞)取本品适量,将推杆和活塞相连接,把活塞完全插入经硅泊润滑过并装满一半水的预灌封注射器内,排除空气,在注射器上插上针头护帽,缓慢向后撤出约3 mm 的距离。
推杆应保持稳定,不应与活塞分离。
【活塞润滑性】取本品适量,将活塞插入硅泊润滑的注射器针管中,用推杆将活塞推入整个注射器针管中。
推杆活塞应平滑的移动,不应有突然的停顿。
【活塞滑动性能】取本品适量,将推杆活塞放入硅油润滑的针管中,以100±5mm/min的速度推动推杆。
预灌封注射器密封系统完整性研究

预灌封注射器密封系统完整性研究摘要目的:通过微生物侵入挑战性试验,确认采用预灌封注射器包装的小容量注射剂产品的密封完整性。
方法:按无菌生产要求在预灌封注射器内灌装胰胨大豆肉汤培养基,培养14 d后,置于大肠埃希菌菌悬液中浸泡4 h。
浸泡后样品继续培养7 d,观察细菌侵入情况。
结果:培养7 d后,注射器内培养基均无细菌生长。
结论:预灌封注射器密封系统能满足密封完好性的要求,可保证产品不受细菌侵入。
ABSTRACT Objective: Seal integrity of the prefilled syringes containing small volume of injection product was confirmed by the bacterial challenging test. Methods: According to production requirements, the pre-casting sterile syringe filling trypticase soy broth was incubated for 14 days, soaked in a suspension containing Escherichia coli for 4 hours. Bacterial contamination was observed after samples were incubated for 7 days. Results: The syringes were not contaminated by the tested E.coli. Conclusion: Prefilled syringes with sealing system can meet the requirements of integrity and protect the products from bacterial invasion.KEY WORDS prefilled syringes; bacterial invasion; integrity预灌封注射器是国内外20世纪90年代开发的一种新型药品包装形式,主要用于小容量注射剂的包装储存并直接用于注射或用于眼科、耳科、骨科等手术冲洗。
YBB药包材标准

YBB00342003药用玻璃成份分类及其试验方法
YBB00352003低硼硅玻璃管制药瓶
YBB00362003钠钙玻璃管制药瓶
YBB00372003抗生素瓶用铝塑组合盖
YBB00382003口服液瓶撕拉铝盖
YBB00392003外用液体药用高密度聚乙烯瓶
YBB00402003输液瓶用铝塑组合盖
YBB00142004笔式注射器用铝盖
YBB00152004笔式注射器用氯化丁基橡胶活塞和垫片
YBB00162004笔式注射器用溴化丁基橡胶活塞和垫片
YBB00172004口服固体药用低密度聚乙烯防潮组合瓶盖
YBB00182004铝/聚乙烯冷成型固体药用复合硬片
YBB00192004双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、袋
YBB00332003钠钙玻璃管制注射剂瓶
YBB00342003药用玻璃成份分类及其试验方法
YBB00352003低硼硅玻璃管制药瓶
YBB00362003钠钙Байду номын сангаас璃管制药瓶
YBB00372003抗生素瓶用铝塑组合盖
YBB00382003口服液瓶撕拉铝盖
YBB00392003外用液体药用高密度聚乙烯瓶
YBB00402003输液瓶用铝塑组合盖
YBB00242003121℃内表面耐水性测定法和分级
YBB00262003硼硅玻璃药用管
YBB00272003低硼硅玻璃药用管
YBB00282003钠钙玻璃药用管
YBB00292003硼硅玻璃输液瓶
YBB00302003低硼硅玻璃模制药瓶
YBB00312003硼硅玻璃模制注射剂瓶
YBB00322003低硼硅玻璃模制注射剂瓶
预灌封注射器用溴化丁基橡胶活塞英文标准

预灌封注射器用溴化丁基橡胶活塞英文标准The English standard for pre-filled syringes with bromobutyl rubber pistons can be described as follows:1. Piston Material: The piston material used in pre-filled syringes is bromobutyl rubber. Bromobutyl rubber is a synthetic rubber that is highly resistant to permeation by gases and moisture. It is also known for its excellent chemical resistance, stability, and low extractables.2. Piston Design: The piston design should ensure a proper seal within the syringe barrel and provide smooth movement during the injection process. The piston should have a tight fit to prevent leakage and maintain the sterility of the drug product.3. Physical Properties: The bromobutyl rubber piston should have specific physical properties to ensure its suitability for use in pre-filled syringes. These properties include good flexibility, high tensile strength, low compression set, and resistance to aging and degradation.4. Chemical Compatibility: The bromobutyl rubber piston should be chemically compatible with the drug product it contains. It should not react with the drug or leach any harmful substances into the drug solution. The piston material should be tested for its compatibility with a wide range of drugs to ensure safety and efficacy.5. Sterilization: The bromobutyl rubber piston should be sterilizable using common sterilization methods such as gamma irradiation or ethylene oxide gas. It should withstand the sterilization process without degrading or compromising its performance.6. Regulatory Standards: The bromobutyl rubber piston used in pre-filled syringes should comply with relevant international standards and regulations. These may include standards set by regulatory bodies such as the U.S. Food and Drug Administration (FDA), European Medicines Agency (EMA), or other national regulatory authorities.7. Quality Control: Manufacturers of pre-filled syringes with bromobutyl rubber pistons should implement stringent quality control measures to ensure the consistency and reliability of the product. This may involve testing the pistons for dimensional accuracy, physical properties, chemical compatibility, and sterility.It is important to note that the specific English standard for pre-filled syringes with bromobutyl rubber pistons may vary depending on the regulatory requirements of different countries or regions. Manufacturers and users of such syringes should refer to the applicable standards and regulations in their respective jurisdictions to ensure compliance and safety.。
丁基橡胶药用瓶塞检测SOP

丁基橡胶药用瓶塞检测SOP1. 目的为规范注射液用卤化丁基橡胶药用瓶塞的检定,特制定本SOP。
2. 范围本SOP适用于直接与注射剂接触的卤化丁基橡胶塞(注射液用卤化丁基橡胶塞、预灌封注射器用氯化丁基橡胶塞、预灌封注射器用溴化丁基橡胶塞)的检定。
3. 定义无4. 职责4.1.QC负责本规程的起草、修订、培训及执行。
4.2.QA、QC组长、质量管理部经理负责本规程的审核。
4.3.质量总监负责批准本规程。
4.4.QA负责本规程执行的监督。
5. 引用标准5.1.注射液用卤化丁基橡胶塞国家食品药品监督管理局直接接触药品的包装材料和容器标准汇编5.2.预灌封注射器用氯化丁基橡胶活塞国家食品药品监督管理局直接接触药品的包装材料和容器标准汇编5.3.预灌封注射器用溴化丁基橡胶活塞国家食品药品监督管理局直接接触药品的包装材料和容器标准汇编5.4.《中华人民共和国药典》6. 材料6.1.仪器设备天平,恒温水浴箱,分光光度计,pH计,恒温干燥箱,变温电炉,干燥器,电导率仪,高温炉。
6.2.试剂溶液标准铅溶液:购入;氯化铵铵溶液:取氯化铵10.5g,加水溶解使成100ml,即得;标准锌溶液:称取硫酸锌(ZnSO4·7H2O)0.440g,置1000ml量瓶中,加水溶解并稀释至刻度,摇匀,即得(每1ml相当于100µg的Zn);0.02mol/L高锰酸钾滴定液: 按《高锰酸钾滴定液配制及标定SOP》操作;0.1mol/L硫代硫酸钠滴定液:按《硫代硫酸钠滴定液配制及标定SOP》操作;碳酸氢钠:购入;硝酸:购入;硝酸银试液:取硝酸银17.5g,加水适量使溶解成1000ml,摇匀,即得;0.1%氯化钾溶液:取氯化钾0.1g,加水使溶解成100 ml,即得;稀硫酸:取硫酸57ml,加水稀释至1000ml,即得;淀粉指示液:取可溶性淀粉0.5g,加水5ml搅匀后,缓缓倾入100ml沸水中,随加随搅拌,继续煮沸2min,放冷,倾取上层清液,即得,本液应临用新制;碱性碘化汞钾试液:二氯化汞饱和水溶液:取二氯化汞7g,溶于100ml水中,摇匀。
浅谈预灌封注射器的基本知识

浅谈预灌封注射器的基本知识发布时间:2021-09-22T07:04:07.939Z 来源:《医师在线》2021年5月10期作者:贾惠鹏[导读]贾惠鹏(扬子江药业集团江苏紫龙药业有限公司;江苏常州213000)摘要:预灌封注射器是一种新型的药用注射剂包装形式,在国内外被越来越多的厂家选择与应用。
预灌封注射器这种包装方式具有用药剂量更准确、保护使用者不受药液伤害、使用方便,无污染等优势,未来前景广阔。
预灌封注射器最早由美国BD公司研制成功,国内企业起步较晚,但发展势头良好,市场认可度与占有率逐年提升。
预灌封注射器最由针管、胶塞、推杆等部分组成,国内生产一般按YBB质量标准要求执行。
1.背景介绍随着国内仿制药一致性评价工作的逐步深入,越来越多的口服制剂的仿制药一致性评价工作被国内制剂企业纳入计划。
注射制剂产品相对于口服固体制剂来说,质量风险明显提高,国家食品药品监督管理总局药品审评中心发布的《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》中要求,“注射剂使用的包装材料和容器的质量和性能不得低于参比制剂,以保证药品质量与参比制剂一致”,这就对包装材料的安全性与稳定性提出了要求,而预灌封注射器是一种新型的注射剂包装形式,开始被越来越多的国内厂家选择与应用。
而之后国家药品监督管理局发布的《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》预灌封注射器发展提供了新的技术指导和法规依据。
2020年以来新冠疫情爆发,新冠疫苗的研发、生产在各主要国家蓬勃发展,作为包装材料的预灌封注射器需求量大增,带动了预灌封注射器产能全球供应不足,主要生产厂家纷纷制定扩产计划。
这一大趋势也刺激了中国预灌封注射器行业的发展,国内各大预灌封注射器生产企业也加大了资金投入力度,进行产能扩充。
2.产品优势预灌封注射器相比注射剂的其他包装形式,具有以下优点:(1)用药剂量更准确:对于粘度较大的注射液在使用过程中残留药液较多,预灌封式注射器可以最大限度的减少药液残留,用药剂量更加准确;(2)保护使用者不受药液伤害:对于一些特殊药物如果操作不当,易造成伤害。
预灌封注射器介绍
预灌封注射器介绍1.0预灌封注射器概述:预灌封注射器是国外九十年代开发的一种新型药品包装形式,经过十多年的推广使用,对于预防传染病的传播和医疗事业的发展,起到了很好的作用。
预灌封注射器主要用于高档药物的包装储存并直接用于注射或用于眼科、耳科、骨科等手术冲洗。
2.0 历史背景:用于人体注射的注射器在世界范围内先后经历了四代产品:1)多次使用的全玻璃注射器2)一次性使用的无菌塑料注射器3)一次性预灌封注射器4)氮气高压无针注射器。
目前,第一代全玻璃注射器已较少使用。
第二代一次性使用的无菌塑料注射器在全世界普遍使用,虽然具有成本低,使用方便的优点,但其自身也有缺陷,如不耐酸碱,回收使用,污染环境等。
因此,发达国家和地区已逐步推广使用第三代的预灌封注射器。
第四代产品还处于研制开发阶段。
预灌封注射器同时具有储存药物和普通注射两种作用,并且采用了兼容性和稳定性良好的材料,不但安全可靠,而且相比传统的”药瓶+注射器”的方式,最大限度地降低了从生产到使用中所耗费的人工和成本,给制药企业和临床使用带来许多方面的优势。
目前已经越来越多的被制药企业采用并应用于临床中,未来的几年中必然成为药品的主要包装方式,并渐渐取代普通注射器的地位。
3.0 产品特点:预灌封注射器作为一种新型的药品包装形式,其特点是:1) 采用高品质的玻璃和橡胶组件,与药物具有良好的相容性,可确保包装的药物的稳定性;2) 减少药物因储存及转移过程的吸附造成的浪费,尤其对于昂贵的生化制剂,具有十分重要的意义;3) 避免使用稀释液后反复抽吸,减少二次污染机会;4) 采用灌装机定量灌装药液的方式,比医护人员手工抽吸药液更加精确;5) 可在注射容器上直接注明药品名称,临床上不易发生差错;如果使用易剥离标签,还有利于保存患者用药信息;6) 操作简便,临床中比使用安瓿节省一半的时间,特别适合急诊患者。
4.0 产品分类和结构(见下页结构示意图)产品分为带注射针和不带注射针两类4.1 带注射针的为针头嵌入式,由玻璃针管,针头护帽,活塞和推杆组成;目前可以生产的规格有1ml标准/25G,1ml细长/27G, 1ml细长带刻度/27G, 2.25ml/27G;4.2不带针的分为锥头式和螺旋头式,锥头式由玻璃针管,锥头头护帽,活塞和推杆组成;螺旋头式由玻璃针管,螺旋头护帽,螺旋头,活塞和推杆组成;目前可以生产的规格有2.25ml 锥头式,2.25ml螺旋头式,3ml锥头式;5.0 材料组成部件名称 材料带注射针 I类中性玻璃/314不锈钢玻璃针管不带注射针 I类中性玻璃推杆(无色) PS(有色) PP/PE/色母料针头护帽 PP/聚异戊二烯橡胶护帽锥头护帽,螺旋头护帽 丁基橡胶活塞 ----- 氯化丁基橡胶6.0使用方法6.1制药企业灌装过程通过灌装机在玻璃针管(带有护帽)内灌装定量的药物,并将活塞压入或旋入,将药液密封,然后加装推杆,进行包装;不带注射针的产品,药厂还应配上相应的冲洗针。
直接接触药品的包装材料和容器标准汇编(1~6辑)
直接接触药品的包装材料和容器标准汇编(1~6辑)第一辑YBB00012002 低密度聚乙烯输液瓶(试行)YBB00022002 聚丙烯输液瓶(试行)YBB00032002 钠钙玻璃输液瓶(试行)废止,新标准号YBB00032005YBB00042002 药用氯化丁基橡胶塞(试行)2005年4月15日起废止,YBB00052002 药用溴化丁基橡胶塞(试行)2005年4月15日起废止,YBB00062002 低密度聚乙烯药用滴眼剂瓶(试行)YBB00072002 聚丙烯药用滴眼剂瓶(试行)YBB00082002 口服液体药用聚丙烯瓶(试行)YBB00092002 口服液体药用高密度聚乙烯瓶(试行)YBB00102002 口服液体药用聚酯瓶(试行)YBB00112002 口服固体药用聚丙烯瓶(试行)YBB00122002 口服固体药用高密度聚乙烯瓶(试行)YBB00132002 药品包装用复合膜、袋通则(试行)YBB00142002 药品包装材料与药物相容性试验指导原则(试行)第二辑YBB00152002 药品包装用铝箔YBB00162002 铝质药用软膏管YBB00172002 聚酯/铝/聚乙烯药品包装用复合膜、袋YBB00182002 聚酯/低密度聚乙烯药品包装用复合膜、袋YBB00192002 双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜袋YBB00202002 聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片2005年2月2日起废止YBB00212002 聚氯乙烯固体药用硬片2005年2月2日起废止YBB00222002 聚氯乙烯/聚偏二氯乙烯固体药用复合硬片2005年2月2日起废止YBB00232002 聚氯乙烯/低密度聚乙烯固体药用复合硬片2005年2月2日起废止YBB00242002 聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片YBB00252002 聚乙烯/铝/聚乙烯复合药用软膏管废止,新标准号YBB00252005YBB00262002 口服固体药用聚酯瓶YBB00272002 钠钙玻璃药瓶YBB00282002 低硼硅玻璃管制口服液体瓶YBB00292002 硼硅玻璃管制注射剂瓶废止,新标准号YBB00292005-1、YBB00292005-2 YBB00302002 低硼硅玻璃管制注射剂瓶YBB00312002 钠钙玻璃模制注射剂瓶YBB00322002 硼硅玻璃安瓿废止,新标准号YBB00322005-2YBB00332002 低硼硅玻璃安瓿YBB00342002 多层共挤输液用膜、袋通则第三辑YBB00012003 细胞毒性检查法YBB00022003 热原检查法YBB00032003 溶血检查法YBB00042003 急性全身毒性检查法YBB00052003 皮肤致敏检查法YBB00062003 皮内刺激检查法YBB00072003 原发性皮肤刺激检查法YBB00082003 气体透过量测定法YBB00092003 水蒸气透过量测定法YBB00102003 剥离强度测定法YBB00112003 拉伸性能测定法YBB00122003 热合强度测定法YBB00132003 密度测定法YBB00142003 氯乙烯单体测定法YBB00152003 偏二氯乙烯单体测定法YBB00162003 内应力测定法YBB00172003 耐内压力测定法YBB00182003 热冲击和热冲击强度测定法YBB00192003 垂直轴偏差测定法YBB00202003 平均线热膨胀系数的测定法YBB00212003 线热膨胀系数的测定法YBB00222003 砷、锑、铅浸出量的测定法YBB00232003 三氧化二硼测定法YBB00242003 121℃内表面耐水性测定法和分级YBB00252003 玻璃颗粒在121℃耐水性测定法和分级第四辑YBB00262003 硼硅玻璃药用管废止,新标准号YBB00012005-1、YBB00012005-2 YBB00272003 低硼硅玻璃药用管YBB00282003 钠钙玻璃药用管YBB00292003 硼硅玻璃输液瓶废止,新标准号YBB00022005-2YBB00302003 低硼硅玻璃模制药瓶YBB00312003 硼硅玻璃模制注射剂瓶废止,新标准号YBB00062005-2YBB00322003 低硼硅玻璃模制注射剂瓶YBB00332003 钠钙玻璃管制注射剂瓶YBB00342003 药用玻璃成份分类及其试验方法YBB00352003 低硼硅玻璃管制药瓶YBB00362003 钠钙玻璃管制药瓶YBB00372003 抗生素瓶用铝塑组合盖YBB00382003 口服液瓶撕拉铝盖YBB00392003 外用液体药用高密度聚乙烯瓶YBB00402003 输液瓶用铝塑组合盖第五辑YBB00012004 低硼硅玻璃输液瓶YBB00022004 硼硅玻璃管制口服液体瓶YBB00032004 钠钙玻璃管制口服液体瓶YBB00042004 硼硅玻璃管制药瓶YBB00052004 硼硅玻璃模制药瓶YBB00062004 预灌封注射器用硼硅玻璃针管YBB00072004 预灌封注射器用氯化丁基橡胶活塞YBB00082004 预灌封注射器用溴化丁基橡胶活塞YBB00092004 预灌封注射器用不锈钢注射针YBB00102004 预灌封注射器用聚异戊二烯橡胶针头护帽YBB00112004 预灌封注射器组合件(带注射针)YBB00122004 笔式注射器用硼硅玻璃珠YBB00132004 笔式注射器用硼硅玻璃套筒YBB00142004 笔式注射器用铝盖YBB00152004 笔式注射器用氯化丁基橡胶活塞和垫片YBB00162004 笔式注射器用溴化丁基橡胶活塞和垫片YBB00172004 口服固体药用低密度聚乙烯防潮组合瓶盖YBB00182004 铝/聚乙烯冷成型固体药用复合硬片YBB00192004 双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、袋YBB00202004 玻璃纸/铝/聚乙烯药品包装用复合膜、袋YBB00212004 药品包装用铝塑封口垫片通则YBB00222004 口服制剂用硅橡胶胶塞、垫片YBB00232004 药用合成聚异戊二烯垫片YBB00242004 塑料输液容器用聚丙烯组合盖YBB00252004 胶囊用明胶YBB00262004 包装材料红外光谱测定法YBB00272004 包装材料不溶性微粒测定法YBB00282004 乙醛测定法YBB00292004 加热伸缩率测定法YBB00302004 挥发性硫化物测定法YBB00312004 包装材料溶剂残留量测定法YBB00322004 注射剂用胶塞、垫片穿刺力测定法YBB00332004 注射剂用胶塞、垫片穿刺落屑测定法YBB00342004 玻璃耐沸腾盐酸浸蚀性的测定法和分级YBB00352004 玻璃耐沸腾混合碱水溶液浸蚀性的测定法和分级YBB00362004 玻璃颗粒在98℃耐水性测定法和分级YBB00372004 砷、锑、铅、镉浸出量测定法YBB00382004 抗机械冲击测定法YBB00392004 直线度测定法YBB00402004 药用陶瓷吸水率测定法YBB00412004 药品包装材料生产厂房洁净室(区)的测试方法YBB00202005 聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片YBB00212005 聚氯乙烯固体药用硬片YBB00222005 聚氯乙烯/聚偏二氯乙烯固体药用复合硬片YBB00232005 聚氯乙烯/低密度聚乙烯固体药用复合硬片YBB00042005 注射液用卤化丁基橡胶塞YBB00052005 注射用无菌粉末用卤化丁基橡胶塞第六辑YBB00072005 药用低密度聚乙烯膜、袋YBB00082005 注射剂瓶用铝盖YBB00092005 输液瓶用铝盖YBB00102005 三层共挤输液用膜(I)、袋YBB00112005 五层共挤输液用膜(I)、袋YBB00122005 药用固体纸袋装硅胶干燥剂YBB00132005 药用聚酯/铝/聚丙烯封口垫片YBB00142005 药用聚酯/铝/聚酯封口垫片YBB00152005 药用聚酯/铝/聚乙烯封口垫片YBB00162005 药用口服固体陶瓷瓶YBB00032005 钠钙玻璃输液瓶替换YBB00032002YBB00292005-1 高硼硅玻璃管制注射剂瓶替换YBB00292002 YBB00292005-2 中性硼硅玻璃管制注射剂瓶替换YBB00292002 YBB00322005-2 中性硼硅玻璃安瓿替换YBB00322002YBB00012005-1 药用高硼硅玻璃管替换YBB00262003YBB00012005-2 药用中性硼硅玻璃管替换YBB00262003YBB00022005-2 中性硼硅玻璃输液瓶替换YBB00292003YBB00062005-2 中性硼硅玻璃模制注射剂瓶替换YBB00312003 YBB00252005 药用聚乙烯/铝/聚乙烯复合软膏管替换YBB00252002 YBB00172005 药用玻璃铅、镉、砷、锑浸出量限度YBB00182005 药用陶瓷容器铅、镉浸出量限度YBB00192005 药用陶瓷容器铅、镉浸出量测定法YBB00242005 环氧乙烷残留量测定法YBB00262005 橡胶灰分的测定法。
YBB药包材标准
YBB00022004硼硅玻璃管制口服液体瓶
YBB00032004钠钙玻璃管制口服液体瓶
YBB00042004硼硅玻璃管制药瓶
YBB00052004硼硅玻璃模制药瓶
YBB00062004预灌封注射器用硼硅玻璃针管
YBB00072004预灌封注射器用氯化丁基橡胶活塞
YBB00082004预灌封注射器用溴化丁基橡胶活塞
YBB00092004预灌封注射器用不锈钢注射针
YBB00102004预灌封注射器用聚异戊二烯橡胶针头护帽
YBB00112004预灌封注射器组合件(带注射针)
YBB00122004笔式注射器用硼硅玻璃珠
YBB00132004笔式注射器用硼硅玻璃套筒
YBB00132002药品包装用复合膜、袋通则(试行)
YBB00142002药品包装材料与药物相容性试验指导原则(试行)
YBB00152002药品包装用铝箔
YBB00162002铝质药用软膏管
YBB00172002聚酯/铝/聚乙烯药品包装用复合膜、袋
YBB00182002聚酯/低密度聚乙烯药品包装用复合膜、袋
YBB00332003钠钙玻璃管制注射剂瓶
YBB00342003药用玻璃成份分类及其试验方法
YBB00352003低硼硅玻璃管制药瓶
YBB00362003钠钙玻璃管制药瓶
YBB00372003抗生素瓶用铝塑组合盖
YBB00382003口服液瓶撕拉铝盖
YBB00392003外用液体药用高密度聚乙烯瓶
YBB00402003输液瓶用铝塑组合盖
YBB00302002低硼硅玻璃管制注射剂瓶
YBB00312002钠钙玻璃模制注射剂瓶
YBB30022012预灌封注射器用溴化丁基橡胶活塞
276
重金属 精密量取供试品溶液 10ml,加醋酸盐缓冲液(pH3.5) 2ml,依法检查(中国药典 2010 版二部附录Ⅷ H 第一法)测定,不得过百万分之一。
铵离子 精密量取供试品溶液 10 ml,加碱性碘化汞钾试液 2ml,放置 15 分钟,不得显色; 如显色,与氯化铵溶液(取氯化铵 31.5mg 加无氯水适量使溶解并稀释至 1000.0ml)2.0ml,加 空白提取液 8ml 与碱性碘化汞钾试液 2ml 制成的对照液比较,不得更深(0.0002%)。
电导率 在供试品溶液制备 5 小时内,用电导率仪测定:用水冲洗测定电极(光亮铂电极或 铂黑电极)数次,取空白对照溶液冲洗电极至少 2 次,测定空白对照溶液的电导率不得过 3.0µS/cm (20℃±1℃)。再用供试品溶液冲洗电极至少 2 次,测定供试品溶液的电导率,应不得过 40.0µS/cm。如果测定不是在 20℃±1℃下进行,则应对温度进行校正。
YBB30022012
预灌封注射器用溴化丁基橡胶活塞
Yuguanfengzhusheqiyong Xiuhuadingjiber Plungers for Prefilled Syringes
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
YBB30012012
预灌封注射器用氯化丁基橡胶活塞Yuguanfengzhusheqiyong Lühuadingjixiangjiao Huosai
Chlorobutyl Rubber Plungers for Prefilled Syringes
本标准适用于预灌封注射器用氯化丁基橡胶活塞。
活塞类型为扣合式(PSL)或螺纹式(PT)。
【外观】取本品数个,目视检测,表面色泽应均匀,不得有污点、杂质、气泡、裂纹、缺
胶、粗糙、胶丝、胶屑、海绵状、毛边;不得有除边造成的残缺或锯齿现象;不得有模具造成的明显痕迹。
如果有浇道口,不应凸出于活塞的表面。
【鉴别】*(1)称取本品2.0g,剪成小颗粒,置坩锅中,加碳酸氢钠2.0g 均匀覆盖试样,
置电炉上,缓缓加热至炭化,放冷,置马弗炉300℃加热至完全灰化,取出后,冷却至室温,加
水10ml 使溶解,滤过,取续滤液1.5ml,置于试管中,加硝酸酸化,加入硝酸银试液1 滴,应产生白色沉淀。
(2)取本品适量,照包装材料红外光谱测定法(YBB60012012)第四法测定,应与对照
图谱基本一致。
【活塞与推杆的配合性】、【活塞润滑性】、【活塞滑动性能】、【器身密合性】照预灌封注射器组合件(YBB40012012)项下的方法检查,应符合规定。
【灰分】取本品1.0g,照橡胶灰分测定法(YBB600212012)测定,不得过50%。
【挥发性硫化物】* 取本品,照挥发性硫化物测定法(YBB60052012)测定,应符合规
定。
【不溶性微粒】取本品10 个,加微粒检查用水50ml,照包装材料不溶性微粒测定法
(YBB60022012)药用胶塞项下测定,每1ml 中含10μm 以上的微粒不得过60 粒,含25μm 以上的微粒不得过6 粒。
【化学性能】供试品溶液的制备:取相当于表面积200cm2 的完整胶塞若干个,按样品外
表面积(cm2)与水(ml)的比例1:2,加水浸没,煮沸5 分钟,放冷,再用同体积水冲洗5 次。
移置于锥形瓶中,加同体积水,置高压蒸汽灭菌器中,升温至121℃±2℃,保持30 分钟,冷却至室温,移出,即得供试品溶液,备用;并同时制备空白对照溶液。
进行下列试验:
澄清度与颜色取供试品溶液,依法检查(中国药典2010 年版二部附录IX B 和附录IX A),
溶液应澄清无色。
如显浑浊,与2 号浊度标准液比较,不得更浓。
如显色,与黄绿色5 号标准比色液比较,不得更深。
pH 变化值取供试品溶液和空白对照溶液各20 ml,分别加入氯化钾溶液(1→1000)1 ml,
照pH 值测定法(中国药典2010 年版二部附录ⅥH)测定,两者之差不得过1.0。
吸光度取供试品溶液适量,用孔径0.45μm 的滤膜过滤,照紫外-可见分光光度法(中国
药典2010 年版二部附录IVA)测定,在220~360nm 波长范围内,吸光度不得大于0.2。
易氧化物精密量取供试品溶液20ml,精密加入0.002mol/L 高锰酸钾滴定液20ml 与稀硫酸
2ml,煮沸3 分钟,迅速冷却,加碘化钾0.1g,用硫代硫酸钠滴定液(0.01mol/L)滴定至浅棕色,再加入5 滴淀粉指示液后滴定至无色。
另取空白对照溶液同法操作,二者消耗硫代硫酸钠滴定液(0.01mol/L)之差不得过7.0 ml。
不挥发物精密量取供试品溶液及空白对照溶液100ml,分别置于已恒重的蒸发皿中,水浴
273
蒸干,在105℃干燥至恒重,两者之差不得过4.0mg。
重金属精密量取供试品溶液10ml,加醋酸盐缓冲液(pH3.5)2ml,依法检查(中国药典
2010 版二部附录ⅧH 第一法)测定,不得过百万分之一。
铵离子精密量取供试品溶液10 ml,加碱性碘化汞钾试液2ml,放置15 分钟,不得显色;
如显色,与氯化铵溶液(取氯化铵31.5mg 加无氯水适量使溶解并稀释至1000.0ml)2.0ml,加
空白提取液8ml 与碱性碘化汞钾试液2ml 制成的对照液比较,不得更深(0.0002%)。
锌离子取供试品溶液,用孔径0.45μm 的滤膜过滤,精密量取滤液10ml,加2 mol/L 盐酸
1ml 和亚铁氰化钾试液(称取4.2g 亚铁氰化钾三水化合物,用水溶解并稀释至100mL,摇匀,即得,本品应临用新制)3 滴混合,不得显色;如显色,与标准锌溶液(称取44.0mg 硫酸锌七水
化合物,用新煮沸并冷却的水溶解并稀释至1000.0ml,本品应临用新配)3.0ml,加空白对照液
7ml 与2 mol/L 盐酸1ml 和亚铁氰化钾试液3 滴对照液比较,不得更深(0.0003%)。
电导率在供试品溶液制备5 小时内,用电导率仪测定:用水冲洗测定电极(光亮铂电极或
铂黑电极)数次,取空白对照溶液冲洗电极至少2 次,测定空白对照溶液的电导率不得过3.0μS/cm (20℃±1℃)。
再用供试品溶液冲洗电极至少2 次,测定供试品溶液的电导率,应不得过
40.0μS/cm。
如果测定不是在20℃±1℃下进行,则应对温度进行校正。
【生物试验】热原* 取本品,按不规则形状比例加入氯化钠注射液,置高压蒸汽灭菌器中
采用115℃±2℃,保持30 分钟,依法检查(YBB60232012),应符合规定。
急性全身毒性试验** 取本品,按不规则形状比例加入氯化钠注射液,置高压蒸汽灭菌器中
采用115℃±2℃,保持30 分钟,依法检查(YBB60252012),应符合规定。
溶血** 取本品,依法检查(YBB60242012),溶血率应符合规定。
__。
