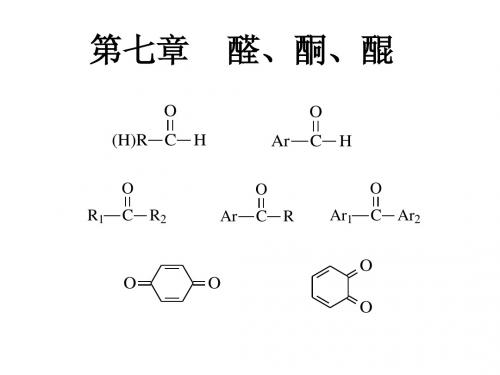
第十一章 醛、酮和醌
合集下载
有机化学醛酮和醌H

甲基环戊基甲酮
乙酸环戊酯
酮分子中α-碳碳键断键的优先顺序:
R3C- > R2CH-,C5-6环烷基 > Ph- > PhCH2- > RCH2- > CH3-
2.2 还原反应 2.2.1 催化氢化
CH3CH=CHCH2CHO H2/Ni T,P CH3(CH2)3CH2OH
3-戊烯醛
1-戊醇
反应物分子中的C=C、C=O双键均被还原。
无α-H的醛
甲醛
甲酸钠
苄醇
3、α-H的反应
醛、酮分子中α -H原子具有酸性,原因是羰基的
极化作用,使生成的共轭碱变得相对稳定(负电荷被
离域化)。事实上,这种转化是以烯醇负离子的形式 为纽带的。
O RCH
-H+
C H( or CH3)
H+ -H+
烯醇负离子
H+
α
RCH2
O C H( or CH3)
水会分解,故需在干醚或四氢呋喃中使用。
2.2.3 异丙醇铝-异丙醇还原法
异丙醇铝
CH3CH=CHCH2CHO + i-PrOH Al(PrO-i)3 CH3CH=CHCH2CH2OH + (CH3)2CO
3-戊烯醛
异丙醇
3-戊烯-1-醇
丙酮
反应物分子中的C=O双键被还原。 该反应又称为麦尔外因-庞道夫-维尔莱 (Meerwain-Ponudorf-Verley)还原法。其逆反应 称为欧芬脑尔(Oppenauer)反应。
使用挥发性的剧毒物HCN。例如:
PhCHO NaHSO3 PhCHSO3Na OH NaCN H2O PhCHCN OH HCl
回流
CH11醛酮和醌
δ δ +
δ + δ
R M g X + CO
RCO M g X H 2ORCO H
与甲醛加成形成伯醇; 与其他醛加成形成仲醇; 与酮加 成形成叔醇。
RMgX
H H CO
H R CH OMgX H2O RCH2OH
R1MgX
H R2 C O
R2
R2
R1 CH OMgX H2O R1 CH OH
R1MgX
R3 R2 C O
R3
R3
R1 C OMgX H2O R1 C OH
R2
R2
b. 与铜锂试剂反应:制备空间位阻大的叔醇。
O
( CH3 )3C C C(CH 3 )3 + (CH 3)3CLi
ROR -70oC
((CH 3) 3C) 3COH
c. 与炔钠反应:
O
① H CC N -a + ② H 2 O ; H+
出版社, 1993.
3. F A Carey. Organic Chemistry, 4th ed. New York:
McGraw – Hill Companies Inc, 2000.
4. T W G Solomons, C B Fryhle. Organic Chemistry, 7th ed.
C H C 3 H C 2 H C 2 H C 2 H O 正戊醛
C H3(C H2)10 C H O 正十二醛(月桂醛)
C H C 3 H C H C 2 H O C H 3 异戊醛
单酮:二“某基”酮 脂肪混酮:小基团在前,大基团在后,“某基某基酮”
C H C H 3 C O 2 C H C H 2 3C H C O 3 C H C H 2 3C H C O 3 C H C H 2 C H 2 3
醛、酮、醌
R H C O + R' OH H
无水HCl
R C
OH OR'
R'OH
无水HCl
R C H
OR' OR'
半缩醛
缩醛
醛与醇生成半缩醛、缩醛的反应是按下列历程进行的:
R H C O H
+
R H
R C O H
Ⅰ
+ +
H
C OH
+
.. R'OH
R C H
OH
+ .OR' .
H
Ⅱ
-H
+
R C H
OH OR'
H O C CHOH CHOH CHOH .. CH2 OH
分子内的六员环状半缩醛
H
OH C CHOH CHOH O CHOH CH2
4. 与格氏试剂的加成反应
格氏试剂是较强的亲核试剂,非常容易与醛、酮 进行加成反应,加成的产物不必分离便可直接水解生 成相应的醇,是制备醇的最重要的方法之一。
无水 乙 醚 R C O MgX H2O H
+
C O + RMgX
R C
OH
+ Mg(OH)X
甲醛与格氏试剂加成产物水解后可以得到比格氏试剂 分子中的烃基多一个碳原子的伯醇;其它醛与格氏试剂 加成后,水解的最终产物是仲醇;酮与格氏试剂加成后, 水解的最终产物是叔醇。
H C O + R MgX H
无水乙醚
H R C OMgX H H2O H
+
HCl OH R C SO3Na R Na2CO3 (CH3)H C O + Na2SO3 + NaHCO3 H(CH3) R C O (CH3)H + NaCl + SO2 + H2O
无水HCl
R C
OH OR'
R'OH
无水HCl
R C H
OR' OR'
半缩醛
缩醛
醛与醇生成半缩醛、缩醛的反应是按下列历程进行的:
R H C O H
+
R H
R C O H
Ⅰ
+ +
H
C OH
+
.. R'OH
R C H
OH
+ .OR' .
H
Ⅱ
-H
+
R C H
OH OR'
H O C CHOH CHOH CHOH .. CH2 OH
分子内的六员环状半缩醛
H
OH C CHOH CHOH O CHOH CH2
4. 与格氏试剂的加成反应
格氏试剂是较强的亲核试剂,非常容易与醛、酮 进行加成反应,加成的产物不必分离便可直接水解生 成相应的醇,是制备醇的最重要的方法之一。
无水 乙 醚 R C O MgX H2O H
+
C O + RMgX
R C
OH
+ Mg(OH)X
甲醛与格氏试剂加成产物水解后可以得到比格氏试剂 分子中的烃基多一个碳原子的伯醇;其它醛与格氏试剂 加成后,水解的最终产物是仲醇;酮与格氏试剂加成后, 水解的最终产物是叔醇。
H C O + R MgX H
无水乙醚
H R C OMgX H H2O H
+
HCl OH R C SO3Na R Na2CO3 (CH3)H C O + Na2SO3 + NaHCO3 H(CH3) R C O (CH3)H + NaCl + SO2 + H2O
醛酮醌

n≤7
C O
Organic Chem
合成上的应用:增长碳链, 合成上的应用:增长碳链,引进新的活性基团
H C OH C CN C C CN CH2NH2 COOR
,
CN
例:
O CH3 C CH3 HCN CH3 CH3 C OH CN H2SO4 CH3OH CH2 C
O COCH3
CH3
有机玻璃单体
4-甲基环己酮
2-甲基环己基甲醛 甲醛
Organic Chem
芳基醛、 芳基醛、酮,总是把芳基看成取代基: 总是把芳基看成取代基:
O C H
O C CH2CH3
苯甲醛
1-苯基-1-丙酮
Organic Chem
二、 醛酮的物理性质
由于羰基的高度极化,醛酮分子间的偶极静电引力大。 由于羰基的高度极化,醛酮分子间的偶极静电引力大。 沸点:( 比相应分子量的烃类、醚类要高。 :(1)比相应分子量的烃类 沸点:( 比相应分子量的烃类、醚类要高。 (2)但比相应分子量的醇要低 但比相应分子量的醇要低。 (2)但比相应分子量的醇要低。因为 偶极静电引力没有氢键强。例如: 偶极静电引力没有氢键强。例如:
2) 与金属锂试剂加成: 与金属锂试剂加成:
Organic Chem
O C3H7MgBr + i Pr C
iPr
iPr 30%
OH C iPr C3H7
当R, R', R''的体积都大,格氏试剂与酮的加成产率低.有时甚至不反应. 的
O LiC(CH3)3 + (CH3)3C C C(CH3)3
(CH3)3C 81%
开链半缩醛不稳定,但环状半缩醛可被 开链半缩醛不稳定, 分离出来: 分离出来:
C O
Organic Chem
合成上的应用:增长碳链, 合成上的应用:增长碳链,引进新的活性基团
H C OH C CN C C CN CH2NH2 COOR
,
CN
例:
O CH3 C CH3 HCN CH3 CH3 C OH CN H2SO4 CH3OH CH2 C
O COCH3
CH3
有机玻璃单体
4-甲基环己酮
2-甲基环己基甲醛 甲醛
Organic Chem
芳基醛、 芳基醛、酮,总是把芳基看成取代基: 总是把芳基看成取代基:
O C H
O C CH2CH3
苯甲醛
1-苯基-1-丙酮
Organic Chem
二、 醛酮的物理性质
由于羰基的高度极化,醛酮分子间的偶极静电引力大。 由于羰基的高度极化,醛酮分子间的偶极静电引力大。 沸点:( 比相应分子量的烃类、醚类要高。 :(1)比相应分子量的烃类 沸点:( 比相应分子量的烃类、醚类要高。 (2)但比相应分子量的醇要低 但比相应分子量的醇要低。 (2)但比相应分子量的醇要低。因为 偶极静电引力没有氢键强。例如: 偶极静电引力没有氢键强。例如:
2) 与金属锂试剂加成: 与金属锂试剂加成:
Organic Chem
O C3H7MgBr + i Pr C
iPr
iPr 30%
OH C iPr C3H7
当R, R', R''的体积都大,格氏试剂与酮的加成产率低.有时甚至不反应. 的
O LiC(CH3)3 + (CH3)3C C C(CH3)3
(CH3)3C 81%
开链半缩醛不稳定,但环状半缩醛可被 开链半缩醛不稳定, 分离出来: 分离出来:
大学有机化学第11章__醛和酮

甲基乙烯基酮
O C CH3
苯乙酮
(乙酰苯)
共九十一页
2)系统(xìtǒng)命名 法
O
5
CH3
CH3CH2-C-CH2-CH-CH2CH3
CH3-CH-CH2CH2CHO
HO-CH-CH3
6
4-甲基戊醛
5-乙基-6-羟基 3-庚酮
- (qiǎngjī)
共九十一页
C H 3
C H O
C H 2 C H 2 C H C H O O H C C H 2 C H C H 2 C H O
共九十一页
加成-消除(xiāochú)历程
R’
R—C=O + H2N—G
H+
R’ R-C — N—G
H+ -H2O
R’ R-C=N—G
OH H
(N-取代(qǔdài)亚胺)
这种加成-消除实际上可以看成由分子间脱去一分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
共九十一页
加成-缩合产物(chǎnwù)的结构及名称:
加成-缩合产物的结构(jiégòu)及名称:
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff base R’
R—C = N-OH 肟(oxime)
H2N—NH2 H2N—NH-
O
R’
R—C=N-NH2 腙(hydrazone) R’
R-C=N-NH-C6H5 苯腙
H2N—NH-C-NH2
R’
R-C=N-NH-CO-NH2 缩氨脲
共九十一页
6) 与格氏试剂加成
O C CH3
苯乙酮
(乙酰苯)
共九十一页
2)系统(xìtǒng)命名 法
O
5
CH3
CH3CH2-C-CH2-CH-CH2CH3
CH3-CH-CH2CH2CHO
HO-CH-CH3
6
4-甲基戊醛
5-乙基-6-羟基 3-庚酮
- (qiǎngjī)
共九十一页
C H 3
C H O
C H 2 C H 2 C H C H O O H C C H 2 C H C H 2 C H O
共九十一页
加成-消除(xiāochú)历程
R’
R—C=O + H2N—G
H+
R’ R-C — N—G
H+ -H2O
R’ R-C=N—G
OH H
(N-取代(qǔdài)亚胺)
这种加成-消除实际上可以看成由分子间脱去一分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
共九十一页
加成-缩合产物(chǎnwù)的结构及名称:
加成-缩合产物的结构(jiégòu)及名称:
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff base R’
R—C = N-OH 肟(oxime)
H2N—NH2 H2N—NH-
O
R’
R—C=N-NH2 腙(hydrazone) R’
R-C=N-NH-C6H5 苯腙
H2N—NH-C-NH2
R’
R-C=N-NH-CO-NH2 缩氨脲
共九十一页
6) 与格氏试剂加成
有机化学第十一章

羰基化合物的活性次序(电子效应和空间效应): 羰基化合物的活性次序(电子效应和空间效应):
HCHO > CH3CHO > ArCHO > CH3COCH3 > CH3COR> CH3COAr > RCOR' > ArCOAr'
O 2N CHO > CHO
>
H 3C
CHO
1、与HCN的加成 、 的加成
维纶
4、与金属有机试剂的加成 、
(1)格氏试剂 )格氏试剂: H2CO +
MgCl 无水 乙醚
CH2OH 64-96%
H2O CH2OMgCl H SO 2 4
CH3 无水 乙醚 CH3COPh + PhCH2MgCl PhCH2 C OMgCl Ph CH3 H2O PhCH2 C OH NH4Cl Ph 92% Grignard: 1912 Nobel Prize
异 丙 醇 铝 ,丙 酮 丙 苯,回流
80%
CHCH CCH CH2 CH3
CH3 C CH CHCH CCH CH2 CH3 O
Oppenauer氧化: 异丙醇铝是催化剂 反应中双键不受影响。 氧化: 异丙醇铝是催化剂, 反应中双键不受影响。 氧化
脱氢:醇在适当的催化剂条件下脱去一分子氢 生成醛酮。 脱氢:醇在适当的催化剂条件下脱去一分子氢,生成醛酮。
CH3OH 浓H2SO4
COOCH3
CH2 C COOCH3 CH3 90%
过氧化苯甲酰
CH2 C CH3
n
甲基丙烯酸甲酯
聚甲基丙烯酸甲酯 (有机玻璃) 有机玻璃)
2、与NaHSO3的加成 、
加成生成a-羟基磺酸钠 羟基磺酸钠: 醛和甲基酮与饱和的NaHSO3加成生成 羟基磺酸钠: 醛和甲基酮与饱和的
有机化学 第十一章 醛酮

苯乙酮的红外光谱图:
O CCH3
山东科技大学
王鹏
化学与环境工程学院
11.3 醛酮的制备
丁酮的1H NMR谱图:
单峰
三重峰
四重峰
山东科技大学
王鹏
化学与环境工程学院
11.6 醛和酮的化学性质
醛和酮的反应部位:
氧化还原反应
亲核加成反应
O C C R (H) H
α-氢的反应
山东科技大学
王鹏
化学与环境工程学院
• 碳负离子 • 氧负离子 • 氮负离子 • 硫负离子
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
二、羰基与碳负电中心的加成
1. 与HCN的加成:
反应现象:
• 仅丙酮与氢氰酸混合,长时间加热仅得极少产物
• 加入极少量的碱,反应能迅速完成;而体系存在酸 时反应受到抑制,甚至不反应
δ+ Li
-n-BuH
H
+
_
(C6H5)3P CH2CH3Br
+ (C6H5)3P (C6H5)3P
_
CHCH3 Ylide CHCH3 磷 叶 立 德
• 磷叶立德可与羰基反应生成烯烃:
R1
Ph3P=CHR +
CO
R2
R1 C CHR
R2
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
CH3CH2CH2 C H
CH3
O CH
正丁醛
异戊醛
苯甲醛
酮:以甲酮作母体,“甲”字可省略
O
CH3 C CH2CH3
甲乙酮 甲基乙基(甲)酮
O CCH3
山东科技大学
王鹏
化学与环境工程学院
11.3 醛酮的制备
丁酮的1H NMR谱图:
单峰
三重峰
四重峰
山东科技大学
王鹏
化学与环境工程学院
11.6 醛和酮的化学性质
醛和酮的反应部位:
氧化还原反应
亲核加成反应
O C C R (H) H
α-氢的反应
山东科技大学
王鹏
化学与环境工程学院
• 碳负离子 • 氧负离子 • 氮负离子 • 硫负离子
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
二、羰基与碳负电中心的加成
1. 与HCN的加成:
反应现象:
• 仅丙酮与氢氰酸混合,长时间加热仅得极少产物
• 加入极少量的碱,反应能迅速完成;而体系存在酸 时反应受到抑制,甚至不反应
δ+ Li
-n-BuH
H
+
_
(C6H5)3P CH2CH3Br
+ (C6H5)3P (C6H5)3P
_
CHCH3 Ylide CHCH3 磷 叶 立 德
• 磷叶立德可与羰基反应生成烯烃:
R1
Ph3P=CHR +
CO
R2
R1 C CHR
R2
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
CH3CH2CH2 C H
CH3
O CH
正丁醛
异戊醛
苯甲醛
酮:以甲酮作母体,“甲”字可省略
O
CH3 C CH2CH3
甲乙酮 甲基乙基(甲)酮
有机化学——醛、酮、醌ppt课件

醛、酮对氢氰酸的加成反应活性次序
H H
O
O C O > CH3 C H> R
O C H>
O C
H
> CH3CCH3
O
O
>
> CH3
O C
R
>
O R C
R' &g;
C
适用范围:只有醛、脂肪族甲基酮、八 个碳原子以下的环酮才能与氢氰酸反应。
练习题
将下列化合物与HCN反应的活性按由大到
小顺序排列:
OH
慢
C
+
C N
快
-
OH C-CN
哪种占优,主要取决于各自中间体的相对稳定性 。
实验事实
(1) 丙酮和氢氰酸反应3-4小时,仅有一半原 料起作用。 (2)若在反应体系中加入一滴氢氧化钾溶液, 则反应可在几分钟内完成。 (3)若加入大量酸,则放置几周也不起反应 。
HCN
H +C N
+
-
实验事实说明羰基与氢氰酸的加成反应是亲核加成。
RC H S O N a 3 O H
(3)与格氏试剂加成
格氏试剂是较强的亲核试剂,非常容易与醛、酮 进行加成反应,加成的产物不必分离便可直接水解生 成相应的醇,是制备醇的最重要的方法之一。
M g X R C O
R H O 2 C O M g X+ + M g ( O H ) C X O H H
R
格氏试剂与甲醛作用,可得到比格氏试剂多一个碳 原子的伯醇;与其它醛作用,可得到仲醇;与酮作用, 可得到叔醇。
反应是可逆的,必须加入过量的饱和亚硫酸氢钠 溶液,以促使平衡向右移动。 适用范围:只有醛、脂肪族甲基酮、八个碳原子 以下的环酮才能与饱和亚硫酸氢钠溶液反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
产物中基团的拥挤程度增大。
Nu:
Nu:
乙醛
丙酮
图11.7 亲核加成反应中的烷基的空间效应
羰基化合物亲核加成的活性次序:
HCHO > CH3CHO > ArCHO > CH3COCH3 > CH3COR> CH3COAr > RCOR' > ArCOAr'
O2N
CHO >
CHO
>
H3C
CHO
(1) 与氢氰酸的加成
Nu:
δ O C
δ
Nu C O H
H Nu
Nu : OH−,H− ,R3C− , NH3, ROH
Nu C O
• C: sp2
sp3
• Nu: 从
C O 的上方或下方进攻
亲核加成通式:
C O + NU
O 亲核 加成
O H+ C O NU
C OH NU
羰基的反应活性
δ
δ O C
影响反应活性的因素 (a) 烃基的电子效应
O
羰基
(carbonyl group)
C
–CHO
O C
醛基
酮基
O
O
O
O
醌
(quinone)
α,β–不饱和
双羰基化合物
“醌式构造”
脂肪醛和酮、芳香醛和酮、
脂环酮
醛和酮 的分类
饱和醛和酮、不饱和醛和酮
一元醛和酮、二元醛和酮 单酮、混酮
11.1
醛和酮的命名
11.1.1 普通命名法 醛:“烃基”
O CH3CH2CH2 C H
RCHO 和 CH3COR NaHSO3 生成α–羟基磺酸钠:
R (CH3)H HO O Na + S O R (CH3)H O Na C SO3H R (CH3)H
加成
OH C SO3 Na
C O
亲核原子
反应特点:
•所有的醛、脂肪族甲基酮和 8 个C以下 的环酮均能发生该反应 •α–羟基磺酸钠在饱和的NaHSO3溶液中 为结晶。由此可用于鉴定
O NU
3 C C H R (H)2、α – 氢的反应
2 羰基的极性使α氢具有活性。
δ+
O
1、羰基的亲核加成反应
3、氧化还原反应
醛和酮的反应部位:
11.5 醛和酮的化学性质
氧化还原反应
O C C H R (H)
亲核加成反应
α-氢的反应
11.5.1 羰基的亲核加成 羰基上的亲核加成反应:
H Nu +
O
烷基的给电效应使羰基稳定, CH 3 降低反应活性; 取代基的吸电效应活化羰基, 提高反应活性。
O CF3 C
C
CH3
CF3
(b) 烃基的空间效应
O R C R
H2O
OH R C OH R
• C: sp2
sp3
R: –H < –CH3 < –C(CH3)3 空间效应依次增大,活性降低。 C: sp2 sp3, 键角: 120° 109.5°
OH C OH
R Li RC
R C RC
O Li C C
H3O+
R C
C Na +
O Na
H3O+
RC C
以醛、酮和有机金属为原料制备醇
甲醛 醛
H H R H R C O
R'M
C O C O
酮 R''
R'CH2OH 伯醇 R CHOH 仲醇 R' R R' COH 叔醇 R''
R’M:碳负离子的等价试剂
第十一章 醛、酮和醌
11.1 醛和酮的命名
11.2 醛和酮的物理性质
11.3 醛和酮的波谱性质 11.4 醛和酮的结构
11.5 醛和酮的化学性质
11.5.1 羰基的亲核加成
11.5.2 α–氢原子的反应
11.5.3 氧化和还原反应
11.6
醛和酮的制法
11.6.1 醛和酮的工业合成
11.6.2 伯醇和仲醇的氧化
HCl(稀)
胡椒醛的提纯:
OH CHO O
NaHSO3 H2O
CH
CHO
NaOH H2O
SO3Na O O + Na2SO3 O 含量 ≥ 95%
O 含量 < 10%
O
晶体
转化为α–羟基腈
CHO NaHSO3
OH CH SO3Na NaCN
OH CH CN
H2O HCl
OH CH 67% COOH
O (CH3)2CHCH2 C CH3 O (CH3)2C
O CH C CH3
O C H
σ / cm-1 1717
1715
1690
1700
1H
NMR:
O C H
δ: 9 ~ 10 δ: ~ 2.2
O CH3C
O CH2C
δ: ~ 2.5
O C H
O C
图 11.3 正辛醛的红外光谱图
O CCH3
醛、甲基酮和脂环酮与HCN作用,生成 α–羟基腈(α–氰醇):
O R C R' + HCN
R R'
C
OH CN
α–羟基腈
反应机理:
O R C R' + C N
慢
R R'
C
O CN
HCN
R R'
C
OH CN
反应特点: • 碱催化反应 • C―C键形成 • ―CN的引入:―CN
―COOH, ―NH2
O CH3CH2 C CH3
• 该反应是可逆反应
R (CH3)H OH C SO3 Na R (CH3)H C O + NaHSO3
产品经稀酸或稀碱处理, 可除NaHSO3。 由此可用于醛、脂肪族甲基酮和8个C以下 环酮的分离、提纯。
Na2CO3(稀)
NaHSO3
NaHCO3 + Na2SO3 NaCl + SO2 + H2O
图11.2 甲醛分子的结构
C
δ
O
δ
C
O
A
C O B
电子离域 偶极矩
μ = (7.7 ~9.7)×10–30C.m
乙醛 (acetaldehyde)
图11.2 乙醛和丙酮 的球棍模型
丙酮 (acetone)
图 11.1 醛分子的结构
C O
极性强
1
δ+
δ-
由于氧的电负性大,成键 电子偏向氧原子,使氧原子带 部分负电荷,羰基碳上带部分 正电荷,羰基为极性基团。
O C
图11.4 苯乙酮的红外光谱图
O
图11. 5 丁酮的核磁共振谱图
1H
C CH3 O C CH2
NMR
δ:2.2 δ:2.5
δ
图11.6苯甲醛的核磁共振谱图
11.4 醛和酮的结构
C O
C C
•羰基的碳原子是sp2杂化 •羰基为平面三角形的几 何构型
H
121.7°
116.5° C
O
H
121.7°
(4-methyl-3-hexanone)
• 不饱和醛和酮的命名是从靠近羰基的 一端编号。
O CH3CH CHCH
CH2 CHCH CHCHO CH3 CH3
2–丁烯醛 (巴豆醛)
2,3–二甲基–4–戊烯醛
O
CH3CH CH–己烯–2–酮
• 命名芳香族的醛和酮,把芳基看成 取代基。
CHO
O C CH2CH3
苯甲醛
1–苯基–1–丙酮
(1-phenyl1-propanone)
•脂环族醛和酮的命名:羰基在环内的—
“环某酮”;羰基在环外的——环作为
取代基。
O
H3C
CH3
CHO
4–甲基环己酮
3–甲基环己基甲醛
11.2 醛和酮的物理性质
状态: 气体:甲醛;液体:C12以下的脂肪醛; 固体:高级的醛和酮 芳醛或芳酮为固体 沸点:醇 > 醛、酮 > 烃和醚 羰基具有极性,但不能形成分子间的氢键
避免使用剧毒HCN
(3) 与醇加成
醛或酮与醇在无水氯化氢或无水强酸催化作用
下经亲核加成反应生成半缩醛 (hemiacetal)或半缩
酮 (hemiketal),进一步反应生成缩醛 或缩酮 。
O R C H OR'
R'OH / H+
OR'
R'OH / H+
R C H
OH
R C H
OR' + H2O
半缩醛
醛和酮能与水形成氢键
11.3 醛和酮的波谱性质
羰基的红外光谱的特征吸收:
C O
伸缩振动
1750 ~ 1630 cm -1 (s) 1740 ~ 1690 cm -1
醛
酮
1750 ~ 1680 cm -1
O C H 伸缩振动
2820 和 2720 cm -1 (m)
羰基与双键共轭,特征吸收向低频方向位移
• β–羟基酯易脱水和水解 ,生成
α,β–不饱和酸
OH C C
H2O, H+ CO2R △
C
C CO2H
① Zn, 甲苯 O + BrCH2COOC2H5 ② H3O+,
OH CH2COOC2H5 (70%)
(5) 与氨及其衍生物的加成缩合反应
甲醛与氨的反应:
H2C O + NH3 H2C NH
