二组分系统气液平衡温度组成图 孙彬芳
第6章 二组分液态部分互溶系统及完全不互溶系统气液平衡相图
C L1’
称为高临界溶解温度或高会溶
富水
温度。
l
L2’
富酚
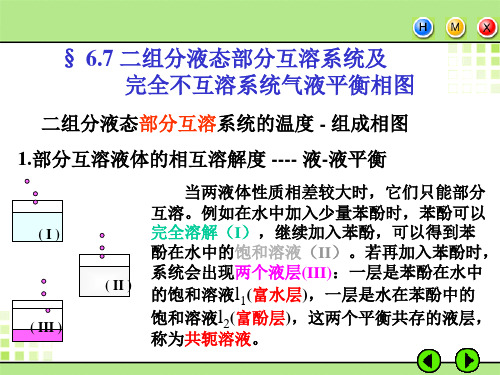
温度高于高会溶温度,液 体水与液体苯酚可完全互溶, 温度低于高会溶温度,两液 体只能部分互溶。
l1+ l2
0M A (水)
N 100
wB /%
B(苯酚)
t
p=const.
e
加热
l1+ l2
g
冷却
的相变化,温度和三相组成均 不变,但三相的数量却在改变, 改变量之间的关系符合杠杆规 则。
二组分系统三相平衡的杠杆规则:
设A、B二组分系统成α,β, γ 三相平衡时,三个相的组成分 别为xB(α)、xB(β)、xB(γ) ,且 xB(γ) 介于xB(α)和xB(β)之间 。如 图:
又为另一液层的饱和蒸汽压。即气相与两个液
L2
相均平衡,而这两个液相相互平衡。
根据这三相组成的关系,可将部分互溶系统气-液平衡的温 度 - 组成图分为两类:
3.部分互溶系统的温度 - 组成图
(1)气相组成介于两液相组成之间的系统
t
P
92
L1 0M A
p=101.325kPa
Q
G L2
wB/%
N 100 B
对照相图理解三相平衡的杠 杆规则
Δn(α) xB ( β ) xB (γ ) Δn( β ) xB (γ ) xB (α)
Δn(α) α
Δn(β) γβ
0 xB(α) xB(γ) xB (β) 1
A
B
Δn(α) [xB (γ ) xB (α)] Δn( β ) [xB ( β ) xB (γ )]
P
4.3 二组分气-液平衡体系

五、完全不互溶双液体系--水蒸气蒸馏
如果两种液体在性质上差别很大,它们间 的相互溶解度很小,这样的体系可看作完全 不互溶的双液系。在这种体系中任一液体的 蒸气压与同温度单独存在时完全一样,并与 两种液体存在的量无关。溶液的总蒸气压等 于两纯组分饱和蒸气压之和。
即:
p p p
* A
* B
不管其相对数量如何,体系的总蒸气压P 大于任一纯组分的蒸气压,因此体系的沸点 必然低于任一液体的沸点。
(三)理想液态混合物的 p-x -y图
若将P=P*A+(P*B-P*A)xB 代入PyB=P*BxB 可得
Px yB * PA ( P P ) xB
* B B * * B A
(xA= 1-xB)
(yA =1-yB)
据此可以分别求得气相和液相的组成。 气相线总是在液相线的下面(见图)
这是 p-x 图的一种,把液相组成 x 和气相组成 y 画在 同一张图上即得 p-x-y 图
(一)产生正负偏差不大的体系
pB p B xA 如图所示,是对拉乌 yB p p 尔定律发生正偏差的情
* B
况,虚线为理论值,实 线为实验值。真实的蒸 气压大于理论计算值。 当正负偏差较小时,溶液 的总蒸气压介于两个纯组 分蒸气压之间。
如:CCl4-环己烷,CCl4-苯
一般偏差体系: p T一定
,
PB= P*BxB)
pA p xA yA p p
A B
pB p xB yB p p
y A p .x A y B p .xB
y A p .x A 若纯液体 B比纯液体A易挥发, y B p .xB 亦即p *> p *,则:
B A
物化-二组分系统气液平衡温度-组成图的绘制

宁波工程学院物理化学实验报告专业班级姓名序号实验日期同组姓名指导老师实验名称二组分系统气液平衡温度-组成图的绘制一、实验目的1、测定在常压下环己烷-乙醇系统的气液平衡数据,绘制系统的沸点组成图;2、确定系统的恒沸温度及恒沸混合物的组成;3、了解阿贝折射仪的测量原理,掌握阿贝折光仪的使用方法。
二、实验原理液体的沸点是指液体的饱和蒸气压和外压相等时的温度。
在一定外压下,纯液体的沸点有确定的值。
但对于完全互溶的双液系,沸点不仅与外压有关,而且还与双液系的组成有关。
本实验采用环乙烷(B)-乙醇(A)系统,其沸点-组成图属于具有最低恒沸点的类型。
在101.325Kpa下,环乙烷的沸点为80.75℃,乙醇的沸点为78.37℃,最低恒沸点为=0.55。
64.8℃,最低恒沸点混合物的组成(摩尔分数)为xB最低恒沸点T-x图沸点仪阿贝折光仪三、实验仪器、试剂仪器:沸点仪1套,NTY-2A型数字式温度计1套,YP-2B精密稳流电源1套,阿贝折射仪1套,HK-1D型恒温水槽1套;试剂:无水乙醇(A.R),环乙烷(A.R),不同组成环乙烷-乙醇混合物。
四、实验步骤1、开启恒温水槽,设定温度为30℃,供阿贝折光仪使用;2、加入试剂,盖好加料口塞子,使电热丝及温度传感器浸入液体中;3、开冷凝水,温度传感器连接NTY-2A型数字式温度计,加热丝连接YP-2B精密稳流电源。
调节稳流电源电流,加热至沸腾。
液体沸腾后,蒸气逸出,经冷凝后流入球形小室。
刚出现在球形小室中的液体不纯,应将其吸取掉,如此2~3次后,待温度恒定后,记下沸点,并停止加热;4、在冷凝管上口冷凝液取样口插入干燥的长吸液管吸取球形小室的气相冷凝液,迅速测其折光率。
用另一根干燥的短吸液管,待沸点仪冷却后,从沸点仪的加料口吸取蒸馏液迅速测其折射率。
实验完毕,将沸点仪中的溶液倒回原瓶;5、同法对1、2、3、4、5、6、7、8以及纯乙醇、纯环己烷进行实验;6、实验结束,关闭电源和冷凝水。
二组分气液平衡相图

实验三二组份气液平衡相图一、目的1、用沸点仪测定和绘制乙醇和环己烷的二组份气液平衡相图;2、用阿贝折射仪测定液体的组成,了解液体折射率的测量原理及方法。
二、基本原理两种液态物质混合而成的二组份系统称为双液系。
二液体若能按任意比例互相溶解,称完全互溶双液系;若只能在一定比例范围内互相溶解,则称部分互溶双液系。
例如水-乙醇双液系、苯-甲苯双液系都是完全互溶双液系,苯-水双液系则是部分互溶双液系。
液体的沸点是指液体的蒸汽压和外压相等时的温度。
在一定的外压下,纯液体的沸点有确定的值,但对于双液系,沸点不仅与外压有关,而且还与双液系的组成有关,即和双液系中两种液体的相对含量有关。
通常用几何作图的方法将双液系的沸点对其气相、液相的组成作图,即得二组份气液平衡相图,它表明溶液在各种沸点的液相组成和与之成平衡的气相组成的关系。
在恒压下,二组份完全互溶双液系的沸点组成图可分为三类:(1)溶液的沸点介于两纯组份沸点之间,如苯和甲苯、水和甲醇等。
(2)溶液有最高沸点,如氯化氢与水、硝酸和水、丙酮与氯仿等。
(3)溶液有最低沸点,如水和乙醇、苯和乙醇、乙醇和环已烷等。
这三种类型的相图如下图所示图4-1 二组份气液平衡相图的三种类型图中、T 分别表示纯A 纯B 的沸点。
图中两曲线包围的区域为气-液两相平衡共存区。
它的上方G 代表气相区,下方L 为液相区。
C 和C'分别表示最高和最低恒沸物的沸点和组成。
T A *B *测绘这类相图时,要求同时测定溶液的沸点及气液平衡时两相的组成。
本实验用回流冷凝法测定环己烷-乙醇溶液在不同组成时的沸点。
所用沸点仪如图4-2所示,是一只带有回流冷凝管的长颈园底烧瓶,冷凝管底部有一球形小室D ,用以收集冷凝下来的气相样品,液相样品则通过烧瓶上的支管L 抽取,图中E是一根电热丝,直接浸在溶液中加热溶液。
溶液的组成用测定其折射率确定。
折射率是物质的一个特征数值。
溶液的折射率与组成有关,因此测得一系列已知浓度的溶液折射率,作出该溶液的折射率-浓度工作曲线,就可按内插法求得具有某折射率的溶液组成。
二组分气液平衡相图

实验三二组份气液平衡相图一、目的1、用沸点仪测定和绘制乙醇和环己烷的二组份气液平衡相图;2、用阿贝折射仪测定液体的组成,了解液体折射率的测量原理及方法。
二、基本原理两种液态物质混合而成的二组份系统称为双液系。
二液体若能按任意比例互相溶解,称完全互溶双液系;若只能在一定比例范围内互相溶解,则称部分互溶双液系。
例如水-乙醇双液系、苯-甲苯双液系都是完全互溶双液系,苯-水双液系则是部分互溶双液系。
液体的沸点是指液体的蒸汽压和外压相等时的温度。
在一定的外压下,纯液体的沸点有确定的值,但对于双液系,沸点不仅与外压有关,而且还与双液系的组成有关,即和双液系中两种液体的相对含量有关。
通常用几何作图的方法将双液系的沸点对其气相、液相的组成作图,即得二组份气液平衡相图,它表明溶液在各种沸点的液相组成和与之成平衡的气相组成的关系。
在恒压下,二组份完全互溶双液系的沸点组成图可分为三类:(1)溶液的沸点介于两纯组份沸点之间,如苯和甲苯、水和甲醇等。
(2)溶液有最高沸点,如氯化氢与水、硝酸和水、丙酮与氯仿等。
(3)溶液有最低沸点,如水和乙醇、苯和乙醇、乙醇和环已烷等。
这三种类型的相图如下图所示图4-1 二组份气液平衡相图的三种类型图中、T 分别表示纯A 纯B 的沸点。
图中两曲线包围的区域为气-液两相平衡共存区。
它的上方G 代表气相区,下方L 为液相区。
C 和C'分别表示最高和最低恒沸物的沸点和组成。
T A *B *测绘这类相图时,要求同时测定溶液的沸点及气液平衡时两相的组成。
本实验用回流冷凝法测定环己烷-乙醇溶液在不同组成时的沸点。
所用沸点仪如图4-2所示,是一只带有回流冷凝管的长颈园底烧瓶,冷凝管底部有一球形小室D ,用以收集冷凝下来的气相样品,液相样品则通过烧瓶上的支管L 抽取,图中E是一根电热丝,直接浸在溶液中加热溶液。
溶液的组成用测定其折射率确定。
折射率是物质的一个特征数值。
溶液的折射率与组成有关,因此测得一系列已知浓度的溶液折射率,作出该溶液的折射率-浓度工作曲线,就可按内插法求得具有某折射率的溶液组成。
完全互溶双液系统气-液平衡相图的绘制(2) 误差分析教学文稿

完全互溶双液系统气-液平衡相图的绘制(2)误差分析大学化学实验Ⅱ实验报告(物理化学部分)(贵州大学化学与化工学院——大学化学教学与示范中心)班级专业:环境科学091姓名:岳凡耀学号: 0908100121指导教师:谭蕾实验成绩:实验编号:十四实验项目名称:完全互溶双液系统气-液平衡相图的绘制报告人:岳凡耀同组人:赵安娜、赵芳、吴红、陈彦霖、孙腾实验时间:2011年4月 28日一、实验目的:1.掌握阿贝折射仪的使用方法通过测定混合物的折射率确定其组成。
2.学习常压下完全互溶双液系统气-液平衡相图的测绘方法,加深对相律、恒沸点的理解。
二、实验原理:相图是描述相平衡系统温度、压力、组成之间关系的图形,可以通过实验测定相平衡系统的组成来绘制。
两种液体物质混合而成的两组分体系称为双液系。
若两液体能以任意比例互溶,称其为完全互溶双液系统;若两液体只能部分互溶,称其为部分互溶双液系统。
当纯液体或液态混合物的蒸气压与外压相等时,液体就会沸腾,此时气-液两相呈平衡,所对应的温度就是沸点。
双液系统的沸点不仅取决于压力,还与液体的组成有关。
表示定压下双液系统气-液两相平衡时温度与组成关系的图称为T-X B图或沸点-组成图。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-X),根据体系对乌拉尔定律的偏差情况,可分为三类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(а)所示。
(2)最大负偏差:混合物存在着最高沸点,如盐酸-水体系,如图1(b)所示。
(3)最大正偏差:混合物存在着最低沸点,如正丙醇-水体系,如图1(c)所示。
图1 完全互溶双液系统的气-液平衡相图在最高沸点和最低沸点处,气相线与液相线相交,对应于此点组成的溶液,达到气-液两相平衡时,气相与液相组成相同,沸腾的结果只使气相量增加、液相量减少,沸腾过程中温度保持不变,这时的温度叫恒沸点,相应的组成叫恒沸组成。
压力不同,同一双液系统的相图不同,恒沸点及恒沸组成也不同。
完全互溶双液系统气-液平衡相图的绘制(2) 误差分析

大学化学实验Ⅱ实验报告(物理化学部分)(贵州大学化学与化工学院——大学化学教学与示范中心)班级专业:环境科学091姓名:岳凡耀学号:0908100121指导教师:谭蕾实验成绩:实验编号:十四实验项目名称:完全互溶双液系统气-液平衡相图的绘制报告人:岳凡耀同组人:赵安娜、赵芳、吴红、陈彦霖、孙腾实验时间:2011年4 月28 日一、实验目的:1.掌握阿贝折射仪的使用方法通过测定混合物的折射率确定其组成。
2.学习常压下完全互溶双液系统气-液平衡相图的测绘方法,加深对相律、恒沸点的理解。
二、实验原理:相图是描述相平衡系统温度、压力、组成之间关系的图形,可以通过实验测定相平衡系统的组成来绘制。
两种液体物质混合而成的两组分体系称为双液系。
若两液体能以任意比例互溶,称其为完全互溶双液系统;若两液体只能部分互溶,称其为部分互溶双液系统。
当纯液体或液态混合物的蒸气压与外压相等时,液体就会沸腾,此时气-液两相呈平衡,所对应的温度就是沸点。
双液系统的沸点不仅取决于压力,还与液体的组成有关。
表示定压下双液系统气-液两相平衡时温度与组成关系的图称为T-X B图或沸点-组成图。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-X),根据体系对乌拉尔定律的偏差情况,可分为三类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(а)所示。
(2)最大负偏差:混合物存在着最高沸点,如盐酸-水体系,如图1(b)所示。
(3)最大正偏差:混合物存在着最低沸点,如正丙醇-水体系,如图1(c)所示。
图1 完全互溶双液系统的气-液平衡相图在最高沸点和最低沸点处,气相线与液相线相交,对应于此点组成的溶液,达到气-液两相平衡时,气相与液相组成相同,沸腾的结果只使气相量增加、液相量减少,沸腾过程中温度保持不变,这时的温度叫恒沸点,相应的组成叫恒沸组成。
压力不同,同一双液系统的相图不同,恒沸点及恒沸组成也不同。
本实验采用回流冷凝的方法绘制乙醇-环己醇体系的T-X B图。
6-2 物理化学相图

即,液相的量 线段oy的长度 类似于杠杆原理
气相的量 线段xo的长度
两相的量之比,可根据系统总组成、平衡的两相的组成求得。(注意单位)
实际溶液的蒸气压-组成图
实际溶液:根据溶液蒸气压的测量结果,绘制相图
l
l+g
p p
l l+g g
B 正偏差 A
A
s
101325 Pa
G
g
O C
100 374 T/ ℃
气固平衡线OC
OC线上的点代表冰和冰蒸气的两相平衡系统
OC线上的温度代表冰的升华温度,压力代表冰的蒸气压
p
B
l
2.23
×107
Pa
A
s
M
101325 Pa
G
g
O C
0
100 374 T/ ℃
固液平衡线OB OB线上的点代表水和冰的两相平衡系统 OB线是冰的熔点随压力变化的曲线:熔点随压力增加而降低
当 1时,f 3 1 2,需要2个变量来确定平衡系统 当 2时,f 3 2 1,只需要1个变量来确定平衡系统 当 3时,f 3 3 0,该平衡系统固定,不需变量确定
p
l
2.23
×107
Pa
A
s
101325 Pa
G C′
g
O
100 374 T/ ℃
TB*
x4
A(苯) B
从 实验绘制 T-x 图
T /K
混合物起始组成为 x1,加热到温度为T1 液体开始沸腾,D点 称为泡点,对应气相 组成为x2 组成为F的气体冷 到E,有组成为x1的 液体出现,E点称为 露点
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
宁波工程学院
物理化学实验报告
专业班级化工095 姓名孙彬芳序号09402010503
同组姓名陈茜茜指导老师罗利娟、蒋仲庆实验日期2011.3.23
实验名称二组分系统气液平衡温度——组成图的绘制
一、实验目的
1. 测定在常压下环己烷—乙醇系统的气液平衡数据,绘制系统的沸点—组成图像。
2. 确定系统的恒沸温度及恒沸混合物组成。
3. 了解阿贝折射仪的测量原理,掌握阿贝折射仪的使用方法。
二、实验原理
液体的沸点是指液体的饱和蒸汽压和外压相等时的温度。
在一定外压下,纯液体的沸点有确定的值。
但对于完全互溶的双液体系,沸点不仅与外压有关,而且还与双液体系的组成有关。
本实验采用环己烷(B)—乙醇(A)系统,其沸点组成图属于具有最低恒沸点的类型(如图2—21所示)。
在101325pa下,环己烷的沸点为80,75℃,乙醇的沸点为78.37℃,最低恒沸点混合物的组成(摩尔分数)为X B=0.55。
实验采用的是沸点仪装置,如图Ⅲ-7-2所示。
它是一只带有回流冷凝水的长颈圆底烧瓶,冷凝管底部有球形小室5用以收集冷凝下来的气相样品。
烧瓶上的加料口2用于混合物的加入和液相样品的吸取。
电热丝3直接浸在混合物加热混合物,温度传感器1浸在页面下。
用沸点仪直接测定一系列不同组成的液态混合物的气液平衡温度,并收集少量馏出物和蒸馏液,分别用阿贝折射仪测定折射率,利用环己烷(B)—乙醇(A)二组分系统的折射率—组成工作曲线,查出对应样品折射率的组成。
三、实验仪器、试剂
仪器:无水乙醇(A,R)、环己烷(A,R)、不同组成环己烷—乙醇混合物
试剂:沸点仪1套、NTY-2A型数字式温度计1套、YB- 2P精密稳流电源1套、阿贝折射仪1套、HK-1D型恒温水槽1套等
四、实验步骤
1.开启恒温水槽,设定水温为30℃,供阿贝折射仪使用。
2.加入试剂,盖好加料口塞子,使电热丝及温度传感器浸入液体中。
3.开冷凝水,温度传感器连接NTY-2A型数字式温度计,加热丝连接YP-2B精密稳流电源。
调节稳流电源电流,加热至沸腾。
液体沸腾后,蒸气逸出,经冷凝后流入球形小室,最初在冷凝管下端球形小室的液体不能代表平衡时气相组成,为加速达到平衡将小室内最初冷凝的也挺倾回沸点仪内,并反复2~3次,待温度读数恒定后记下沸点并停止加热。
4.在冷凝管上口冷凝液取样口插入干燥的长吸液管吸取球形小室中的气相冷凝液,迅速测其折光率,测完以后,将沸点仪中溶液倒回原瓶。
5.同时完成1,2,3,4,5,6,7,8,纯乙醇以及纯环己烷实验。
6.实验结束,关闭电源及水源。
五、数据记录与处理
1、30℃时,已知组成的环己烷(B)—乙醇(A)二组分系统的折射率表见表2.4.1
由表2.4.1制作环己烷(B)—乙醇(A)二组分系统的工作曲线
2、由气相和液相样品的折射率数据,从折射率—组成的工作曲线上,用内插法查的相应的组成,并记录于表2.4.2中
实验温度:30.0℃大气压101.325Kpa
斜率:0.06486 截距:1.36051
直线方程为Y=0.06486X+1.36051
由直线方程可以得到液相X B气相Y B。
(表)已知组成的环己烷(B)—乙醇(A)二组分系统的折射率(温度:30.0℃)
(图)已知组成的环己烷(B)—乙醇(A)二组分系统的折射率工作曲线
由环己烷(B)—乙醇(A)二组分系统的气液温度—组成图确定二组分系统的恒沸点为63.5℃,恒沸混合物的组成X B=0.505。
六、结果与讨论
X B=0.505<X B(理论)=0.55,最低恒沸温度63.5℃小于理论最低恒沸点64.8℃,造成较大误差的原因可能是:
1.从吸取液体到测其折光率时并不是十分迅速,这段时间可能对测定其折光率有所影响,尤其是气相测定影响较大。
2.测量下一组液体的折射率时没有将折射仪彻底洗净,导致误差。
3. 个人读数的标准不同,读出来的数据不同,导致误差。
4. 第3组测定的气相x B的值偏差较大,应该是操作者读取仪器读数时造成的随机误差所决定的。
5. 从二组分系统工作曲线读取x B和y B时,读取的数据偏差很大,容易造成随机误差,以致画出的二组分沸点组成图跟理论图有所偏差。
