价键理论、晶体场理论讲解
第二章 价键理论、晶体场理论

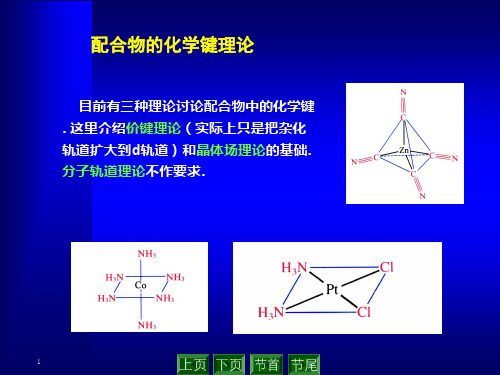
第二章配合物的化学键理论内容:研究中心原子和配体之间结合力的本性。
目标:解释性质,如配位数、几何结构、磁学性质、光谱、热力学稳定性、动力学反应性等。
三种理论:①价键理论、②晶体场理论、③分子轨道理论第一节价键理论(Valence bond theory)由L.Pauling提出一、理论要点:①配体的孤对电子可以进入中心原子的空轨道;中心原子总是用空轨道杂化,然后用杂化轨道接收配体提供的孤对电子。
②中心原子用于成键的轨道是杂化轨道(用于说明构型)。
中心原子的价层电子结构与配体的种类和数目共同决定杂化类型。
③杂化类型决定配合物的空间构型,磁距和相对稳定性。
二、轨道杂化及对配合物构型的解释能量相差不大的原子轨道可通过线性组合构成相同数目的杂化轨道。
对构型的解释(依据电子云最大重叠原理:杂化轨道极大值应指向配体)指向实例sp3、sd3杂化四面体顶点Ni(CO)4sp2、sd2、dp2、d3杂化三角形顶点[AgCl3]2-dsp2、d2p2 杂化正方形顶点[PtCl4]2-d2sp3杂化八面体顶点[ Fe(CN)6]4-sp杂化直线型[AgCl2]-三、内轨型和外轨型若要形成ML6型配合物(L为单齿配体),则需要6个空杂化轨道接收6个L提供的孤电子对,满足该条件的杂化类型有d2sp3和sp3 d2。
尽管这两种杂化都导致八面体型配合物,但前者是次外层(n-1)d轨道,而后者是最外层nd轨道,因此与这两种杂化相应的配合物分别称内轨型和外轨型配合物。
中心原子的价层电子数和配体的性质都是影响配合物内轨型和外轨型的因素。
当d电子数≤3时,该层空d轨道≥2,总是生成内轨型配合物。
当中心原子价层d电子数为7~10时,即使强制d轨道中的电子配对,所能得到的该层空d轨道数也小于2,因此只能用最外层d轨道参与杂化,总是生成外轨型配合物。
当中心原子价层d电子数为4~6时,对于配位能力较强的配体,即配位原子电负性较小,容易给出孤电子对,对中心原子价层d电子排布影响较大,强制d电子配对,空出2个价层d轨道参与d2sp3杂化,生成内轨型配合物.若配体的配位能力较弱,即配位原子电负性较大,则不易给出孤电子对,对中心原子价层d电子排布影响较小,只能用最外层d轨道参与杂化,生成外轨型配合物。
价键理论和晶体场理论
67.524 ×10-20 35.250 ×10-20 强 3d6 t2g6 eg0 0 0 低自旋 内轨型 d2sp3
八面体场中电子在t 八面体场中电子在 2g和eg轨道中的分布
只 有 一 种 排 列 1 d4 2 d5 3 d6 2 d7 1 d1 d2 d3 d8 d9
高 自 旋
4
5
4
3
低 自 旋
+ [Cr (H2O)6]3+ [Cr (H2O)6]2+ [CrCl6]3-
[MoCl6]319200
∆o /cm-1
17600
14000
13600
配位体的影响: ● 配位体的影响:光谱化学序列 (ectrochemical series) [Co(H2O)6]3+ [CoF6]3[Co(NH3)6]3+ [Co(CN)6]313000 18600 22900 34000 ∆o /cm-1 各种配体对同一M产生的晶体场分裂能的值由小到大的顺序 产生的晶体场分裂能的值由小到大的顺序: 各种配体对同一 产生的晶体场分裂能的值由小到大的顺序 I-<Br-<Cl-,SCN-<F-<OH-<C2O42<H2O<NCS-<edta<NH3<en<bipy <phen<SO32-<NO2<CO, CN初步看作是配位原子电负性的排列: 初步看作是配位原子电负性的排列: 卤素 < 氧 < 氮 < 碳 电负性
直 线 形
平面 三角形
正四 面体
平面 正方形
三角 双锥 形四方 锥形(2) 配 Nhomakorabea物的磁性
配合物磁性的测定是判断配合物结构的一个重要手段. 配合物磁性的测定是判断配合物结构的一个重要手段 物质在磁场中表现出来的性质. 磁 性:物质在磁场中表现出来的性质 顺磁性: 顺磁性:被磁场吸引 n > 0 , µ > 0,如O2, NO, NO2. , 反磁性: 反磁性:被磁场排斥 n =0 , µ = 0. 铁磁性:被磁场强烈吸引 铁磁性:被磁场强烈吸引. 例:Fe,Co,Ni. , , 磁 矩: µ=[n(n+2)]1/2 (B.M.)玻尔磁子 玻尔磁子. 玻尔磁子
配位化学第三章

实例:
[Ti(H2O)6]3+ K3[Mn(CN)6] K3[Fe(CN)6]
Ti3+: 3d1 Mn3+: 3d4 Fe3+: 3d5
µ=1.73 n =1 µ=3.18 n =2 µ=2.40 n =1
配位化学第三章
配合物的空间构型与中心离子的 杂化类型、配位数的关系
配位数 2
4
6
杂化
类型 sp
CN-的成键π2pz 轨道肩并肩重叠形成离域π键。
CN
NC
CN
Ni2+
配位化学第三章
NC
3.1.2 价键理论的应用
(1)解释了配合物的空间构型 (2)说明配合物的磁性 (3)比较同类配合物的稳定性
配位化学第三章
举例说明:
1. 已知[Ag(NH3)2]+的μm=0,用VB法说明其空
间结构。
4d
5s
5p
Ag+ [Kr]
4d
5p
[Ag(NH3)2]+
NH3 NH3 sp杂化 所以[Ag(NH3)2]+的空间构型为直线型。
配位化学第三章
2. [BeX4]2-的空间构型为四面体。为什么?
Be2+
1s
2s
2p
[BeX4]2-
1s
X- X- X- X-
sp3杂化
在[BeX4]2- 中,由于Be2+采取sp3杂化,所以 [BeX4]2-的 空间构型是正四面体。
dsp2
sp3 sp3d2或d2sp3
型空 间 构
直线形 平面正方形
四面体
八面体
举例:Ag(NH3)2 Ni(C)N24 NiCl24
配合物的化学键理论

杂化
轨道 sp3d2 d2sp3
sp3
dsp2
配键 类型 外轨型 内轨型
外轨型
内轨型
Kf 1014
稳定性
<
1042
107. 96
1031. 3
<
磁性
Ni2+的d电子构型 杂化轨道 配键类型
未成对电子数 磁性
[Ni(NH3)4]2+ [Ni(CN)4]2 d8
sp3 外轨型
dsp2 内轨型
2 顺磁性
弱场配体
强场配体
——以上称为光谱化学序列
4. 电子成对能和配合物高、低自旋
电子在分裂后轨道上的分布遵循: 能量最低原理和洪特规则
如 Cr3+ d3
eg
E t2g
八面体场
d4d7构型的离子, d电子分布有高、低自旋两种方式。
如 Cr2+ d4
[Cr(H2O)6]2+
eg
△o t2g
[Cr(CN)6]4-
中心离子和配体之间以静电引力相互作用而形 成化学键。
中心离子的5个能量相同的d轨道受配体负电场 的排斥作用,发生能级分裂(有的轨道能量升 高,有的能量降低)。
2. 正八面体场中d轨道的能级分裂
无外电场作用下的d轨道 Edxy= Edxz= Edyz= Edx2-y2= Edz2
在带负电荷均匀球形场的作用下,d轨道能量 均升高相同值,能级不发生分裂。
请问: [Zn(NH3)4]2+、 [Ag(NH3)2]+呈现什么颜色?
中心离子d 轨道全空(d0)或全满(d10), 不能发生 d-d跃迁,其水合离子为无色。
解释配合物的稳定性
Eeg=+0.
配位化学讲义 第四章(1) 价键理论、晶体场理论

配位化学讲义第四章(1)价键理论、晶体场理论第三章配合物的化学键理论目标:解释性质,如配位数、几何结构、磁学性质、光谱、热力学稳定性、动力学反应性等。
三种理论:①价键理论、②晶体场理论、③分子轨道理论第一节价键理论(Valencebond theory)由L.Pauling提出要点:①配体的孤对电子可以进入中心原子的空轨道;②中心原子用于成键的轨道是杂化轨道(用于说明构型)。
一、轨道杂化及对配合物构型的解释能量相差不大的原子轨道可通过线性组合构成相同数目的杂化轨道。
对构型的解释(依据电子云最大重叠原理:杂化轨道极大值应指向配体)指向实例sp3、sd3杂化四面体顶点Ni(CO)4sp2、sd2、dp2、d3杂化三角形顶点[AgCl3]2-dsp2、d2p2 杂化正方形顶点[PtCl4]2-d2sp3杂化八面体顶点[Fe(CN)6]4-sp杂化直线型[AgCl2]-二、AB n型分子的杂化轨道1、原子轨道的变换性质考虑原子轨道波函数,在AB n分子所属点群的各种对称操作下的变换性质。
类型轨道多项式sp x xp p y yp z zd xy xyd xz xzd d yz yzd x2-y2x2-y2d z22z2-x2-y2(简记为z2)*s轨道总是按全对称表示变换的。
例:[HgI3]- (D3h群)平面三角形A1′:d z2、sE′:(p x、p y )、(d x2-y2、d xy)A 2″:p zE″:(d xz、d yz)2、σ轨道杂化方案1)四面体分子AB4(Td)[CoCl4]2-以四个杂化轨道的集合作为分子点群(Td)表示的基,确定该表示的特征标:r1r4r2r3恒等操作,χ(E)=4 C3操作,χ(C3)=1对C2、S4和σd用同样方法处理,得T d E 8C3 3C2 6S46σdΓ 4 1 00 2约化:T d E 8C3 3C2 6S4 6σdA1 1 1 1 11A2 1 1 1 -1 - 1E 2 -1 2 00 (z2, x2-y2)T1 3 0 -1 1 -1T2 3 0 -1 -11 (xy,xz,yz) (x,y,z)a(A1)=1/24(1×4+8×1×1+3×1×0+6×1×0+6×1×2)=1a(A2)=1/24 [1×4+8×1×1+3×1×0+6×(-1)×0+6×(-1)×2]=0a(E)=1/24 [2×4+8×(-1)×1+3×2×0+6×0×0+6×0×2]=0a(T1)=1/24 [3×4+8×0×1+3×(-1)×0+6×1×0+6×(-1)×2]=0a(T2)=1/24 [3×4+8×0×1+3×(-1)×0+6×(-1)×0+6×1×2]=1约化结果Γ=A1+T2由特征标表:A1T2s(p x、p y、p z)(d xy、d xz、d yz)可有两种组合:sp3(s、p x、p y、p z)、sd3(s、d xy、d xz、d yz)* 以一组杂化轨道为基的表示的特征标的简化计算规则:①不变(1)②改变符号(-1)③与其他函数变换(0)2)再以[CdCI5]3-三角双锥(D3h)为例:41325D3h E 2C33C2σh2S3 3σvΓ 5 2 13 0 3约化结果:Γ= 2A1′+A2〞+E′A1′A2〞E′s p z (p x、p y)d z2(d xy、d x2-y2)两种可能的组合:(s、d z2、p z 、p x、p y)( s、d z2、p z、d xy、d x2-y2)3)[HgI3]- ( D3h)123D3h E 2C3 3C2σh2S33σvΓ 3 0 13 0 1约化得:Γ=A1′+E′A1′E′s (p x、p y)d z2(d xy、d x2-y2)可能的组合有:(s、p x、p y)、(s、d xy、d x2-y2)、(d z2、p x、p y)、(d z2、d xy、d x2-y2)4)平面AB4型分子(D4h)例:[PtCl4]2-C2′C2″D4h E 2C4(C41,C43) C2(C42) 2C2′2C2″i 2S4σh 2σv2σdΓ 4 0 0 20 0 0 4 2 0约化得:Γ=A1g+B1g+E uA1g B1g E us d x2-y2(p x、p y)d z2两种类型:dsp2(d x2-y2、s、p x、p y)、d2p2(d z2、d x2-y2、p x、p y)5)八面体AB6(O h) 例:[Fe(H2O)6]3+O h E 8C3 6C26C4 3C2i 6S4′8S6 3σh 6σdΓ 6 0 0 2 2 0 0 0 4 2约化得:Γ=A1g+E g+T1u A1g E gT1us (d z2、d x2-y2) (p x、p y、p z)只有唯一的d2sp3杂化(d z2、d x2-y2、s、p x、p y、p z)3、π成键杂化方案在AB n分子中,原子A上要有2n个π型杂化轨道和在B原子上的2n个π原子轨道成键。
配合物的价键理论

sp sp2 sp3 d2sp2 d2sp3
直线型 三角形 正四面体 四方锥
正八面体 [Fe(CN)6]4-
一定程度上解释了配合物的磁学性 质
顺磁性的[Ni(H2O)6]2+:
•• •• •• •• •• ••Fra bibliotek3d4s
4p
4d
sp3d2杂化,外轨型
3、 价键理论的缺点
i. 不能预测配合物的高、低自旋状态
称为光谱化学序列 说明: (1)即配位场强的顺序,几乎和中心离子无关。 说明: )即配位场强的顺序,几乎和中心离子无关。 (2)强场配位体:∆o大 )强场配位体: 者 弱场配位体: 弱场配位体:∆o小者
值随中心离子而改变。 ②当配位体固定时, △o值随中心离子而改变。 当配位体固定时, A、中央离子电荷愈高,△o值愈大。 、中央离子电荷愈高, 值愈大。 例如
个配体需要6个杂化轨道 解:6个配体需要 个杂化轨道 d2sp3或 sp3d2 个配体需要 或
Mn2+ 3d5:
µ实测表明有1个单电子:
有2个内层空d轨道,采取d2sp3杂化; 八面体,内轨型,较稳定
2、价键理论的优点 很好地解释了配合物的空间构型和配位数
配位数 2 3 4 5 6 杂化轨道 空间构型 举例 [Ag(CN)2][CuCl3]2[MnCl4]2NiBr3(PR3)
⑴定义 d电子从未分裂的d轨道进入分裂的d轨道所产生的总能量下降 值,称为晶体场稳定化能,并用CFSE表示。 dz2, d(x2-y2) eg 10Dq
6Dq
Es
自由离子d轨道 球形场
4Dq
dxz,dxy,dyz
t2g
d轨道在Oh场中轨道能级的分裂图
量子力学指出:
第12章晶体场部分
Co2+ d7
eg 弱场
△o
t2g
△O<P 高自旋
排布式: t2g5 eg2 dε5 dγ2
△´o
eg 强场△O t2g >P低
自旋
排布式: t2g6 eg1
dε6 dγ1
d8、d9、d10构型的离子
d电子排布只有一种方式
d8 如Ni2+
d9 如Cu2+ d10 如Zn2+ Cu+
△t =
4 9
△o
△s = 17.2 Dq
4. d 轨道能级分裂后的电子排布
电子在分裂后轨道上的分布遵循
—能量最低原理和洪特规则
d1-d3构型的离子
如 Ti 3+
电子分布在d轨道
eg
Ti 3d24s2 E
Ti3+ 3d1
球形场中 (未分裂)
t2g
八面体场
Ti 3+的d电子能级分裂前后的排布
d1-d3构型的离子
Fe3+ d5
[FeF6]3F-是弱场 高自旋
eg △o
g
分布式: t2g3 eg2 dε3 dγ2
[Fe(CN)6]3CN-是强场 低自旋
eg △´o
t2g
t2g5 eg0 dε5 dγ0
Co3+ Fe2+ d6
eg △o
t2g
排布式: t2g4 eg2 dε4 dγ2 eg
△´o t2g
△´o
eg △´o
t2g
eg t2g △´o
eg t2g
弱场
未成对
t2g eg 电子数
强场
未成对
第一节 晶体场理论
△ (b)
Eb=E0+(E0+P)=2E0+P
若△〉P,则(b)稳定 强场时低自旋排布稳定
对于 d 组态也类似,这个结论得到了络合物磁性 测定的证实。现列于表3-1.3中。
表 组态 d4 离子 Cr2+ Mn3+ Mn2+ Fe3+ Fe2+ d6 d7 Co3+ Co2+
2 E t2 1.78Dq 5 t 3 E e 2.67 Dq 5 t
如下面的d轨道能级分裂图
t2
2 t 5
3 t 5
4 4 t 9 0 9 10Dq
Es
自由离子d 轨道
球形场
八面体场
e
Td场中d轨道能级的分裂图
可见
在四面体场中,d轨道分裂结果是:相对Es而言,
例如
(FeF6)3-, [Ni(NH3)6]2+
•Fe3+ d5 n=5 • Ni2+ d8
n=2
中心离子的d电子结构与自由离子相同,可见电 价络合物中,自旋平行的电子达到可允许的最 大值,称为高自旋络合物,这可用实践性测量 证明。
复
习
共价配键
共价配键中央离子以空的杂化轨道接受配体的孤对电子时形
yL
d
x
L
xz
d
yz
d
z
和 d x 2 y 2 轨道 : 电子云极大值正好与配位体迎头相撞
因此
受到较大的推斥,使轨道能量升高较多 另三个d 轨道的电子云极大值正好 插在配位体之间,受到推斥力较小。
但是
总之,由于八面体配位物的作用,使中央d轨道分裂成两组: 一组:d(x2-y2)
聊聊配合物那些事,价键理论和晶体场理论
聊聊配合物那些事,价键理论和晶体场理论今天刚好学生答辩,答辩中途惊闻袁老去世的消息。
怎么说呢,有的人伟大到,你以为他远离了生老病死。
或者,活在活着的人们心中,他就是永远活着。
除了难过,突然给自己又像上了发条一样。
是不是也需要在自己喜欢职业上,去更加努力?如果热爱,就热爱到老。
配合物是一个很神奇的方向,今天11位学生答辩,几乎每一位学生做的研究,都离不开配合物,准确一点说,现在的各种材料,离不开配位键。
单分子磁体、荧光材料、生物材料。
可以是新合成的功能有机配体,与金属离子形成新的功能配合物,也可是金属离子与刚性配体通过配位键形成的多孔材料,还有各种神奇的复合材料。
什么是配合物?是不是所有的配合物都有内界和外界?上面举出例子,中性配合物分子(或者说,配位单元是中性分子)就没有内界和外界之分。
另外要特别注意配位数的概念。
这里的配位数,我们只需要有一个印象,一定要特别注意,配体的个数,不等于配位数。
只有单齿配体(一个配体提供一个配原子)时,配体的个数才和配位数相等。
常见的二齿配体,是乙二胺,和草酸根,这个一定要根深蒂固的记住,因为一个二齿配体就代表着2个配位数,这会影响后面的构型的判断。
EDTA是常见的6齿配体,一个配体提供6个配位原子。
注意注意:氨是无机配体。
这个构型是不是瞅着很眼熟?和前面的学到的杂化轨道是不是有些类似?这个配体尽可能远离,是不是和价层电子对互斥理论有些类似?关于磁矩中n:配合物中,中心离子的成单电子数。
也就是,配位后,中心离子的成单电子数!上面是配合物的基本概念。
然后是价键理论。
形成几个配位σ键(这里为什么强调是σ键,因为有的Π键是以配位键的形式存在的后面我们会讲 p-d Π键),就需要中心离子提供几个空轨道,中心离子用空轨道进行杂化。
这里要注意几点:1. 三大强配体,CN-, CO, -NO2- ,和金属离子配位时,会是3d轨道上的电子重排,如果重排后空出内层3d轨道,就会采取内轨型杂化方式。
价键理论-晶体场-配位化合物
晶体场分裂(CRYSTAL FIELD SPLITTING)
自由离子
八面体
四面体
平面正方形
FREE ION OCTAHEDRAL TETRAHEDRAL SQUARE影响
❖
和晶体场的分裂能
❖ 二、 影响分裂能大小的因素
§3 配合物的化学键理论
CHEMISTRY BOND THEORY OF COORDINATION COMPOUNDS
3.1 价键理论
VALENCE BOND THEORY
3.2 晶体场理论
CRYSTAL FIELD THEORY, CFT
3.3 分子轨道理论
自1798年(18世纪末)Tarsert(塔赦特)在实验室制得第一个配 合物[Co(NH3)6]Cl3六氨合钴(III)氯化物后的近百年中,很多科学家都 力求对这种化合物的结构作出科学的解释,但直到1893 年瑞士科学家 维尔纳(Werner. A. 1866–1919 享年53岁)才提出配位理论,成为配位 化学中价键概念的一项指导原则,成为配位化学的奠基人。维尔纳因此 而得到诺贝尔化学奖。
成体可能采取d2sp3或sp3d2杂化轨道成键。
[Fe(CN)6]3- ,μ=2.4B.M. ;
3d
4s 4p
Fe3+
[Fe(CN)6]3-
d2sp3杂化 CN-CN- CN- CN-CN-CN-
内轨配键。以内轨配键形成的配合物叫 内轨形配合物。
[FeF6]3- ,μ=5.90B.M.
3d
4s 4p 4d··
[BeX4]2-的空间构型为四面体。
1s
2s
2p
Be2+
1s [BeX4]2-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章配合物的化学键理论目标:解释性质,如配位数、几何结构、磁学性质、光谱、热力学稳定性、动力学反应性等。
三种理论:①价键理论(Valence bonding theory VBT)②晶体场理论(Crystal field theory CFT)③分子轨道理论(Molecular orbital theory MOT)第一节价键理论由L. C. Pauling提出要点:①配体的孤对电子可以进入中心原子的空轨道;②中心原子用于成键的轨道是杂化轨道(用于说明构型)。
一、轨道杂化(Hybrid orbital)及对配合物构型的解释能量相差不大的原子轨道可通过线性组合构成相同数目的杂化轨道。
对构型的解释(依据电子云最大重叠原理:杂化轨道极大值应指向配体)指向实例sp 3、sd 3杂化 四面体顶点 Ni(CO)4COCOOCCOsp 2、sd 2、dp 2、d 3杂化 三角形顶点 [AgCl 3]2-Cl ClClAgdsp 2、d 2p 2 杂化 正方形顶点 [PtCl 4]2-ClClClClPtd 2sp 3杂化 八面体顶点 [Fe(CN)6]4-CNNCFeNCCNsp杂化直线型[AgCl2]-二、AB n型分子的杂化轨道1、原子轨道的变换性质考虑原子轨道波函数,在AB n分子所属点群的各种对称操作下的变换性质。
O.+xf = x(p x) = ?类型轨道多项式sp x xp p y yp z zd xy xyd xz xzd d yz yzd x2-y2x2-y2d z22z2-x2-y2(简记为z2)*s轨道总是按全对称表示变换的。
2、如何判定原子轨道波函数的对称类型例:[HgI 3]− (D 3h 群)平面三角形III HgD 3hE 2C 33σv 11111-12-10z(x, y)x 2+(x 2(x3C 2σh 2S 3A 1'A 2'E'A 1"A 2"11111-12-101111-1-111-1-1-112-1-21E"A1′:d z2、sE′:(p x、p y )、(d x2-y2、d xy)A2″:p zE″:(d xz、d yz)3、轨道杂化方案步骤:A、以一组杂化轨道集合作为分子所属点群表示的基,写出群的表示。
B、将上述表示约化为不可约表示。
C、在点群的特征标表中查出与上述不可约表示对应的原子轨道。
D、确定原子轨道的正确组合。
1)四面体分子AB4(Td)[CoCl4]2−以四个杂化轨道的集合作为分子点群(Td)表示的基,确定该表示的特征标:r1r4r2r3T d E 8C 3 3C 2 6S 4 6σdΓ ? ? ? ? ?r 1r 2r 3r 4恒等操作,χ(E)=4000100110r2r300001r4r1r2r3r4r1r 1r 2r 3r 4C 3C 3操作,χ(C 3)=1100100000r2r300101r4r1r3r4r2r1r 1r 2r 3r 4C 2C 2操作,χ(C 2) = 0000011000r2r300101r4r1r1r4r3r2r 1r 2r 3r 4S 4旋转反映操作 χ(S 4) = 0110000000r2r310001r4r1r3r1r2r4r 1r 2r 3r 4反映操作 χ(σd ) = 2000100100r2r300101r4r1r2r4r3r1T d E 8C 3 3C 2 6S 4 6σdΓ 4 1 0 0 2约化:T d A 1A 2E T 1T 2E 8C 33C 26S 46 d 11111111-1-12-1200330-11-10-1-11(xy, yz,xz)(2z 2-x 2-y2a(A 2) =a(E) =a(A 1) =a(T 1) =a(T 2) =241241241241241×[3×4+8×0×1+3×(-1)×0+6×(-1)×0+6×1×2]×[3×4+8×0×1+3×(-1)×0+6×1×0+6×(-1)×2×[2×4+8×(-1)×1+3×2×0+6×0×0+6×0×2]×[1×4+8×1×1+3×1×0+6×(-1)×0+6×(-1)×(1×4+8×1×1+3×1×0+6×1×0+6×1×2)=1约化结果Γ=A1+T2由特征标表:A1T2s (p x、p y、p z)(d xy、d xz、d yz)可有两种组合:sp3(s、p x、p y、p z)、sd3(s、d xy、d xz、d yz)* 以一组杂化轨道为基的表示的特征标的简化计算规则:①不变(1)②改变符号(-1)③与其他函数变换(0)2)再以[CdCl5]3−三角双锥(D3h)为例:42135D3h E 2C33C2 σh 2S3 3σvΓ 5 2 1 3 0 3约化结果:Γ= 2A1′+A2〞+E′A1′A2〞E′s p z (p x、p y)d z2(d xy、d x2-y2)两种可能的组合:(s、d z2、p z 、p x、p y)( s、d z2、p z、d xy、d x2-y2)3)[HgI3]− ( D3h)213D3h E 2C3 3C2 σh 2S33σvΓ 3 0 1 3 0 1约化得:Γ=A1′+E′A1′E′s (p x、p y)d z2(d xy、d x2-y2)可能的组合有:(s 、p x 、p y )、 (s 、d xy 、d x 2-y 2)、(d z 2、p x 、p y )、 (d z 2、d xy 、d x 2-y 2)4)平面AB 4型分子(D 4h ) 例:[PtCl 4]2−C 2'C 2"r 2r 3r 4r 1D4h E 2C4(C41,C43) C2(C42) 2C2′2C2″i 2S4σh 2σv2σdΓ 4 0 0 2 0 0 0 4 2 0约化得:Γ=A1g+B1g+E uA1g B1g E us d x2-y2(p x、p y)d z2两种类型:dsp2(d x2-y2、s、p x、p y)、d2p2(d z2、d x2-y2、p x、p y)5)八面体AB6(O h) 例:[Fe(H2O)6]3+r1r2r5r3r4r6C3C 4C2O h E 8C3 6C26C4 3C2i 6S4′8S6 3σh 6σdΓ 6 0 0 2 2 0 0 0 4 2约化得:Γ=A1g+E g+T1uA1g E g T1us (d z2、d x2-y2) (p x、p y、p z)只有唯一的d2sp3杂化(d z2、d x2-y2、s、p x、p y、p z)4、对配合物磁性的解释1)配合物磁性与配合物中成单电子数的关系配合物的分子磁矩μ与配合物中未成对电子数n 有关。
如:对某些配合物:µ=[n(n+2)]1/2 B.M.1B.M. = 9.27×10-21erg·G-12)实验发现:K4[Fe(CN)6] µ=0.00 B.M.FeSO4.7H2O µ=5.10 B.M.3) 价键理论的解释(内、外轨型配合物)内轨型配合物,如:K4[Fe(CN)6 ]自由Fe2+( d 6 ):3d4s4p重排为:3d4s4p[Fe(CN)6]4−3d4s4pd2sp3外轨型配合物:如[Fe (H2O)6]2+4d 3d4s4psp3d25、价键理论的成功与不足1)成功①杂化轨道配位数、构型②内、外轨型配合物磁性③继承了传统的价键概念(配位共价键),简明易于理解。
2)不足①定量程度差,无法解释配合物的吸收光谱②无法说明Cu2+平面正方形内轨型配合物的稳定性如[Cu(NH3)4]2+:Cu2+3d4s4p4d 平面正方形构型:dsp23d4s4p第二节晶体场理论(Crystal field theory)一、概述由H. Bethe和J. H. van Vleck提出理论模型:①把配体视为点电荷或偶极子(不考虑其结构);②配体与中心离子间的作用是纯静电相互作用,不形成任何共价键。
二、d轨道能级分裂(单电子能级的分裂)1、定义:由于d轨道空间取向不同,与非球形对称静电场的作用则不相同,引起d轨道能级发生分裂。
2、群论在d轨道能级分裂中的应用静电作用模型:d x2-y2 d z2d xyd yz d xz将一组五个d 轨道波函数作为配位场所属点群表示的基,并由此决定d 轨道能级分裂的方式。
由O h 群特征标表:A 1g A 2gT 1g T 2g A 1u A 2u T 1u T 2uE u O hE gE 8C 36C 26S 46σd1111111-1-112-1002330-11-101-1-16C 43C 2i 8S 63σh 111111-111-120-1203310-1-1-10-111111111-1-112-1002330-11-101-1-1-1-1-1-1-1-11-1-11-201-20-3-3-101111-1(xy, yz(2z 2-x 2(x, y, z)(xy、yz、xz) →(d xy、d yz、d xz) →t2g不可约表示的基(x2-y2、z2) →(d x2-y2、d z2) →e g不可约表示的基O h T d D4hs a1g a1a1gp t1u t2a2u+e ud e g+t2g e+t2a1g+b1g+f a2u+t1u+t2u a2+t1+t2a2u+b1u+g a1g+e g+t1g+t2g a1+e+t1+t22a1g+a2gh e u+2t1u+t2u e+t1+2t2a1u+2a2u3、正八面体场中d轨道的分裂1)d轨道与电场的作用d x2-y2d xy2)能级计算:E s 4Dq6Dq=e g(dx2_y2 dt2g(d xy, d yz,o10D自由离子球形场八面体场d轨道分裂能Δo=E eg-E t2g=10Dq (1)根据能量重心原理:2E eg+3E t2g=5Es。
若取Es为能量零点,则2E eg+3E t2g=0 (2)联合(1)与(2)方程,解得E eg = 6DqE t2g = -4Dq4、正四面体场中d轨道能级的分裂1) d轨道的分组T d A1 A2 E T1 T2E8C33C26S46 d11111111-1-12-1200330-11-10-1-11(xy, yz,xz)(2z2-x2-y22) d轨道与电场的作用d z2 d x2-y2d xy d yz d xz-------- --------- --------------- -------------- -------------- ---------------------- --------- --------------- -------------- -------------- --------------d x2-y2d xy极大值指向面心极大值指向棱的中点ABCoOACαβαsin α = A C /OAsin β = AB/OAOABβA'A"3a2a2aA'AA"OOA 22a ()+a222==AA"=aa 22a 2ABCa 23a 2OA 22a ()+a222==AA"=2a2AB =a2AC =sin β = AB/OA sin α = A C /OA ==2313==54.7β=α=0.8160.57735.3ooβ > α,这表明d xy与点电荷A 作用比d x2-y2更强。
