高中化学化学除杂考试试题
化学除杂试题及答案

化学除杂试题及答案一、选择题1. 以下哪种试剂可以用来除去铜中的铁杂质?A. 稀硫酸B. 稀盐酸C. 稀硝酸D. 稀氢氧化钠溶液答案:A2. 除去氯化钠溶液中的硫酸钠杂质,应选用的试剂是:A. 氯化钡溶液B. 碳酸钠溶液C. 硝酸银溶液D. 氢氧化钠溶液答案:A3. 欲除去二氧化碳中的一氧化碳,应采用的方法是:A. 通过石灰水B. 通过氢氧化钠溶液C. 通过灼热的氧化铜D. 通过浓硫酸答案:C二、填空题4. 在实验室中,除去硝酸钾溶液中的少量氯化钠,可以采用______的方法。
答案:结晶5. 为了除去铜粉中的氧化铜,可以加入______,然后过滤。
答案:稀盐酸三、简答题6. 描述如何从氯化钠溶液中除去少量的碳酸钠。
答案:首先向溶液中加入适量的稀盐酸,使碳酸钠与盐酸反应生成氯化钠、水和二氧化碳。
反应方程式为:Na2CO3 + 2HCl → 2NaCl +H2O + CO2↑。
然后通过过滤除去生成的二氧化碳气体,最后通过蒸发结晶得到纯净的氯化钠。
7. 说明如何利用化学方法除去粗铜中的锌。
答案:将粗铜与稀硫酸反应,锌会与稀硫酸反应生成硫酸锌和氢气,而铜不会与稀硫酸反应。
反应方程式为:Zn + H2SO4 → ZnSO4 +H2↑。
通过过滤可以分离出未反应的铜,从而得到纯净的铜。
四、实验题8. 实验中,你得到了含有少量铁粉的铜粉样品。
请设计一个实验方案,以除去铜粉中的铁粉。
答案:将铜粉样品放入足量的稀盐酸中,铁粉会与稀盐酸反应生成氯化亚铁和氢气,而铜不会与稀盐酸反应。
反应方程式为:Fe + 2HCl→ FeCl2 + H2↑。
待反应完成后,通过过滤分离出铜粉,洗涤并干燥即可得到纯净的铜粉。
人教版高中化学必修第一册习题练习之 碳酸钠和碳酸氢钠的鉴别及除杂

碳酸钠和碳酸氢钠的鉴别及除杂1.除去NaHCO3溶液中混有的少量Na2CO3,下列方法最合理的是()A.加入稀盐酸B.通入过量的CO2C.加入适量的NaOH溶液D.加入适量的澄清石灰水B[A.加入稀盐酸,两种盐均能反应,NaHCO3被消耗且引入了Cl-,达不到除杂目的,A项不合理;B.通入过量的CO2,CO2能与H2O和Na2CO3反应生成NaHCO3,把Na2CO3除去的同时又不引入新的杂质,B项合理;C.加入适量的NaOH溶液,NaOH与NaHCO3反应生成Na2CO3,NaHCO3被消耗且达不到除杂目的,C项不合理;D.加入适量的澄清石灰水,Ca(OH)2能与NaHCO3反应,NaHCO3被消耗且会引入新的杂质,D项不合理。
] 2.(2021·山东兖州高一检测)有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是()C[有关反应为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,Ca(OH)2+2NaHCO3===CaCO3↓+Na2CO3+2H2O,两者均产生白色沉淀,现象相同,A错误;加入等浓度的稀盐酸时,NaHCO3溶液反应更剧烈,B错误;Na2CO3与CaCl2反应生成CaCO3白色沉淀,NaHCO3与CaCl2不反应,C正确;逐滴加入盐酸时,NaHCO3溶液立即产生气泡,Na2CO3溶液开始无明显现象,后有气泡产生,D错误。
]3.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是()A.分别加热这两种固体物质,并将生成的气体通入澄清石灰水中B.分别在这两种物质的溶液中,加入CaCl2溶液C.分别把等质量的这两种固体物质加入同浓度的稀盐酸中D.分别在这两种物质的溶液中,加入少量澄清石灰水D [A 项,加热时只有NaHCO 3分解:2NaHCO 3=====△Na 2CO 3+H 2O +CO 2↑,产生的CO 2可使澄清石灰水变浑浊,故可用来鉴别;B 项,NaHCO 3溶液与CaCl 2溶液不反应,而Na 2CO 3溶液与CaCl 2溶液反应生成CaCO 3沉淀,故可用来鉴别;C 项,NaHCO 3与稀盐酸的反应比Na 2CO 3与稀盐酸的反应快,故可用来鉴别;D 项,Ca(OH)2溶液与Na 2CO 3、NaHCO 3溶液均能反应生成CaCO 3沉淀,故不能用来鉴别。
高中化学常见有机物的分离除杂和提纯

有机物的分离除杂和提纯1.下列分离或除杂的方法不正确的是( ) A .用分液法分离水和酒精 B .用蒸馏法分离苯和溴苯 C .用重结晶方法提纯苯甲酸D .用饱和碳酸氢钠溶液除去二氧化碳中混有的少量氯化氢气体 答案:A2.将CH 3CHO(易溶于水,沸点为20.8℃的液体)和CH 3COOH 分离的正确方法是( ) A .加热蒸馏B .加入Na 2CO 3后,通过萃取的方法分离C .加入烧碱溶液之后蒸出乙醛,再加入浓硫酸,蒸出乙酸D .和Na 反应后进行分离解析:尽管乙醛沸点仅为20.8℃,而乙酸沸点为117.9℃,但考虑到两者均易挥发,因此C 选项的方法分离效果更好。
答案:C3.下列实验方案不合理的是( )A .用饱和Na 2CO 3溶液除去乙酸乙酯中混有的乙酸等B .分离苯和硝基苯的混合物,可用蒸馏法C .可用苯将溴从溴苯中萃取出来D .可用水来鉴别苯、乙醇、四氯化碳解析:因乙酸乙酯在饱和Na 2CO 3溶液中的溶解度很小,且乙酸易溶于饱和Na 2CO 3溶液,因此可用饱和Na 2CO 3溶液来除去乙酸乙酯中混有的乙酸等杂质;苯与硝基苯的沸点相差较大,可用蒸馏法将两者分离开来;溴易溶于溴苯,也易溶于苯,因此不能用苯作萃取剂将溴从溴苯中除去;苯不溶于水,加入水时,液体分为两层,上层为苯(油状液体),下层为水,乙醇与水混合时不分层,四氯化碳不溶于水,加水混合时,液体也分为两层,上层为水,下层为四氯化碳(油状液体),因此可用水来鉴别苯、乙醇、四氯化碳。
答案:C4.化学工作者从下面的有机反应RH +Cl 2(g)――→光RCl(l)+HCl(g)受到启发提出的在农药和有机合成工业中可获得副产品的设想已成为现实,试指出由上述反应产物中分离得到盐酸的最佳方法是( )A .水洗分液法B .蒸馏法C .升华法D .有机溶剂萃取法解析:本题关键是选最佳方法。
因HCl 极易溶于水,有机物一般不溶于水,故用水洗分液法分离得到盐酸最简便。
高二化学高中化学人教版试题答案及解析

高二化学高中化学人教版试题答案及解析1.请完成下列物质的分离提纯问题。
Ⅰ、现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。
相应的实验过程可用下图表示:请回答下列问题:(1)写出实验流程中下列物质的化学式:试剂X_______,沉淀B 。
(2)证明AgNO3加过量的实验方法是。
(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
Ⅱ、某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:A.把盛有溶液的分液漏斗放在铁架台的铁圈中;E.旋开活塞,用烧杯接收溶液;F.从分液漏斗上口倒出上层液体;G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:(填编号字母)。
(2)设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:。
(3)最后碘的CCl4是通过获得(填“漏斗上口”或“漏斗下口”)。
从含碘的CCl4溶液中提取碘和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有处。
(4)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。
【答案】Ⅰ、(1)BaCl2或Ba(NO3)2、AgCl ;(2)取滤液或溶液2少许于试管,加入稀盐酸,若产生白色沉淀,证明AgNO3过量;(3)Na2CO3,HNO3,蒸发;Ⅱ、(1)CBDAHGEF;(2)取少量(或1~2mL)该水溶液于试管中,加入淀粉溶液,若变蓝,则该水溶液中还含有单质碘;(3)漏斗下口,5;(4)蒸馏烧瓶。
【解析】I、(1)除去溶液中NaCl和Na2SO4,根据实验过程图,先除去SO42-,常用Ba2+除去SO42-,不引入新杂质,可以用Ba(NO3)2,因为还要除去Cl-,还可以用BaCl2,则沉淀A是BaSO4,溶液1中有NaCl、NaNO3、BaCl2,加入过量AgNO3溶液,生成AgCl,则沉淀B为AgCl,溶液2中有NaNO3、Ba(NO3)2、AgNO3,加入Na2CO3溶液,则沉淀C是Ag2CO3、BaCO3,溶液3中有NaNO3、Na2CO3,试剂X为Ba(NO3)2或BaCl2,沉淀B是AgCl;(2)取溶液2少量,置于试管中,然后向试管中滴加稀盐酸,观察是否有沉淀产生,若有沉淀,则说明硝酸银过量;(3)根据上述分析,溶液3中肯定含有Na2CO3,除去Na2CO3,不引入新杂质,因此需要加入适量的硝酸,然后采用蒸发的方法得到硝酸钠固体;Ⅱ、(1)萃取实验中,首先检验分液漏斗的是否漏水,然后把混合液加入分液漏斗中,并盖好瓶塞,进行振荡,时不时旋开活塞放气,放在带有铁圈的铁架台上静置,旋开活塞,下层液体从下口流出,上层液体从上口倒出,因此顺序应是:CBDAHGEF;(2)淀粉遇碘单质变蓝,取萃取后的水溶液少量置于试管中,然后加入淀粉溶液,如果溶液变蓝说明含有碘单质,反之没有;(3)因为CCl4的密度大于水的密度,因此从漏斗的下口得到,没垫石棉网、温度计的水银球的位置、冷却水进水口、没有沸石或碎瓷片、牛角管和锥形瓶接触处有塞子;(4)因为碘单质的沸点高,CCl4的沸点低,CCl4先被蒸出,因此碘单质聚集在蒸馏烧瓶中。
【高中化学】化学经典除杂试题

离子共存高考试题1.(91全国化学,21)在某无色透明的酸性溶液中,能共存的离子组是A .NH 4+、NO 3-、Al 3+、Cl -B .Na +、Al 3+、K +、NO 3-C .MnO 4-、K +、SO 42-、Na +D .K +、SO 42-、HCO 3-、NO 3-2.(92全国化学,15)若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是A .SO 42-B .S 2-C .CO 32-D .Cl -3.(93全国化学,16)下列各组离子:(1)I —、ClO —、NO 3—、H +(2)K +、NH 4+、HCO 3—、OH —(3)SO 32—、SO 42—、Cl —、OH — (4)Fe 3+、Cu 2+、SO 42—、Cl — (5)H +、K +、AlO 2—、HSO 3—(6)Ca 2+、Na +、SO 42—、CO 32—在水溶液中能大量共存的是A .(1)和(6)B .(3)和(4)C .(2)和(5)D .(1)和(4) 4.(94全国化学,13)在PH=3的无色透明溶液中不能..大量共存的离子组 A .Al 3+ Ag + NO 3—Cl —B .Mg 2+ NH 4+ NO 3—Cl —C .Ba 2+ K + S 2— Cl —D .Zn 2+ Na + NO 3— SO 42—5.(95全国化学,11)在pH =1的溶液中,可以大量共存的离子组是A .Na +、K +、S 2-、Cl -B .Al 3+、Mg 2+、SO 42-、Cl -C .K +、Na +、AlO 2-、NO 3-D .K +、Na +、SO 42-、S 2O 32-6.(96全国化学,11)下列各组离子,在强碱性溶液中可以大量共存的是A .K +、Na +、HSO 3-、Cl -B .Na +、Ba 2+、AlO 2-、NO 3-C .NH 4+、K +、Cl -、NO 3-D .K +、Na +、ClO -、S 2-7.(06江苏,5)下列反应的离子方程式正确的是 BA .向沸水中滴加FeCl 3溶液制备Fe(OH)3胶体:Fe 3++3H 2O△Fe(OH)3↓+3H +B .用小苏打治疗胃酸过多:HCO 3-+H +===CO 2↑+H 2O C .实验室用浓盐酸与MnO 2反应制Cl 2:MnO 2+2H ++2Cl-△Cl 2↑+Mn 2++H 2OD .用FeCl 3溶液腐蚀印刷电路板:Fe 3++Cu===Fe 2++Cu 2+ 8.(96全国化学,18)某溶液中有NH 4+、Mg 2+、Fe 2+和Al 3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( ). A .NH 4+ B .Mg 2+ C .Fe 2+ D .Al 3+ 9.(97全国化学,9)下列各组离子,在强碱性溶液中可以大量共存的是A .I -、AlO 2-、Cl -、S 2-B .Na +、K +、NH 4+、Ba 2+C .Br -、S 2-、Cl -、CO 32-D .SO 32-、NO 3-、SO 42-、HCO 3-10.(99全国化学)下列各组离于在溶液中既可以大量共存,且加入氨水后也不产牛沉淀的是A .Na +、Ba 2+、Cl -、SO 42-B .K +、AlO 2-、NO 3-、OH -C .H +、NH 4+、Al 3+、SO 42-D .H +、Cl -、CH 3COO -、NO 3-11.(2004全国)在pH =l 含+2Ba 离子的溶液中,还能大量存在的离子是A .-2AlOB .-ClOC .-ClD .-24SO12、(2004年广东卷)下列反应完成后没有..沉淀的是 A 、BaCl 2溶液与Na 2CO 3溶液加足量稀CH 3COOHB 、Ba(OH)2溶液与KNO 3溶液加足量稀H 2SO 4C 、AgNO 3溶液与Na 2CO 3溶液加足量稀HClD 、Ca(OH)2溶液与FeCl 3溶液加足量稀HNO 3 13、(2004年江苏卷)巳知某溶液中存在较多的H +、SO 42—、NO 3—,则该溶液中还可能大量存在的离子组是A .Al 3+、CH 3C00—、Cl —B .Mg 2+、Ba 2+、Br —C .Mg 2+、Cl —、I —D .Na +、NH 4+、Cl —14.(2005年广东)下列各组离子一定能大量共存的是A .在含大量Fe 3+的溶液中:NH 4+、Na +、Cl —、SCN —B .在强碱溶液中:Na +、K +、AlO 2—、CO 32—C .在c (H +) =10—13mol/L 的溶液中:NH 4+、Al 3+、SO 42—、NO 3—D .在pH =1的溶液中:K +、Fe 2+、Cl —、NO 3— 15.(2005年江苏)某溶液既能溶解Al(OH)3,又能溶解H 2SiO 3,在该溶液中可以大量共存的离子组是A .K +、Na +、HCO -3、NO -3 B .Na +、SO -24、Cl —、ClO — C .H +、Mg 2+、SO -24、NO -3 D .Ag +、K +、NO -3、Na + 16、(2005年天津卷)下列各组离子在溶液中能大量共存的是A 酸性溶液Na +、K +、MnO 4-、Br -B 酸性溶液Fe 3+、NH 4+、SCN -、NO 3-C 碱性溶液Na +、K +、AlO 2-、SO 42-D 碱性溶液Ba 2+、Na +、CO 32-、Cl -17.下列各组离子在溶液中能大量共存的是 ( )A .酸性溶液Na +、K +、MnO 4-、Br -B .酸性溶液Fe 3+、NH 4+、SCN -、NO 3-C .碱性溶液Na +、K +、AlO 2-、SO -24 D .碱性溶液Ba 2+、Na +、CO -23、Cl - 18、(2006年江苏卷).一定能在下列溶液中大量共存的离子组是 A .含有大量Al 3+的溶液:Na +、NH 4+、SO 42-、Cl - D .含有大量NO 3-的溶液:H +、Fe 2+、SO 42-、Cl - C .含有大量Fe 3+的溶液:Na +、Mg 2+、NO 3-、SCN -B .c (H +)=1×10-13mol ·L -1的溶液:Na +、Ca 2+、SO 42-、CO 32- 19、(2006年上海卷)已知某溶液中存在较多的H +、SO 42-、NO 3-,则溶液中还可能大量存在的离子组是A A13+、CH 3COO -、C1-B Na +、NH 4+、C1-C Mg 2+、C1-、Fe 2+D Mg 2+、Ba 2+、Br -20.(2006年四川卷)室温下,在强酸性和强碱性溶液中都不能..大量共存的离子组是 A. NH 4+、Cu 2+、Cl 一、N03- B. K +、Na +、S032一、S 2—C. K +、Na +、A102-、S042-D. Ba 2+、Fe 2+、N03-、Br -21、(2007北京卷).在由水电离产生的H +浓度为1×10-13mol·L -1的溶液中,一定能大量共存的离子组是① K +、Cl -、NO 3-、S 2- ② K +、Fe 2+、I -、SO 42- ③ Na +、Cl -、NO 3-、SO 42- ④Na +、Ca 2+、Cl -、HCO 3- ⑤ K +、Ba 2+、Cl -、NO 3- A .①③ B .③⑤ C .③④ D .②⑤22. (2007年江苏向存在大量Na +、Cl -的溶液中通入足量的NH 3后,该溶液中还可能大量存在的离于组是A .K +、Br -、CO 32-B .Al 3+、H +、MnO 4-C .NH 4+、Fe 3+、SO 42-D .Ag +、Cu 2+、NO 3- 23.(2008年江苏)在下列溶液中,各组离子一定能够大量共存的是A .使酚酞试液变红的溶液: Na +、Cl -、SO 42-、Fe 3+B .使紫色石蕊试液变红的溶液:Fe 2+、Mg 2+、NO 3-、Cl -C . c (H +)=10-12 mol ·L -1的溶液:K +、Ba 2+、Cl -、Br -D .碳酸氢钠溶液:K +、SO 42-、Cl -、H + 24.(2008年广东卷理科基础)下列各组离子一定能大量共存的是A .在含有大量[Al(OH)3]-的溶液中:NH 4+、Na +、Cl -、H +B .在强碱溶液中:Na +、K +、CO 32-、NO 3-C .在pH =12的溶液中:NH 4+、Na +、SO 42-、Cl -D .在c(H +)=0.1mol ·L -1的溶液中:K +、I -、Cl -、NO 3-25、(2008年重庆)下列各组离子在给定条件下能大量共存的是A 、在pH =1溶液中:NH 4+、K +、ClO —、Cl —B 、有SO 42—存在的溶液中:Na +、Mg 2+、Ca 2+、I —C 、有NO 3—存在的强酸性溶液中:NH 4+、Ba 2+、Fe 2+、Br —D 、在c(H +) =1.0×10—13mol/L 的溶液中:Na +、S 2—、AlO 2—、SO 32— 26.(2008年全国I )在溶液中加入中量Na 2O 2后仍能大量共存的离子组是A.NH +4、Ba 2+、Cl -、NO -3B.K +、AlO -2、Cl -、SO 2-4C.Ca 2+、Mg 2+、NO -3、HCO -3D.Na +、Cl -、CO 2-3、SO 2-327、(2008年海南)在pH =13的无色溶液中,可以大量共存的一组离子是:A 、NH 4+、NO 3— 、K +、SO 42—B 、CO 32_、NO 3—、HCO 3—、Na + C 、Na +、ClO —、AlO 2—、NO 3— D 、CrO 42—、K +、Na +、SO 42—28.(02上海,19)下列离子方程式书写正确的是 BA .FeCl 2溶液中通入Cl 2:Fe 2++Cl 2===Fe 3++2Cl -B .澄清石灰水与少量小苏打溶液混合:Ca 2+十OH -+HCO 3-===CaCO 3↓+H 2OC .FeS 固体放人稀硝酸溶液中:FeS +2H +===Fe 2++H 2S ↑D .AlCl 3溶液中加入过量氨水:Al 3++4OH -===AlO 2-+2H 2O 29.(99全国,2)下列离子方程式书写正确的是 ABA .过量氯气通入溴化亚铁溶液中 3Cl 2+2Fe 2++4Br -===6Cl -+2Fe 3++2Br 2B .过量二氧化碳通入偏铝酸钠溶液中 CO 2+2H 2O+AlO -2===Al(OH)3↓+HCO -3C .在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合NH +4+HSO -3+2OH —===SO -23+NH 3↑+2H 2OD .碳酸氢镁溶液中加入过量石灰水 Mg 2++2HCO -3+Ca 2++2OH —===CaCO 3↓+2H 2O+MgCO 3↓30.(96上海,9)下列离子方程式书写正确的是 CA .氯化铁溶液中通入硫化氢气体:2Fe 3++S 2-=2Fe 2++S ↓B .碳酸钡中加入稀硫酸:BaCO 3+2H +=Ba 2++CO 2↑+H 2OC .偏铝酸钠溶液中加入过量盐酸:AlO 2-+4H +=Al 3++2H 2OD .碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO 3-+OH -=CO 32-+H 2O31.(01上海,12)下列离子在溶液中因发生氧化还原反应而不能大量共存的是 AA .H 3O +、NO 3-、Fe 2+、Na +B .Ag +、NO 3-、Cl -、K +C .K +、Ba 2+、OH -、SO 42-D .Cu 2+、NH 4+、Br -、OH -32.(00广东,16)某溶液中含有大量Fe 2+、Fe 3+、Mg 2+和NH 4+,其[H +]=10-2 mol·L -1,在该溶液中可以大量存在的阴离子是 AA.SO42-B.NO3-C.SCN-D.CO32-33、(2007全国卷II)27. (15分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:为鉴别它们,分别完成以下实验,其结果是:a.B和D都不溶于水,也不溶于酸;b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀d.E溶于水后,与上述某阴离子反应可生成B;e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀是减少,但不消失。
高中化学物质检验除杂综合题(有答案)_2(1)

⾼中化学物质检验除杂综合题(有答案)_2(1)⽅法归纳检验、鉴别物质的依据:从物质的物理性质⽅⾯:颜⾊、⽓味、溶解性、挥发性从物质的化学性质⽅⾯:发⽣反应时要能产⽣⽓体、沉淀或颜⾊变化等现象从化学⾓度讲,鉴别是对已知物的种类进⾏辨认,其⽬的在于把⼏种物质区别开来。
⼀般说来,不需要将鉴别物质逐⼀进⾏检验,这和鉴定不同。
鉴定是⽤实验⽅法,鉴定物质的组成,然后确定物质是什么,或该物质中含有哪些成分。
根据实验确定某⼀物质的习题是鉴定题,物质的鉴定通常必须分别检验出阳离⼦和阴离⼦;根据实验区别⼏种已知物质的习题是鉴别题。
现谈谈鉴别物质的20种⽅法。
1.沉淀法待鉴别物质的溶液中,加⼊某种试剂,观察是否有沉淀产⽣,进⾏鉴别。
例:如何鉴别Na2SO4溶液和NaNO3溶液。
使⽤BaCl2溶液鉴定。
反应的离⼦⽅程式:Ba2++SO42-=BaSO4↓2.⽓体法根据某物质加⼊某⼀试剂,是否有⽓体产⽣,予以鉴别。
例:有两瓶失落标签的固体,它们是Na2CO3和NaCl,如何鉴别。
使⽤盐酸鉴别。
反应离⼦⽅程式:CO32-+2H+=CO2↑+H2O3.过量法利⽤加⼊某种试剂,产⽣沉淀,继续滴加,沉淀消失,达到鉴别的⽬的。
例:怎样鉴别ZnCl2溶液和MgCl2溶液。
解:将两种待鉴别的溶液分别放⼊⼆⽀试管中,加⼊NaOH溶液,可观察到均有⽩⾊沉淀产⽣,继续滴加NaOH溶液,可看到有⼀⽀试管内的⽩⾊沉淀逐渐消失,另⼀⽀试管内⽆此现象。
则先产⽣⽩⾊沉淀后逐渐消失的试管内放的是ZnCl2溶液,另⼀⽀试管内是MgCl2溶液。
反应的离⼦⽅程式:Mg2++2OH-=Mg(OH)2↓Zn2++2OH-=Zn(OH)2↓Zn(OH)2+2OH-=ZnO22-+2H2O4.相互法利⽤物质间反应,现象不同⽽予以鉴别。
例:不⽤任何化学试剂,也不能加热,如何鉴别NaOH溶液和AlCl3溶液。
解:根据NaOH溶液滴⼊AlCl3溶液中和AlCl3溶液滴⼊NaOH溶液中现象不同进⾏鉴别。
高中化学除杂问题总结
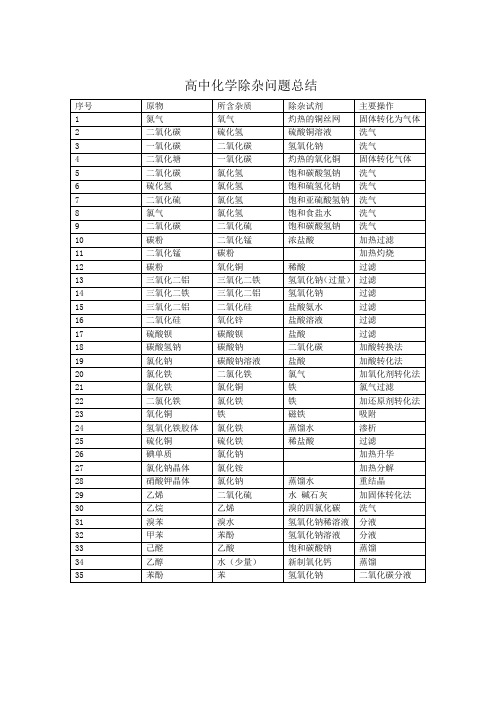
加酸转换法
19
氯化钠
碳酸钠溶液
盐酸
加酸转化法
20
氯化铁
二氯化铁
氯气
加氧化剂转化法
21
氯化铁
氯化铜
铁
氯气过滤
22
二氯化铁
氯化铁
铁
加还原剂转化法
23
氧化铜
铁
磁铁
吸附
24
氢氧化铁胶体
氯化铁
蒸馏水
渗析
25
硫化铜
硫化铁
稀盐酸
过滤
26
碘单质
氯化钠
加热升华
27
氯化钠晶体
氯化铵
加热分解
28
硝酸钾晶体
氯化钠
蒸馏水
洗气
9
二氧化碳
二氧化硫
饱和碳酸氢钠
洗气
10
碳粉
二氧化锰
浓盐酸
加热过滤
11
二氧化锰
碳粉
加热灼烧
12
碳粉
氧化铜
稀酸
过滤
13
三氧化二铝
三氧化二铁
氢氧化钠(过量)
过滤
14
三氧化二铁
三氧化二铝
氢氧化钠
过滤
15
三氧化二铝
二氧化硅
盐酸氨水
过滤
16
二氧化硅
氧化锌
盐酸溶液
过滤
17
硫酸钡
碳酸钡
盐酸
过滤
18
碳酸氢钠
碳酸钠
高中化学除杂问题总结
序号
原物
所含杂质
除杂试剂
主要操作
1
氮气
氧气
灼热的铜丝网
固体转化为气体
2
二氧化碳
高中化学实验常见除杂

高中化学实验常见除杂一说化学大家就会觉得化学很繁多,其实在学习化学中,还是须要积累的,我整理了中学化学试验常见除杂,希望能帮助到大家。
必修教材有机物除杂(括号内为杂质)1.乙烷或甲烷(乙烯) 溴水洗气解析:乙烯能与溴水发生加成反应生成1,2-二溴乙烷变成了液体,而乙烷不能。
2.乙醇(少量水) 加入新制的生石灰蒸馏解析:水与CaO反应生成氢氧化钙,乙醇易挥发,加热蒸馏即可得到乙醇。
点评:氧化钙除去较多的水分,乙醇和水属于互溶的液体,实行蒸馏的方法3、乙醇(乙酸) 加入新制的生石灰或NaOH 蒸馏解析:乙酸与CaO反应生成乙酸钙,乙醇易挥发,加热蒸馏即可得到乙醇。
4.溴苯(溴) 氢氧化钠溶液分液解析:Br2 +2NaOH=NaBr+NaBrO+H2O,生成的盐NaBr和NaBrO 都易溶于水进入水层,而溴苯在常温常压下不与NaOH反应,而且难溶于通过分液取下层既能得到溴苯。
5. 硝基苯(混酸) 氢氧化钠溶液或水分液解析:利用浓硫酸和浓硝酸易与氢氧化钠溶液反应或易溶于水的性质使混酸进入水层,硝基苯难溶于水,密度大于水,在下层。
6.乙酸乙酯(乙酸、乙醇) 饱和碳酸钠溶液分液解析:乙醇溶解在碳酸钠溶液中,乙酸与碳酸钠溶液反应均进入水层,乙酸乙酯不溶于水,在上层,通过分液即可分别。
7.肥皂(甘油) 饱和食盐水盐析、过滤解析:加入饱和食盐水使肥皂发生盐析,再通过过滤滤出肥皂即可。
有机物的分别8. 淀粉溶液(纯碱) 蒸馏水渗析法解析:淀粉溶液是胶体,胶体中混有的小分子或离子可以用渗析法除去。
选修教材有机物除杂9. 苯(苯甲酸) 氢氧化钠溶液分液解析:苯甲酸能与NaOH反应生成苯甲酸钠,苯甲酸钠易溶于水,而苯不溶于水,通过分液取上层就能得到苯。
10. 苯(苯酚) 氢氧化钠溶液分液解析:原理与1类似,苯酚能与NaOH应生成苯酚钠,苯酚钠易溶于水。
11. 苯(乙苯) 酸性高锰酸钾溶液和氢氧化钠溶液分液解析:先用酸性高锰酸钾溶液将乙苯氧化为苯甲酸,再用氢氧化钠溶液将苯甲酸转化为苯甲酸钠溶于水层,分液即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子共存高考试题1.(91全国化学,21)在某无色透明的酸性溶液中,能共存的离子组是A .NH 4+、NO 3-、Al 3+、Cl -B .Na +、Al 3+、K +、NO 3-C .MnO 4-、K +、SO 42-、Na +D .K +、SO 42-、HCO 3-、NO 3-2.(92全国化学,15)若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是 A .SO 42-B .S 2-C .CO 32-D .Cl -3.(93全国化学,16)下列各组离子:(1)I —、ClO —、NO 3—、H +(2)K +、NH 4+、HCO 3—、OH —(3)SO 32—、SO 42—、Cl —、OH — (4)Fe 3+、Cu 2+、SO 42—、Cl — (5)H +、K +、AlO 2—、HSO 3—(6)Ca 2+、Na +、SO 42—、CO 32—在水溶液中能大量共存的是A .(1)和(6)B .(3)和(4)C .(2)和(5)D .(1)和(4)4.(94全国化学,13)在PH=3的无色透明溶液中不能..大量共存的离子组 A .Al 3+ Ag + NO 3— Cl — B .Mg 2+ NH 4+ NO 3— Cl — C .Ba 2+ K + S 2— Cl —D .Zn 2+ Na + NO 3— SO 42—5.(95全国化学,11)在pH =1的溶液中,可以大量共存的离子组是A .Na +、K +、S 2-、Cl -B .Al 3+、Mg 2+、SO 42-、Cl -C .K +、Na +、AlO 2-、NO 3-D .K +、Na +、SO 42-、S 2O 32-6.(96全国化学,11)下列各组离子,在强碱性溶液中可以大量共存的是A .K +、Na +、HSO 3-、Cl -B .Na +、Ba 2+、AlO 2-、NO 3-C .NH 4+、K +、Cl -、NO 3-D .K +、Na +、ClO -、S 2-7.(06江苏,5)下列反应的离子方程式正确的是 BA .向沸水中滴加FeCl 3溶液制备Fe(OH)3胶体:Fe 3++3H 2O △3↓+3H +B .用小苏打治疗胃酸过多:HCO 3-+H +===CO 2↑+H 2OC .实验室用浓盐酸与MnO 2反应制Cl 2:MnO 2+2H ++2Cl -△2↑+Mn 2++H 2OD .用FeCl 3溶液腐蚀印刷电路板:Fe 3++Cu===Fe 2++Cu 2+8.(96全国化学,18)某溶液中有NH 4+、Mg 2+、Fe 2+和Al 3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( ). A .NH 4+B .Mg 2+C .Fe 2+D .Al 3+9.(97全国化学,9)下列各组离子,在强碱性溶液中可以大量共存的是A .I -、AlO 2-、Cl -、S 2-B .Na +、K +、NH 4+、Ba 2+C .Br -、S 2-、Cl -、CO 32-D .SO 32-、NO 3-、SO 42-、HCO 3-10.(99全国化学)下列各组离于在溶液中既可以大量共存,且加入氨水后也不产牛沉淀的是A .Na +、Ba 2+、Cl -、SO 42-B .K +、AlO 2-、NO 3-、OH -C .H +、NH 4+、Al 3+、SO 42-D .H +、Cl -、CH 3COO -、NO 3-11.(2004全国)在pH =l 含+2Ba 离子的溶液中,还能大量存在的离子是A .-2AlOB .-ClOC .-ClD .-24SO12、(2004年广东卷)下列反应完成后没有..沉淀的是 A 、BaCl 2溶液与Na 2CO 3溶液加足量稀CH 3COOHB 、Ba(OH)2溶液与KNO 3溶液加足量稀H 2SO 4C 、AgNO 3溶液与Na 2CO 3溶液加足量稀HClD 、Ca(OH)2溶液与FeCl 3溶液加足量稀HNO 3 13、(2004年江苏卷)巳知某溶液中存在较多的H +、SO 42—、NO 3—,则该溶液中还可能大量存在的离子组是A .Al 3+、CH 3C00—、Cl —B .Mg 2+、Ba 2+、Br —C .Mg 2+、Cl —、I —D .Na +、NH 4+、Cl —14.(2005年广东)下列各组离子一定能大量共存的是A .在含大量Fe 3+的溶液中:NH 4+、Na +、Cl —、SCN —B .在强碱溶液中:Na +、K +、AlO 2—、CO 32—C .在c (H +) =10—13mol/L 的溶液中:NH 4+、Al 3+、SO 42—、NO 3—D .在pH =1的溶液中:K +、Fe 2+、Cl —、NO 3— 15.(2005年江苏)某溶液既能溶解Al(OH)3,又能溶解H 2SiO 3,在该溶液中可以大量共存的离子组是A .K +、Na +、HCO -3、NO -3 B .Na +、SO -24、Cl —、ClO — C .H +、Mg 2+、SO -24、NO -3 D .Ag +、K +、NO -3、Na + 16、(2005年天津卷)下列各组离子在溶液中能大量共存的是A 酸性溶液Na +、K +、MnO 4-、Br -B 酸性溶液Fe 3+、NH 4+、SCN -、NO 3-C 碱性溶液Na +、K +、AlO 2-、SO 42-D 碱性溶液Ba 2+、Na +、CO 32-、Cl -17.下列各组离子在溶液中能大量共存的是 ( )A .酸性溶液Na +、K +、MnO 4-、Br -B .酸性溶液Fe 3+、NH 4+、SCN -、NO 3-C .碱性溶液Na +、K +、AlO 2-、SO -24 D .碱性溶液Ba 2+、Na +、CO -23、Cl - 18、(2006年江苏卷).一定能在下列溶液中大量共存的离子组是 A .含有大量Al 3+的溶液:Na +、NH 4+、SO 42-、Cl - D .含有大量NO 3-的溶液:H +、Fe 2+、SO 42-、Cl - C .含有大量Fe 3+的溶液:Na +、Mg 2+、NO 3-、SCN -B .c (H +)=1×10-13mol ·L -1的溶液:Na +、Ca 2+、SO 42-、CO 32- 19、(2006年上海卷)已知某溶液中存在较多的H +、SO 42-、NO 3-,则溶液中还可能大量存在的离子组是A A13+、CH 3COO -、C1-B Na +、NH 4+、C1-C Mg 2+、C1-、Fe 2+D Mg 2+、Ba 2+、Br -20.(2006年四川卷)室温下,在强酸性和强碱性溶液中都不能..大量共存的离子组是 A. NH 4+、Cu 2+、Cl 一、N03- B. K +、Na +、S032一、S 2—C. K +、Na +、A102-、S042-D. Ba 2+、Fe 2+、N03-、Br -21、(2007北京卷).在由水电离产生的H +浓度为1×10-13mol·L -1的溶液中,一定能大量共存的离子组是① K +、Cl -、NO 3-、S 2- ② K +、Fe 2+、I -、SO 42- ③ Na +、Cl -、NO 3-、SO 42- ④Na +、Ca 2+、Cl -、HCO 3- ⑤ K +、Ba 2+、Cl -、NO 3- A .①③ B .③⑤ C .③④ D .②⑤22. (2007年江苏向存在大量Na +、Cl -的溶液中通入足量的NH 3后,该溶液中还可能大量存在的离于组是A .K +、Br -、CO 32-B .Al 3+、H +、MnO 4-C .NH 4+、Fe 3+、SO 42-D .Ag +、Cu 2+、NO 3- 23.(2008年江苏)在下列溶液中,各组离子一定能够大量共存的是A .使酚酞试液变红的溶液: Na +、Cl -、SO 42-、Fe 3+B .使紫色石蕊试液变红的溶液:Fe 2+、Mg 2+、NO 3-、Cl -C . c (H +)=10-12 mol ·L -1的溶液:K +、Ba 2+、Cl -、Br -D .碳酸氢钠溶液:K +、SO 42-、Cl -、H + 24.(2008年广东卷理科基础)下列各组离子一定能大量共存的是A .在含有大量[Al(OH)3]-的溶液中:NH 4+、Na +、Cl -、H +B .在强碱溶液中:Na +、K +、CO 32-、NO 3-C .在pH =12的溶液中:NH 4+、Na +、SO 42-、Cl -D .在c(H +)=0.1mol ·L -1的溶液中:K +、I -、Cl -、NO 3- 25、(2008年重庆)下列各组离子在给定条件下能大量共存的是A 、在pH =1溶液中:NH 4+、K +、ClO —、Cl —B 、有SO 42—存在的溶液中:Na +、Mg 2+、Ca 2+、I —C 、有NO 3—存在的强酸性溶液中:NH 4+、Ba 2+、Fe 2+、Br —D 、在c(H +) =1.0×10—13mol/L 的溶液中:Na +、S 2—、AlO 2—、SO 32— 26.(2008年全国I )在溶液中加入中量Na 2O 2后仍能大量共存的离子组是A.NH +4、Ba 2+、Cl -、NO -3B.K +、AlO -2、Cl -、SO 2-4C.Ca 2+、Mg 2+、NO -3、HCO -3D.Na +、Cl -、CO 2-3、SO 2-327、(2008年海南)在pH =13的无色溶液中,可以大量共存的一组离子是:A 、NH 4+、NO 3— 、K +、SO 42—B 、CO 32_、NO 3—、HCO 3—、Na + C 、Na +、ClO —、AlO 2—、NO 3— D 、CrO 42—、K +、Na +、SO 42—28.(02上海,19)下列离子方程式书写正确的是 BA .FeCl 2溶液中通入Cl 2:Fe 2++Cl 2===Fe 3++2Cl-B .澄清石灰水与少量小苏打溶液混合:Ca 2+十OH -+HCO 3-===CaCO 3↓+H 2OC .FeS 固体放人稀硝酸溶液中:FeS +2H +===Fe 2++H 2S ↑D .AlCl 3溶液中加入过量氨水:Al 3++4OH -===AlO 2-+2H 2O29.(99全国,2)下列离子方程式书写正确的是 ABA .过量氯气通入溴化亚铁溶液中 3Cl 2+2Fe 2++4Br -===6Cl -+2Fe 3++2Br 2B .过量二氧化碳通入偏铝酸钠溶液中 CO 2+2H 2O+AlO -2===Al(OH)3↓+HCO -3C .在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合NH +4+HSO -3+2OH —===SO -23+NH 3↑+2H 2O D .碳酸氢镁溶液中加入过量石灰水 Mg 2++2HCO -3+Ca 2++2OH —===CaCO 3↓+2H 2O+MgCO 3↓30.(96上海,9)下列离子方程式书写正确的是 CA .氯化铁溶液中通入硫化氢气体:2Fe 3++S 2-=2Fe 2++S ↓B .碳酸钡中加入稀硫酸:BaCO 3+2H +=Ba 2++CO 2↑+H 2OC .偏铝酸钠溶液中加入过量盐酸:AlO 2-+4H +=Al 3++2H 2OD .碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO 3-+OH -=CO 32-+H 2O 31.(01上海,12)下列离子在溶液中因发生氧化还原反应而不能大量共存的是 AA .H 3O +、NO 3-、Fe 2+、Na +B .Ag +、NO 3-、Cl -、K +C .K +、Ba 2+、OH -、SO 42-D .Cu 2+、NH 4+、Br -、OH -32.(00广东,16)某溶液中含有大量Fe 2+、Fe 3+、Mg 2+和NH 4+,其[H +]=10-2 mol·L-1,在该溶液中可以大量存在的阴离子是 AA .SO 42-B .NO 3-C .SCN -D .CO 32-33、(2007全国卷II )27. (15分)现有五种离子化合物A 、B 、C 、D 和E ,都是由下表中离子形成的:为鉴别它们,分别完成以下实验,其结果是: a .B 和D 都不溶于水,也不溶于酸;b .A 溶于水后,与上述某阳离子反应可生成B ,且A 溶液与过量氨水反应生成白色沉淀c .C 溶于水后,与上述某阳离子反应可生成D ,且C 溶液与过量氨水反应生成白色沉淀d .E 溶于水后,与上述某阴离子反应可生成B ;e .A 溶液与适量E 溶液反应生成沉淀,再加过量E 溶液,沉淀是减少,但不消失。
