高中化学除杂总结表
高中化学常见气体除杂

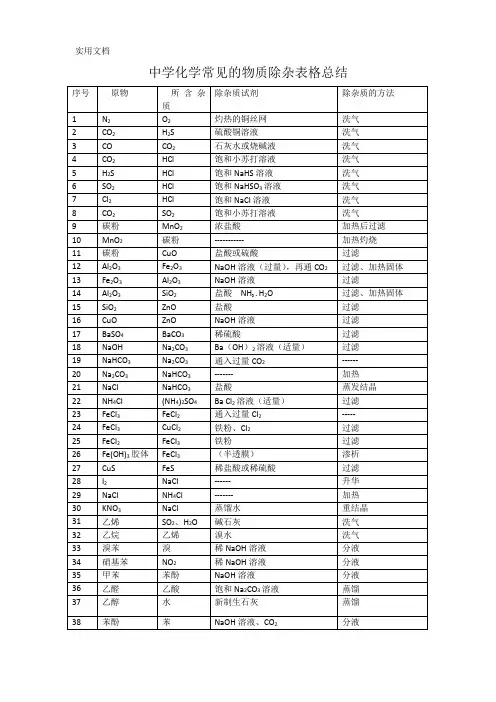
高中化学常见气体除杂篇一:【高中化学】常见物质除杂方法归纳原物所含杂质除杂质试剂除杂质的方法1 N2 O2 灼热的铜丝网洗气2 CO2 H2S硫酸铜溶液洗气3 CO CO2石灰水或烧碱液洗气4 CO2 HCl饱和小苏打溶液洗气5 H2S HCl饱和NaHS溶液洗气6 SO2 HCl饱和NaHSO3溶液洗气7 Cl2 HCl 饱和NaCl溶液洗气8 CO2 SO2 饱和小苏打溶液洗气9 碳粉MnO2 浓盐酸加热后过滤10 MnO2 碳粉 -----------加热灼烧11 碳粉 CuO 盐酸或硫酸过滤12 Al2O3Fe2O3 NaOH溶液(过量),再通CO2过滤、加热固体13 Fe2O3 Al2O3 NaOH溶液过滤14 Al2O3 SiO2盐酸 NH3?H2O 过滤、加热固体15 SiO2ZnO 盐酸过滤116 CuO ZnO NaOH溶液过滤17 BaSO4 BaCO3稀硫酸过滤18 NaOHNa2CO3 Ba(OH)2溶液(适量) 过滤19 NaHCO3 Na2CO3通入过量CO2------20 Na2CO3 NaHCO3 ------- 加热21 NaCl NaHCO3盐酸蒸发结晶22 NH4Cl (NH4)2SO4 Ba Cl2溶液(适量) 过滤23 FeCl3 FeCl2 通入过量Cl2 -----24 FeCl3 CuCl2铁粉、Cl2过滤25 FeCl2 FeCl3 铁粉过滤26 Fe(OH)3胶体 FeCl3 (半透膜) 渗析27 CuS FeS 稀盐酸或稀硫酸过滤28 I2NaCl------ 升华29 NaCl NH4Cl -------加热30 KNO3 NaCl蒸馏水重结晶31 乙烯 SO2、H2O 碱石灰洗气32 乙烷乙烯溴水洗气33 溴苯溴稀NaOH溶液分液34 硝基苯 NO2稀NaOH溶液分液35 甲苯苯酚 NaOH溶液分液36 乙醛乙酸饱和Na2CO3溶液蒸馏37 乙醇水新制生石灰蒸馏238 苯酚苯NaOH溶液、CO2 分液39 乙酸乙酯乙酸饱和Na2CO3溶液分液40 溴乙烷乙醇蒸馏水分液41 肥皂甘油食盐过滤42 葡萄糖淀粉 (半透膜) 渗析气体除杂的原则:(1)不引入新的杂质(2)不减少被净化气体的量注意的问题:(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
中学化学常见地物质除杂表格的总结

化学常见的物质除杂总结1.N2(O2) ——灼热的铜丝 2Cu+O2=2CuO2.CO2(H2S)——用饱和NaHCO3溶液 NaHCO3+H2S=NaHS+H2O+CO2↑3.CO2(CO)——灼热的氧化铜 CuO+CO=Cu+CO24.CO2(HCl)——用饱和NaHCO3溶液 NaHCO3+HCl=NaCl+H2O+CO2↑5.H2S(HCl)——用饱和NaHS溶液 NaHS+HCl=NaCl+H2S6.SO2(HCl)——用饱和NaHSO3溶液 NaHSO3+HCl=NaCl+H2O+SO2↑7.Cl2(HCl)——用饱和食盐水,HCl易溶而Cl2不溶8.MnO2(碳粉)——1.将混合物在氧气中点燃 C+O2=CO22.通入灼热的氧化钙 C+CaO=Ca+CO2↑(条件:高温)3.通入灼热的氧化铁 3C+2Fe2O3=3CO2↑+ 4Fe9.碳粉(MnO2)——加浓盐酸MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O10.C(CuO)——加稀盐酸CuO+2HCl=CuCl2+H2O11.Al2O3(Fe2O3)方法一:将固体混合物溶于过量的氢氧化钠溶液,过滤除去氧化铁,留下滤液。
Al2O3+2OH -=2AlO2-+H2O向滤液中通入过量的CO2,过滤得到Al(OH)3,加热使Al(OH)3分解。
AlO2-+2H2O+CO2=Al(OH)3+HCO3-2Al(OH)3====Al2O3+3H2O方法二:1、将固体混合物溶于过量的盐酸溶液中,是混合物完全溶解。
Al2O3+6H+=2Al3++3H2OFe2O3+6H+=2Fe3++3H2O2、加入过量NaOH溶液,过滤除去沉淀Fe(OH)3, Fe3++3OH-=Fe(OH)3Al3++4OH-=AlO-+2H2O3、向滤液中通入过量的CO2,过滤得到Al(OH)3,加热使Al(OH)3分解。
AlO2-+2H2O+CO2=Al(OH)3+HCO3-2Al(OH)3=Al2O3+3H2O 注:如果是Fe2O3(Al2O3)就直接加氢氧化钠啊!12.SiO2(Al2O3)——加入稀盐酸Al2O3+ 6HCl = 2AlCl3+ 3H2O13.FeCl3(FeCl2)——通入氯气Cl2+2FeCl2=2FeCl314.FeCl2(FeCl3)——加入铁Cu+2FeCl3=CuCl2+FeCl215.NaCl(NH4Cl)——固体的话直接加热NH4Cl=NH3+HCl16.C2H6(C2H4)——通入溴水或者酸性高锰酸钾溶液CH2=CH2+Br2→CH2Br-CH2Br17.溴苯(Br2)——加入氢氧化钠2NaOH+Br2=NaBr+NaBrO+H2O分液18.硝基苯(NO2)——加入氢氧化钠2NO2+ 2NaOH = NaNO2+ NaNO3+H2O分液19.甲苯(苯酚)——加入氢氧化钠Ph-OH+NaOH=Ph-ONa+H2O分液20.乙醛(乙酸)——加饱和碳酸钠2CH3COOH + Na2CO3= 2CH3COONa+ H2O + CO2蒸馏21.乙醇(水)——加氧化钙蒸馏22.乙酸乙酯(乙酸)——饱和碳酸钠溶液2CH3COOH + Na2CO3= 2CH3COONa+ H2O + CO2分液23.肥皂(甘油)——加入NaCl,发生盐析进行过滤24.葡萄糖(淀粉)——加入稀硫酸水解C6H10O5(淀粉)+H2O=C6H12O6(葡萄糖)25.溴乙烷(乙醇)——用水,分液物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理。
高中化学常见物质除杂方法归纳

原物所含杂质除杂质试剂除杂质的方法1 N2 O2灼热的铜丝网洗气2 CO2 H2S 硫酸铜溶液洗气3 CO CO2石灰水或烧碱液洗气4 CO2 HCl 饱和小苏打溶液洗气5 H2S HCl 饱和NaHS溶液洗气6 SO2 HCl 饱和NaHSO3溶液洗气7 Cl2 HCl 饱和NaCl溶液洗气8 CO2 SO2饱和小苏打溶液洗气9 碳粉 MnO2浓盐酸加热后过滤10 MnO2碳粉 ----------- 加热灼烧11 碳粉 CuO 盐酸或硫酸过滤12 Al2O3 Fe2O3 NaOH溶液(过量),再通CO2过滤、加热固体13 Fe2O3 Al2O3 NaOH溶液过滤14 Al2O3 SiO2盐酸 NH3•H2O 过滤、加热固体15 SiO2 ZnO 盐酸过滤16 CuO ZnO NaOH溶液过滤17 BaSO4 BaCO3稀硫酸过滤18 NaOH Na2CO3 Ba(OH)2溶液(适量)过滤19 NaHCO3 Na2CO3通入过量CO2 ------20 Na2CO3 NaHCO3 ------- 加热21 NaCl NaHCO3 盐酸蒸发结晶22 NH4Cl (NH4)2SO4 Ba Cl2溶液(适量)过滤23 FeCl3 FeCl2通入过量Cl2 -----24 FeCl3 CuCl2铁粉、Cl2过滤25 FeCl2 FeCl3铁粉过滤26 Fe(OH)3胶体 FeCl3(半透膜)渗析27 CuS FeS 稀盐酸或稀硫酸过滤28 I2 NaCl ------ 升华29 NaCl NH4Cl ------- 加热30 KNO3 NaCl 蒸馏水重结晶31 乙烯 SO2、H2O 碱石灰洗气32 乙烷乙烯溴水洗气33 溴苯溴稀NaOH溶液分液34 硝基苯 NO2稀NaOH溶液分液35 甲苯苯酚 NaOH溶液分液36 乙醛乙酸饱和Na2CO3溶液蒸馏37 乙醇水新制生石灰蒸馏38 苯酚苯 NaOH溶液、CO2分液39 乙酸乙酯乙酸饱和Na2CO3溶液分液40 溴乙烷乙醇蒸馏水分液41 肥皂甘油食盐过滤42 葡萄糖淀粉(半透膜)渗析气体除杂的原则:(1)不引入新的杂质(2)不减少被净化气体的量注意的问题:(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
高中化学质除杂加物质颜色表格总结
中学化学常见的物质除杂表格总结净化气体的量注意的问题:(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
(2)除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。
方法:1杂质转化法:欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为苯酚钠,利用苯酚钠易溶于水,使之与苯分开2吸收洗涤法;欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠溶液,再通过浓硫酸即可除去3沉淀过滤法;欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入少量铁粉,待充分反应后,过滤除去不溶物即可4加热升华法;欲除去碘中的沙子,即可用此法5溶液萃取法;欲除去水中含有的少量溴,可采用此法6结晶和重结晶;欲除去硝酸钠溶液中少量的氯化钠,可利用二者的溶解度不同,降低溶液温度,使硝酸钠结晶析出,可得到纯硝酸钠晶体7分馏蒸馏法;欲除去乙醚中少量的酒精,可采用多次蒸馏的方法8分液法;欲将密度不同且又互不相溶的液体混合物分离,可采用此法,如将苯和水分离9渗析法;欲除去胶体中的离子,可采用此法。
如除去氢氧化钠胶体中的氯离子高中化学常见有色物质归类1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O42、红色固体:Cu、Cu2O、Fe2O3 、HgO、红磷3、淡黄色固体:S、 Na2O2、 AgBr4.紫黑色固体:KMnO4、I2 5、黄色固体: AgI 、Ag3PO4 6、绿色固体: Cu2(OH)2CO3 7、蓝色晶体:CuSO4·5H2O8 、蓝色沉淀 Cu(OH)2 9、红褐色沉淀: Fe(OH)310、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
高中化学除杂总结大全

部分组成,回答下列问题:
根据上述实验要求,将各实验装置按从左到右的顺序用序号连接起来:( )
→ ( )→( )→ ( )
指出 A、B 装置在实验中的作用:
A
B
实验完毕后,加热和通入氢气同时停止,等试管冷却后得到固体的质量与理论
上所得铜的质量相比较,将会----------(偏大、偏小或不变)
分析:装置的排列从左到右顺序一般是:(1)气体的发生装置(2)气体的除
有机物的分离应结合有机物的物理性质和化学性质。 例如乙烷中混 有乙烯时,有将气体通过溴水或 溶液,用洗气的方法将乙烯除 去, 若溴 乙烷中混有乙醇时,可用水除去,利用乙醇与水互溶,水与溴乙烷不互
4
溶,用水 将乙醇从溴乙烷中萃取出来,
苯中混有苯酚时,单纯用物理性质或单纯用化学性 质都无法将它们分开,而
至溶液呈中性(用 PH 试纸控制),得不含杂质的氯化钠溶液。
分析:为了除去杂质 NH4HCO3 和 Na2SO4,一般可提出两个实验方案:第一
方案是利用 NH4HCO3 受热(35℃以上)易分解成气态物质的特性,先加热氯化
钠晶体除掉 NH4HCO3,再加 Ba2+除掉 SO42-;第二方案是用 Ba(OH)2 同时除掉
两种杂质,这种方法简便,“一举两得”,故优先选用。
具体操作步骤如下:①将不纯的氯化钠晶体溶于适量的蒸馏水中,滴加稍过量
的 Ba(OH)2 溶液,使 SO42-及 CO32-(原 HCO3-与 OH-反应后生成)完全沉淀。
检验 Ba(OH)2 是否过量的方法:取少量滤液,滴几滴 Na2SO4 或稀 H2SO4,
2.乙醇(水) 错例 A:蒸馏,收集 78℃时的馏分。 错因:在 78℃时,一定浓度(95.57%)的乙醇和水会发生“共沸”现象,即 以恒定组成共同气化,少量水无法被蒸馏除去。 错例 B:加生石灰,过滤。
高中化学除杂方法(精编版)

高中化学除杂知识1..N 2(O 2 ) ——灼热的铜丝 2Cu+O 2=2CuO2.CO 2 (H 2S)——用饱和 NaHCO 3 溶液 NaHCO 3+H 2S=NaHS+H 2O+CO 2 ↑3.CO 2 (CO)——灼热的氧化铜 CuO+CO=Cu+CO 24.CO 2 (HCl) ——用饱和 NaHCO 3 溶液 NaHCO 3+HCl=NaCl+H 2 O+CO 2↑5.H 2S(HCl)——用饱和 NaHS 溶液 NaHS+HCl=NaCl+H 2S6.SO 2 (HCl) ——用饱和 NaHSO 3 溶液 NaHSO 3+HCl=NaCl+H 2O+SO 2↑7.Cl 2(HCl) ——用饱和食盐水, HCl 易溶而 Cl 2 不溶8.MnO 2( 碳粉 ) —— 1.将混淆物在氧气中点燃 C+O 2=CO 22.通入灼热的氧化钙 C+CaO=Ca+CO 2↑ (条件 :高温 )3.通入灼热的氧化铁3C+2Fe 2O 3=3CO 2 ↑+ 4Fe9.碳粉( MnO 2)——加浓盐酸 MnO 2 +4HCl( 浓)=MnCl 2+Cl 2↑ +2H 2O 10.C(CuO )——加稀盐酸 CuO+2HCl=CuCl 2 +H 2O 11.Al 2 O 3 ( Fe 2 O 3) 方法一:将固体混淆物溶于过度的氢氧化钠溶液,过滤除掉氧化铁,留下滤液。
Al 2 O 3 +2OH -=2AlO 2-+H 2O向滤液中通入过度的CO 2,过滤获得 Al(OH) 3,加热使 Al(OH) 3 分解。
AlO 2 - +2H 22 33- O+CO =Al(OH) +HCO 2Al(OH) 3====Al 2 O 3 +3H 2 O方法二:将固体混淆物溶于过度的盐酸溶液中,是混淆物完整溶解。
Al 2 O 3 +6H+=2Al 3++3H 2 OFe 2 O 3 +6H+=2Fe3++3H 2O 2、加入过度 NaOH 溶液 ,过滤除掉积淀Fe(OH) 3, Fe 3++3OH - =Fe(OH)3Al 3++4OH-=AlO -+2H 2O 3、向滤液中通入过度的 CO2,过滤获得 Al(OH) 3 ,加热使 Al(OH) 3 分解。
(完整版)高中化学除杂总结表
30
乙烯
二氧化硫
水 碱石灰(SO2是酸性氧化物,能和碱反应,乙烯不与氢氧化钠发生反应,且几乎不溶于水。)SO2+2NaOH=Na2SO3+H2O,SO2+CaO=CaSO3,(引伸:能与碱石灰反应的物质不能用碱石灰来干燥)
加固体转化法
31
乙烷
乙烯
通过盛有溴水的洗气瓶,溴水和乙烯加成生成液态的1,2-二溴乙烷.CH2=CH2+Br2→CH2BrCH2Br,
CuS
FeS
稀盐酸,FeS + H2SO4= H2S↑ + FeSO4,CuS不会被硫酸溶解
过滤
27
碘单质
氯化钠
加热,碘升华(利用碘的ຫໍສະໝຸດ 质)加热升华28NaCl晶体
氯化铵
加热NH4CL→NH3↑+H2O
加热分解
29
KNO3晶体
氯化钠
蒸馏水, (温度升高,KNO3的溶解度随之大大的增加,而NaCl的溶解度受温度影响不大),加适量的水溶解,再置于蒸发皿加热,NaCl会析出,待NaCl晶体不再析出,停止加热,趁热过滤溶液(过滤热饱和溶液法).重复数次后适当地晾干,即可得到纯度较高的NaCl晶体了.再对滤液降温,结晶出的就是KNO3
过滤
14
Fe2O3
Al2O3
氢氧化钠,Al2O3是两性氧化物,能与强碱溶液反应,往试样里加入足量的 NaOH溶液,使其中Al2O3转化为可溶性NaAlO2,然后过滤,洗涤难溶物,即为纯净的Fe2O3
过滤
15
Al2O3
SiO2
盐酸氨水,加入稀盐酸Al2O3+ 6HCl = 2AlCl3+ 3H2O ,过滤去除二氧化硅, 向滤液中通入AlCl3+3NH3·H2O=Al(OH)3↓+ 3NH4Cl,过滤得到Al(OH)3, 然后洗涤,灼烧得Al2O3。反应式: 2Al(OH)3=(加热)Al2O3+3H2O。
高中化学有机物常见“除杂方法”大全
高中化学有机物常见“除杂方法”大全1、气态烷(气态烯、炔)除杂试剂:溴水、浓溴水、溴的四氯化碳溶液操作:洗气注意:酸性高锰酸钾溶液不可。
原理:气态烯、炔中不饱和的双键、叁键可与上述除杂试剂发生反应,生成不挥发的溴代烷2、汽油、煤油、柴油的分离(说白了就是石油的分馏)除杂试剂:物理方法操作:分馏原理:各石油产品沸点范围的不同。
3、乙烯(CO2、SO2、H2O、微量乙醇蒸气)除杂试剂:NaOH溶液-浓硫酸操作:洗气原理:CO2、SO2可与NaOH反应生成盐而被除去,乙醇蒸气NaOH溶液中的水后溶被除去,剩余水蒸气可被浓硫酸吸收。
4、乙炔(H2S、PH3、H2O)除杂试剂:CuSO4溶液-浓硫酸操作:洗气原理:H2S、PH3可与CuSO4溶液反应生不溶物而被除去,剩余水蒸气可被浓硫酸吸收。
5、甲烷、一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷的分离除杂试剂:物理方法操作:分馏原理:沸点不同。
)6、溴苯(Br2除杂试剂:NaOH溶液操作:分液可与NaOH溶液反应生成盐,系强极性离子化合物,不溶原理:Br2于苯而溶于水(相似相容原理)。
、水)7、硝基苯(HNO3除杂试剂:水、操作:分液原理:等于是用水萃取硝基苯中的硝酸,具体原理见“萃取”。
TNT、苦味酸除杂可使用相同操作。
8、气态卤代烃(卤化氢)除杂试剂:水操作:洗气(需使用防倒吸装置)原理:卤化氢易溶于水,可被水吸收,气态卤代烃不溶于水。
9、乙醇(水或水溶液)除杂试剂:CaO、碱石灰操作:蒸馏原理:CaO与水反应生成不挥发的Ca(OH)2,故只会蒸馏出无水的乙醇。
10、苯(苯酚)除杂试剂:NaOH溶液操作:分液原理:苯酚可与NaOH溶液反应生成苯酚钠,系强极性离子化合物,不溶于苯而溶于水(相似相容原理)。
11、乙酸乙酯(乙醇、乙酸、水)除杂试剂:浓硫酸+饱和Na2CO3溶液操作:蒸馏+分液原理:乙酸与乙醇发生可逆的酯化反应生成乙酸乙酯和水,四者共同存在于反应容器当中。
高中化学除杂总结表格高清
结晶 利用物质的溶解度差异分离固体混合物
分离固体混合物
以上是化学除杂的一些基本方法和原理的总结。在实际应用中,还需要根据具 体情况选择合适的方法,并结合化学知识进行操作和处理。
化学除杂是一种分离混合物中杂质的技术。以下是一些化学除杂的总结:
除杂方 法
原理
应用Leabharlann 洗涤 利用溶剂溶解杂质,与原混合物分离
分离固体颗粒
利用沉淀剂使混合物中的离子形成沉淀,与 分离溶液中的离
沉淀 原混合物分离
子
过滤 利用过滤介质分离固体颗粒或杂质
分离固体颗粒或 杂质
蒸馏 利用物质的沸点差异分离混合物
分离液体混合物
高中化学实验常见除杂
高中化学实验常见除杂一说化学大家就会觉得化学很繁多,其实在学习化学中,还是需要积累的,小编整理了高中化学实验常见除杂,希望能帮助到大家。
必修教材有机物除杂(括号内为杂质)1.乙烷或甲烷(乙烯) 溴水洗气解析:乙烯能与溴水发生加成反应生成1,2-二溴乙烷变成了液体,而乙烷不能。
2.乙醇(少量水) 加入新制的生石灰蒸馏解析:水与CaO反应生成氢氧化钙,乙醇易挥发,加热蒸馏即可得到乙醇。
点评:氧化钙除去较多的水分,乙醇和水属于互溶的液体,采取蒸馏的方法3、乙醇(乙酸) 加入新制的生石灰或NaOH 蒸馏解析:乙酸与CaO反应生成乙酸钙,乙醇易挥发,加热蒸馏即可得到乙醇。
4.溴苯(溴) 氢氧化钠溶液分液解析:Br2 +2NaOH=NaBr+NaBrO+H2O,生成的盐NaBr和NaBrO都易溶于水进入水层,而溴苯在常温常压下不与NaOH反应,而且难溶于通过分液取下层既能得到溴苯。
5. 硝基苯(混酸) 氢氧化钠溶液或水分液解析:利用浓硫酸和浓硝酸易与氢氧化钠溶液反应或易溶于水的性质使混酸进入水层,硝基苯难溶于水,密度大于水,在下层。
6.乙酸乙酯(乙酸、乙醇) 饱和碳酸钠溶液分液解析:乙醇溶解在碳酸钠溶液中,乙酸与碳酸钠溶液反应均进入水层,乙酸乙酯不溶于水,在上层,通过分液即可分离。
7.肥皂(甘油) 饱和食盐水盐析、过滤解析:加入饱和食盐水使肥皂发生盐析,再通过过滤滤出肥皂即可。
有机物的分离8. 淀粉溶液(纯碱) 蒸馏水渗析法解析:淀粉溶液是胶体,胶体中混有的小分子或离子可以用渗析法除去。
选修教材有机物除杂9. 苯(苯甲酸) 氢氧化钠溶液分液解析:苯甲酸能与NaOH反应生成苯甲酸钠,苯甲酸钠易溶于水,而苯不溶于水,通过分液取上层就能得到苯。
10. 苯(苯酚) 氢氧化钠溶液分液解析:原理与1类似,苯酚能与NaOH应生成苯酚钠,苯酚钠易溶于水。
11. 苯(乙苯) 酸性高锰酸钾溶液和氢氧化钠溶液分液解析:先用酸性高锰酸钾溶液将乙苯氧化为苯甲酸,再用氢氧化钠溶液将苯甲酸转化为苯甲酸钠溶于水层,分液即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
30
乙烯
二氧化硫
水 碱石灰(SO2是酸性氧化物,能和碱反应,乙烯不与氢氧化钠发生反应,且几乎不溶于水。)SO2+2NaOH=Na2SO3+H2O,SO2+CaO=CaSO3,(引伸:能与碱石灰反应的物质不能用碱石灰来干燥)
加固体转化法
31
乙烷
乙烯
通过盛有溴水的洗气瓶,溴水和乙烯加成生成液态的1,2-二溴乙烷.CH2=CH2+Br2→CH2BrCH2Br,
洗气
32
溴苯
溴水
氢氧化钠稀溶液,Br2+ 2NaOH = NaBr + NaBrO + H2O,而溴苯与NaOH溶液反应很缓慢,所以将NaOH溶液加入到溴苯中振荡后,Br2反应后到无机层中,溴苯在有机层中,然后用分液漏斗进行分液操作,除去NaBr + NaBrO
分液
33
甲苯
苯酚
氢氧化钠溶液,(苯酚有酚羟基,有弱酸性.可以通过加入少量碱使其成为酚钠盐,酚钠盐在水中溶解度大增,用少量水即可洗去苯酚.苯酚钠是有机物,但它属于离子化合物,又是钠盐,他易溶于水,难溶于有机溶剂)C6H5OH+NaOH=C6H5ONa+H2O
蒸馏
36
苯酚
苯
氢氧化钠,C6H5OH+NaOH=C6H5ONa+H2O,将得到的苯酚钠溶液和苯分液取下层溶液部分,(上层是苯(烃的密度小于水))然后向苯酚钠中通入CO2,生成碳酸氢钠与苯酚, C6H5ONa+CO2+H2O= C6H5OH+NaHCO3再将得到的碳酸氢钠溶液和苯酚分液,取油状部分即得到苯酚.
氯气过滤
23
FeCl2
FeCl3
铁,2FeCl3+Fe=3FeCl2
加还原剂转化法
24
CuO
铁
磁铁
吸附
25
氢氧化铁胶体
氯化铁
蒸馏水,胶体净化的一般方法:渗析法.将胶体装入半透膜制作的渗析袋,置于流水中.一段时间后,电解质离子逐渐穿过半透膜而被流水带走,而胶粒颗粒大不能穿过半透膜,从而得到净化
渗析
26
加酸转化法
20
NaCl
NaHCO3
盐酸,2NaHCO3+HCl=NaCl+ H2O+CO2↑
21
FeCl3
2FeCl2
通入氯气,Cl2+2FeCl2=2FeCl3
加氧化剂转化法
22
FeCl3
CuCl2
加铁,先 2FeCl3+Fe=3FeCl2,后 Fe+CuCl2=FeCl2+Cu(活动性强的金属把活动性弱的金属置换出来),过滤除Cu,再通入氯气,Cl2+2FeCl2=2FeCl3
分液
34
乙醛
乙酸
饱和碳酸钠,加入Na2CO3,将乙酸变为乙酸钠(2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑),盐类(乙酸钠)的沸点会升高很多,利用蒸馏就能使乙醛挥发出去,得到提纯
蒸馏
35
乙醇
水(少量)
新制氧化钙,CaO+H2O=Ca(OH)2,再蒸馏,蒸馏时乙醇挥发出来,收集挥发的乙醇冷凝回流.这样就可以分离出来。(如果直接蒸馏,那么乙醇和水蒸汽会混在一起,分离不出.)
二氧化碳分液
37
乙酸乙酯
乙酸
饱和Na2CO3溶液,将乙酸变为乙酸钠(2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑,分液,上层为乙酸乙酯
分液
38
溴乙烷
乙醇
蒸馏水。溴乙烷不溶于水,而乙醇可以与水混溶,用水使乙醇溶解,静止分层后,用分液漏斗分离(溴乙烷的密度较大,下层是溴乙烷,上层是乙醇和水的混合液)
分液
过滤
16
SiO2
Al2O3
加盐酸:Al2O3+6HCl=2AlCl3+3H2O,过滤得二氧化硅。
过滤
17
SiO2
ZnO
盐酸溶液,ZnO+2HCl═ZnCl2+H2O,过滤得二氧化硅
过滤
18
BaSO4
BaCO3
盐酸,BaCO3+HCl=BaCl2+H2O+CO2↑
过滤
19
NaHCO3
Na2CO3
二氧化碳,Na2CO3+CO2+H2O= 2NaHCO3
萃取分液
39
肥皂
甘油
食盐,脂肪酸钠(肥皂)在浓的盐水中不溶解,而甘油在盐水中的溶解度很大,所以可以用加入食盐的办法把肥皂和甘油分开.,发生盐析进行过滤
盐析过滤
40
葡萄糖
淀粉
淀粉是胶体,微粒较大,葡萄糖形成的是溶液
渗析
41
硝基苯
NO2
氢氧化钠,2NO2+ 2NaOH = NaNO2+ NaNO3+H2O(岐化反应),分液
饱和碳酸氢钠,NaHCO3+SO2=NaH SO3+H2O+CO2↑
洗气
10
碳粉
MnO2
浓盐酸, MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
加热过滤
11
MnO2
碳粉
C+O2=CO2
灼烧12碳粉Fra bibliotekCuO
稀盐酸CuO+2HCl=CuCl2+H2O
过滤
13
Al2O3
Fe2O3
氢氧化钠(过量,保证Al2O3充分被溶解), Fe2O3与NaOH不发应,Al2O3+2NaOH=2NaAlO2+H2O, 过滤除去氧化铁, 向滤液中通入过量的CO2,NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,过滤得到Al(OH)3, 然后洗涤,灼烧.反应式:2Al(OH)3=(加热)Al2O3+3H2O。
CuS
FeS
稀盐酸,FeS + H2SO4= H2S↑ + FeSO4,CuS不会被硫酸溶解
过滤
27
碘单质
氯化钠
加热,碘升华(利用碘的性质)
加热升华
28
NaCl晶体
氯化铵
加热NH4CL→NH3↑+H2O
加热分解
29
KNO3晶体
氯化钠
蒸馏水, (温度升高,KNO3的溶解度随之大大的增加,而NaCl的溶解度受温度影响不大),加适量的水溶解,再置于蒸发皿加热,NaCl会析出,待NaCl晶体不再析出,停止加热,趁热过滤溶液(过滤热饱和溶液法).重复数次后适当地晾干,即可得到纯度较高的NaCl晶体了.再对滤液降温,结晶出的就是KNO3
过滤
14
Fe2O3
Al2O3
氢氧化钠,Al2O3是两性氧化物,能与强碱溶液反应,往试样里加入足量的 NaOH溶液,使其中Al2O3转化为可溶性NaAlO2,然后过滤,洗涤难溶物,即为纯净的Fe2O3
过滤
15
Al2O3
SiO2
盐酸氨水,加入稀盐酸Al2O3+ 6HCl = 2AlCl3+ 3H2O ,过滤去除二氧化硅, 向滤液中通入AlCl3+3NH3·H2O=Al(OH)3↓+ 3NH4Cl,过滤得到Al(OH)3, 然后洗涤,灼烧得Al2O3。反应式: 2Al(OH)3=(加热)Al2O3+3H2O。
CO2
HCL
饱和碳酸氢钠NaHCO3溶液 NaHCO3+HCl=NaCl+H2O+CO2↑
洗气
6
H2S
HCL
饱和硫氢化钠NaHS+HCl=NaCl+H2S
洗气
7
SO2
HCL
饱和亚硫酸氢钠NaHSO3+HCl=NaCl+H2O+SO2↑
洗气
8
Cl2
HCl
饱和食盐水,HCl易溶于NaCl中
洗气
9
CO2
SO2
高中化学除杂总结表
序号
原物
杂质
除杂试剂
操作
1
N2
O2
灼热的铜丝网2Cu+O2=2CuO
固转气
2
CO2
H2S
饱和NaHCO3溶液 NaHCO3+H2S=NaHS+H2O+CO2↑
洗气
3
CO
CO2
氢氧化钠CO2+NaOH=Na2CO3+H2O
洗气
4
CO2
CO
灼热的氧化铜CuO+CO=Cu+CO2
固转气
5
