第二章 缓冲溶液1
《医用化学》

《医用化学》教学大纲建桥学院护理系2011年建桥护理护理系三年制专科护理专业《医用化学》课程教学大纲一、课程的性质与任务(一)本课程的性质本课程主要面向护理专业大一学生,属于专业基础课。
(二)本课程的任务在整个专业的培养计划中,本课程属于专业基础课。
本课程注重与中学化学的衔接,促使学生尽快完成从中学到大学学习方法的转变;注重与后续课程及相关学科的联系,大量增加与医学相关的化学知识,提高学生的学习兴趣。
具体实施时,理论课与实验课交替进行,使学生不但打好扎实的理论基础,还掌握基本的实验操作技能,养成良好的科学工作作风;同时培养学生分析问题、解决问题的能力,为今后的学习和工作打下良好的基础。
二、课程的基本要求通过本课程的学习,使学生明确化学基础理论和基本知识在本专业中的重要性;理解常用的溶液浓度、溶液的渗透压、缓冲溶液、配位化合物等对专业的意义;熟练地进行有关的化学计算;认识有机物的结构特点;运用命名原则进行命名;理解有关有机化合物的主要化学性质并书写化学反应式;掌握化学实验基本技能,正确使用常用仪器和试剂进行化学实验,并规范地书写实验报告;养成积极主动、严谨求实的学习习惯和遵守纪律、团结合作、爱护公物和良好品德。
三、课程内容(一)课程主要内容第一章绪论学习要点:化学的研究对象是物质、即研究物质的组成、结构、性质及其变化规律。
化学是医学的基础,医学的发展和进步离不开化学。
人和大自然具有相同的化学元素组成;人体是一个复杂的化学反应系统,每时每刻都在进行着各种形式的化学反应,只不过这些反应比体外反应更复杂、更高效、更精确。
医学化学是一门重要的公共基础课,包括无机化学、有机化学和化学实验三部分。
学习要求:掌握化学的研究对象熟悉化学和医学的关系,SI单位制和法定计量单位了解医学化学课程的地位和作用,有益的学习方法第二章溶液学习要点:1、溶液组成标度的表示方法2、溶液的渗透压3、渗透压在医学上的意义学习要求:掌握物质的量浓度、质量浓度、质量分数、体积分数及其有关计算,渗透现象产生条件,渗透压和渗透浓度的概念及计算。
生物化学第三版课后习题答案

1. 举例说明化学与生物化学之间的关系。
提示:生物化学是应用化学的理论和方法来研究生命现象,在分子水平上解释和阐明生命现象化学本质的一门学科.化学和生物化学关系密切,相互渗透、相互促进和相互融合。
一方面,生物化学的发展依赖于化学理论和技术的进步,另一方面,生物化学的发展又推动着化学学科的不断进步和创新。
举例:略。
2.试解释生物大分子和小分子化合物之间的相同和不同之处。
提示:生物大分子一般由结构比较简单的小分子,即结构单元分子组合而成,通常具有特定的空间结构。
常见的生物大分子包括蛋白质、核酸、脂类和糖类。
生物大分子与小分子化合物相同之处在丁: 1) 共价键是维系它们结构的最主要的键; 2)有一定的立休形象和空间大小; 3)化学和|物理性质主要决定于分子中存在的官能团。
生物大分子与小分子化合物不同之处在于: (1) 生物大分子的分子量要比小分子化合物大得多,分子的粒径大小差异很大; (2) 生物大分子的空间结构婴复杂得多,维系空间结构的力主要是各种非共价作用力; (3) 生物大分子特征的空间结构使其具有小分子化合物所不具有的专性识别和结合位点,这些位点通过与相应的配体特异性结合,能形成超分子,这种特性是许多重要生理现象的分子基础。
3. 生物大分子的手性特征有何意义?提示:生物大分子都是手性分子,这种结构特点在生物大分子的分子识别及其特殊的生理功能方面意义重大。
主要表现在: (1) 分子识别是产生生理现象的重要基础,特异性识别对于产生特定生物效应出关重要; (2) 生物大分了通过特征的三维手性空间环境能特异性识别前手性的小分子配体,产生专一性的相互作用。
4.指出取代物的构型:6.举例说明分子识别的概念及其意义。
提示: :分子识别是指分子间发生特异性结合的相互作用,如tRNA分子与氨酰tRNA合成醉的相互作用,抗体与抗原之间的相互作用等。
分子识别是生命体产生各种生理现象的化学本质,是保证生命活动有序地进行的分子基础。
缓冲溶液

②弱碱及其对应盐
H2CO3 - HCO3NH4+ - NH3
③多元酸的酸式盐及 H2PO4- - HPO42-
其对应的次级盐 HPO42- - PO43一些常见的缓冲系 (弱酸) (共轭碱) 列于表4-1中(p52)。 共轭酸碱对
缓冲系的组成:
缓冲溶液由 HB ~ B- 组成 ① HB与B-为共轭酸碱对
HB
例:在1L混合液中,含有0.10molHAc 和0.10molNaAc (HAc:pKa=4.76)
(1) 计算混合液的pH值
解: pH = pKa + lg —ccHB—-B pH = pKa + lg —ccAHc—A-c = 4.76 + l0g 0—.1
0.1
例:在1L混合液中,含有0.10mol HAc和 0.10mol NaAc (HAc:pKa=4.76)
(3) 在此混合液中加入0.01molNaOH, 溶液的pH值=?
解: HAc + NaOH → NaAc + H2O
0.0190 0.01 0.110
pH = pKa + lg —c00c.A.H10—cA1-9c
= 44.7.865+0.09
例:在1L混合液中,含有0.10mol HAc 和0.10mol NaAc (HAc:pKa=4.76)
P53, 4.4式
根据上面的公式,您认为缓冲溶液的 pH值与什么因素有关?
1、缓冲溶液的pH值首先取决于弱酸的 离解常数Ka值。
2、其次取决于缓冲对浓度的比例--缓冲比, 当pKa一定时,pH值随着缓 冲比的改变而改变。缓冲比为1时,pH = pKa
3、当缓冲液适当稀释时,缓冲比不变, pH 基本不变 。
常用缓冲溶液的配制及氨基酸常数等
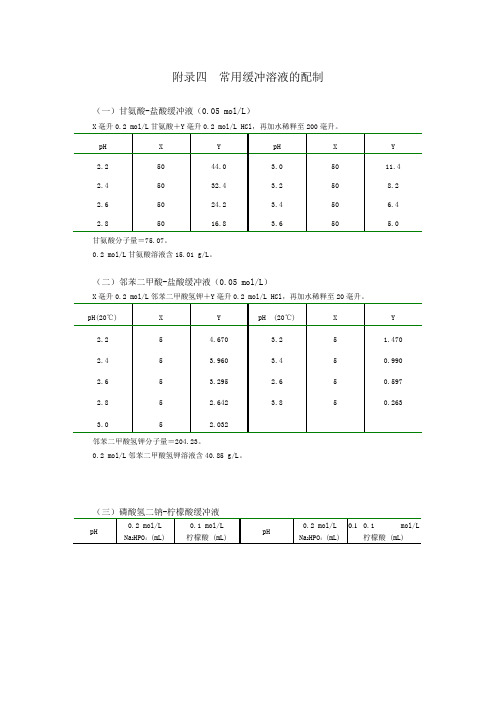
附录四常用缓冲溶液的配制(一)甘氨酸-盐酸缓冲液(0.05 mol/L)甘氨酸分子量=75.07。
0.2 mol/L甘氨酸溶液含15.01 g/L。
(二)邻苯二甲酸-盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量=204.23。
0.2 mol/L邻苯二甲酸氢钾溶液含40.85 g/L。
Na2HPO4分子量=141.98;0.2 mol/L溶液为28.40 g/L。
Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
C6H8O7·H2O分子量=210.14;0.1 mol/L溶液为21.01 g/L。
①使用时可以每升中加入1克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
柠檬酸:C6H8O7·H2O分子量=210.14 ;0.1 mol/L溶液为21.01 g/L。
柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L。
NaAc·3H2O分子量=136.09;0.2 mol/L溶液为27.22 g/L。
冰乙酸11.8 mL稀释至1 L(需标定)。
(七)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L)(八)磷酸盐缓冲液Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
NaH2PO4·H2O分子量=138.01;0.2 mol/L溶液为27.6 g/L。
NaH2PO4·2H2O分子量=156.03;0.2 mol/L溶液为31.21 g/L。
巴比妥钠分子量=206.18;0.04 mol/L溶液为8.25 g/L。
缓冲溶液配置实验报告

竭诚为您提供优质文档/双击可除缓冲溶液配置实验报告篇一:缓冲溶液配制实验实验报告(二)缓冲溶液的配制和ph的测定区县____________学号____________姓名___________ 成绩_________实验内容:1.hAc-naAc缓冲溶液的配制注意:百里酚蓝指示剂的变色范围如下:在试管中加入3mL0.1mol·L的hAc和3mL0.1mol·L的naAc溶液就配制成了该缓冲溶液.加百里酚蓝指示剂5滴,显示___________色.计算此缓冲溶液的ph将配制的缓冲溶液为为3份.(1)取一份,加入5滴0.1mol·L的盐酸,则颜色变化是__________________________________________.再加入过量的0.1mol·L的盐酸,则颜色的变化是_________________________________.(2)取一份,加入5滴0.1mol·L的naoh溶液,则颜色变化是_____________________________________.再加入过量的0.1mol·L的naoh溶液,则颜色的变化是_________________________________.(3)取一份,加入5滴水,则溶液的颜色变化是_________________.2.nh3·h2o-nh4cl缓冲溶液的配制将25mL0.1mol·L的nh3·h2o和25mL0.1mol·L的nh4cl 溶液混合在烧杯中,即成缓冲溶液.测定ph值后,分成2分,分别加入0.5mL0.1mol·Lhcl溶液和0.5mL0.1mol·Lnaoh溶液.填写下表:思考题:什么是缓冲溶液?答:-1-1-1-1-1-1-1-1篇二:4缓冲溶液的配制与ph值的测定实验三缓冲溶液的配制与ph值的测定1.实验目的(1)掌握缓冲溶液的配制原理和方法;(2)熟悉有关缓冲溶液配制的计算公式;(3)了解缓冲溶液的有关性质;(4)学习用ph计测定溶液的ph值;2.实验原理在一定程度上能抵抗外加少量酸、碱或稀释,而保持溶液ph值基本不变的作用称为缓冲作用。
[无极及分析化学]各章知识点
![[无极及分析化学]各章知识点](https://img.taocdn.com/s3/m/6a2d240a16fc700abb68fc25.png)
3.掌握运用盖斯定律进行化学反应自由能变(参 考状态单质的标准摩尔自由能 = 零、反应自由能 由物质的生成自由能求得)。 4.掌握利用反应焓变、熵变、自由能变等热力学、 数据判断化学反应的方向、反应自发进行的温度 (低温、高温、任何温度)、反应是否自发可用温 度来调整。
5.掌握标准反应平衡常数的表达、利用已知 反应平衡常数求其他反应的平衡常数。 6.掌握化学平衡的移动;掌握标准自由能变 与标准平衡常数之间的换算;浓度、压力、温 度对化学平衡的影响。
第二章 化学反应的一般原理
一 、基本概念 5.化学反应速率(化学反应速率的概念、化学反 应速率方程式、反应速率(碰撞、过渡态)理论、 活化能、温度、催化剂对反应速度的影响) 6.化学反应条件的优化
二 计算
1.掌握运用盖斯定律进行化学反应焓变的计 算(参考状态单质的标准摩尔生成焓=零、反应 焓由物质的生成焓或燃烧焓求得) 2.熵(熵的变化规律、反应或过程前后熵的 变化)
二 、计算 1.分步沉淀 2. 定量分离的条件 3. 沉淀的溶解的平衡计算
第六章 氧化还原平衡与氧化还原滴定法
一、基本概念(术语) 1.电极电位 (条件、标准)。 2. 原电池写法(给定化学反应式能分解成正、 负极,并写出原电池的表示式)。 3. 判断氧化和还原反应进行的方向(用标准电 极电位的判断)。 4. 氧化和还原反应的平衡常数。
14. 共价键的特点共价化合物的特点 15.共价键的类型 16 . 杂化轨道和化合物的构型 17. 分子间的力(色、取、诱及氢键 18. 离子的极化 (极化力和变形性、对 晶体键型的影响、对化合物的影响)
第八章
配位化合物与配位滴定
一.基本概念(术语) 1.配合物的组成和命名 2. 配合物中心离子的杂化轨道类型 3. 内轨和外轨配合物,内轨和外轨配合物 合物与磁矩的关系. 4. 高自旋、低自旋配合物 5. 配合平衡的移动(酸度、沉淀、氧化 还原其的影响)
缓冲溶液1

3.若ca、cb远较溶液中[H+]和[OH-]大时, 既可忽略水的离解,又可在考虑总浓度时忽略弱酸 和共轭碱(或弱碱与共轭酸)的离解 [H+]= Ka·ca/cb pH=pKa+lgcb/ca (二) 标准缓冲溶液 前面曾讲到,标准缓冲游液的pH值是经过实验 准确地确定的,即测得的是 H+ 的活度。因此,若用 有关公式进行理论计算时,应该校正离子强度的影 响,否则理论计算值与实验值不相符。例如由 0.025 mol·L-1Na2HPO4和0.025 mol·L-1 KH2PO4所组成的 缓冲溶液,经精确测定,pH值为6.86。
例如,甲基橙的pKHIn=3.4,理论变色范围
应为2.4-4.4,而实测变色范围是3.1-4.4。这说明 甲基橙要由黄色变成红色,碱式色的浓度([In-]) 应是酸式色浓度([HIn])的l0倍;而酸式色的浓度 只要大于碱式色浓度的2倍,就能观察出酸式色
(红色)。 产生这种差异性的原因,是由于人眼对
2
2
0.050
二、缓冲容量和缓冲范围
缓冲溶液是一种能对溶液酸度起稳定 ( 缓冲 ) 作 用的溶液,如果向溶液加入少量强酸或强碱,或者 将其稍加稀释时,缓冲溶液能使溶液的 pH 值基本 上保持不变。也就是说, 缓冲溶液只能在加入一定 数量的酸碱,才能保持溶液的pH基本保持不变。 1922年范斯莱克提出以缓冲容量作为衡量溶液 缓冲能力的尺度。其定义可用数学式表示为: β=db/dpH =-da/dpH
例 1 考 虑 离 子 强 度 的 影 响 , 计 算 0.025mol· L-1 Na2HPO4—0.025 mol· L-KH2PO4缓冲溶液的 pH值。 解: I=0.10 mol/L
lg H
2 PO4
缓冲液配制和pH值测定

一. 目的了解配制缓冲液和pH计的基本原理。
掌握配制缓冲液和使用pH计的基本方法。
二. 原理在一定的酸或碱作用下,能够自动调整和保持溶液pH值基本不变的溶液称为缓冲液。
以HAc和NaAc组成的缓冲液为例,它的pH符合下面关系:pH= pKa-lg[HAc]/[Ac-],因此改变[HAc]/[Ac-]的比值,可以在一定范围内配制不同pH值的缓冲液。
缓冲液的缓冲容量大小不仅与其总浓度有关,而且与其组分比也有关。
总浓度越大,缓冲容量越大;总浓度一定,其组分浓度比越接近1,缓冲容量越大。
缓冲液适当稀释或浓缩,其pH值基本保持不变。
测定pH值的pH计(或称酸度计),一般是由一支对H+敏感的玻璃电极和一支不随溶液中被测离子活度变化而改变其本身电位的甘汞电极以及一个测量电位的电位计所组成,两支电极和测试溶液构成一个伏特电池,电极在不同的pH值溶液中产生不同的电位,它符合电化学理论中的Nernst方程,即E = E0-(2.303RT/F)pH。
测定中,首先测得已知pH的标准缓冲液中产生的电位Es,然后,由测得未知pH缓冲液中产生的电位Ex通过公式可直接算出该缓冲液的pH(pHx)。
为了方便,pH计上装有一个定位调节器,当测量标准缓冲液pH时,利用它可把读数直接指示在标准的pH值上,这样在以后测未知pH的缓冲液时,该电位读数也就直接表示相应的pH值。
在本实验使用的Beckman Φ61 pH计计中,以上过程均由仪器自动完成。
三. 实验试剂及设备1. 试剂磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钠(NaH2PO4·2H2O)冰醋酸、醋酸钠(NaAc·3H2O)、三羟甲基氨基甲烷(Tris)甘氨酸、盐酸、标准pH缓冲液(pH4.01、7.00、10.01)2. 仪器电子天平(感量0.001g)pH计3. 器材容量瓶:100mL×2量筒:50mL×1移液管:10mL×1烧杯:100mL⨯1 200mL⨯2漏斗、洗瓶、洗耳球、移液管架、玻棒:各1四. 操作步骤1. 磷酸氢二钠-磷酸二氢钠缓冲液配制(0.1mol/L,pH7.0)(1) 由附录“常用缓冲溶液的配制”表中通过计算,分别称取Na2HPO4·12H2O g,NaH2PO4·2H2O g,用蒸馏水溶解后,定容至100mL。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五节 血液中的缓冲系
• 在这些缓冲系中,碳酸缓冲系H2CO3-HCO3-的浓 度最高,在维持血液pH的正常范围中发挥的作用 最重要。 • 碳酸缓冲系来源于呼吸作用的二氧化碳溶于血液 生成的碳酸,与其离解产生的碳酸氢根离子,以 及血液中贮存的碳酸氢根离子达成平衡:
第五节 血液中的缓冲系
• 若 血 液 的 pH 小 于 7.35 , 则 会 发 生 酸 中 毒 (acidosis);若pH大于7.45,则发生碱中毒 (alkalosis)。若血液的pH小于6.8或大于7.8, 就会导致死亡。
许多化学反应,需要在一定的酸度条件 下才能正常进行。 人体内的各种体液都具有一定的pH范围, 如血液的pH范围为7.35~7.45,如果超出这
个范围,就会出现酸中毒和碱中毒。因此,
维持溶液和体液的pH基本恒定,在化学和医
学上都同样具有重要的意义。
第二章 缓冲溶液
Buffer Solution
学习要求
实 验
溶
液
pH (实验)
1
5.0 ml 0.20 M HAc 9.0 ml 0.20 M NaAc 往上述混合溶液中 加入: 0.10 ml(2滴) 1.0 M HCl 加入: 0.10 ml(2滴) 1.0 M NaOH 往10ml pH=5.00的HCl溶液中 加入: 0.10 ml(2滴) 1.0 M HCl 加入: 0.10 ml(2滴) 1.0 M NaOH
• • • • • 掌握缓冲溶液的概念、组成和缓冲机理。 掌握影响缓冲溶液pH的因素、应用HendersonHasselbalch方程式计算缓冲溶液pH值。 掌握缓冲容量的概念、影响因素及有关计算。 熟悉配制缓冲溶液的原则和方法。了解医学上 常用缓冲溶液配方和标准缓冲溶液。 熟悉血液中的主要缓冲系及在稳定血液pH过程 中的作用。
5.01
4.96 5.09
2
3
2.00 12.00
可见,加入少量强酸(或强碱)溶液后,对No.1
溶液的pH影响很小。No.1溶液有缓冲作用。
第一节 缓冲溶液及缓冲机制
一.缓冲溶液的缓冲作用和组成 结论 HAc — NaAc 混合溶液有抵抗外来 少量强酸、强碱而保持pH值基本不 变的能力。
第一节 缓冲溶液及缓冲机制
第二节 缓冲溶液的pH值
一.缓冲溶液pH值的计算公式
② 由于 c = n/V,所以
第二节 缓冲溶液的pH值
一.缓冲溶液pH值的计算公式
③ 根据 n = cV,若取储备液 c(B-) = c(HB)(混合 前的浓度)
例: 1L缓冲溶液中含有0.10molHAc和0.20mol NaAc, 求该缓冲溶液的pH值。 Ka(HAc) =1.76×10-5 解:该缓冲溶液中含有HAc-NaAc缓冲对 又 Ka(HAc) =1.76×10-5 Ca =0.10mol· -1 L Cb = 0.20 mol· -1 L Cb 0.20 pH = pKa + lg —— = 4.75 + lg—— 0.10 Ca = 5.05
-1
pH(25℃) 3.557 4.008 6.865 7.413 9.180
KHC4H4O6 KHC8H4O4 KH2PO4-Na2HPO4 KH2PO4-Na2HPO4 (Na2B4O7· 10H2O)
第五节 血液中的缓冲系
• 血浆中: H2CO3-HCO3H2PO4--HPO42HnP-Hn-1P-(血浆蛋白) • 红细胞中: H2b-Hb-(血红蛋白) H2bO2-HbO2-(氧合血红蛋白) H2CO3-HCO3H2PO4--HPO42-
+
质子转移平衡 H A c+H 2O H 2C O 3+ H 2O H 3P O 4+ H 2O T r is · + H 2 O H H 2C 8H 4O 4+ H 2O N H 4 +H 2O C H 3N H 3 + H 2O H 2P O 4 + H 2O HPO4
2+ + +
A c +H 3O
一.缓冲溶液的缓冲作用和组成 1. 缓冲溶液(buffer solution)
• 能抵抗外来少量强酸、强碱或稍加稀释,而保持其 pH基本不变的溶液。
2.
•
缓冲作用(buffer action)
缓冲溶液对强酸、强碱或稀释的抵抗作用。
3.
• •
缓冲溶液的组成
一般由足够浓度的共轭酸碱对的两种物质组成。 组成缓冲溶液的共轭酸碱对的两种物质合称为缓冲 系(buffer system)或缓冲对(buffer pair)。
解:
H3PO4 + NaOH NaH2PO4 + H2O 2.0mmol Na2HPO4 + H2O 1.0mmol 0.10mmol 0.10mmol 30× 反应前 20× 1.0mmol 反应后 NaH2PO4 反应前 2.0mmol 反应后 1.0mmol + NaOH 1.0mmol
• 1、一定温度下,加水稀释弱酸,数值将减小 的是 ( A )
第三节 缓冲容量和缓冲范围
一、缓冲容量 缓冲溶液的缓冲能力有一定限度,当加入 强酸或强碱过量,缓冲溶液的pH将发生较 大的变化,失去缓冲能力。用缓冲容量β作 为衡量缓冲能力大小的尺度。定义为
缓冲容量(β)在数值上等于使1L缓冲溶液 值改变1个pH单位时,所需加入一元强酸或一 元强碱的物质的量
影响缓冲容量的因素 总浓度 当缓冲比一定,总浓度越大,缓冲容量越大。 缓冲比 a.最大缓冲容量 当总浓度一定时,缓冲比等于1时,缓冲容 量最大,此时溶液:
A.[H+]
B. α
C.pH
D. Ka
2、在氨水中加入氯化铵后,则氨水的解离度 ( C )
A.增大
C.减小
B.不变
D.先增大后减小
第三节 缓冲容量和缓冲范围
四、缓冲范围
• 把缓冲溶液pH=pKa±1变化范围称为缓冲 范围。
第四节 缓冲溶液的配制
一、配制方法 1.选择合适的缓冲系:
(1)pH在pKa±1缓冲范围内并尽量接近弱酸pKa。 (2)缓冲系的物质必须对主反应无干扰。
2.配制的缓冲溶液的总浓度要适当:
• 一般总浓度0.05mol· -1~0.2mol· -1。 L L
2.多元弱酸的酸式盐及其对应的次级盐。 例如:NaHCO3-Na2CO3 3.弱碱及其对应的盐 例如:NH3-NH4Cl
第一节 缓冲溶液及缓冲机制
一.缓冲溶液的缓冲作用和组成
在实际应用中,还采用酸碱反应的生成物与剩余的反应 物组成缓冲系。 • 弱酸(过量)+ 强碱 • 强酸 + 弱碱(过量)
•
优点:
-
-
+ + +
H C O 3 +H 3O H 2P O 4 + H 3O T r is + H 3 O
+
H C 8H 4O 4 + H 3O N H 3+ H 3O
2+ +
+
C H 3N H 2+ H 3O HPO4 PO4 +H 3O
+ 3+
+H 2O
+ H 3O
缓冲溶液的组成 1.弱酸及其对应的盐 例如,HAc-NaAc
+ -
当加入少量强酸时消耗掉外来的H+离子,而溶液的pH 保持基本不变。 H+ + Ac- HAc
当加入少量强碱时质子转移平衡右移,补充消耗掉的 H3O+离子,而的pH值保持基本不变。 OH- + H3O+ 2H2O • 共轭碱称为抗酸成分,共轭酸称为抗碱成分。
第一节 缓冲溶液及缓冲机制
二.缓冲机制 结论 ① 由于缓冲溶液中同时含有较大量的抗碱 成分和抗酸成分,消耗外来的少量强酸、 强碱。 ② 它们通过弱酸解离平衡的移动,使溶液 H+离子或OH-离子浓度未有明显的变化, 因此具有缓冲作用。
以HAc-NaAc缓冲溶液为例(与酸作用)
平衡向左移动
少量H+
+ -
HAc + H2O
H3O + Ac
以HB代表弱酸,并与NaB组成缓冲溶液。
HB + H2O H3O + B
+ -
NaB
Na+ + B-
第二节 缓冲溶液的pH值
一.缓冲溶液pH值的计算公式 1. 如何推求Henderson—Hasselbalch方程 式
HB + H2O H3O + B
+ -
第二节 缓冲溶液的pH值
一.缓冲溶液pH值的计算公式 2. Henderson—Hasselbalch方程式的意义
NaAc
Na + Ac
+
-
共轭碱是抗酸成分
以HAc-NaAc缓冲溶液为例(与碱作用): 少量OH平衡向右移动
HAc + H2O H3O + Ac
+ -ຫໍສະໝຸດ 共轭酸是抗碱成分NaAc Na + Ac
+ -
第二节 缓冲溶液的pH值
一.缓冲溶液pH值的计算公式: Henderson—Hasselbalch方程式
能引起血液中酸度增加的因素
能引起血液中碱度增加的因素
第五节 血液中的缓冲系
• 正常情况下,[HCO3-]与[CO2]溶解的比率为 24mmol· -1比1.2mmol· -1,即20/1。 L L • pKa1 =6.10, pH=6.10 + lg
pH=7.40
思
考
混合 20 mL 0.10 mol· -1 的 H3PO4与 30 L mL 0.10 mol· -1 的 NaOH,所得缓冲溶液的 L pH=? 已知:pKa1=2.16, pKa2=7.21, pKa3=12.32。
