十类化学平衡图像题例析
常见的化学平衡图像分析

较大。
例11 (双选)气态反应A(g)+B(g) C(g)+D(g),同温同压下在催化剂条件(a)时和无催化剂条件(b)时的反应过程 中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的是( )
C%
A. 0
A%
a
b t
a
b
C.
0
t
V v正
B. 0
V v正
v逆 t
a
D. 0
v逆 t
a b
b
谢谢观赏
(3)作判断:将图象中表现的关系与所学规律对比,作出符合题目要求的判断。
分类讨论
1.v — t 图 2.n(或c)—t图 3.转化率(或百分含量等)—T(P)—t图
4. v — P(或T)图 5. 转化率(或百分含量等) —T、P图
时间曲线 条件曲线
1、V-t图像 例1 下图是可逆反应A+2B 2C+3D,随外界条件改变而变化的情况。
(1)该反应的反应物是 ___________;
A
(2)反应物的转化率是________________;
(3)该反应的化学方程式为____________________.40%
2A
B+3C
[小结:解题关键]
(1)判断反应物和生成物 (2)确定方程式中各物质前的计量数 (3)按要求作答
例3 在密闭容器中,反应X(g)+Y(g) Z(g)(正反应
m nxyRA m nxy
1×107Pa 1×106Pa
化学平衡图像题解法例析

t
T1、P2
T1、P1
T2、P2
2.在密闭容器中进行下列反应:M(g)+ N(g) R(g)+2L此反应符合右图,下列叙述正确的是( )
D
随堂测试:
1、正反应是 反应 (放热、吸热) m+n p +q (> = < )
v
0 t1 t2 t3 t4 t5 t6 t
0~t1、t2~t3、 t3~t4 、t5~t6
t1:升高温度,
A
随堂测试:
t3:使用催化剂,
t4:减小体系压强
某密闭容器中充入等物质的量的A和B,一定 温度下发生反应A(g)+xB(g) 2C(g),达到平衡后, 在不同的时间段,分别改变影响反应的一个条件, 测得容器中物质的物质的量浓度、反应速率分别随 时间的变化如下图所示:
可逆反应 mA(g) + nB(g) pC(g) +qD(g)
C%
t
T1
T2
1、T1 T2 ( > = < ) 正反应是 反应 (放热、吸热)
B%
t
T1
T2
2、T1 T2 ( > = < ) 正反应是 反应 (放热、吸热)
6
④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
C
(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是______。 (2)此可逆反应的正反应是______反应(填“放热”或“吸热”)。
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应,并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)看起点和终点
分清反应物和生成物,浓度(或物质的量)减小的是反应物,增大的是生成物,生成物多数是以原点为起点。
化学平衡图像题解析(ppt 19页)实用资料

5、只有学习潇洒才可能一切潇洒。但是只是可能,因为处世能力过分出众而成功得人是有,但是你必须牢记实力得价值。 6、有时,放弃是另一种坚持,你错失了夏花绚烂,必将会走进秋叶静羌,任何事,任何人,都会成为过去,不要跟它过不去,无论多难,我们都要学会抽身而 退。
A(g)+2B(g)
nC(g)
在相同温度,不同压强时,A的转化率跟
反应时间(t)的关系如图3所示,其中结论
正确的是
A、p1>p2, n>3 C、p1<p2, n<3
A
的
转 化 率
B B、p1<p2, n>3
D、p1>p2, n=3
p1
p2
时间
【课堂练习】如图曲线是在其他条件一定时,
反应: 2NO2
V
V
V逆
V正
0
A
T0
V
V
V逆
V正
0
C
T0
V逆
左图表示温度对某
一反应的正、逆反
V正
应的速率的影响,
T
B
已知该反应的正向
V正
是放热反应,则左
V 逆 侧图像中正确的是:
T
D
C
V
V 平衡点
逆
V正
0
P
t
平衡点之后增大压强 V逆、V正均增大 V逆>V正平衡逆向移动
化学平衡常见图像分析完整版

化学平衡常见图像分析集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]化学平衡常见图像分析化学平衡图像问题的综合性强,思维难度大,是许多学生感到困难的题型之一。
化学平衡图像题的特征是以图像的形式将一些相关量之间的关系通过形象直观的曲线表示出来,把习题中的化学原理抽象为数学问题,旨在考查学生对曲线的数学意义和化学意义之间对应关系的分析、理解和运用能力。
一、化学平衡常见图像及其分析图像I:图像分析:(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓度导致。
(2)若a、b有断点,则平衡移动可能是由于以下原因所导致:①同时不同程度地改变反应物(或生成物)的浓度;②改变反应体系的压强;③改变反应体系的温度。
(3)若平衡无移动,则可能是由于以下原因所导致:①反应前后气体分子个数不变;②使用了催化剂。
(4)若在的上方,即平衡向正反应方向移动;若在的上方,即平衡向逆反应方向移动。
图像II:图像分析:(1)由曲线的拐点作垂直于时间轴(t线)的垂线,其交点即为该条件下达到平衡的时间。
(2)由达到平衡的时间长短,推断与、与的相对大小(对于此图像:、)。
(3)由两平衡时,不同p、T下的量的变化可判断纵坐标y代表的物理量。
图像III:图像分析:(1)固定温度T(或压强p),即作横坐标轴的垂线,观察分析图中所示各物理量随压强p(或温度T)的变化结果。
(2)关键是准确判断所作垂线与原温度(或压强)曲线的交点的纵坐标。
(3)y可以是某物质的质量分数、转化率、浓度、浓度比值、体积分数、物质的量分数等。
图像IV:图像分析:(1)温度为点为化学平衡点。
(2)温度段是随温度(T)升高,反应速率加快,产物的浓度增大或反应物的转化率增大。
(3)温度段是随温度升高平衡向吸热反应方向移动的结果。
二、解答化学平衡图像问题的技巧在解答化学平衡图像问题时,要注意技巧性方法的应用。
1、“先拐先平,数值大”:在含量—时间曲线中,先出现拐点的,则先达到化学平衡状态,说明该曲线的温度较高或压强较大;2、“定一议二”:在含量—温度(或压强)曲线中,图像中有三个变量,先确定一个量不变,再讨论另外两个量的关系(因为化学平衡移动原理只适用于外界“单因素”的改变,导致的平衡移动的分析),即确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后(通常作一条横坐标的垂线),讨论横坐标与曲线的关系。
常见化学平衡图像及分析

问题二:在t2时刻,其他条件不变,只增大压强,若m+n>p+q,:
1、条件改变的瞬时,正、逆反应速率如何变化?随后正、逆反应 速率如何变化? 2、画出改变条件后的v-t图像,并分析平衡如何移动?
问题三:在t3时刻,其他条件不变,
①只升高温度,若该反应△H>0,画出改变条件后的v-t图像。
0
时间
实用文档
练习2
2A(g) + B(g)
2C(g)
【看图技巧2】
C “定一议二”,
的 百
P1 < P2
T2 > T1
正反应是_吸_热反应.
分 含 量
T2 P1 T1 P2
T1 P1
0
t
实用文档
四、转化率—压强(或温度)图像分析
mA(g) + nB(g) pC(g) + qD(g)
等压线
A 的
常见化学平衡图像及分析
实用文档
历年高考查情况
实用文档
2017考试大纲
• 通过对自然界、生产和生活中的化学现象 的观察,以及实验现象、实物、模型的观 察,对图形、图表的阅读,获取有关的感 性知识和印象,并进行初步加工、吸收、 有序存储。
• 将分析和解决问题的过程及成果,能正确 地运用化学术语及文字、图表、模型、图 形等进行表达,并做出合理解释。
温度
p+q,
△H<
0
练习2: •对于反应mA(g)+nB(g)
等压线
A%
200℃
300℃
P
pC(g)+qD(g)
请根据图像求:m+n = p+q, △H >0
常见化学平衡图像及分析(课堂PPT)

转
化
率
10 oC
0
t
(A)
0
P
(B)
0
P
(C)
18
图面
像线
点
分 变化量
②只加入催化剂,画出改变条件后的v-t图像。
V正
V正
V逆
V正
V逆
0
V逆
0
0 t0
t1
t2 t
0 t0
t1
t
7
V-t图解题思路: 1.分析反应特点:
物质状态、反应前后气体计量数变化、△H 2.根据勒夏特列原理判断平衡移动方向,推知:
改变条件后 V正、V逆的相对大小 3.根据反应速率的影响因素,推知:
解题思路:从反应特点入手,观察物质状态、 反应前后体积变化以及反应热
理论依据:以勒夏特列原理为核心,化学反应 速率和化学平衡理论综合运用
2
一、v-t图模型建立 问mA题规(g1):律+n当:B(向gv)密-⇌t闭图pC容中(g器)V+中q正D充、(g入),V一逆从定的反量应相的开A始和到B,若达发到生化反学应平: 衡时对,大如小何用决v定-t图平定衡性的建表立示的此方过程向?
随后正、逆反应速率如何变化? 2.画出改变条件后v-t图像,并分析平衡移动情况。
V
V正
V正
V逆
V逆
0
0 t0
t1
t2 t
练习1:在t1时刻,其他条件不变,只减小反应物的浓
度,画出改变条件后的v-t图像。
4
二、 v-t图像常见形式及分析
增大c(反) V正增大V逆瞬间不变平应方衡向向移正动反V正V逆大于原平衡
常见化学平衡图像及分析
1
一定条件下,可逆反应:N2(g)+3H2(g)⇌2NH3(g) △H <0,
常见化学平衡图像及分析共21页

16、业余生活要有意义,不要越轨。——华盛顿 17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、自己活着,就是为了使别人过得更美好。——雷锋 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃
END
常见化学平衡图像及分析
•
6、黄金时代是在我们的前面,而不在 我们的 后面。
•
7、心急吃不了热汤圆。
•
8、你可以很有个性,但某些时候请收 敛。
•
9、只为成功找方法,不为失败找借口 (蹩脚 的工人 总是说 工具不 好)。
•
10、只要下定决心克服恐惧,便几乎 能克服 任何恐 惧。因 为,请 记住, 除了在 脑海中 ,恐惧 无处藏 身。-- 戴尔. 卡耐基 。
化学平衡图像分析经典例题与习题附答案
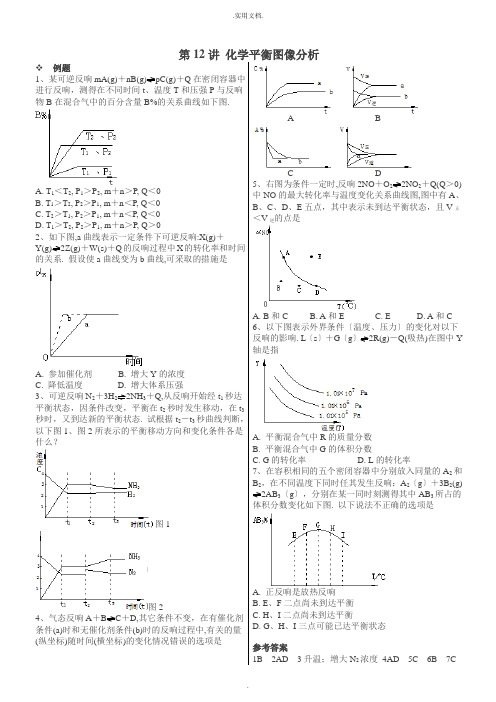
第12讲化学平衡图像分析❖例题1、某可逆反响mA(g)+nB(g)pC(g)+Q在密闭容器中进行反响,测得在不同时间t、温度T和压强P与反响物B在混合气中的百分含量B%的关系曲线如下图.A. T1<T2, P1>P2, m+n>P, Q<0B. T1>T2, P2>P1, m+n<P, Q<0C. T2>T1, P2>P1, m+n<P, Q<0D. T1>T2, P2>P1, m+n>P, Q>02、如下图,a曲线表示一定条件下可逆反响:X(g)+Y(g)2Z(g)+W(s)+Q的反响过程中X的转化率和时间的关系. 假设使a曲线变为b曲线,可采取的措施是A. 参加催化剂B. 增大Y的浓度C. 降低温度D. 增大体系压强3、可逆反响N2+3H22NH3+Q,从反响开始经t1秒达平衡状态,因条件改变,平衡在t2秒时发生移动,在t3秒时,又到达新的平衡状态. 试根据t2-t3秒曲线判断,以下图1、图2所表示的平衡移动方向和变化条件各是什么?图1图24、气态反响A+B C+D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反响过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的选项是A BC D5、右图为条件一定时,反响2NO+O22NO2+Q(Q>0)中NO的最大转化率与温度变化关系曲线图,图中有A、B、C、D、E五点,其中表示未到达平衡状态,且V正<V逆的点是A. B和CB. A和EC. ED. A和C6、以下图表示外界条件〔温度、压力〕的变化对以下反响的影响. L〔s〕+G〔g〕2R(g)-Q(吸热)在图中Y 轴是指A. 平衡混合气中R的质量分数B. 平衡混合气中G的体积分数C. G的转化率D. L的转化率7、在容积相同的五个密闭容器中分别放入同量的A2和B2,在不同温度下同时任其发生反响:A2〔g〕+3B2(g) 2AB3〔g〕,分别在某一同时刻测得其中AB3所占的体积分数变化如下图. 以下说法不正确的选项是A. 正反响是放热反响B. E、F二点尚未到达平衡C. H、I二点尚未到达平衡D. G、H、I三点可能已达平衡状态参考答案1B 2AD 3升温;增大N2浓度4AD 5C 6B 7C.❖习题1、如右图所示表示平衡混合物中x的百分含量在不同的压强下,随温度变化的情况,在以下平衡体系中,x 可以代表用下横线标明的物质〔反响中各物质为气态〕的是A.N2+2H22NH3 △H<0B.H2+I22HI △H<0C.2SO32SO2+O2 △H>0D.4NH3+5O24NO+6H2O △H<02、在溶积固定的4L密闭容顺中,进行可逆反响:X〔气〕+2Y〔气〕2Z〔气〕并到达平衡,在此过程中,以Y 的浓度改变表示的反响速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影局部面积表示A.X的浓度的减少B.Y的物质的量的减少C.Z的浓度的增加D.X的物质的量的减少3、今有反响X(g)+Y(g)2Z(g)+ △H<0假设反响开始经t1秒后到达平衡,又经t2秒后,由于反响条件的改变使平衡破坏,那么t3时又到达平衡,如图表示,试分析,以t2到t3秒曲线变化的原因是A.增大了X和Y的浓度B.使用了催化剂C.增加了反就体系的压强D.升高了反响的温度4、对到达平衡状态的可逆反响X+Y Z+W,在其他条件不变的情况下,增大压强,反响速率变化图象如右图所示,那么图象中关于X、Y、Z、W四种物质的聚集状态为A.Z、W均为气体,X、Y中有一种是气体B.Z、W中有一种是气体,X、Y皆非气体C.X、Y、Z、W皆非气体D.X、Y均为气体,Z、W中有一种为气体5、可逆反响aA+bB cC中,物质的含量A%和C%随温度的变化曲线如下图,以下说法正确的选项是A.该反响在T1、T3温度时到达过化学平衡B.该反响在T2温度时到达过化学平衡C.该反响的逆反响是放热反响D.升高温度,平衡会向正反响方向移动6、右图表示反响N2〔g〕+3H2〔g〕2NH3〔g〕;ΔH=-92. 2kJ/mol。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
十类化学平衡图像题例析
解题关键:
一是读图,弄清图像含义,通过观察弄清横坐标、纵坐标的含义及单位;搞清特殊点的意义,如坐标轴的“0”点,曲线的起点、终点、交叉点、极值点、转折点等;分析曲线的变化趋势如斜率大小、升降。
二是识图,进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算。
三是用图,联想化学原理解答问题。
1. 以速度—时间(v-t)图像计算平衡浓度
例 1 在容积固定为2L 的密闭容器中,充入X 、Y 气体各2mol ,发生可逆反应:
X(g)+2Y(g)
2Z(g),并达平衡,以Y 的浓度改变表示的反应
速度v v 正逆、与时间t 的关系如图所示,则Y 的平衡浓度表达式正确的是(式中S 是对应区域的面积)( )B A S B S C S D S aOb
aOb
abdO
bOd ....2121----
2. 以v-t 图像描述化学平衡移动的本质 例2 已知合成氨的反应为:N H 223+ 29243NH kJ +.在一定条件下达到化
学平衡,现升高温度使平衡发生移动,下列图像中能正确描述正、逆反应速率(v)变化的是
(C )
3. 以物质的量(浓度)—时间(n(c)-t )图像描述可逆反应达平衡的过程
例3 在一定温度下,容器内某一反应中M 、N 的物质的量n 随反应时间t 变化的曲线
如图所示,下列表述中正确的是( D )
A. 反应的化学方程式为2M
N B.t v v 2时,达到平衡正逆= C. t v v 3时,正逆>
D. t c c N M 12时浓度=
4 、含量—时间—温度(压强)图
这类图象反映了反应物或生成物的量在不同温度(压强)下对时间的关系,解题时要注
意一定条件下物质含量不再改变时,应是化学反应达到平衡的特征.
例4.同压、不同温度下的反应:A (g )+B (g )C (g );△H A 的含量和温度的关系如图3所示,下列结论正确的是 ( A ) A .T 1>T 2,△H>0 B .T 1<T 2,△H>0 C .T 1>T 2,△H<0 D .T 1<T 2,△H<0
例4-1.现有可逆反应A (g )+2B (g )nC (g );△H<0,在相
同温度、不同压强时,A 的转化率跟反应时间(t )的关系如图4,其中结论正确的是(B )
A .p 1>p 2,n >3
B .p 1<p 2,n >3
C .p 1<p 2,n <3
D .p 1>p 2,n=3 5. 以物质的量(转化率)—时间(n(R)-t )图像描述温度或压强对平衡移动的影响
例5 反应2X(g)+Y(g)
2Z(g)+Q ,在不同温度(T T 12和)及压强(p p 12和)
下,产物Z 的物质的量n Z 与反应时间t 的关系如图所示,下述判断正确的是( C )
A T T p p B T T p p C T T p p D T T p p (121212121212)
1212
<<<>>>><,,,,
6. 以转化率(体积分数)—压强、温度(R ()ϕ—p 、T )图像判断平衡状态 例6 如图,条件一定时,反应22NO g O g ()()+
2NO g Q 2()+(正反应为
放热)中NO 的R m ax 与T 变化关系曲线图,图中有a 、b 、c 、d4个点,其中表示未达到平衡状态,且v v 正逆<的点是( D ) A. a B. b C. c D. d 7. 根据R (质量分数w 、体积分数ϕ)—p 、T 图像判断反应特征 例7 已知反应mA g nB g ()()+
xC g yD g ()()+,A 的转化率R A 与p 、T 的
关系如图,根据图示可以得出的正确结论是( A )
A. 正反应吸热,m n x y +>+
B. 正反应吸热,m n x y +<+
C. 正反应放热,m n x y +>+
D. 正反应放热,m n x y +<+ 8. 由v-p (T )图像描述平衡移动时正逆v 的变化 例8 下列反应符合下图p-v 变化曲线的是( B ) A. H g I g 22()()+ 2HI(g)
B. 322NO g H O l ()()+ 23HNO l NO g ()()+
C. 4532NH g O g ()()+ 4NO(g)+62H O g ()
D. CO(g)+C(s)
2CO(g)
9. 混合气体平均相对分子质量—温度(压强)(M T (p r -))图像
例9 可逆反应2A+B 2C (g )+Q (Q>0)随T (℃)变化气体平均相对分子质量
M r 的变化如图所示,则下列叙述中正确的是( CD )
A. A 和B 可能都是固体
B. A 和B 一定都是气体
C. A 和B 可能都是气体
D. 若B 为固体,则A 一定为气体
解析 正反应放热则逆反应吸热,观察曲线可知,T 升高化学平衡向逆向移动,气体的M r 减小。
由平均摩尔质量定义M m n =
总总
可判断:T 升高,A 和B 都是固体时,只有1种气体C ,
M r 不变;A 和B 是气体时,气体m 总不变,n 总变大,M r 减小,符合题意,但不是绝对
惟一的;当B 为固体A 为气体时,气体的n 总不变,但m 总变小,同样导致M r 减小,故正确答案为C 、D 。
10. 由体积分数—温度(ϕ-T )图像判断平衡进程
例10 在容积相同的不同密闭容器内,分别充入同量的N H 22和,在不同温度,任其发生反应N H 223+ 23NH ,
在第7秒时分别测定其中N H 3的体积分数ϕ()NH 3,
并绘成下图曲线。
(1)A 、B 、C 、D 、E 中,尚未达到化学平衡状态的点是________。
(2)此反应的正反应是______热反应。
(3)AC 段曲线是增函数曲线,CE 段曲线是减函数曲线,试从化学反应速率和化学平衡角度说明理由为
____________________________________________________。
(4)T T v v T v v T T 12334到变化时,;时,;到变化时,正
逆正逆v 正
_____v 逆。
解析 该曲线表明在相同时刻不同温度时ϕ()NH 3的情况,C 点是最大点也是转折点,说明C 点达到了化学平衡状态,C 点之前的A 、B 点尚未达到平衡;C 点之后,T 升高,ϕ()NH 3下降,说明正反应为放热反应;AC 段化学反应尚未平衡,受速率控制,T 升高,反应速率加快,ϕ()NH 3增大为增函数;CE 段达到平衡后受平衡因素控制,T 升高,平衡向吸热的逆向移动,故ϕ()NH 3下降为减函数。
T T v v T 123→>,;时,正逆
v v T T v v 正逆正逆;时,=→<34。
练习:
1. 对于可逆反应:A 2(g )+3B 2(g )
2AB 3(g ) △H<0,下列图象中正确的是( AB )
2、化学反应N 2(g)+3H 2(g)
2NH 3(g) △H<0 在某一时间段中反
应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的
时间段是( D ) ,氨的百分含量最高的时间段是( A ) A.t 0-t 1 B.t 2-t 3
C.t 3-t 4
D. t 5-t 6
3如图所示,可逆反应:2A(g)+B(g)
2C(g) △H<0的图像正确
的是( A )
4.取5等份NO 2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO 2(g)N 2O 4(g),△H <0。
反应相同时间后,分别测定体系中NO 2的百分量(NO 2%),并作出其随反应温度(T )变化的关系图。
下列示意图中,可能与实验结果相符的是BD
4.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
2C(g);△H<0。
某研
究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列
关系图:
下列判断一定错误的是( AB )
A .图I 研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B .图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C .图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D .图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
5.m A(s) + n B(g)
p C(g) △H <0 ;的可逆反应,在室温条件下B %与压强(p )的关系如下图所示,则下列有关叙述正确的是( CD ) A .m +n <p B .n >p
C .X 点时混合物的正反应速率大于逆反应速率
D .X 点比Y 点混合物的反应速率慢
6.已知2NO 2(g)N 2O 4(g) ΔH <0。
将NO 2充入容易导热的材料制成的容器a 和b 中
进行反应。
a 的容积保持不变,b 的上盖可随容器内气体压强的改变而上下移动,以保
持容器内外压强相等。
当同温同压时,将等量的NO 2充入“起始态”体积相同的容器a 、b 中,反应同时开始。
(填“>”、“=”或“<”)
(1)反应开始时,a 与b 中生成N 2O 4的速率v a ___=___v b 。
(2)反应过程中两容器里生成N 2O 4的速率是v a ___<___v b 。
(3)达到平衡时,a 与b 中N 2O 4的百分数(A)相比较,则是A a __<____A b 。
