QP-09-R02-A.0设计和开发确认报告
全套医疗器械设计和开发资料(模板可修改)

全套医疗器械设计和开发资料(模板可修改)产品设计和开发文档(含风险管理文档)产品名称:一次性使用XXXXX XXXX文档编号:XM2019-01(模板可直接修改填写)编制:审核:批准:X X X X X医疗器械有限公司XXXXX医疗器械有限公司产品设计和开发文档清单产品名称:一次性使用******* *** 项目组组长:***XXXXX医疗器械有限公司NO:02日期:上海qs医疗器械有限公司项目负责人任命书NO:3上海qs医疗器械有限公司设计和开发的流程图NO.4XXXXX医疗器械有限公司设计和开发计划编制(技术科):xxx 审核(管代):批准(总经理):编制日期:2015.11.26 审核日期:批准日期:XXXXX医疗器械有限公司项目任务及职能分配表日期:XXXXX医疗器械有限公司风险管理计划NO.81 简述此计划对一次性使用xxx 水封式系列的全部风险管理活动策划,用实现该产品全程风险管理工作的安排。
本风险管理计划主要是对产品在其整个生命周期内(包括设计开发、产品实现、最终停用和处置阶段)进行风险管理活动的策划。
1.1产品的预期用途及组成该系列引流装置能使胸腔残气、胸腔积液“只出不进”,可通过引流液的量,色态变化和水柱波动值的变化,方便临床对患者进行病情趋势分析。
主要材料为PVC/PE/PVE/ABS,由瓶体、瓶盖、挂钩、防溢盖、阻流阀、水柱波动管、引流管、悬挂装置等组成。
1.2产品覆盖范围八种规格型号的引流装置具体结构见下图;图1:Y0xxx单腔-xx00结构图图2:YYxxx二腔-1xx00结构图图3:YYxxx三腔-xx00结构图图4:YTx-单腔-1x00结构图图5:YTx-x腔-1x0结构图图6:YTx-二腔-xx0结构图图7:YTx-二腔-2x00结构图图8:YTx-三x腔-x00结构图1.4适用环境适用于负压吸引或患者重力引流作用引流;2 产品描述产品分类目录:II类6854 手术室、急救室、诊疗室设备及器具主要性能:符合YY/T qs.1-2015《一次性使用xxx 水封式》标准中的性能指标要求。
QP-001文件控制程序
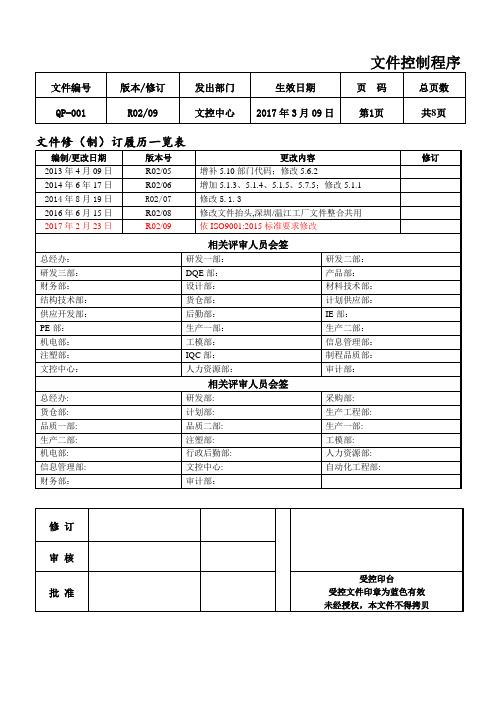
编制/更改日期
版本号
更改内容
修订
2013年4月09日
R02/05
增补5.10部门代码;修改5.6.2
2014年6年17日
R02/06
增加5.1.3、5.1.4、5.1.5、5.7.5;修改5.1.1
2014年8月19日
R02/07
修改5.1.3
2016年6月15日
R02/08
物料清单(外单)
部门相关人员
部门主管
中心副总或总监
部门主管
物料清单(内单)
部门相关人员
部门主管
原理图
部门相关人员
部门主管
变压器规格书
部门相关人员
部门主管
(工程)图纸
部门相关人员
部门主管
包材(外单)
部门相关人员
部门主管
中心副总或总监
部门主管
包材(内单)
部门相关人员
部门主管
中心副总或总监
部门主管
三阶文件
5.1.5为了保证前期文件的有效性,不需变更的文件暂不增加会签栏;从本程序生效日期起,所有新编的文件及变更的文件,都需增加会签栏。
5.2文件的编写和发放
5.2.1受控文件应在审批前由文控文员统一进行编号,按5.10执行。
注:技术类文件编号见《技术文件编码规则》
5.2.2文控文员在彩蝶系统内,收到待发布文档时,必须先查看该受控文档是否符合要求(上传彩蝶系统文件包括原始编写档和会签扫描档),然后再发布,如需发放纸档的文件,必须在1个工作日内完成文件受控及通知相关部门领取,分发时要做签收并在《文件发放/回收记录》上记录。
四阶文件(表单/表格) 例:EN-QR-001
外来文件 例:W-001
TOC验证报告

TOC验证报告总有机碳分析仪确认方案QC- GTP7126 (00)-2012执行标准:国家GMP规范设备名称:总有机碳分析仪设备型号:Toc-Vwp型设备编号:H52304800049NK出厂日期:2010 年9 月设备制造商:日本岛津公司确认方式:前确认确认方案制订人: 日期:确认方案审核人: 日期:确认方案批准人: 日期:江西博雅生物制药股份有限公司总有机碳分析仪确认方案第 1 页共22页江西博雅生物制药股份有限公司总有机碳分析仪确认小组及人员职责一、确认小组:1、组长:李育琼2、成员:邱卫璠、彭萍莲、黄新红、吴水龙二、人员职责:1、确认方案制订人:李育琼职责:负责确认方案起草、修订工作,组织确认方案实施。
2、确认方案审核人:邱芳职责:负责确认方案审核。
3、确认实施人员:李育琼、邱卫璠、彭萍莲、黄新红职责:负责确认实施及相关原始记录填写。
4、确认过程监督人:吴水龙职责:参与确认工作并对实施过程进行监督。
5、确认报告人:李育琼职责:负责确认过程及记录审核,并报告确认结果。
6、确认报告审核人:邱芳职责:负责确认报告审核。
7、确认报告批准人:何淑琴职责:负责确认报告批准。
江西博雅生物制药股份有限公司年月日总有机碳分析仪确认方案第 2 页共22页目录1. 确认目的2. 仪器介绍3. 仪器选型确认和接受标准 3.1 用户需求标准3.2仪器主要构件和设计参数确认4. 安装确认和接受标准 4.1 安装确认概要4.2 安装确认报告4.2.1 IQ1.1资料文件4.2.2 IQ2.1 TOC-Vwp仪5. 运行确认和接受标准 5.1 运行确认概要5.2 运行确认报告5.2.1 OQ1.1压力表校准 5.2.2 OQ1.2 检测前准备 5.2.3 OQ2.1 TOC检测确认6. 性能确认和接受标准 6.1 性能确认概要6.2 性能确认报告7. 偏离清单8. 培训要求9(再确认和风险评估10. 签署确认报告总有机碳分析仪确认方案第 3 页共22页1. 确认目的本确认是仪器购置后的前确认,确认仪器的选型确认、安装确认(IQ)、运行确认(OQ)、性能确认(PQ)等是否符合要求和满足使用。
预研管理流程

深圳市知行智驱技术有限公司流程文件文件名称:预研管理流程文件编号:ZXID-QPYF-01版本:A0文件所属部门:研发编制/日期:审核/日期:批准/日期:修订记录1 目的:指导技术预研/产品预研项目的实施,加强技术预研/产品预研项目的规范化管理,保证技术预研/产品预研项目的顺利进行。
2 范围:适用于公司技术预研/产品预研项目。
3 定义或术语:无4 角色、职责:4.1 项目经理:负责接收新产品开发任务书,组建项目团队,制定项目计划,组织关键评审;项目费用控制。
4.2 系统工程师:负责智力资产及同类技术分析,技术方案、标准计划和验证方案的制定,对外合作计划的制定并组织执行,技术成果的总结。
4.3 硬件工程师:负责硬件原理图设计、硬件物料验证、实物验证,以及项目过程中其它相关技术活动。
4.4 Layout工程师:负责PCB设计、与结构件的装配对接。
4.5 软件工程师:负责软件设计及系统调试。
4.6 结构工程师:负责结构模型、结构零部件图的设计。
4.7 测试工程师:负责测试环境的开发,协助实物验证。
4.8 项目秘书:负责项目环境的建立和关闭、文档移交计划的制定和文档接收,组织召开项目例会、编写会议纪要。
5 流程图:6 流程活动说明:活动名称:接受任务书,组建项目团队活动名称:建立项目环境活动名称:制定项目计划活动名称:智力资产分析,同类技术分析活动名称:制定技术方案活动名称:组织技术方案评审活动名称:组织专利申请活动名称:制定验证方案活动名称:实施对外合作活动名称:原理图设计, PCB设计,软件设计,结构件设计活动名称:测试环境开发活动名称:物料采购申请活动名称:实物验证活动名称:起草相关标准活动名称:组织验证评审活动名称:技术成果总结活动名称:关闭项目环境7 相关文件:《集成成品开发流程》 ZXID-QPYF-02 《需求管理流程》ZXID-QPY1-01《零星物料采购流程》ZXID-QWG2-01《设备管理流程》ZXID-QPG4-01 《样品确认流程》 ZXID-QWG2-028 使用表单:《文献检索报告》 ZXID-QPYF-02-R01 《技术策略报告》 ZXID-QPYF-02-R02 《总体技术方案》 ZXID-QPYF-02-R03 《产品特性清单》 ZXID-QPYF-02-R04 《产品集成测试方案》 ZXID-QPYF-02-R06 《测试与验证主计划》 ZXID-QPYF-02-R07 《专利交底文件》 ZXID-QPYF-02-R08 《零部件图纸》 ZXID-QPYF-02-R09 《工艺开发方案》 ZXID-QPYF-02-R10。
KSZ62075B隧道式灭菌干燥机2确认方案

KSZ620/75B隧道式灭菌干燥机2确认方案目录1. 目的 (2)2. 范围 (2)3. 职责 (2)4. 法规和指南 (2)5. 缩略语 (2)6. 系统介绍 (3)7. 验证历史 (3)8. 人员确认 (3)9. 验证培训 (3)10. 安装确认IQ (4)11. 运行确认OQ (8)12. 性能确认PQ (13)13. 验证结论与建议 (17)14. 偏差处理 (17)15. 变更控制 (17)16. 相关记录 (17)1. 目的通过对KSZ620/75B隧道式灭菌干燥机2的IQ、OQ和PQ确认,确认本灭菌隧道式灭菌干燥机的安装符合设计和生产工艺要求,设备满足GMP要求,运行稳定可靠,性能符合URS要求。
2. 范围2.1. 从《小容量注射剂三车间系统影响性评估报告》(编号SIA-L-00)可知,KSZ620/75B隧道式灭菌干燥机2为直接影响系统,需进行设备确认,其IQ、OQ和PQ是基于《KSZ620/75B隧道式4.4. GAMP 5良好自动化制造规范54.5.《中国药典》2015年版6.1.楚天科技股份有限公司生产的型号为KSZ620/75B隧道式灭菌干燥机2(设备编号:L-PE004)安装在我公司小容量注射剂三车间生产线的洗瓶间(L-1018),安装环境为C级,主要用于安瓿的干6.2.6.3.7.的第8. 人员确认在方案培训前,本方案涉及的所有人员须在《人员确认表》(3QP-L-PE004-R01-00)中签字。
9. 验证培训9.1. 在方案执行前,对所有参与人员进行本方案的培训,做好《验证培训记录》(3QP-L-PE004-R02- 00)。
9.2. 培训要确保测试人员熟悉本方案,能够准确地执行本方案而不会产生错误。
10. 安装确认IQIQ的目的是检查本隧道式灭菌干燥机是按照相应设计要求和供应商的建议进行安装的,设备能够满足GMP要求;将确定直接影响系统的关键部件被正确地安装,并符合设计文件需求;确定支持文件、质量文件在现场。
洁净压缩空气系统确认方案

洁净压缩空气系统确认方案Document serial number【UU89WT-UU98YT-UU8CB-UUUT-UUT108】洁净压缩空气系统DQ/IQ/OQ/PQ(4Q)验证报告文件编号:版本设施名称:洁净压缩空气系统设备编号:存放位置:药业有限公司目录1.概述1.1.验证对象本次验证对象为药业有限公司新药生产基地室的洁净压缩空气系统。
该系统服务对象为本公司在中国医药城新药生产基地一期工程(A号楼)一层制剂研发室、二层分析实验室、一层固体制剂车间和医疗器械车间。
洁净压缩空气主要用作:直接接触药品的设备用气、设备动力用气、设备控制用气、实验室检测用气等,要求洁净压缩空气质量稳定并且符合美国药典USP(38)、欧盟药典EP第8版、中国国家标准及国际ISO标准。
该系统主要由阿特拉斯科普特ZT55-10风冷式无油螺杆空压机(设备编号:EQ-05001)、塞弗尔SFA-086M-S316微热再生吸附式干燥塔(设备编号:)、申牌5m3缓冲罐(设备编号:)、过滤器及316L不锈钢管路组成,产气量3/min,产气压力。
流程图如下:1.2.验证目的验证洁净压缩空气系统的设计、安装、运行及最终的性能是否符合现行美国FDA标准、欧洲现行GMP标准、中国新版GMP标准及其他相关标准;1.3.验证依据ISO8573-2010压缩空气第一部分污染物和净化等级GB/压缩空气第一部分污染物净化等级GMP 药品生产质量管理规范(2010年修订)第五章2010版GMP指南-厂房设施与设备-厂房-设备2010版GMP附录-确认与验证欧洲药典EP第8版-Air, Medical美国药典USP38-Medical Air欧盟现行GMP-第二部分-第三章美国FDA现行药品生产质量管理规范(cGMP)-D设备GB150 2011 压力容器-第四部分制造、检验和验收1.4.质量要求系统要符合相应规范、法规及法律的要求。
报告中用“是”或“否”判定结果是否符合要求,部分需进行文字性补充描述。
APQP产品设计开发程序文件

报价回复确认记录/开发试制协议 由项目负责人负责组建小组,交总经 理审批;若审批不通过,则由项目负 责人进行
确定可靠性和质量目标
《新产品开发计划》 QM/FLT09-09
初始过程流程图
若审批不通过,则需重新进行分析研 《设计任务书》QM/FLT09-10(含初始 究后再设定。 产品材料、初始过程流程) 审批签字 OK
4.19
提交设计文件和首批产品
项目组识别培
客户未出书面生产件批准文件,以订单/ 口头形式进行批准时,由项目负责人组织 各部门进行评审,并交总经理批准。
4.20
审批 OK
4.21
转2 2
项目负责人汇总整理产品档案,发放最终版相关文件至供应商和相关部门,并
5.1
下批量订单
5.2
接受并排计划
。
阶段 序号
特殊包装、专 用器具由技术 部设计制造
内外部物流
由于不合格或客户不同用途等原因会造 成此过程重复多次。
《小组可行性承诺》 策划外部发货方式和公司内部流转、 工位器具。一方面策划发运包装,另 一方面审核或策划外协件的包装方式 。
编制各类工序指导书
制作检验指导书
产品包装方案
《检测试验设备一览表》 设备/模具工装一览表》
2.7
1 2.12 产品设计信息评价
检测试验设备一
转1 要尽可能做到第一次 就开发量产模具,从而避 免重复工作和浪费,所以 后面量产模具开发可能不
质保部负责将识别出的试验设备和夹具汇总, 统一编制《检测试验设备一览表》。
《设计评审报告-产品设计输出》 QM/FLT09-12
OK
。
阶段 序号
##########################有限公司 ##########################有限公司
预研管理流程

深圳市知行智驱技术有限公司流程文件文件名称:预研管理流程文件编号:ZXID-QPYF-01版本:A0文件所属部门:研发编制/日期:审核/日期:批准/日期:修订记录日期修订版本修订内容的描述修订人1 目的:指导技术预研/产品预研项目的实施,加强技术预研/产品预研项目的规范化管理,保证技术预研/产品预研项目的顺利进行。
2 范围:适用于公司技术预研/产品预研项目。
3 定义或术语:无4 角色、职责:4.1 项目经理:负责接收新产品开发任务书,组建项目团队,制定项目计划,组织关键评审;项目费用控制。
4.2 系统工程师:负责智力资产及同类技术分析,技术方案、标准计划和验证方案的制定,对外合作计划的制定并组织执行,技术成果的总结。
4.3 硬件工程师:负责硬件原理图设计、硬件物料验证、实物验证,以及项目过程中其它相关技术活动。
4.4 Layout工程师:负责PCB设计、与结构件的装配对接。
4.5 软件工程师:负责软件设计及系统调试。
4.6 结构工程师:负责结构模型、结构零部件图的设计。
4.7 测试工程师:负责测试环境的开发,协助实物验证。
4.8 项目秘书:负责项目环境的建立和关闭、文档移交计划的制定和文档接收,组织召开项目例会、编写会议纪要。
5 流程图:项目秘书测试工程师结构工程师软件工程师L a y o u t 工程师硬件工程师系统工程师项目经理其他代表开发验证及验收计划及方案组建 项目团队接受任务书制定项目计划组织技术方案评审组织验证评审关闭项目环境同类技术分析组织专利申请制定技术方案智力资产分析制定验证方案起草相关标准技术成果总结原理图设计PCB 设计物料采购申请测试环境开发建立项目环境实物验证注:其他领域参与的活动未作定义,如有需要请项目组自行增加实施对外合作结构件设计软件 设计010020040050060070080090100110120130140150160030010010010010010开始结束新产品开发任务书文献检索报告技术策略报告总体技术方案/技术规范产品特性清单/DFMA专利交底文件图纸预研成果总结报告6 流程活动说明:活动名称:接受任务书,组建项目团队活动编号:010, 020活动责任人:活动参与人:项目经理活动描述:接受任务书:项目经理接受由总经理签发的技术预研/产品预研《新产品开发任务书》。
