2015年高考化学真题分类汇编8《水溶液中的离子平衡》
2015届化学《创新导学案》新课标高考总复习检测8水溶液中的离子平衡8-1 Word版含解析

8-1一、选择题1.(2014·湖南永州一模)下列有关电解质溶液的说法正确的是()A.0.1 mol/L的醋酸加水稀释后,溶液中所有离子的浓度均减小B.分别向同体积、同pH的醋酸和盐酸中加入足量的锌粉,两者产生H2的体积一样多C.向水中加入少量NaHSO4固体,c(H+)增大,K w不变D.将V1L pH=11的NaOH溶液与V2L pH=3的HA溶液混合,溶液显中性,则V1≤V2【解析】K w=c(H+)·c(OH-),K w只与温度有关,醋酸稀释后c(H+)减小,但c(OH-)增大,A项错误;pH相同,说明溶液中H+浓度相同,但醋酸溶液中有大量的醋酸分子,醋酸与足量锌反应产生的H2多,B 项错误;NaHSO4完全电离导致溶液中c(H+)增大,温度不变,K w不变,C项正确;如果HA为强酸,pH =3的HA与pH=11的NaOH等体积恰好反应,溶液呈中性,V2=V1;如果HA为弱酸,等体积pH=3的HA与pH=11的NaOH反应时,酸有剩余,要使溶液呈中性,则V2<V1,D项错误。
【答案】C2.(2014·浙江宁波二模)下列说法正确的是()A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH 3COOH CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大B.25 ℃时,向水中加入少量固体CH 3COONa,水的电离平衡:H2O H++OH-逆向移动,c(H+)降低C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO-3)【解析】A选项可利用平衡常数表达式的变形式来推断,c(H+)/c(CH3COOH)=K/c(CH3COO-),加入少量氢氧化钠溶液之后,c(CH3COO-)增大,但平衡常数K不变,故c(H+)/c(CH3COOH)值减小,A选项错误。
高考化学专题11 水溶液中的离子平衡—三年高考(2015-2017)化学真题分项版解析(解析版)
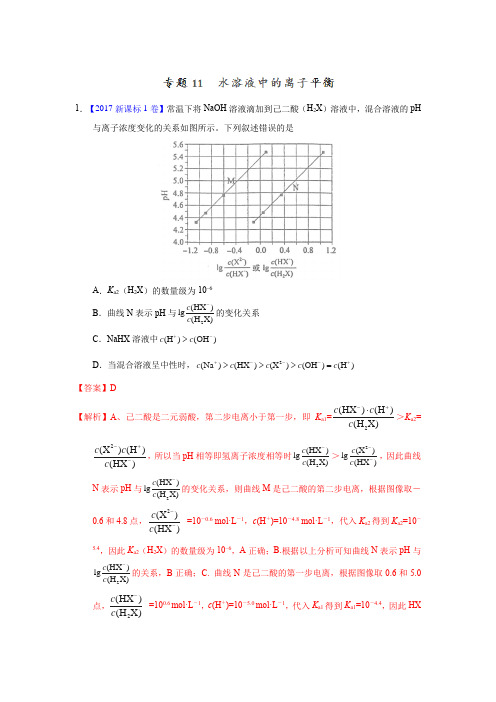
1.【2017新课标1卷】常温下将NaOH 溶液滴加到己二酸(H 2X )溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
下列叙述错误的是A .K a2(H 2X )的数量级为10–6B .曲线N 表示pH 与2(HX )lg (H X)c c -的变化关系 C .NaHX 溶液中(H )(OH )c c +->D .当混合溶液呈中性时,2(Na )(HX )(X )(OH )(H )c c c c c +---+>>>=【答案】D【解析】A 、己二酸是二元弱酸,第二步电离小于第一步,即K a1=2(HX )(H )(H X)c c c -+⋅>K a2=2(X )(H )(HX )c c c -+-,所以当pH 相等即氢离子浓度相等时2(HX )lg (H X)c c ->2(X )lg (HX )c c --,因此曲线N 表示pH 与2(HX )lg (H X)c c -的变化关系,则曲线M 是己二酸的第二步电离,根据图像取-0.6和4.8点,2(X )(HX )c c -- =10-0.6 mol·L -1,c (H +)=10-4.8 mol·L -1,代入K a2得到K a2=10-5.4,因此K a2(H 2X )的数量级为10–6,A 正确;B.根据以上分析可知曲线N 表示pH 与2(HX )lg (H X)c c -的关系,B 正确;C. 曲线N 是己二酸的第一步电离,根据图像取0.6和5.0点,2(HX )(H X)c c - =100.6 mol·L -1,c (H +)=10-5.0 mol·L -1,代入K a1得到K a1=10-4.4,因此HX-的水解常数是w 1a K K =10-14/10-4.4<K a2,所以NaHX 溶液显酸性,即c (H +)>c (OH -),C 正确;D.根据图像可知当2(X )lg (HX )c c --=0时溶液显酸性,因此当混合溶液呈中性时,2(X )lg (HX )c c -->0,即c (X 2–)>c (HX –),D 错误;答案选D 。
高考化学试题分类汇编H单元水溶液中的离子平衡(含解析)

H单元水溶液中的离子平衡目录H单元水溶液中的离子平衡.................................................................................................. - 1 -H1弱电解质的电离 (1)H2水的电离和溶液的酸碱性............................................................................................... - 11 -H3盐类的水解 (3)H4胶体的性质及其运用....................................................................................................... - 39 -H5难溶电解质的溶解平衡(课标新增内容) (3)H6水溶液中的离子平衡综合............................................................................................... - 55 -H1弱电解质的电离【题文】(理综卷·2015届河北省唐山市高三9月模拟考试(2014.09))13.已知:95℃时,K W=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A溶液PH=6,则下列说法正确的是A.H2A在水溶液中的电离方程式为:H2A H++HA-,HA-H++A2-B.(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-)C.0.0lmol·L-l的H2A溶液pH=2D.等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多【知识点】水的离子积常数、溶液pH值、盐溶液中离子浓度H1 H2 H3【答案解析】B解析:根据95℃时,K W=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A溶液PH=6,可知溶液呈中性,Na2A为强酸强碱盐。
高考化学复习专题八 水溶液中的离子平衡

高中化学学习材料金戈铁骑整理制作专题八水溶液中的离子平衡1.(2015·吉林省吉林市一中质检一)25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是()弱酸CH3COOH HCN H2CO3Ka 1.8×10-5 4.9×10-10K1=4.3×10-7 K2=5.6×10-11A.0.1 mol/L 的CH3COOH的 pH比0.1mol/L HCN的pH大B.等物质的量浓度溶液pH关系:pH(CH3COONa)<pH(NaHCO3) <pH(NaCN)C.向NaCN溶液中通入少量CO2: CO2 + H2O + 2NaCN == 2HCN + Na2CO3D.NaHCO3和Na2CO3的混合液中:c(Na+) +c(H+)=c(OH-)+ c(HCO3-)+c(CO32-)答案:B解析:根据电离平衡常数可知酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3-。
醋酸电离能力比HCN强,相同浓度下CH3COOH溶液的酸性比HCN强,A项错误;酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的pH越大,物质的量浓度的各溶液pH关系为:pH(CH3COONa)<pH(NaHCO3)<pH(NaCN),B项正确;强酸制弱酸原理可知NaCN溶液中通入少量CO2,反应方程式为: CO2+ H2O + NaCN ==HCN + NaHCO3,C项错误;Na2CO3和NaHCO3等物质的量混合溶液中,根据溶液电中性,存在C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c (CO32-),D项错误。
2、 (2015吉林省东北师大附中第三次摸底)根据下表提供的数据,判断下列离子方程式或化学方程式正确的是化学式电离常数HClO K=3×10-8H2CO3K1=4×10-7 K2=6×10-11A.向Na2CO3溶液中滴加少量氯水:CO32-+ 2Cl2 + H2O = 2Cl-+ 2HClO + CO2↑B.向NaHCO3溶液中滴加少量氯水:2HCO3-+ Cl2 = Cl-+ ClO-+ 2CO2↑ + H2OC.向NaClO溶液中通少量CO2:CO2 + NaClO + H2O = NaHCO3 + HClOD.向NaClO溶液中通过量CO2:CO2 + 2NaClO + H2O = Na2CO3 + 2HClO【答案】C 解析:HClO的电离常数小于H2CO3的第一步电离,向Na2CO3溶液中滴加少量氯水,不能生成CO2,应生成HCO3‾,故A错误;向NaHCO3溶液中滴加少量氯水,HClO的电离常数小于H2CO3的第一步电离,产物不能生成CO2,故B错误;HClO的电离常数小于H2CO3的第一步电离,向NaClO溶液中通少量CO2:CO2 + NaClO + H2O = NaHCO3 + HClO,故C正确;向NaClO溶液中通过量CO2,应生成HCO3‾,故D错误;3.(2015福建省厦门市期末)25℃时,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示。
2015年高考化学真题分类汇编:专题11反应速率、化学平衡(1)教程

专题 12 :水溶液中的离子均衡1.【 2015 新课标Ⅰ卷理综化学】浓度均为、体积均为 V0的 MOH 和 ROH 溶液,分别加水稀释至体积V, pH 随lgV的变化以下图,以下表达错误..的V0是()A. MOH 的碱性强于ROH 的碱性B. ROH 的电离程度: b 点大于 a 点-C.若两溶液无穷稀释,则它们的c(OH )相等D.当lg V=2 时,若两溶液同时高升温度,则c( M ) 增大V0 c( R )【答案】 D【考点定位】电解质强弱的判断、电离均衡挪动(稀释、升温);难度为较难等级。
【名师点晴】本题了图象方法在溶液的稀释与溶液的pH 的关系的知识。
解图像题的要领时是:先看三点,再看增减;先看单线,再做关系。
本题划分MOH 和 ROH的重点就是两线的起点 pH 。
当开始时溶液的体积同样时,稀释的倍数越大,溶液的离子浓度越小,溶液的pH 就越小。
稀释同样倍数时,强碱比弱碱的pH 变化大。
2.【 2015 浙江理综化学】40℃时,在氨-水系统中不停通入CO2,各样离子的变化趋向以下图所示。
以下说法不正确的是(...)A.在 pH= 9. 0 时, c( NH4+) > c( HCOˉ3 ) >c( NH2COOˉ ) >c( CO32- )B.不一样 pH 的溶液中存在关系:c( NH4+) + c( H+) = 2c( CO32- ) + c( HCO3-) +c( NH2COOˉ)+c( OHˉ)C.跟着 CO2的通入,c( OHˉ )不停增大c(NH3 ·H2O)D.在溶液中 pH 不停降低的过程中,有含 NH2COOˉ的中间产物生成【答案】 C【分析】 A、在 pH= 9. 0 时,作直线垂直于横坐标,从图上可直接看得出:c( NH4 +) > c( HCOˉ3 ) >c( NH2COOˉ ) >c( CO32- ) ,A 正确; B、依据电荷守恒可得:c( NH4 +) +c( H+) = 2c( CO3 2-) +c( HCO3-) + c( NH2COOˉ ) +c( OHˉ ) ,B 正确; C、c( OHˉ)3 2c(OH ) c( NH 4 ) K b+=c( NH 4 , K b不变, c( NH4 ) 不停增大,则比值不停减小,c(NH 3 H 2O) c( NH 4 ) )C 不正确; D、从图上看, pH 降低过程中,有含NH2COOˉ的中间产物生成,D 正确。
高考化学复习专题八 水溶液中的离子平衡.docx

高中化学学习材料鼎尚图文收集整理专题八水溶液中的离子平衡1.(2015·吉林省吉林市一中质检一)25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是()弱酸CH3COOH HCN H2CO3Ka 1.8×10-5 4.9×10-10K1=4.3×10-7 K2=5.6×10-11A.0.1 mol/L 的CH3COOH的 pH比0.1mol/L HCN的pH大B.等物质的量浓度溶液pH关系:pH(CH3COONa)<pH(NaHCO3) <pH(NaCN)C.向NaCN溶液中通入少量CO2: CO2 + H2O + 2NaCN == 2HCN + Na2CO3D.NaHCO3和Na2CO3的混合液中:c(Na+) +c(H+)=c(OH-)+ c(HCO3-)+c(CO32-)答案:B解析:根据电离平衡常数可知酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3-。
醋酸电离能力比HCN强,相同浓度下CH3COOH溶液的酸性比HCN强,A项错误;酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的pH越大,物质的量浓度的各溶液pH关系为:pH(CH3COONa)<pH(NaHCO3)<pH(NaCN),B项正确;强酸制弱酸原理可知NaCN溶液中通入少量CO2,反应方程式为: CO2+ H2O + NaCN ==HCN + NaHCO3,C项错误;Na2CO3和NaHCO3等物质的量混合溶液中,根据溶液电中性,存在C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c (CO32-),D项错误。
2、 (2015吉林省东北师大附中第三次摸底)根据下表提供的数据,判断下列离子方程式或化学方程式正确的是化学式电离常数HClO K=3×10-8H2CO3K1=4×10-7 K2=6×10-11A.向Na2CO3溶液中滴加少量氯水:CO32-+ 2Cl2 + H2O = 2Cl-+ 2HClO + CO2↑B.向NaHCO3溶液中滴加少量氯水:2HCO3-+ Cl2 = Cl-+ ClO-+ 2CO2↑ + H2OC.向NaClO溶液中通少量CO2:CO2 + NaClO + H2O = NaHCO3 + HClOD.向NaClO溶液中通过量CO2:CO2 + 2NaClO + H2O = Na2CO3 + 2HClO【答案】C 解析:HClO的电离常数小于H2CO3的第一步电离,向Na2CO3溶液中滴加少量氯水,不能生成CO2,应生成HCO3‾,故A错误;向NaHCO3溶液中滴加少量氯水,HClO的电离常数小于H2CO3的第一步电离,产物不能生成CO2,故B错误;HClO的电离常数小于H2CO3的第一步电离,向NaClO溶液中通少量CO2:CO2 + NaClO + H2O = NaHCO3 + HClO,故C正确;向NaClO溶液中通过量CO2,应生成HCO3‾,故D错误;3.(2015福建省厦门市期末)25℃时,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示。
2015届化学《创新导学案》新课标高考总复习检测8水溶液中的离子平衡8-2 Word版含解析

8-2一、选择题1.(2012·上海高考)水中加入下列溶液对水的电离平衡不产生影响的是()A.NaHSO4溶液B.KF溶液C.KAl(SO4)2溶液D.NaI溶液【解析】硫酸氢钠完全电离相当于一元强酸,对水的电离起到抑制作用;氟离子水解,KF溶液显碱性,铝离子水解,KAl(SO4)2溶液显酸性,对水的电离均有影响;NaI是强酸强碱盐,不发生水解,对水的电离平衡不产生影响。
【答案】D2.(2014·哈尔滨模拟)向纯水中加入少量下列物质或改变下列条件,能促进水的电离,并能使溶液中c(OH-)>c(H+)的操作是()①稀硫酸②金属钠③氨气④FeCl3固体⑤NaClO固体⑥将水加热煮沸A.②⑤B.①④C.③④⑥D.④【解析】稀硫酸、氨气抑制水的电离,金属钠、FeCl3固体、NaClO固体、将水加热煮沸促进水的电离,但FeCl3固体使溶液显酸性,将水加热煮沸,水仍呈中性。
【答案】A3.(2013·大纲全国)下图表示水中c(H+)和c(OH-)的关系,下列判断错误的是()A.两条曲线间任意点均有c(H+)×c(OH-)=K wB.M区域内任意点均有c(H+)<c(OH-)C.图中T1<T2D.XZ线上任意点均有pH=7【解析】水的离子积常数表达式为:K w=c(H+)·c(OH-),适用于水及稀的水溶液,A项正确;观察题中图示,XZ线表示溶液呈中性,c(H+)=c(OH-),M区域溶液呈碱性,c(OH-)>c(H+),B项正确;H2O(l) H+(aq)+OH-(aq)ΔH>0,升高温度平衡正向移动,图中Z点K=10-6.5×10-6.5=10-13大于X点的K w=10-7×10-7=10-14,所以T2>T1,C项正确;XZ线上任意点表示溶液呈中性,由于各点温度不同,故pH不同,D项错误。
【答案】D4.某溶液在25 ℃时由水电离出的氢离子的浓度为1×10-12 mol·L-1,下列说法正确的是() A.HCO-3、HS-等离子在该溶液中不能大量存在B.该溶液的pH不可能为2C.向该溶液中加入铝片后,一定能生成氢气D.若该溶液中的溶质只有一种,它一定是酸或者是碱【解析】25 ℃,纯水中c(H+)=c(OH-)=1×10-7 mol·L-1,而这里“由水电离出的氢离子的浓度为1×10-12mol·L-1”,这是水的电离被抑制的结果。
高考化学一轮总复习第八章水溶液中的离子平衡全国高考题型突破电离平衡图象问题分析课件

(2)对于 pH=x 的强碱溶液稀释时,体积每增大 10n 倍,pH 就减小 n 个单位,即 pH=x-n;对于 pH=x 的 弱碱溶液来说,体积每增大 10n 倍,pH 减小不足 n 个单 位,即 pH>x-n;无论怎样稀释,碱溶液的 pH 不能等于 或小于 7,只能趋近于 7。
(3)加水稀释相同倍数后的 pH 大小:氨水>NaOH 溶 液,盐酸>醋酸。
④ 紧跟老师的推导过程抓住老师的思路。老师在课堂上讲解某一结论时,一般有一个推导过程,如数学问题的来龙去脉、物理概念的抽象归纳、语 文课的分析等。感悟和理解推导过程是一个投入思维、感悟方法的过程,这有助于理解记忆结论,也有助于提高分析问题和运用知识的能力。
⑤ 搁置问题抓住老师的思路。碰到自己还没有完全理解老师所讲内容的时候,最好是做个记号,姑且先把这个问题放在一边,继续听老师讲后面的 内容,以免顾此失彼。来自:学习方法网
答案:B
编后语
老师上课都有一定的思路,抓住老师的思路就能取得良好的学习效果。在上一小节中已经提及听课中要跟随老师的思路,这里再进一步论述听课时如何 抓住老师的思路。
① 根据课堂提问抓住老师的思路。老师在讲课过程中往往会提出一些问题,有的要求回答,有的则是自问自答。一般来说,老师在课堂上提出的问 题都是学习中的关键,若能抓住老师提出的问题深入思考,就可以抓住老师的思路。
第八章 水溶液中的离子 平衡
全国高考题型突破 电离平衡图象问题分析
(2015·全国Ⅰ卷)浓度均为 0.10 mol·L-1、体积均为
V0 的 MOH 和 ROH 溶液,分别加水稀释 至体积 V,pH 随 lgVV0的变化如图所示。 下列叙述错误的是( )
A.MOH 的碱性强于 ROH 的碱性 B.ROH 的电离程度:b 点大于 a 点
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
八、水溶液中的离子平衡
(2015安徽13)25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加
0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是:
A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B.加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D.加入20mL盐酸时: c(Cl-) =c(NH4+) +c(Na+)
(2015海南3)0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液
pH最小的是
A. NO2 B.SO2 C.SO3 D.CO2
(2015广东11)一定温度下,水溶液中H+和OH-的浓度变化曲线如图2,下列说法正确的
是
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
(205山东 13)室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶
液pH的变化曲线如图所示。下列说法正确的是
A、a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B、a、b两点所示溶液中水的电离程度相同
C、pH=7时,c(Na+)= c(A—)+ c(HA)
D、b点所示溶液中c(A—)> c(HA)
(2015四川6)常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部
分NaHCO3晶体,过滤,所得滤液pH<7,下列关于滤液中的离子浓度关系不正确的是
A. B.c(Na+)= c(HCO3-)+ c(CO32-)+
c(H2CO3)
C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-) D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
(2015新课标Ⅰ13)浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释
至体积V,pH随的变化如图所示,下列叙述错误的是( )
(2015重庆3)下列叙述正确的是
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1mol AgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)
(2015江苏14)室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液
体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
(2015浙江12)40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所
示。下列说法不正确的是
A.在pH=9.0时,c(NH4+)>c(HCO)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+
c(OHˉ)
C.随着CO2的通入,不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
(2015天津5)室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入
下列物质。有关结论正确的是
加入的物质 结论
A 50mL 1 mol·L-1H2SO4 反应结束后,c(Na+)=c(SO42-)
B 0.05molCaO 溶液中 增大
C 50mL H2O 由水电离出的c(H+)·c(OH—)不变
D 0.1molNaHSO4固体 反应完全后,溶液pH减小,c(Na+)不变
(2015天津3)下列说法不正确的是
Na与H2O的反应是熵增的放热反应,该反应能自发进行
饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)Mg2+(aq)+2OH—(aq),该固体可溶于
NH4Cl溶液
