碳氮比的测定实验方案
实验方案
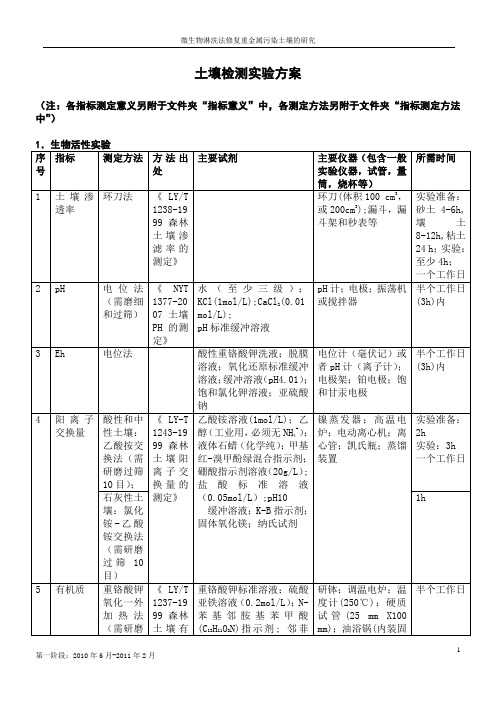
土壤检测实验方案
(注:各指标测定意义另附于文件夹“指标意义”中,各测定方法另附于文件夹“指标测定方法中”)
注:10 目(筛孔直径2.00mm),100 目(筛孔直径0.149mm)
附录
1.称量(皿重、湿重)
2.烘干(105°C,24h)
3.称量(干重):计算含水率
4.研磨
5.过筛(120目)
6.四酸消解
(1)主要试剂:
浓盐酸(HCl),密度1.19g/mL,优级纯
浓硝酸(HNO3)密度1.42g/mL优级纯
硝酸溶液,1硝酸+5超纯水(体积),用1.2配制
氢氟酸(HF),密度1.49g/mL
高氯酸(HClO4),密度1.68g/mL优级纯
主要仪器:
一般实验仪器(试管、烧杯、容量瓶等)
塑料小瓶;聚四氟乙烯坩埚
电热板(可温控)
实验用水(电导率不低于18.3)
7.测定指标
(1)总铜(《GBT 17138-1997 土壤质量铜、锌的测定火焰原子吸收分光光度法》)
(2)总铅、隔(《GB_T_17141-1997_土壤质量_铅、镉的测定_石墨炉原子吸收分光光度法》)(3)总汞(《GBT 22105.1-2008 土壤质量总汞、总砷、总铅的测定原子荧光法(第1部分):土壤中总汞的测定》)
(4)总砷(《GBT 22105.1-2008 土壤质量_总汞、总砷、总铅的测定_原子荧光法(第2部分):土壤中总砷的测定》)
(5)总铬(HJ491-2009《土壤_总铬的测定_火焰原子吸收分光光度》)。
(完整word版)碳氮比的测定实验方案

碳氮比的测定1.实验目的:测定过滤槽中碳氮比2.实验原理和步骤2.1测定总氮2.1.1原理在60℃以上水溶液中,过硫酸钾可分解产生硫酸氢鉀和原子态氧,氮污染人为来源,硫酸氢鉀在溶液中离解而产生氢离子,故在氢氧化钠的碱性介质中可促使分解过程趋于完全。
氮的最低检出浓度为0.050mg/L,测定上限为4mg/L。
本方法的摩尔吸光系数为 1.47×103L·mo1-1·cm-1。
测定中干扰物主要是碘离子与溴离子,碘离子相对于总氮含量的2.2倍以上,溴离子相对于总氮含量的3.4倍以上有干扰。
分解出的原子态氧在120~124℃条件下,可使水样中含氮化合物的氮元素转化为硝酸盐,并且在此过程中有机物同时被氧化分解,可用紫外分光光度法于波长220和275nm处,分别测出吸光度A220及A275按下式求出校正吸光度A:A = A220 - A275按A的值查校准曲线并计算总氮的含量。
2.1.2 试剂(1)碱性过硫酸钾溶液:称取40g过硫酸钾,另称取15g氢氧化钠,溶于水中,稀释至1000mL,因为过硫酸钾固体较难溶解,可在电热加热器中加热,并不断搅拌以加速其快速溶解。
待全部溶解后将其冷却至室温,再碱性过硫酸钾溶液存放在聚乙烯瓶内。
(2)硝酸钾标准储备液,CN=100mg/L:硝酸钾在105~110℃烘箱中干燥3小时,在干燥器中冷却后,称取0.7218g,溶于蒸馏水中,移至1000mL容量瓶中,用水稀释至标线在1~10℃暗处保存,(硝酸钾溶液见光易分解)或加入1~2mL三氯甲烷保存,可稳定6个月。
2.1.3 实验仪器(1)T6紫外分光光度计及10mm石英比色皿(2)具玻璃磨口塞比色管,25ml(3)立式高压灭菌器2.1.4 实验过程2.1.4.1水样预处理采样:在金湖各个不同地点才金湖水样,在水样采集后立即放于低于4℃的条件下保存,保存时间不得超过24小时。
当水样放置时间较长时,可在1000mL水样中加入约0.5mL硫酸密度为1.84g/mL),酸化到pH小于2,并尽快测定。
C、N、P检测方法

1. 有机质测定-重铬酸钾容量法—稀释热法简版(唐艳萍论文):准确称取0.5000g土壤样品,置于500ml的锥形瓶中,准确加入1mol/L重铬酸钾10ml混匀。
接着加浓硫酸20ml,转动锥形瓶使其与土壤充分发生作用。
静置30min后,加水至刻度250ml,然后加入3-4滴邻啡啰啉指示剂。
用0.5mol/LFeSO4标准溶液滴定至砖红色为止,设三个平行样。
用相同的方法测空白(不含土样),根据滴定用量计算有机物的含量。
2. 总磷测定-NaOH熔融—钼锑抗比色法简版(唐艳萍论文):准确称取0.2500g风干土壤,小心置于坩埚底部。
加入无水乙醇3-4滴湿润土壤,接着平铺2gNaOH于土壤表面。
把坩埚放入马弗炉,升至400度左右时,关掉电源。
15min后再打开电源加热至720度,15min后取出冷却。
最后加入10ml的水(80度)并且用水多次洗涤坩埚,将提取液与洗涤液一同并入100ml容量瓶中,冷却,定容至刻度,过滤。
取上述溶液7ml于50ml 容量瓶中,用水稀释到30ml,调节PH至微黄色。
加入5ml钼锑抗显色剂,缓缓转动容量瓶使之摇匀,加水定容至刻度线。
放置30min后,在700nm处进行比色测定。
读取吸光度,从校准曲线上查得相应的含磷量。
校准曲线:分别准确吸取5mg/L磷标准液0、1、3、7、10ml于容量瓶中,同时加入2-3滴二硝基酚指示剂,并调节溶液pH至微黄色,准确加入5ml钼锑抗显色剂,缓缓转动容量瓶使之摇匀,加水定容至刻度线。
即得含磷量分别为0.0、0.1、0.3、0.5、0.7、1.0mg/L的标准溶液系列。
放置30min后,在波长700nm 处进行比色测定,读取吸光度,以磷浓度(mg/L)为横坐标,吸光度(Abs)为纵坐标,绘制校准曲线。
3.速效磷测定-0.05mol/LNaHCO3法简版任溶溶:参照NaHCO3法称取过20目筛的风干土样2.5g(精确到0.001g)于150mL锥形瓶中,加入0.05mol/L NaHCO3溶液50Ml,再加一勺无磷活性炭,塞紧后在震荡机上震荡30min,立即用无磷滤纸过滤,吸取10mL滤液于150mL 锥形瓶中,再加入蒸馏水35mL,然后加入钼锑抗试剂5mL,摇匀,放置30min 后,在700nm波长处测定吸光度。
碳氮比的测定实验方案

碳氮比的测定1.实验目的:测定过滤槽中碳氮比2.实验原理和步骤2.1测定总氮2.1.1原理在60℃以上水溶液中,过硫酸钾可分解产生硫酸氢鉀和原子态氧,氮污染人为来源,硫酸氢鉀在溶液中离解而产生氢离子,故在氢氧化钠的碱性介质中可促使分解过程趋于完全。
氮的最低检出浓度为0.050mg/L,测定上限为4mg/L。
本方法的摩尔吸光系数为1.47×103L·mo1-1·cm-1。
测定中干扰物主要是碘离子与溴离子,碘离子相对于总氮含量的2.2倍以上,溴离子相对于总氮含量的3.4倍以上有干扰。
分解出的原子态氧在120~124℃条件下,可使水样中含氮化合物的氮元素转化为硝酸盐,并且在此过程中有机物同时被氧化分解,可用紫外分光光度法于波长220和275nm处,分别测出吸光度A220及A275按下式求出校正吸光度A:A = A220 - A275按A的值查校准曲线并计算总氮的含量。
2.1.2 试剂(1)碱性过硫酸钾溶液:称取40g过硫酸钾,另称取15g氢氧化钠,溶于水中,稀释至1000mL,因为过硫酸钾固体较难溶解,可在电热加热器中加热,并不断搅拌以加速其快速溶解。
待全部溶解后将其冷却至室温,再碱性过硫酸钾溶液存放在聚乙烯瓶内。
(2)硝酸钾标准储备液,C N=100mg/L:硝酸钾在105~110℃烘箱中干燥3小时,在干燥器中冷却后,称取0.7218g,溶于蒸馏水中,移至1000mL容量瓶中,用水稀释至标线在1~10℃暗处保存,(硝酸钾溶液见光易分解)或加入1~2mL三氯甲烷保存,可稳定6个月。
2.1.3 实验仪器(1)T6紫外分光光度计及10mm石英比色皿(2)具玻璃磨口塞比色管,25ml(3)立式高压灭菌器2.1.4 实验过程2.1.4.1水样预处理采样:在金湖各个不同地点才金湖水样,在水样采集后立即放于低于4℃的条件下保存,保存时间不得超过24小时。
当水样放置时间较长时,可在1000mL 水样中加入约0.5mL硫酸密度为1.84g/mL),酸化到pH小于2,并尽快测定。
实验方案方法有关氮

实验方案和方法一、校准线绘制求解各处理吸光度的校准值,以校准值为横坐标,对应各处理的氮素含量为纵坐标(ug ),绘制校准线,校准线模拟是相似系数.01~*99.902=R 说明校准线模拟较为准确。
校准线模拟成功后,吸光度和氮素含量的函数即为氮素测定求解的模型。
1、硝态氮N NO --3校准线绘制(标准3KNO 贮备液mL ug /100)实验步骤:①将标准贮备液稀释10倍,即得mL ug /10标准使用液;②选取25L m 比色管进行实验测定;③向比色管中加入0.1、0.3、0.5、0.7、1.0、3.0、5.0、7.0、10.0mL 标准使用液,每个处理设置3个平行实验,增加一组实验空白;④将各比色管定容到25mL ;⑤向每只比色管滴加0.05mL 氨基磺酸,摇匀;⑥再向各比色管滴加0.5mL HCl ,盖紧比色管塞子摇匀;⑦在双波长nm .0220、nm .0275下进行比色;⑧实验结果:.0275.02202A A A -=校2、总氮TN 校准线绘制(标准3KNO 贮备液mL ug /100)实验步骤:①将标准贮备液稀释10倍,即得mL ug /10标准使用液;②选取25L m 比色管进行实验测定;③向比色管中加入0.1、0.3、0.5、0.7、1.0、3.0、5.0、7.0、10.0mL 标准使用液,每个处理设置3个平行实验,增加一组实验空白;④将各比色管定容到10mL ;⑤向每只比色管滴加5mL 碱性过硫酸钾溶液,摇匀,绑紧,在121.2℃下消煮半小时,拿出自然冷却;⑥再向各比色管滴加1mL 1+9盐酸溶液,摇匀,定容至25mL ,盖紧比色管塞子摇匀;⑦在双波长nm .0220、nm .0275下进行比色;⑧实验结果:.0275.02202A A A -=校3、铵态氮N NH -+4校准线绘制(标准Cl NH 4贮备液mL ug /1000) 实验步骤:①将标准贮备液稀释100倍,即得mL ug /10标准使用液;②选取50L m 比色管进行实验测定;③向比色管中加入0.00、0.5、0.7、1.0、3.0、5.0、7.0、10.0mL 标准使用液,每个处理设置3个平行实验,增加一组实验空白;④将各比色管定容到50mL ;⑤向每只比色管滴加3mL 酒石酸钾钠溶液,摇匀;⑥再向各比色管滴加2mL NaOH 溶液,盖紧比色管塞子摇匀;⑦再向各比色管滴加1.5mL 钠氏试剂,盖紧比色管塞子摇匀10分钟显色后在单波长nm .0420下进行比色;⑧实验结果:实验空白校A A A r -=.0420二、实验测定(一)排水水样氮素测定总氮测定时,直接加未预处理的水样,若有沉淀,实验时,取上清液进行比色;硝态氮和铵态氮需对水样先进行絮凝、过滤预处理,提取上清液作为实验水样。
森林土壤有机质的测定及碳氮比的计算

森林土壤有机质的测定及碳氮比的计算森林土壤有机质是森林生态系统中的重要组成部分,对维持森林生态系统的功能具有重要作用。
本文介绍了森林土壤有机质的测定方法,包括湿法氧化法、热酸氧化法和干燥熔融法等。
同时,本文还介绍了碳氮比的计算方法,以及碳氮比对森林土壤有机质质量和质量变化的影响。
本文的研究结果对于森林生态系统的管理和保护具有重要意义。
关键词:森林土壤有机质;测定方法;碳氮比;影响一、引言森林生态系统是地球上最为广泛和复杂的生态系统之一,其中土壤有机质是森林生态系统中的重要组成部分。
森林土壤有机质不仅对于森林生态系统的生产力、物质循环和能量流动具有重要作用,而且对于森林生态系统的生物多样性保护、土壤保持和水源涵养等方面也具有重要作用。
因此,研究森林土壤有机质的质量和质量变化对于森林生态系统的管理和保护具有重要意义。
本文主要介绍森林土壤有机质的测定方法和碳氮比的计算方法,以及碳氮比对森林土壤有机质质量和质量变化的影响。
本文的研究结果可为森林生态系统的管理和保护提供参考。
二、森林土壤有机质的测定方法森林土壤有机质的测定方法包括湿法氧化法、热酸氧化法、干燥熔融法等。
下面分别介绍这几种方法。
1. 湿法氧化法湿法氧化法是一种常用的森林土壤有机质测定方法,其基本原理是将土壤样品与强氧化剂(如K2Cr2O7、KMnO4等)反应,使有机质氧化为CO2和H2O。
在反应过程中,氧化剂的消耗量与土壤样品中有机质的含量成正比,因此可以根据氧化剂的消耗量来计算土壤样品中有机质的含量。
湿法氧化法的操作步骤如下:(1)取约10g土壤样品,加入200mL盛有强氧化剂的瓶中,摇匀。
(2)将瓶放入水浴中,在100℃下加热1小时,使反应达到平衡。
(3)取出瓶,冷却至室温,在瓶口处加入5mL浓硫酸,加盖,摇匀。
(4)再次加热1小时,使反应彻底完成。
(5)取出瓶,冷却至室温,加入蒸馏水至刻度线,摇匀。
(6)过滤,将滤液取10mL,加入250mL锥形瓶中,加入几滴酚酞指示剂,用0.1mol/L NaOH标准溶液滴定至粉红色消失。
果实的碳氮比-概述说明以及解释
果实的碳氮比-概述说明以及解释1.引言1.1 概述概述:碳氮比是指果实中碳元素与氮元素的比值,它在果实的生长发育过程中起着重要作用。
碳氮比是影响果实品质、口感、营养价值等方面的重要指标,也是衡量果实健康状况和生长环境的重要参考。
本文将深入探讨果实的碳氮比在果园生产中的重要性,分析影响果实碳氮比的因素,并对未来的研究方向进行展望。
愿我们的研究能为果农生产和果实品质提供有益的参考和指导。
1.2 文章结构文章结构部分的内容应该包括对整篇文章的框架和逻辑进行简要介绍,使读者能够更好地理解整篇文章的内容安排和脉络。
在这一部分,我们可以描述本文分为引言、正文和结论三个主要部分,每个部分的内容和目的。
具体地说,引言部分主要介绍了文章的背景和动机,概述了文章要探讨的主题和问题,引导读者进入文章的主题范围。
正文部分将深入讨论什么是碳氮比、碳氮比的重要性以及影响果实碳氮比的因素,从不同角度对这一概念进行解读和阐述。
结论部分则对整篇文章的内容进行总结和归纳,强调文章的核心观点和结论,并展望未来可能的研究方向和应用前景。
通过这样的文章结构,读者可以清楚地了解本文的主题内容和逻辑脉络,帮助他们更好地理解文章的主要观点和论证过程。
1.3 目的本文旨在探讨果实的碳氮比这一重要概念,揭示其在农业生产和食品营养方面的意义。
通过研究果实碳氮比的变化规律及其影响因素,我们可以更好地了解果实的营养价值和品质特征,为果树种植、果实储藏和加工提供科学依据。
同时,深入探讨碳氮比对土壤肥力和生态环境的影响,有助于优化农业生产系统、实现可持续发展目标。
因此,本文旨在为读者提供关于果实碳氮比的全面了解,促进相关领域的研究与应用,推动果树产业的健康发展。
2.正文2.1 什么是碳氮比碳氮比是指作物或果实中碳元素与氮元素的比值。
通常以重量比或摩尔比来表示。
在自然界中,碳氮比对于植物的生长发育和产量品质具有重要影响。
碳氮比值的大小会直接影响到植物的营养吸收、生理代谢、抗性能力等方面。
土壤中碳氮磷实验报告单
一、实验目的1. 了解土壤中碳、氮、磷的组成及含量。
2. 掌握土壤中碳、氮、磷的测定方法。
3. 分析土壤中碳、氮、磷的相互作用及影响因素。
二、实验原理土壤中碳、氮、磷是土壤肥力的重要组成部分,对植物生长具有重要意义。
本实验采用重铬酸钾氧化法测定土壤有机碳,采用凯氏定氮法测定土壤全氮,采用钼锑抗比色法测定土壤有效磷。
三、实验材料与仪器1. 实验材料:土壤样品(采集自某地区),重铬酸钾、硫酸、硫酸银、钼酸铵、抗坏血酸、盐酸、氢氧化钠等试剂。
2. 实验仪器:电子天平、高温炉、电热板、酸度计、分光光度计、凯氏瓶、消化器、蒸馏器、移液管、容量瓶等。
四、实验方法1. 土壤有机碳测定(1)称取土壤样品1.0g,置于消化器中。
(2)加入10mL浓硫酸,混匀后置于高温炉中消化,待消化液呈无色透明时取出。
(3)将消化液转移至100mL容量瓶中,用去离子水定容至刻度。
(4)取1mL消化液,加入10mL重铬酸钾溶液,混匀后置于电热板上煮沸5min。
(5)取出冷却后,用去离子水定容至50mL,用分光光度计在570nm波长下测定吸光度。
2. 土壤全氮测定(1)称取土壤样品1.0g,置于凯氏瓶中。
(2)加入10mL浓硫酸,混匀后置于电热板上消化,待消化液呈无色透明时取出。
(3)将消化液转移至100mL容量瓶中,用去离子水定容至刻度。
(4)取2mL消化液,加入1mL硫酸银溶液,混匀后置于电热板上煮沸,直至溶液呈红色。
(5)取出冷却后,用去离子水定容至50mL,用分光光度计在620nm波长下测定吸光度。
3. 土壤有效磷测定(1)称取土壤样品1.0g,置于100mL容量瓶中。
(2)加入10mL钼酸铵溶液,混匀后置于电热板上煮沸5min。
(3)取出冷却后,加入1mL抗坏血酸溶液,混匀后置于电热板上煮沸,直至溶液呈无色。
(4)取出冷却后,用去离子水定容至50mL,用分光光度计在690nm波长下测定吸光度。
五、实验结果与分析1. 土壤有机碳含量实验结果显示,土壤有机碳含量为12.34g/kg。
碳氮比的测定实验方案
碳氮比的测定实验方案碳氮比是指有机物中碳元素和氮元素的相对含量比值。
测定碳氮比的实验方案可以分为两大类:测定有机物总碳和总氮的方法和测定有机物中各个功能团中碳氮比的方法。
以下是两种常用的测定碳氮比的实验方案。
实验一:测定有机物总碳和总氮的方法材料和器材:1.实验溶液:待测有机物溶液。
2.硫酸钾(或硫酸钠)和硫酸铜。
3.盐酸和银硝酸。
4.高温燃烧炉。
5.硝化炉。
6.电子天平。
7.燃烧船和干燥瓶。
步骤:1.将待测有机物溶液加入燃烧船中。
2.将燃烧船放入高温燃烧炉中燃烧,使有机物燃烧完全。
3.将燃烧后的残渣转移到硫酸钾(或硫酸钠)和硫酸铜的混合物中,加热反应,使残渣中的氮转化为氨。
4.向反应混合物中加入过量的盐酸和银硝酸,沉淀掉生成的氯化银。
5.过滤掉沉淀,用水洗涤,收集过滤纸。
6.对过滤纸和残渣进行称重。
计算:1.计算过滤纸重量:过滤纸重量=过滤纸和残渣总重量-燃烧船重量。
2.计算残渣重量:残渣重量=过滤纸和残渣总重量-过滤纸重量。
3.计算总氮量:总氮量=残渣重量×14/1084.计算总碳量:总碳量=燃烧船重量×3.67+过滤纸重量×3.67-残渣重量×3.67实验二:测定有机物中各个功能团中碳氮比的方法材料和器材:1.有机物样品。
2.氧气气体。
3.苛性钠。
4.硫酸钾。
5.高压反应釜。
6.气相色谱仪。
步骤:1.将有机物样品和一定量的氧气气体一起加入高压反应釜中。
2.加入适量的苛性钠和硫酸钾催化剂。
3.在高压和高温下进行催化反应。
4.反应结束后,将产物转移到装有吸附剂的气相色谱仪中进行分析。
计算:通过气相色谱仪的检测结果,可以得到各个功能团的相对含量。
根据链长的不同,不同功能团的碳氮比也不同。
通过比较各个功能团的碳氮比,可以推测有机物中各个功能团的相对含量。
以上是两种常用的测定碳氮比的实验方案,可以通过测定有机物总碳和总氮的方法或测定有机物中各个功能团中碳氮比的方法来获得碳氮比的信息。
完整版碳氮比的测定试验方案
碳氮比的测定1. 实验目的:测定过滤槽中碳氮比2. 实验原理和步骤2.1 测定总氮2.1.1 原理在60°C以上水溶液中,过硫酸钾可分解产生硫酸氢鉀和原子态氧,氮污染人为来源,硫酸氢鉀在溶液中离解而产生氢离子,故在氢氧化钠的碱性介质中可促使分解过程趋于完全。
氮的最低检出浓度为0.050mg/L,测定上限为4mg/L。
本方法的摩尔吸光系数为1.47 x 103L • mo「1• cmf1。
测定中干扰物主要是碘离子与溴离子,碘离子相对于总氮含量的 2.2 倍以上,溴离子相对于总氮含量的 3.4 倍以上有干扰。
分解出的原子态氧在120~124C条件下,可使水样中含氮化合物的氮元素转化为硝酸盐,并且在此过程中有机物同时被氧化分解,可用紫外分光光度法于波长220和275nm处,分别测出吸光度仏及Z按下式求出校正吸光度A:A = A 220 - A 275 按A 的值查校准曲线并计算总氮的含量。
2.1.2 试剂(1)碱性过硫酸钾溶液:称取40g过硫酸钾,另称取15g氢氧化钠,溶于水中,稀释至1000mL因为过硫酸钾固体较难溶解,可在电热加热器中加热,并不断搅拌以加速其快速溶解。
待全部溶解后将其冷却至室温,再碱性过硫酸钾溶液存放在聚乙烯瓶内。
(2)硝酸钾标准储备液,C=100mg/L:硝酸钾在105~110C烘箱中干燥3小时, 在干燥器中冷却后,称取0.7218g,溶于蒸馏水中,移至1000mL容量瓶中,用水稀释至标线在1~10C暗处保存,(硝酸钾溶液见光易分解)或加入1~2mL三氯甲烷保存,可稳定 6 个月。
2.1.3 实验仪器(1) T6紫外分光光度计及10mm石英比色皿( 2)具玻璃磨口塞比色管,25ml( 3)立式高压灭菌器2.1.4 实验过程2.1.4.1 水样预处理采样:在金湖各个不同地点才金湖水样,在水样采集后立即放于低于4C的条件下保存,保存时间不得超过24小时。
当水样放置时间较长时,可在1000mL水样中加入约0.5mL硫酸密度为1.84g/mL),酸化到pH小于2,并尽快测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳氮比的测定
1.实验目的:测定过滤槽中碳氮比
2.实验原理和步骤
2.1测定总氮
2.1.1原理
在60℃以上水溶液中,过硫酸钾可分解产生硫酸氢鉀和原子态氧,氮污染人为来源,硫酸氢鉀在溶液中离解而产生氢离子,故在氢氧化钠的碱性介质中可促使分解过程趋于完全。
氮的最低检出浓度为0.050mg/L,测定上限为4mg/L。
本方法的摩尔吸光系数为 1.47×103L·mo1-1·cm-1。
测定中干扰物主要是碘离子与溴离子,碘离子相对于总氮含量的2.2倍以上,溴离子相对于总氮含量的3.4倍以上有干扰。
分解出的原子态氧在120~124℃条件下,可使水样中含氮化合物的氮元素转化为硝酸盐,并且在此过程中有机物同时被氧化分解,可用紫外分光
光度法于波长220和275nm处,分别测出吸光度A
220及A
275
按下式求出校正吸光
度A:A = A
220 - A
275
按A的值查校准曲线并计算总氮的含量。
2.1.2 试剂
(1)碱性过硫酸钾溶液:称取40g过硫酸钾,另称取15g氢氧化钠,溶于水中,稀释至1000mL,因为过硫酸钾固体较难溶解,可在电热加热器中加热,并不断搅拌以加速其快速溶解。
待全部溶解后将其冷却至室温,再碱性过硫酸钾溶液存放在聚乙烯瓶内。
(2)硝酸钾标准储备液,C
N
=100mg/L:硝酸钾在105~110℃烘箱中干燥3小时,在干燥器中冷却后,称取0.7218g,溶于蒸馏水中,移至1000mL容量瓶中,用水稀释至标线在1~10℃暗处保存,(硝酸钾溶液见光易分解)或加入1~2mL三氯甲烷保存,可稳定6个月。
2.1.3 实验仪器
(1)T6紫外分光光度计及10mm石英比色皿
(2)具玻璃磨口塞比色管,25ml
(3)立式高压灭菌器
2.1.4 实验过程
2.1.4.1水样预处理
采样:在金湖各个不同地点才金湖水样,在水样采集后立即放于低于4℃的条件下保存,保存时间不得超过24小时。
当水样放置时间较长时,可在1000mL水样中加入约0.5mL硫酸
密度为1.84g/mL),酸化到pH小于2,并尽快测定。
样品可储存在玻璃瓶中。
2.1.4.2水样的测定
(1)测定:用吸量管吸取10.00mL水样,(共6个水样)置于比色管中。
加入5mL碱性过硫酸钾溶液,塞紧磨口塞,编号水样1、水样2、水样3、水样4、水样5、水样6.
(2)校准系列的制备:
a.移取硝酸钾式样10mL定容到100mL。
用吸量管向7个比色管中,分别加入硝酸钾标使用液0.0、0.30、0.50、1.00、3.00、5.00、7.00。
加水稀释至10.00mL。
b.将6个水样和7个标准系列包好报纸,用棉线将这13支比色管捆紧,以防弹出。
c.将比色管置于医用手提蒸汽灭菌器中,加热,使压力表指针到1.1~1.4kg/cm2,此时温度达120~124℃后开始计时。
加热半小时待其压力降至0时停止加热。
c.将捆好的比色管从医用手提式蒸汽灭菌器中取出,冷却,取出13支比色管冷却至室温。
d.加盐酸(1+9)1mL,用无氨水稀释至25mL标线,混匀。
e.移取部分溶液至10mm石英比色皿中,在紫外分光光度计上,分别在波长为220nm与275nm处测定吸光度,并计算出校正吸光度A。
2.2水质总碳的测定(燃烧氧化-非分散红外吸收法)
2.2.1实验原理
将试样连同净化气体分别导入高温燃烧管和低温反应管中,经高温燃烧管的试样被高温催化氧化,其中的有机碳和无机碳均转化为二氧化碳,经低温反应管的试样被酸化后,其中的无机碳分解成二氧化碳,两种反应管中生成的二氧化碳分别被导入非分散红外检测器。
在特定波长下,一定质量浓度范围内二氧化碳的红外线吸收强度与其质量浓度成正比,由此可对试样总碳(TC)和无机碳(IC)进行定量测定。
总碳与无机碳的差值,即为总有机碳。
2.2.2 干扰及消除
水中常见共存离子超过下列质量浓度时:SO
42−400 mg/L、Cl−400mg/L、NO
3−
100 mg/L、
PO
4
3−100 mg/L、S2−100 mg/L,可用无二氧化碳水(2.2.3.1)稀释水样,至上述共存离子质量浓度低于其干扰允许质量浓度后,再进行分析。
2.2.3 试剂和材料
本标准所用试剂除另有说明外,均应为符合国家标准的分析纯试剂。
所用水均为无二氧化碳水(2.2.3.1)。
2.2.
3.1 无二氧化碳水:将重蒸馏水在烧杯中煮沸蒸发(蒸发量10%),冷却后备用。
也可使用纯水机制备的纯水或超纯水。
无二氧化碳水应临用现制,并经检验TOC质量浓度不超过0.5 mg/L。
2.2.
3.2 硫酸(H2SO4):ρ(H2SO4)=1.84 g/ml。
2.2.
3.3 邻苯二甲酸氢钾(KHC8H4O4):优级纯。
2.2.
3.4无水碳酸钠(Na2CO3):优级纯。
2.2.
3.5 碳酸氢钠(NaHCO3):优级纯。
2.2.
3.6 氢氧化钠溶液:ρ(NaOH)=10 g/L。
2.2.
3.6 有机碳标准贮备液:ρ(有机碳,C)= 400 mg/L。
准确称取邻苯
二甲酸氢钾(预先在110~120℃下干燥至恒重)0.8502 g,置于烧杯中,加水(2.2.3.1)溶解后,转移此溶液于1 000 ml容量瓶中,用水(2.2.3.1)稀释至标线,混匀。
在4℃条件下可保存两个月。
2.2.
3.7 无机碳标准贮备液:ρ(无机碳,C)=400 mg/L。
准确称取无水
碳酸钠(预先在105℃下干燥至恒重)1.7634 g和碳酸氢钠(预先在干燥器内干燥)1.4000g,置于烧杯中,加水(2.2.3.1)溶解后,转移此溶液于1000 ml
容量瓶中,用水(2.2.3.1)稀释至标线,混匀。
在4℃条件下可保存两周。
2.2.3.8差减法标准使用液:ρ(总碳,C)= 200 mg/L,ρ(无机碳,C)
= 100 mg/L。
用单标线吸量管分别吸取50.00 ml有机碳标准贮备液(2.2.3.6)和无机碳标准贮备液(2.2.3.7)于200 ml容量瓶中,用水(2.2.3.1)稀释至标线,混匀。
在4℃条件下贮存可稳定保存一周。
2.2.
3.9载气:氮气或氧气,纯度大于99.99%。
6 仪器和设备本标准除非另有说明,分析时均使用符合国家A级标准的玻璃量器。
2.2.4. 非分散红外吸收TOC分析仪。
2.2.5 一般实验室常用仪器。
2.2.6 样品
水样应采集在棕色玻璃瓶中并应充满采样瓶,不留顶空。
水样采集后应在24 h 内测定。
否则应加入硫酸(2.2.3.2)将水样酸化至pH≤2,在4℃条件下可保存7 d。
2.2.7分析步骤
2.2.7.1 仪器的调试
按TOC分析仪说明书设定条件参数,进行调试。
2.2.7.2 差减法校准曲线的绘制
在一组七个100 ml容量瓶中,分别加入0.00、2.00、5.00、10.00、20.00、40.00、100.00 ml差减法标准使用液(2.2.3.8),用水(2.2.3.1)稀释至标线,混匀。
配制成总碳质量浓度为0.0、4.0、10.0、20.0、40.0、80.0、200.0 mg/L和无机碳质量浓度为0.0、2.0、5.0、10.0、20.0、40.0、100.0 mg/L的标准系列溶液,按照的步骤测定其响应值。
以标准系列溶液质量浓度对应仪器响应值,分别绘制总碳和无机碳校准曲线。
3.结果计算碳氮比=总碳/总氮。
