气体摩尔体积-教学课件PPT
合集下载
气体摩尔体积ppt课件

5.下列说法正确的是( B ) A.硫酸、磷酸的摩尔质量均为98g B.20℃、1.0×105Pa时,同体积的O2与CO2含有相同的分子数 C.标准状况下,16gO2与24g Mg所占的体积相同 D.当1mol气态物质的体积为22.4L时,该气体一定处于标准状况
谢谢观看
SHUAN Q for watching!
可以自由移动
没有固定的形状, 不易被压缩
气态
微粒间的空隙较大
可以自由移动
没有固定的形状, 容易被压缩
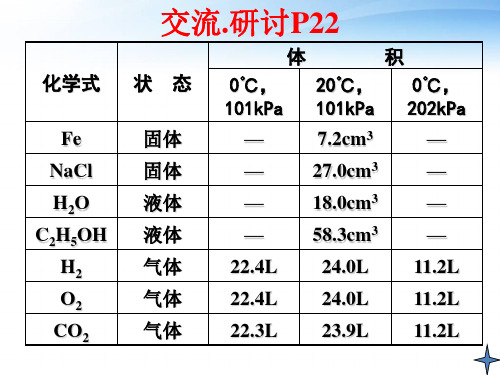
1mol任何微粒的集合体所含的微粒数目都相同,但1mol不同物质的的质量往往不 同。那么1mol不同物质的体积是否相同呢?
20°C 1 mol 固体的体积
大鹿化学工作室
20°C 1 mol 液体的体积
专题一 物质的分类及计量
第二单元 物质的化学计量 第二课时 气体摩尔体积
质量 (m)
n=m/M
物质的量 (n)
n=N/NA
微粒数 (N)
物质的体积
(V)?
我们在前面的学习中已经知道了两个计算物质的量的公式:n=N/NA和n=m/M,如果已知某 气体的体积,能否直接应用上面的公式计算出某气体的物质的量呢?显然不能,因为既不 知道气体的分子数,也不知道气体的质量。那么,气体体积与物质的量之间有什么关系呢?
相关公式 (1)气体的物质的量:n=Mm=NNA=VVm; (2)气体的摩尔质量:M=Vm·ρ (ρ 为气体的密度,单位为 g/L); (3)气体的分子数:N=n·NA=VVmNA; (4)气体的质量:m=n·M=VVmM=ρV。
推论
相同条件
同温同压
同温同容
同温同物 质的量 同温同压 同温同压 同体积
粒子数目相同物质的体积关系
气体摩尔体积-PPT课件

质量(g) 体积(L)
2 32 22.4
H2 O2
气体 气体
0.0893 1.429 1.965
22.39
CO2 气体 N2 气体
44
22.39
1.25
28
22.4
从表格体积数据你得出什么结论?
结论:00C、1.01×105Pa下,1mol气体液体所占的
练习
1.在标况下
1)
0.5mol HCl气体占有的体积是多少?
2) 3.36LH2 的物质的量是多少?
2.在标况下 1) 16克氧气的体积是多少? 2) 44.8L氮气中含有的分子数是多少?
3.同温同压下,质量相同的N2、CO2、Cl2、CH4、O 2五种 气体所占的体积由大到小的顺序是
体积怎样呢? 2.是不是在相同条件下,1mol任何气体的体 积都相同呢?
素材2
以下是1mol物质在00C、1.01×105Pa下的体积 物质 状态 密度 体积 Fe 7.8g/ml 7.2ml 固体 Al 2.7g/ml 10ml 固体 H2O 1g/ml 18ml 液体 H2SO4 1.83g/ml 53.6ml 液体 H2 气体 0.0893g/L 22.4L O2 1.429g/L 22.39L 气体 CO2 1.965g/L 22.39L 气体 N2 1.25g/L 22.4L 气体
瑞安中学
苏香妹
复习
问:什么叫摩尔质量? 单位物质的量的物质所具有的质量叫摩尔质量
问:1mol物质的质量是多少?
1mol任何粒子的质量以克为单位,数值上 等于该粒子的相对原子质量或相对分子质量
迁移:什么叫气体摩尔体积?
素材1
计算1mol下列气体在00C、1.01×105Pa下的体积
气体摩尔体积课件

气体摩尔体积ppt课件
欢迎来到本次课程,我们将探讨关于气体摩尔体积的知识。在本课程中,我 们将介绍摩尔体积的概念、计算方法以及其在化学、物理和环境保护领域的 应用。
什么是气体摩尔体积?
气体摩尔体积是指单位摩尔物质所占有的体积。它与气体的性质以及物质粒子之间的相互作用有着密切的关系。
1 摩尔体积的概念
1
摩尔体积计算的基本步骤
1. 确定气体的体积
摩尔体积计算的实例分析
2
2. 确定气体的摩尔数
通过实际例子演示如何计算摩尔体积。
3. 使用计算公式计算摩尔体积
摩尔体积的应用
摩尔体积在化学反应、理论化学和物理化学以及环境保护等领域都有重要的应用。
化学反应中的应用
摩尔体积可以用于计算反应物 和生成物之间的化学计量关系。
举例:用摩尔体积法确定气体 的分子式。
理论化学与物理化学 中的应用
摩尔体积与理论化学和物理化 学的研究密切相关。
举例:用摩尔体积描述理论气 体行为。
环境保护中的应用
摩尔体积可以用于监测和控制 环境中的气体浓度。
举例:用摩尔体积测定大气中 的污染物浓度。
总结
摩尔体积在化学和相关领域中扮演着重要角色,它不仅可以帮助我们理解物质的性质,还有着广阔的应用前景。
1 摩尔体积的重要性总结
摩尔体积的计算可以帮助化学学生更好地理 解物质的性质。
2 摩尔体积的未来前景展望
随着科学技术的进步,我们对于摩尔体积的 研究将会更深入,应用将会更加广泛。摩尔体积是指一摩尔物质 所占有的积。2 摩尔体积的计算公式
摩尔体积可以通过将气体 的体积除以气体的物质的 摩尔数来计算。
3 摩尔体积与物质的性
质关系
不同物质的摩尔体积会受 到物质的性质以及外界条 件的影响。
欢迎来到本次课程,我们将探讨关于气体摩尔体积的知识。在本课程中,我 们将介绍摩尔体积的概念、计算方法以及其在化学、物理和环境保护领域的 应用。
什么是气体摩尔体积?
气体摩尔体积是指单位摩尔物质所占有的体积。它与气体的性质以及物质粒子之间的相互作用有着密切的关系。
1 摩尔体积的概念
1
摩尔体积计算的基本步骤
1. 确定气体的体积
摩尔体积计算的实例分析
2
2. 确定气体的摩尔数
通过实际例子演示如何计算摩尔体积。
3. 使用计算公式计算摩尔体积
摩尔体积的应用
摩尔体积在化学反应、理论化学和物理化学以及环境保护等领域都有重要的应用。
化学反应中的应用
摩尔体积可以用于计算反应物 和生成物之间的化学计量关系。
举例:用摩尔体积法确定气体 的分子式。
理论化学与物理化学 中的应用
摩尔体积与理论化学和物理化 学的研究密切相关。
举例:用摩尔体积描述理论气 体行为。
环境保护中的应用
摩尔体积可以用于监测和控制 环境中的气体浓度。
举例:用摩尔体积测定大气中 的污染物浓度。
总结
摩尔体积在化学和相关领域中扮演着重要角色,它不仅可以帮助我们理解物质的性质,还有着广阔的应用前景。
1 摩尔体积的重要性总结
摩尔体积的计算可以帮助化学学生更好地理 解物质的性质。
2 摩尔体积的未来前景展望
随着科学技术的进步,我们对于摩尔体积的 研究将会更深入,应用将会更加广泛。摩尔体积是指一摩尔物质 所占有的积。2 摩尔体积的计算公式
摩尔体积可以通过将气体 的体积除以气体的物质的 摩尔数来计算。
3 摩尔体积与物质的性
质关系
不同物质的摩尔体积会受 到物质的性质以及外界条 件的影响。
必修一-气体摩尔体积((第1课时)PPT课件

3、适应对象:气体{可以是单一气体,也可以是混合气体}
一定温度一定压强下的气体摩尔体积为 定值
0标0C准.10状1况KP下的气体摩尔体积为约定22值.4L!/mol
在25℃和1个标准大气压,气体摩尔体积为约 2定4.值5L/mol
影响因素: 4、2021/3/12 温度和压强
25
标准状况下的气体摩尔体积:
问题2 :影响固体、液体摩尔体积 主要因素有哪些?
问题3 :影响气体摩尔体积主要因 素有哪些?
问题4 :影响气体分子之间的平均距
离的因素有哪些?
2021/3/12
6
问题 :影响物质体积的因素 有哪些?
2021/3/12
7
①
2021/3/12
8
②
2021/3/12
9
③
2021/3/12
10
影响物质 体积大小 的因素
条件:标准状况(S T P) 0℃、 1.01×105 Pa 对象:1mol任何气体,可以是单一纯净的气体,也可 以是混合气体。
结论 体积约为22.4L
6.02×1023 分子
2021/3/12
标态下的气体摩尔体积 26
问题2 :使用标准状况下气体 摩尔体积应注意什么?
2021/3/12
27
【合作探究二】
问题1
影响物质 的摩尔体 积的因素
2021/3/12
⑴粒子数目的多少 ⑵ 粒子本身的大小
⑶粒子之间的平均距离
⑵ 粒子本身的大小
⑶粒子之间的平均距离 11
问题2 :影响固体、液体摩尔体 积主要因素有哪些?
2021/3/12
12
影响固体、液体摩尔体积的主要因素
因素 粒子大小 粒子间距离 状态
一定温度一定压强下的气体摩尔体积为 定值
0标0C准.10状1况KP下的气体摩尔体积为约定22值.4L!/mol
在25℃和1个标准大气压,气体摩尔体积为约 2定4.值5L/mol
影响因素: 4、2021/3/12 温度和压强
25
标准状况下的气体摩尔体积:
问题2 :影响固体、液体摩尔体积 主要因素有哪些?
问题3 :影响气体摩尔体积主要因 素有哪些?
问题4 :影响气体分子之间的平均距
离的因素有哪些?
2021/3/12
6
问题 :影响物质体积的因素 有哪些?
2021/3/12
7
①
2021/3/12
8
②
2021/3/12
9
③
2021/3/12
10
影响物质 体积大小 的因素
条件:标准状况(S T P) 0℃、 1.01×105 Pa 对象:1mol任何气体,可以是单一纯净的气体,也可 以是混合气体。
结论 体积约为22.4L
6.02×1023 分子
2021/3/12
标态下的气体摩尔体积 26
问题2 :使用标准状况下气体 摩尔体积应注意什么?
2021/3/12
27
【合作探究二】
问题1
影响物质 的摩尔体 积的因素
2021/3/12
⑴粒子数目的多少 ⑵ 粒子本身的大小
⑶粒子之间的平均距离
⑵ 粒子本身的大小
⑶粒子之间的平均距离 11
问题2 :影响固体、液体摩尔体 积主要因素有哪些?
2021/3/12
12
影响固体、液体摩尔体积的主要因素
因素 粒子大小 粒子间距离 状态
气体摩尔体积-课件PPT

二、气体摩尔体积
【巧判断】 (1)气体摩尔体积是一定值,无论什么条件一定是 22.4 L·mol-1。 ( ) 提示:×。气体摩尔体积受温度、压强影响,不同的温 度、压强下数值不同。
(2)标准状况下1 mol CCl4所占的体积为22.4 L。 ()
提示:×。标准状况下CCl4为液体,不能套用气体摩尔 体积。
【解析】选B。常温常压下的气体摩尔体积大于
22.4 L·mol-1,N2分子数小于0.5 NA,A错误;标准状况
下,1 mol任何气体的体积都约为22.4 L,其分子数为
NA,B正确;标准状况下,H2O为液体,C错误;未指明标准状
况,D错误。
【母题追问】(1)A选项改为“在常温常压下,14 g N2
【情境·思考】篮球起源于美国马萨诸塞州,1891年12月21日由 詹姆士·奈史密斯创造,是奥运会核心比赛项目,是以手为中心 的身体对抗性体育运动。用打气筒给篮球打气时,气体源源不断 地被打进去,而篮球的体积却不发生很大变化。 气体体积与什么因素有关?两种气体体积相同,所含的分子数一 定相同吗?
提示:影响气体体积大小的主要因素是气体分子之间的距离,给 篮球打气时,篮球的体积不会发生很大变化是因为气体分子之间 的距离在不断缩小。两种气体体积相同,所含的分子数不一定相 同。因为气体体积受温度和压强的影响较大,温度和压强不同时, 体积相同的两种气体的物质的量不一定相同,故所含的分子数也 不一定相同。
(2)同温同压下,相同体积的物质含有相同数目的分子。 ()
提示:×。阿伏加德罗定律只适用于气体物质,对液体、 固体物质不适用。
知识点一 气体摩尔体积及相关计算 【重点释疑】 1.标准状况下的气体摩尔体积
(1)1个条件:必须为标准状况。非标准状况下,1 mol气 体的体积不一定是22.4 L。因此在使用气体摩尔体积 时,一定要看清气体所处的状态。 (2)1种状态:必须为气体。如水、酒精、CCl4等物质在 标准状况下不是气体。 (3)2个数据:“1 mol”“约22.4 L”。
气体摩尔体积课件(共28张PPT)高中化学沪科版(2020)必修第一册

= .
.
= .
.
= .
.
= .
.
【结论1】同温同压下,1 mol气体的体积远大于1 mol固体或液体的体积。
【思考】计算1 mol各物质的体积,并寻找规律。
NaCl
Fe
C2H5OH
H2SO4
H2(273 K)
He(273 K)
CH4(273 K)
固
固
液
液
气
气
气
1
1
1
1
1
1
1
58.5
56
46
98
2
4
16
2.17
7.86
0.789
1.84
0.000 088
0.000 176
0.000 716
【结论2】同温同压下,1 mol气体的体积近似相等。
V=
V=
V=
V=
V=V=V=
L。
V(O2) = n(O2) × Vm = 0.8 mol × 22.4 L·mol-1 = 17.92 L
2. 标准状况下,56 L CO2的物质的量为 2.5
n(CO2) =
V(CO2)
56 L
=
= 2.5 mol
Vm
22.4 L·mol−1
mol。
【资料卡片】
分子直径/
(nm)
分子间的平均距离/
(nm)
0.35
0.36
0.33
3.3
3.3
3.3
注:均为常温常压下的测量值
气体物质分子间的平均距离远大于分子本身大小,在分子数
目相同的情况下,气体的体积主要由分子间的距离大小决定。
高中化学人教版 必修一《气体摩尔体积》课件(25张PPT)

❖概念:单位物质的量的气体所占的体积。
❖公式: Vm=
V n
❖常用单位有L/mol和m3/mol。
对象:任何气体(纯净或混合气体)
标准状况:温度为0℃,压强为101KPa
在标准状况下,1 mol任何气体的体积都约是22.4L。
三、阿伏加德罗定律
在相同温度和压强下,相同体积的
都含有的分子数目。
因素 状态
固体和 液体
粒子大小 粒子间距离
主要因素 次忽要因略素
气体 次忽要因略素 主要因素
结论
1:在相同的条件下,固体或液体的摩
尔体积取决于微粒自身的大小。
大小
--由微粒本质属性决定
距2:离在相同的条件下,气体的摩尔体
积取决于微粒间的平均距离。
--外界条件能否控制?
1、气体分子间距与温度的关系
阿伏加德罗定律
PV
n RT
(1)“三同”定“一同”。
注意:(2)适用于气态物质。既适用于单一气体,
又适用于混合气体。
[练习1]
同温同压下,同物质的量的乙炔气体
(C2H2)与苯蒸气(C6H6)体积比是(B)
(A)3:1
(B)1:1
(C)1:3
(D)2:3
[练习2]
将H2、O2、N2三种气体分别装在三个容积相等的 容器中,当温度和密度完全相同时,三种气体压
温故:什么叫摩尔质量?
单位物质的量的物质所具有的质量 摩尔质量
探新:什么叫摩尔体积?
单位物质的量的物质所具有的体积
摩尔体积
公式:Vm =
V ——
符号: Vm
n
单位:L/mol或(L·mol-1)。
思考
不同物质的摩尔质量一般不同,那么不同 状态时(固体、液体、气体)物质的摩尔体积 是否相同呢?
气体摩尔体积-ppt课件
A.①③⑤
B.④
C.③④
D.①④
第二课时
阿伏加德罗定律及其推论(适用于任何气体)
克拉贝隆方程 PV=nRT
各量意义
两种变形
知识点二 阿伏加德罗定律及其推论
1、定律:在______同__温__同__压_______下,______相__同__体__积______ 的任何气体都含有___相__同__数__目___的分子,这一结论称为阿伏 加德罗定律。 总结:“三同”定“一同”。
小结
1mol物质 气体
固体 液体
微粒数目 NA个
NA个 NA个
体积主要 决定因素
结论
微粒的平 均距离
同温同压下,不 同的气体分子间 的距离可看作相 等,因此其体积 相同。
微粒的大小 微粒的大小
同温同压下,粒 子本身的大小不 同决定了其体积 不同。
气体分子间的平均距离由什么决定?
温度
压强
知识点一 气体摩尔体积
1、在标准状况下①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S④0.2mol NH3,通过公式计算 或说明排序
a.体积
b.密度
。
c.质量。
d.氢原子个数。
2.同温同压下,质量相同的N2、CO2、Cl2、CH4、O 2 五种气体所占的体积由大到小的顺序是
B.XY D.X2Y3
[自我测评]————(做一做) 下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表 容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。 其中能表示等质量的氢气与氦气的是( A )
同温同压同质量时??
阿伏加德罗定律的推论 2.同温、同压→气体的密度与摩尔质量成正比→ρρ21=MM12;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
50个乒乓球与50个篮球分别紧密堆积,哪 个所占的体积更大呢?
50个乒乓球紧密堆积,50个乒乓球松散堆 积,哪个所占的体积更大呢?
粒子本身
[思考]
50个乒乓球与100个乒乓球分别紧密堆积, 哪个所占的体积更大呢?
50个乒乓球与50个篮球分别紧密堆积,哪 个所占的体积更大呢?
★气体的体积,在同温同压下只与气体的微粒 数目有关而与气体分子的种类无关
讨论:
有人说:“非标准状况下, 1mol气体的体积一定不是 22.4L。”这一说法对吗?为什 么?
* 三、阿伏加德罗定律
1、含义 同温、同压下,相同体积的任何气体含有相同数目的
分子。 2、数学表达式 相同条件下: V1/V2=N1/N2
[思考]
50个乒乓球与100个乒乓球分别紧密堆积, 哪个所占的体积更大呢?
50个乒乓球与50个篮球分别紧密堆积,哪 个所占的体积更大呢?
50个乒乓球紧密堆积,50个乒乓球松散堆 积,哪个所占的体积更大呢?
微粒数越多,则体积越大
*
①物质的粒子数目;
[思考]
50个乒乓球与100个乒乓球分别紧密堆积, 哪个所占的体积更大呢?
(2) 在标准状况下,44.8L H2的物质的
量是多少?
2mol
(3) 在标准状况下,14g CO的体积是多
少?
11.2L
(子4)数在是标多准少状?况下,9.3033×.6L10N232中含有氮分
注意: (1)“三同”定“一 同”。 (2)适用于气态物质。既适用于单一气体, 又适用于混合气体。
当堂检测1
*一、对下列说法做出判断:
1、标准状况下,1mol任何物质 的体积都约为 22.4L
2、 1mol气体的体积约为 22.4L
3、1mol H2和1mol N2体积相等
4、标准状况下,以任意比混合的 氢气氮气混合气体共1mol其体积约 为22.4L
50个乒乓球紧密堆积,50个乒乓球松散堆 积,哪个所占的体积更大呢?
粒子间的距离
*
①物质的粒子数目;
②粒子的大小; ③粒子之间的距离;
固体变液体,又变为气体, 分子间距离的变化。
二、气体摩尔体积
1、气体摩尔体积:单位物质的量的气体所占 的体积。
2、符号:Vm 3、常用单位:L/mol m3/mol 4、公式: Vm=V/n V=n*Vm n=V/Vm 5、气体摩尔体积:在标准状况下,1摩任何 气体的体积都约是22.4升。
*第一章 从实验学化学 第二节化学计量在实验中的应用 第三课时 气体摩尔体积
* 学习目标
1.了解影响气体、液体及固体体积的 因素 2.掌握气体摩尔体积的概念及简单运 算 3.理解阿伏伽德罗定律
* 自学指导 (5分钟时间阅读13---14页的内容,回答下列问 题)
1.决定物质体积大小的因素有哪些? 2.气体摩尔体积的概念是什么?符号______,单 位_______. 3.气体摩尔体积﹑气体体积﹑物质的量三者关系 ___________. 4.气体摩尔体积的数值是不是固定不变的?如果 不是,受什么影响? 5.标准状况是__________,标况下气体摩尔体积 是________.
当堂检测2
下列说法正确的是( D )
A. 1mol 任何气体的体积都是22.4L B. 1mol H2的质量是2g,体积是22.4L C.标准状况下,1mol任何物质所占的体积都 约是22.4L D.标准状况下,1mol任何气体所占的体积都 约是22.4L
当堂检测3
(1) 在标准状况下,0.5mol氧气占有的 体积是多少? 11.2L
(标准状况:T=0 ℃,P=101KPa)
[注意]
★气体摩尔体积是一个带有单位的物理量。
★ 同种气体不同温度和压强下摩尔体积不同
★ 标准状况下的气体摩尔体积约为22.4L/mol, 在非标准状况时不能使用22.4L/mol。
★只适用于气态物质(包括混合气体),对于 固态物质和液态物质来讲,都是不适用的。
50个乒乓球紧密堆积,50个乒乓球松散堆 积,哪个所占的体积更大呢?
粒子本身
[思考]
50个乒乓球与100个乒乓球分别紧密堆积, 哪个所占的体积更大呢?
50个乒乓球与50个篮球分别紧密堆积,哪 个所占的体积更大呢?
★气体的体积,在同温同压下只与气体的微粒 数目有关而与气体分子的种类无关
讨论:
有人说:“非标准状况下, 1mol气体的体积一定不是 22.4L。”这一说法对吗?为什 么?
* 三、阿伏加德罗定律
1、含义 同温、同压下,相同体积的任何气体含有相同数目的
分子。 2、数学表达式 相同条件下: V1/V2=N1/N2
[思考]
50个乒乓球与100个乒乓球分别紧密堆积, 哪个所占的体积更大呢?
50个乒乓球与50个篮球分别紧密堆积,哪 个所占的体积更大呢?
50个乒乓球紧密堆积,50个乒乓球松散堆 积,哪个所占的体积更大呢?
微粒数越多,则体积越大
*
①物质的粒子数目;
[思考]
50个乒乓球与100个乒乓球分别紧密堆积, 哪个所占的体积更大呢?
(2) 在标准状况下,44.8L H2的物质的
量是多少?
2mol
(3) 在标准状况下,14g CO的体积是多
少?
11.2L
(子4)数在是标多准少状?况下,9.3033×.6L10N232中含有氮分
注意: (1)“三同”定“一 同”。 (2)适用于气态物质。既适用于单一气体, 又适用于混合气体。
当堂检测1
*一、对下列说法做出判断:
1、标准状况下,1mol任何物质 的体积都约为 22.4L
2、 1mol气体的体积约为 22.4L
3、1mol H2和1mol N2体积相等
4、标准状况下,以任意比混合的 氢气氮气混合气体共1mol其体积约 为22.4L
50个乒乓球紧密堆积,50个乒乓球松散堆 积,哪个所占的体积更大呢?
粒子间的距离
*
①物质的粒子数目;
②粒子的大小; ③粒子之间的距离;
固体变液体,又变为气体, 分子间距离的变化。
二、气体摩尔体积
1、气体摩尔体积:单位物质的量的气体所占 的体积。
2、符号:Vm 3、常用单位:L/mol m3/mol 4、公式: Vm=V/n V=n*Vm n=V/Vm 5、气体摩尔体积:在标准状况下,1摩任何 气体的体积都约是22.4升。
*第一章 从实验学化学 第二节化学计量在实验中的应用 第三课时 气体摩尔体积
* 学习目标
1.了解影响气体、液体及固体体积的 因素 2.掌握气体摩尔体积的概念及简单运 算 3.理解阿伏伽德罗定律
* 自学指导 (5分钟时间阅读13---14页的内容,回答下列问 题)
1.决定物质体积大小的因素有哪些? 2.气体摩尔体积的概念是什么?符号______,单 位_______. 3.气体摩尔体积﹑气体体积﹑物质的量三者关系 ___________. 4.气体摩尔体积的数值是不是固定不变的?如果 不是,受什么影响? 5.标准状况是__________,标况下气体摩尔体积 是________.
当堂检测2
下列说法正确的是( D )
A. 1mol 任何气体的体积都是22.4L B. 1mol H2的质量是2g,体积是22.4L C.标准状况下,1mol任何物质所占的体积都 约是22.4L D.标准状况下,1mol任何气体所占的体积都 约是22.4L
当堂检测3
(1) 在标准状况下,0.5mol氧气占有的 体积是多少? 11.2L
(标准状况:T=0 ℃,P=101KPa)
[注意]
★气体摩尔体积是一个带有单位的物理量。
★ 同种气体不同温度和压强下摩尔体积不同
★ 标准状况下的气体摩尔体积约为22.4L/mol, 在非标准状况时不能使用22.4L/mol。
★只适用于气态物质(包括混合气体),对于 固态物质和液态物质来讲,都是不适用的。
