盐水解 酸碱理论2012.3.5
盐的水解
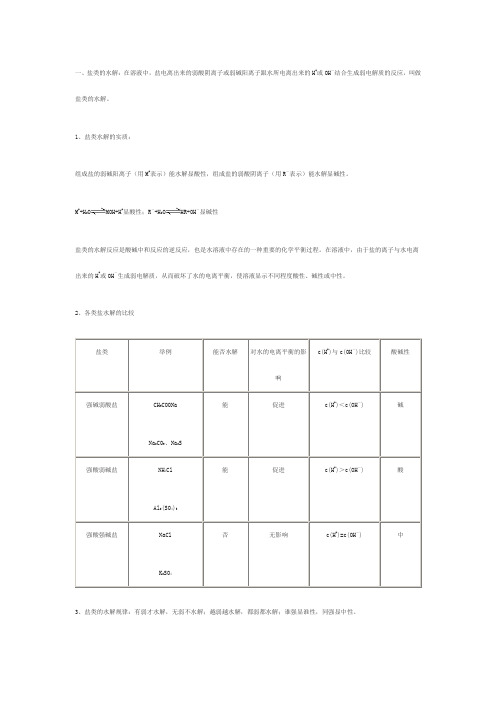
一、盐类的水解:在溶液中,盐电离出来的弱酸阴离子或弱碱阳离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
1、盐类水解的实质:组成盐的弱碱阳离子(用M+表示)能水解显酸性,组成盐的弱酸阴离子(用R-表示)能水解显碱性。
M++H2O MOH+H+显酸性;R-+H2O HR+OH-显碱性盐类的水解反应是酸碱中和反应的逆反应,也是水溶液中存在的一种重要的化学平衡过程。
在溶液中,由于盐的离子与水电离出来的H+或OH-生成弱电解质,从而破坏了水的电离平衡,使溶液显示不同程度酸性、碱性或中性。
2、各类盐水解的比较3、盐类的水解规律:有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性。
⑴强酸强碱盐:不水解,水溶液呈中性,如:NaCl、KNO3等⑵强碱弱酸盐:能水解,水溶液呈碱性,如:Na2S、Na2CO3等⑶强酸弱碱盐:能水解,水溶液呈酸性,如:NH4NO3等⑷弱酸弱碱盐:能水解,谁强显谁性,如NH4Ac显中性、(NH4)2S显碱性;若水解时可生成沉淀和气体,则可水解完全,如:Al2S3、Mg3N2等⑸酸式盐的水解:溶液的酸碱性决定于阴离子是以水解为主要过程还是以电离为主要过程。
①阴离子是强酸根,如NaHSO4不水解:NaHSO4 =Na++H++SO42-本身电离出H+,呈酸性。
②阴离子以电离为主:如H2PO4-、HSO3-如:NaH2PO4=Na++H2PO4-,则有:H2PO4-H++HPO42-(主要,大)呈酸性;H2PO4-+H2O H3PO4+OH-(次要,小)③阴离子以水解为主:HCO3-、HS-、HPO42-HCO3-+H2O H2CO3+OH-(主要,大)呈碱性;HCO3-H++CO32-(次要,小)4、影响水解的因素:(1)内因:盐本身的性质,“越弱越水解”。
(2)外因:①温度:升高温度促进水解②浓度:加水稀释,水解程度增大③溶液的pH改变水解平衡中某种离子的浓度时,水解就向着能够减弱这种改变的方向移动。
盐水解ph计算范文

盐水解ph计算范文盐水是由于溶解了固体盐类(如氯化钠、硝酸钙等)而成的溶液,它在生活中有着广泛的应用。
在实验室和工业生产中,准确测量盐水的pH 值对于控制化学反应、判断溶液的性质等方面非常重要。
本文将详细介绍盐水解pH计算的原理、方法和注意事项。
一、盐水解pH计算的原理盐水的pH值是指测定盐水溶液酸碱度的指标,表示盐水溶液中氢离子(H+)的浓度。
当盐溶解在水中时,会与水分子进行反应,产生酸性或碱性物质。
这些物质的水解产物会影响盐水溶液的pH值。
盐水的pH计算主要分为两种情况:一种是弱酸与强碱(或弱碱与强酸)反应生成的盐水;另一种是弱酸与弱碱反应生成的盐水。
1.弱酸与强碱(或弱碱与强酸)反应生成的盐水当弱酸与强碱(或弱碱与强酸)反应生成的盐水中,水解产物会影响溶液的pH值。
一般来说,弱酸的水解产物具有一定的酸性,而强碱的水解产物具有一定的碱性。
通过计算水解产物的浓度以及各种离子的浓度,可以推算出盐水溶液的pH值。
2.弱酸与弱碱反应生成的盐水在弱酸与弱碱反应生成的盐水中,溶液的pH值的计算会变得更加复杂。
此时,需要考虑弱酸与弱碱的离解度以及水解反应产生的离子浓度。
通过计算各种离子浓度并用水离解常数公式计算pH值。
二、盐水解pH计算的方法根据盐水是由弱酸/弱碱和强碱/强酸反应产生的不同情况,盐水解pH计算的方法也有所不同。
1.弱酸与强碱(或弱碱与强酸)反应生成的盐水对于这种情况,可以通过以下步骤计算盐水的pH值:(1)根据反应方程式写出完整的离解和水解反应方程。
(2)推算出弱酸和强碱(或弱碱和强酸)水解产物的浓度,可以使用水离解常数公式和质量守恒定律。
(3)计算出水解产物生成的碱性和酸性物质的浓度。
(4)根据阿伦尼乌斯(Arrhenius)定义的酸碱反应公式,计算出pH值。
2.弱酸与弱碱反应生成的盐水对于这种情况,计算盐水的pH值较为复杂,需要考虑酸碱离子的离解度和水解反应产生的离子浓度。
通过以下步骤可以计算出盐水的pH值:(1)根据反应方程式写出完整的离解和水解反应方程。
盐类的水解 课件

C(Na+) = C(CO32-) + C(HCO3-) + C(H2CO3)
六、溶液中离子浓度的大小的判断
①、多元弱酸溶液,根据分步电离分析。如H3PO4溶液
C(H+) >C(H2PO4-) > C(HPO42-) > C(PO43-) > C(OH-)
②、多元弱酸的正盐溶液,根据弱酸根分步水解分析。
七、盐溶液蒸干时所得产物的判断方法
1、考虑盐是否水解
①不水解的盐蒸干后一般得到原溶质。如:NaCl、K2SO4等
②金属阳离子易水解的挥发性强酸盐,蒸干后得到氢氧化物,
蒸干后再灼烧得到金属氧化物。如:AlCl3 、FeCl3 等
∆
AlCl3 + 3H2O
Al(OH)3↓ + 3HCl↑
∆
2Al(OH)3
3、质子守恒 [水电离产生的 C(H+)=C(OH-)]
C(OH-) = C(H+) + C(HCO3-) + 2C(H2CO3)
练习:
以0.1mol/L 的NaHCO3溶液为例分析 1、电荷守恒: 首先分析溶液中有哪些粒子
C(Na+) + C(H+) = 2C(CO32-) + C(HCO3-) + C(OH-)
6、热碱液去污效果更好
CO32- + H2O
HCO3- + OH-
7、活泼金属在强酸弱碱盐溶液中会产生气体
Mg + 2NH4+ = Mg2+ + 2NH3 ↑ + H2 ↑
8、水垢中Mg(OH)2的形成 Mg(HCO3)2 =∆= MgCO3+ CO2 ↑ + H2O
盐的水解知识点总结

盐的水解知识点总结1. 盐的水解概念盐是由阳离子和阴离子组成的化合物,当盐溶解于水中时,会发生水解反应。
水解反应是指盐溶解后,其阳离子和阴离子会与水分子发生化学反应,形成新的物质。
水解反应可以分为强水解和弱水解两种情况。
强水解是指盐溶解后,其离子会与水分子完全发生化学反应,产生大量的氢氧根离子(OH^-)或氢离子(H^+)。
强水解的盐包括氯化钠、硝酸铵、硫酸钠等。
弱水解是指盐溶解后,其离子只与水分子部分发生化学反应,产生少量的氢氧根离子(OH^-)或氢离子(H^+)。
弱水解的盐包括碳酸钙、氢氧化铝等。
2. 盐的水解平衡盐的水解过程是一个动态的过程,其达到平衡状态时,水中同时存在盐的离子和水分子之间的反应和生成。
水解平衡是指盐溶解后,其离子和水分子之间的反应和生成达到动态平衡状态。
在水解平衡时,盐的溶解度和水解程度是一个动态平衡的过程。
具体来说,当盐溶解于水中时,其离子和水分子之间的反应和生成达到平衡状态,此时其溶解度几乎不再改变。
3. 盐的水解产物盐的水解反应会产生离子和水分子之间的化学反应,从而形成新的物质。
具体来说,强水解盐溶解后会产生大量的氢氧根离子(OH^-)或氢离子(H^+);而弱水解盐溶解后会产生少量的氢氧根离子(OH^-)或氢离子(H^+)。
这些产物在水溶液中会影响其PH值,从而影响水的化学性质和溶解度。
4. 盐的水解影响因素盐的水解反应会受到多种因素的影响,包括温度、溶液浓度、压力、PH值等。
具体来说,温度对盐的水解速率具有显著影响,通常情况下,温度越高,盐的水解速率越快。
溶液浓度对盐的水解程度也有影响,通常情况下,浓度越高,水解程度越低。
压力对盐的水解影响较小,而PH值对盐的水解程度影响较大,一般来说,PH值越高,水解程度越高。
5. 盐的水解应用盐的水解过程在化学和生活中具有广泛的应用。
在化学工业中,盐的水解反应可以制取氢氧根离子(OH^-)或氢离子(H^+),用于制备酸、碱、盐等化学品。
盐类水解原理

盐类水解原理盐是由正离子和负离子组成的化合物,它们在水中溶解时会发生水解反应。
水解是指化合物与水分子相互作用,形成离子或者分解成更简单的化合物的过程。
在盐类水解中,正离子和负离子与水分子发生相互作用,导致盐类分解或产生酸碱反应。
一、盐的水解反应类型盐的水解反应可以分为三种类型:酸性盐的水解、碱性盐的水解和中性盐的水解。
1. 酸性盐的水解酸性盐是指含有可水解的阳离子和酸性残基的盐。
在水中,酸性盐会发生水解反应产生酸和碱。
例如,硫酸铵(NH4HSO4)在水中水解生成硫酸(H2SO4)和铵氢碱(NH4HS)。
2. 碱性盐的水解碱性盐是指含有可水解的阳离子和碱性残基的盐。
在水中,碱性盐会发生水解反应产生碱和酸。
例如,氯化铵(NH4Cl)在水中水解生成氨气(NH3)和盐酸(HCl)。
3. 中性盐的水解中性盐是指既不含有酸性残基也不含有碱性残基的盐。
在水中,中性盐的水解反应不会产生酸碱。
例如,氯化钠(NaCl)在水中不发生水解反应。
二、酸性盐的水解原理酸性盐的水解是由于可水解阳离子和酸性残基的影响。
可水解阳离子与水分子发生作用形成酸,而酸性残基与水分子发生作用形成碱。
这种酸碱反应导致酸性盐的水解。
以硫酸铵为例,硫酸铵中的铵离子(NH4+)与水分子发生作用形成了铵氢碱(NH4HS),同时水分子与硫酸根离子(HSO4-)发生作用形成了硫酸(H2SO4)。
因此,硫酸铵的水解反应可以被表示为:NH4HSO4 + H2O → H2SO4 + NH4HS。
三、碱性盐的水解原理碱性盐的水解是由于可水解阳离子和碱性残基的影响。
可水解阳离子与水分子发生作用形成碱,而碱性残基与水分子发生作用形成酸。
这种酸碱反应导致碱性盐的水解。
以氯化铵为例,氯化铵中的铵离子(NH4+)与水分子发生作用形成了氨气(NH3),同时水分子与氯离子(Cl-)发生作用形成了盐酸(HCl)。
因此,氯化铵的水解反应可以被表示为:NH4Cl + H2O → NH3 + HCl。
盐的水解

酸式盐的水解
NaHSO4=Na++H++SO42NaH2PO4=Na++H2PO4H2PO4HPO4
2-
酸性
H++HPO42H++PO43H3PO4+OH-
电离强于水解,溶液 呈酸性
H2PO4-+H2O
NaHCO3=Na++HCO3HCO3
-
H++CO32H2CO3+OH-
水解强于电离,溶液 呈碱性
A 醋酸与氢氧化钠等物质的量混合 B 醋酸过量
C 氢氧化钠过量
D
NH4Cl = NH4+ + Cl-
+
H2O OH- + H+ NH3· 2O H 水解离子方程式:NH4+ + H2O NH3· 2O + H+ H
多元弱碱的强酸盐
例:FeCl3溶液: Fe3++3H2O
Fe(OH)3+3H+
思考: 反应生成的氢氧化铁是否写沉定符号? 练习: 在PH=4的NH4Cl溶液中,水所电离出的氢 离子浓度是多少?水的电离度是多少?
盐的水解
盐的水解:
在水溶液中盐电离出的 离子跟水所电离出来的H+或OH-结合生 成弱电解质的反应,叫做盐类的水解。 水解的条件:生成弱电解质。 水解的实质:破坏了水的电离平衡。 水解的结果: 使溶液中C(H+) ≠C(OH-)
水解反应与中和反应的关系:
酸+碱
中和 水解
盐+水
一.强碱弱酸盐-----碱性
练习:
下列说法正确的是: A.在碳酸钠溶液中,由于溶液呈碱性,水的电离程度将减小. B.碳酸钠与酸反应的实质是:酸电离出的H+与CO32-水解所生 成的OH-发生中和反应,破坏了水解平衡,使水解向正反应方 向进行. C.碳酸钠溶液中各离子浓度的关系: C(Na+)>C(CO32->C(OH-)>C(HCO3-)>C(H+) D. 相同条件下,碳酸钠溶液的碱性强于碳酸氢钠溶液. E.若C(Na+)=C(CO32-),则溶液PH=7
盐类的水解知识点总结

水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H++OH—A(OH)n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(An+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱不水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为:1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐不一定如 NH4CN CH3CO2NH4NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若只有电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4H2PO4—HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(很特殊,电离大于水解):NaHSO3、NaH2PO4、NaHSO4(三)影响水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度不变,浓度越小,水解程度越大.(2)浓度不变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的影响.HAH++A——QA—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度h—水解程度思考:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分别加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何影响?(五)盐类水解原理的应用考点1.判断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分别为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。
盐类水解的原理

盐类水解的原理盐类水解是指盐在水中溶解时,水分子与盐离子发生化学反应,产生酸性或碱性溶液的过程。
盐类水解是化学学科中的一个重要概念,它在生活和工业生产中有着广泛的应用。
首先,我们来了解一下盐类的定义。
盐类是由金属离子和非金属离子组成的化合物,通常是由酸和碱中和而成。
盐类的水解包括酸性盐和碱性盐两种情况。
酸性盐的水解是指酸性盐在水中溶解时,产生酸性溶液的过程。
以硫酸铵为例,硫酸铵在水中溶解时,产生氢离子和铵离子,使溶液呈酸性。
其化学方程式为:NH4HSO4 → NH4+ + HSO4-。
HSO4+ H2O → H2SO4 + OH-。
由此可见,硫酸铵的水解产生了硫酸和氢氧化铵,使溶液呈酸性。
碱性盐的水解是指碱性盐在水中溶解时,产生碱性溶液的过程。
以氯化钠为例,氯化钠在水中溶解时,产生钠离子和氯离子,使溶液呈碱性。
其化学方程式为:NaCl → Na+ + Cl-。
Na+ + H2O → NaOH + H+。
Cl+ H2O → HCl + OH-。
由此可见,氯化钠的水解产生了氢氧化钠和盐酸,使溶液呈碱性。
在生活中,盐类水解的原理被广泛应用于食品加工、化妆品生产、药品制造等领域。
比如,在食品加工中,食盐(氯化钠)的水解作用可以影响食品的口感和保存时间;在化妆品生产中,盐类水解可以调节化妆品的酸碱度,改善产品的质地和稳定性;在药品制造中,盐类水解可以影响药物的吸收和释放速度,从而调节药效。
总之,盐类水解是化学学科中一个重要的概念,它在生活和工业生产中有着广泛的应用。
通过对盐类水解原理的深入理解,我们可以更好地掌握化学知识,提高生活和工作中的实际应用能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
也可以写成 H2PO4 (aq)
2 HPO4 (aq) H (aq)
8 K ( H PO ) 6 . 2 10 a,2 3 4
H2PO4 (aq) H2O (l)
H3PO4 (aq) O H (aq) 水解
14 K 1 . 0 10 3 12 w K (PO ) 1 . 5 10 h,3 4 3 K ( H PO ) 6 . 7 10 a,1 3 4
2
[Fe(OH)(H 2 O) 5 ]
2
H [Fe(OH) 2 (H 2 O) 4 ]
酸
H+
+
碱
例:HAc的共轭碱是Ac- ,
Ac-的共轭酸是HAc,
HAc和Ac-为一对共轭酸碱对。 两性物质: 既能给出质子,又能接受质子的物质。
如:HSO , [Fe(OH)(H 2 O)5 ] ,
酸和碱的古典定义
酸 碱
使石蕊溶液变红
味道是酸的 与活泼金属反应 与碱反应
使石蕊溶液变蓝
味道是苦的 手感滑腻 与酸反应
1.酸碱电离理论 (ARRHENIUS酸碱理论, 1887)
阿伦尼乌斯, 19、 20 世纪交 替时期的一位顶级化学巨人。 ChemTeam,2002
阿伦尼乌斯, 18591927Svante August Arrhenius瑞典化学家
2.布朗斯特-劳瑞酸碱质子理论(1923)
Johannes Nicolaus Brønsted, 1879-1947 丹麦化学家
Thomas Martin Lowry, 1874-1936 英国化学家
A.酸碱质子理论的基本概念
酸:凡是能释放出质子(H+)的任何 分子或离子。 (质子的给予体) 碱:凡是能与质子(H+)结合的分子 或离子。 (质子的接受体)
若h 5%, [OH ]和h可作近似计算。
练习:计算 0.10mol· L-1 NH4Cl溶液的pH和 NH4+的水解度。已知NH3的Kbθ= 1.8×10-5
-14 K 1.0 10 w K (NH ) 解: h 4 -5 K b (NH3 ) 1.8 10
例题4.13 298K时,0.1M NaAc水溶液pH和水解度h 已知HAc的Kaθ= 1.74×10-5
Ac (aq) H2O (l)
c0 ceq 0.1 0.1-0.1h (0.1h)2 0.1-0.1h
HAc(aq) O H (aq)
0 0.1h
ቤተ መጻሕፍቲ ባይዱ
0 0.1h
Kw = K h ( Ac ) K a ( HAc)
电离大于水解, NaH2PO4溶液显弱酸性;
相反,Na2HPO4溶液电离小于水解,显弱碱性。
4.3.4.6.影响盐类水解的因素及应用
Kh ①盐的浓度: c盐↓ , 水解度增大。h c(盐)
② 温度:水解反应为吸热反应, △ rHm >0 ,
T↑, Kh ↑,水解度增大。 总之,加热和稀释都有利于盐类的水解。 ③溶液的酸碱度:加酸可以引起盐类水解平衡 的移动,例如加酸能抑制下述水解产物的生成。
5 K (NH H O) 1 . 8 10 b 3 2
K a K b 碱性 NH 4CN
K a (HCN) 5.8 10
a
10
5 K (NH H O) 1 . 8 10 b 3 2
K K
a
b
酸性 NH 4 F
K (HF) 6.9 10
酸碱电离理论
要点:在水溶液中 • 电离出的阳离子皆为H+的物质叫做酸, • 电离出的阴离子皆为OH-的物质叫做碱。 酸碱中和反应的本质是: H+ + OH- = H2O
局限: ① ������ Arrhenius的酸碱理论仅限于水溶液,而未包 含非水溶液。 ② ������ Arrhenius的盐总是中性的,但是我们知道有 些盐是有酸碱性的。
若h 5%, [H ]和h可作近似计算。
• 把以上近似计算推广到一般:
c盐 Kh
• 当 h 5%, 即
400
[OH ] • 浓度为c盐的一元弱酸强碱盐溶液中,
Kh c盐
• 浓度为c盐的一元弱碱强酸盐溶液中, [ H ]
c盐 Kh
Kh c盐
• 当
400,即h 5%时, 必须解一元二次方程求 [H ]或[O H ]
4.3.4 盐类水解
4.3.4.1.
弱酸强碱盐 4.3.4.2.弱碱强酸盐 4.3.4.3. 一元弱酸弱碱盐 4.3.4.4.多元弱酸强碱盐 4.3.4.5.多元弱酸酸式盐 4.3.4.6.影响盐类水解的因素及应用
概念:盐的水解、水解常数、水解度
盐类水解:盐电离出的离子与水电离出的 H+离子或OH-离子结合生成弱酸或弱碱,
从而使溶液酸碱性发生改变的反应。
K 水解常数: 水解反应的标准平衡常数 h 水解度h:水解反应的转化率
c0 ceq 水解了的盐的浓度 h 100% 100% 盐的初始浓度 c0
盐类在水中也有酸碱性
类型
弱酸强碱盐水解 弱碱强酸盐水解
酸碱性
溶液显碱性 溶液显酸性
PH
举例
强酸强碱盐不水解 溶液显中性 水解后溶液 的酸碱性由 对应的弱酸 弱碱的相对 强弱决定
Kw [HAc][O H ] K h ( Ac ) [Ac ] K a (HAc)
NH (aq) H2O(l)
h
4
4
NH3 H2O(aq) H (aq)
w
[H ][NH3 ] K K (NH ) [NH4 ] K b (NH3 )
4.3.5 酸碱理论的发展
醋蝎的防御武器
醋蝎的秘密武
器是酸雾,其中 含有84%的醋酸, 以及辛酸和水
混入辛酸可以
增强醋酸的威力, 因为醋酸挥发性 太强,容易散开
醋蝎,又称鞭尾蝎,在受 到侵扰时,会从腹后部喷 射出雾状醋酸来御敌
醋蝎只在防御
时使用酸雾喷射 器,而不在捕食 时使用
酸与碱
为何要定义酸和碱?
4 2
HCO , H 2 O, HS 等。
3
课堂练习
P91 4.25
4.26
① 酸碱电离反应的本质是质子转移。 HF(aq) H+ + H2O(l) HF(aq) + H2O(l) 碱(2) 酸(1) H+ + F-(aq) H3O+(aq) H3O+(aq) + F-(aq) 酸(2) 碱(1)
酸
HAc H 2 PO HPO NH
4 2 4 4
H+ +碱
H Ac 2 H HPO4
3 H PO 4
H NH 3 H CH 3 NH 2 H [Fe(OH)(H 2 O) 5 ]
[CH 3 NH 3 ] [Fe(H 2 O) 6]
3
酸和碱最早起源于古希腊人对物质的分类,酸 (acids)味酸,而碱(bases)能消除酸味,所 以酸碱的概念一直是相互联系的。 后来人们发现酸还具有其它性质,例如酸能使石 蕊变色,还能腐蚀金属。 碱的最早名称是alkaline,是一个具有阿拉伯语 词根的单词,意为“烘烤”,因为第一个碱来自 于草木灰的萃取物。
SnCl 2 H 2 O Bi(NO3 ) 3 H 2 O SbCl 3 H 2 O
Sn(OH)Cl(s ) HCl BiONO3 (s) 2HNO3 SbOCl(s) 2HCl
“肥皂水是碱性的,洗衣粉溶液是酸性的,两者 不能混用”?
C17H35COONa
脂肪酸钠
十二烷基苯磺酸钠
② 水是两性物质,它的自身电离反应 也是质子转移反应。
H+
H2O(l)+H2O(l) 酸(1) 碱(2)
H3O+(aq) +OH-(aq) 酸(2) 碱(1)
4
5 K (NH H O) 1 . 8 10 b 3 2
4.3.4.4.多元弱酸强碱盐
如Na3PO4的水解,是酸性还是碱性?
PO (aq) H2O (l)
K h,1
3 4
HPO (aq) O H (aq)
2 4
14 K 1 . 0 10 2 w 2 . 2 10 K a,3 4.5 1013
14 K 1 . 0 10 12 w 1.5 10 3 K a,1 6.7 10
多元弱酸强碱盐也呈碱性,它们的水解都是分步 进行的。
对于H3PO4
K K K a,1 a,2 a,3
对于 PO
3 4
Kh,1 Kh,2 Kh,3
即 c(O H ) 0.037mol L1
3
x 0.037
pH 14 pO H 14 ( lg0.037) 12.57
4.3.4.5.多元弱酸酸式盐 如NaH2PO4(s)加入水中,是酸性还是碱性? Na2HPO4呢?
H2 PO4 (aq) H2O (l) 2 HPO4 (aq) H3O (aq)电离
4.3.4.3. 一元弱酸弱碱盐 NH4 Ac(s) NH4 (aq) Ac (aq)
NH4 (aq) Ac (aq) H2O(l)
NH3 H2O(aq) HAc(aq)
5 K (HAc) 1 . 8 10 a
K K a b 中性 NH 4 Ac
