2021届高考二轮习题复习专题七 化学反应与能量变化 教师版
(7)化学反应历程与能量变化——2021年高考化学真题模拟试题
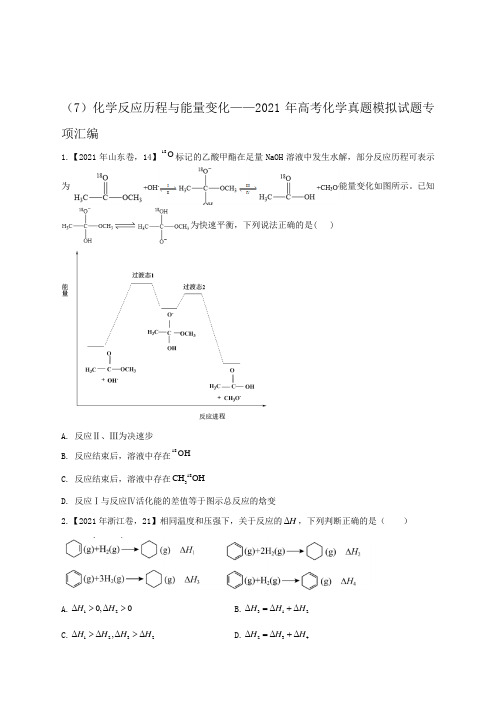
(7)化学反应历程与能量变化——2021年高考化学真题模拟试题专项汇编1.【2021年山东卷,14】18O 标记的乙酸甲酯在足量NaOH 溶液中发生水解,部分反应历程可表示为能量变化如图所示。
已知为快速平衡,下列说法正确的是( )A. 反应Ⅱ、Ⅲ为决速步B. 反应结束后,溶液中存在18-OHC. 反应结束后,溶液中存在183CH OHD. 反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变2.【2021年浙江卷,21】相同温度和压强下,关于反应的ΔH ,下列判断正确的是( )A.12Δ0,Δ0H H >>B.312ΔΔΔH H H =+C.1232ΔΔ,ΔΔH H H H >>D.234ΔΔΔH H H =+3.【2021年湖南卷,14】铁的配合物离子(用[L Fe H]+--表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:下列说法错误的是( ) A.该过程的总反应为22HCOOHCO H ↑+↑催化剂B.H +浓度过大或者过小,均导致反应速率降低C.该催化循环中Fe 元素的化合价发生了变化D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定4.【2021年湖南省邵阳市第二中学高三第一次自主调研,9】中国科学院化学研究所报道了化合物1催化2CO 氢化机理。
其机理中化合物1(催化剂,固态)→化合物2(中间产物,固态)的过程和其相对能量曲线如下图所示。
下列说法错误的是( )A.化合物1与2CO 反应生成化合物2的过程中有两个过渡态1-21-2TS1TS2、,说明这一过程包含两个基元反应B.图中l-2Ⅰ与化合物2互为同分异构体C.过程①的活化能高于过程②的活化能D.过程①的热化学方程式为:()()()121-2I s +CO g =I s ?Δ 2.08kJ mol H -= 5.【2021年山东省临沂市四县高考模拟训练,14】二氟卡宾(2:CF )作为一种活性中间体,一直受到有机氟化学研究工作者的高度关注。
2021届高考化学二轮复习化学反应与能量变化课件(53张)

氢氧极性键生成,错误;D项,由示意图可知,步骤④的能垒最大,E正=1.86 eV-
(-0.16 eV)=2.02 eV,错误。
高考 · 经典再研
突破 · 核心整合
模拟 · 对点演习
高考 · 经典再研
突破 · 核心整合
模拟 · 对点演习
考向一 化学反应中能量的变化与图像分析 1.(2020天津耀华中学一模)为减少温室气体的排放,科学家研究出以TiO2为催 化剂的光热化学循环分解CO2的反应,该反应机理及各分子化学键完全断裂 时的能量变化如下图所示。
高考 · 经典再研
突破 · 核心整合
模拟 · 对点演习
解析
中和反应的反应热的单位应该是kJ·mol-1,故A错误;中和反应为放
热反应,反应的ΔH小于0,故B错误;如果是1 mol二元强酸和1 mol二元强碱反
应,则放出的热量不为57.3 kJ,故C错误;NH3·H2O是弱电解质,电离需要吸收热
量,故稀氨水与稀盐酸反应生成1 mol水放出的热量小于57.3 kJ,D正确。
ΔH=-30 kJ/mol
高考 · 经典再研
突破 · 核心整合
模拟 · 对点演习
解析 由题图信息可知,该反应中,在光能和热能的作用下,二氧化碳发生 了分解反应,光能和热能转化为化学能,A正确;该过程中二氧化碳发生了分解 反应:2CO2(g) 2CO(g)+O2(g),属于氧化还原反应,故有电子转移,B不正确; 催化剂不能改变反应的焓变,但是可以降低反应的活化能,故使用TiO2作催化 剂可以提高化学反应速率,C不正确;化学反应的焓变等于反应物的键能总和 与生成物的键能总和的差,ΔH=2×1 598 kJ/mol-2×1 072 kJ/mol-496 kJ/mol= +556 kJ/mol,则分解CO2反应的热化学方程式为2CO2(g) 2CO(g)+O2(g) ΔH =+556 kJ/mol,D不正确。
2021届高三化学三轮复习 全国II卷—化学反应与能量

2021届高三化学三轮复习 全国II 卷—化学反应与能量1.硅烷是一种易自燃的气体,用晶体硅和氢气合成硅烷的能量变化如图所示(图中a b c 、、均为正值)。
下列说法错误的是( )A.合成硅烷的热化学方程式为1243Si(s)2H (g)SiH (g)ΔkJ mol H c -+==-⋅B.总反应的活化能为1()kJ mol a b -+⋅C.Si —H 键的键能为1kJ mol 4a b c -++⋅D.4CH 中C —H 键的键能小于4SiH 中Si —H 键的键能2.2BeCl 是有机反应的催化剂。
铍和氯气反应的能量变化如图所示。
下列说法正确的是( )A.2E 是正反应的活化能B.该反应的0H ∆<C.加入催化剂,H ∆减小D.21E -E3.已知下列热化学方程式: ①22(,)O (g)CO (g)C s +石墨 11393.5kJ mol H -∆=-⋅②2222H (g)O (g)2H O(l)+ 12571.6kJ mol H -∆=-⋅③4222CH (g)2O (g)CO (g)2H O(l)++ 13890.3kJ mol H -∆=-⋅则242C(s,)4H (g)2CH (g)H +∆=石墨( )A.174.8kJ mol -+⋅B.1159.6kJ mol --⋅C.174.8kJ mol --⋅D.1149.6kJ mol --⋅4.向23Na CO 溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是( )A.反应()322HCO aq H (aq)CO (g)H O(l)-++=+为放热反应B.2322CO (aq)2H (aq)CO (g)H O(1)-++=+123H H H H ∆=∆+∆+∆C.12H H ∆>∆,23H H ∆<∆D.2322H CO (aq)CO (g)H O(1)=+,若使用催化剂,则3H ∆变小 5.用4CH 催化还原2NO 可以消除氮氧化物的污染,例如: ①14222CH (g)4NO (g)4NO(g)CO (g)2H O(g)574kJ mol H -+=++∆=-⋅②14222CH (g)4NO(g)2N (g)CO (g)2H O(g)1160kJ mol H -+=++∆=-⋅下列说法不正确的是( )A.由反应①可知14222CH (g)4NO (g)4NO(g)CO (g)2H O(1)574kJ mol H -+=++∆>-⋅B.反应①②转移的电子数相同C.若用标准状况下44.48L CH 还原2NO 至2N ,放出的热量为173.4kJD.若用标准状况下44.48L CH 还原2NO 至2N ,整个过程中转移的电子总物质的量为1.6mol 6.已知:①12222H (g)O (g)2H O(1)571.6kJ mol H -+=∆=-⋅②132222CH OH(1)3O (g)2CO (g)4H O(1)1452kJ mol H -+=+∆=-⋅③12H (aq)OH (aq)H O(1)57.3kJ mol H +--+=∆=-⋅则下列说法正确的是( )A.2H (g)的摩尔燃烧焓为1571.6kJ mol -⋅B.124242111H SO (aq)Ba(OH)(aq)BaSO (s)H O(1)57.3kJ mol 222H -+=+∆=-⋅C.等质量的2H (g)和3CH OH(l)完全燃烧生成2CO 和液态水,2H (g)放出的热量多D.22mol H (g) 在足量氧气中完全燃烧生成气态水放出的热量大于571.6kJ 7.用4CH 催化还原NO x ,可以消除氮氧化物的污染。
高中化学 (新高考)2021届高考二轮精品专题七 化学反应与能量变化 学生版

能源问题已成为全球性的热点问题,这几年高考中该类试题的数目呈上升趋势,考查的内容不断拓展,难度有所提高,过去以考查热化学方程式的书写、燃烧热、中和热等概念及热量计算为主,近两年对化学键与能量的关系、盖斯定律进行了不同程度的考查。
反应热是近几年高考的重点考查内容之一,考查的内容主要有:①热化学方程式的书写及正误判断;①比较反应热的大小;①有关反应热的简单计算(应用盖斯定律计算反应热);①化学键键能与反应热、反应热与能源的综合考查。
①.客观题(1)结合图像考查对反应热、吸热反应、放热反应的理解。
(2)考查热化学方程式的正误判断以及ΔH 的计算及比较。
①.主观题化学反应原理题中根据盖斯定律书写热化学方程式、计算反应热等。
一、反应中能量的变化1.基本概念:①反应热:在化学反应过程中放出或吸收的热量。
反应热用符号“ΔH ”表示。
单位“kJ/mol”。
①吸热反应和放热反应:在化学反应过程中,通常用E 反表示反应物所具有的总能量,E 生表示生成物所具有的总能量。
①若E 反>E 生,为放热反应;当ΔH 为“-”或ΔH <0。
①若E 反<E 生,为吸热反应;当ΔH 为“+”或ΔH >0。
2.吸热反应和放热反应的判断方法(1)根据反应类型判断:通常情况下燃烧反应、中和反应、金属和酸反应制氢气的反应为放热反应;电解质的电离、盐类水解、大多数的分解反应等为吸热反应。
若正反应为吸热反应,则逆反应为放热反应。
(2)由物质的聚集状态判断:同种物质的聚集状态不同,其本身具有的能量也不相同。
一般情况下:气态物质所具有的能量大于液态,液态具有的能量大于固态;物质处与稳定状态的能量小于不稳定状态的能量。
如:硫蒸气在氧气中完全燃烧放出的能量大于固态硫完全燃烧放出的能量。
石墨比金刚石稳定,所以由石墨命题趋势考点清单专题 七 ××化学反应与能量变化转化为金刚石的反应为吸热反应。
(3)由盖斯定律判断:如一个反应可分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同,通过化学反应的能量变化值来进行计算,若ΔH>0,则反应为吸热反应,反之则为放热反应。
2021年高考化学选修四一轮复习题7:化学反应与能量的变化

2021年高考化学选修四一轮复习题7:化学反应与能量的变化一、选择题(每小题4分,每小题有1~2个正确选项,共44分)1.反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少了0.6 mol·L-1。
下列叙述正确的是()A.用A表示的反应速率是0.4 mol·(L·min)-1B.分别用B、C、D表示反应的速率,其比值是3∶2∶1C.在2 min末的反应速率,用B表示是0.3 mol·(L·min)-1D.在这2 min内B和C两物质的浓度都减小解析:A为固体,一般不用固体表示化学反应速率,因为固体的浓度一般视为常数,A项错误;在同一反应中,不同物质表示的化学反应速率的比值等于它们的化学计量数之比,B项正确;v(B)=0.3 mol·(L·min)-1为平均值并非2 min末的速率,C项错误;B为反应物,C为生成物,两者不可能同时减小,D项错误。
答案:B2.在一定条件下,将A2和B2气体通入1 L密闭容器中,反应按下式进行:m A2+n B22C,2 s内反应速率如下:v(A2)=0.5 mol·L -1·s-1,v(B2)=1.5 mol·L-1·s-1,v(C)=1 mol·L-1·s-1,则m和n的值分别为()A.2、3B.3、2C.3、1 D.1、3解析:对同一化学反应,用不同物质表示的化学反应速率之比等于化学方程式中相应物质的化学计量数之比,所以m∶n∶2=v(A2)∶v(B2)∶v(C)=0.5 mol·L-1·s-1∶1.5 mol·L-1·s-1∶1 mol·L-1·s -1=1∶3∶2,故m和n的值分别为1、3。
答案:D3.反应m A(g)+n B(g)===w C(g)中,在同一时间段内测得:A 每分钟减少0.15 mol·L-1,B每分钟减少0.05 mol·L-1,C每分钟增加0.1 mol·L-1,则下列叙述正确的是()A.在体积和温度不变的条件下,随着反应的进行,压强逐渐增大B.化学计量数之比是m∶n∶w=3∶1∶2C.单位时间内反应物浓度的减少等于生成物浓度的增加D.若在前10 s内A减少了x mol,则在前20 s内A减少了2x mol 解析:根据反应物、生成物浓度的变化之比等于化学方程式中化学计量数之比可知A和C均错误。
全国通用近年高考化学大二轮复习选择题专项训练七化学反应中的能量变化(2021年整理)

(全国通用版)2019版高考化学大二轮复习选择题专项训练七化学反应中的能量变化编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((全国通用版)2019版高考化学大二轮复习选择题专项训练七化学反应中的能量变化)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(全国通用版)2019版高考化学大二轮复习选择题专项训练七化学反应中的能量变化的全部内容。
选择题专项训练七化学反应中的能量变化1.下列说法中不正确的是()A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多B.从C(石墨,s)C(金刚石,s)ΔH=+1。
9 kJ·mol-1,可知石墨比金刚石更稳定C.在稀溶液中:H+(aq)+OH—(aq)H2O(l)ΔH=-57.3 kJ·mol-1,若将含0。
5 mol H2SO4的浓硫酸与1 mol NaOH溶液混合,放出的热量大于57。
3 kJD.反应H2(g)+F2(g )2HF(g) ΔH=-270 kJ·mol—1,说明在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量2。
在25 ℃、101 kPa时一些烷烃的燃烧热如下表:化合物燃烧热ΔH/(kJ·mol—1)化合物燃烧热ΔH/(kJ·mol—1)甲烷—890.31正丁烷-2 878。
0乙烷—1 559.8异丁烷—2 869。
6丙烷—2 219.9异戊烷—3 531.3下列说法正确的是()A.热稳定性:正丁烷>异丁烷B。
正戊烷的燃烧热ΔH大约是-3 540 kJ·mol—1C.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g) 4CO2(g)+6H2O(g) ΔH=-1 559。
2021届高三化学二轮复习——化学能与热能学案及分类训练

2021届高三化学二轮复习——化学能与热能学案及分类训练核心知识梳理1.理解化学反应热效应的两种角度(1)从微观的角度说,是旧化学键断裂吸收的能量与新化学键形成放出的能量的差值,如下图所示:a表示旧化学键断裂吸收的能量;b表示新化学键形成放出的能量;c表示反应热。
(2)从宏观的角度说,是反应物的总能量与生成物的总能量的差值,在上图中:a表示活化能;b表示活化分子结合成生成物所释放的能量;c表示反应热。
2.反应热的量化参数3.燃烧热、中和热的比较燃烧热中和热相同点能量变化放热ΔH及其单位ΔH<0,单位均为kJ·mol-1不同点反应物的量 1 mol不一定为1 mol生成物的量不确定生成液态水的物质的量为1 mol反应热的含义25 ℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量在稀溶液里,酸与碱发生中和反应生成1 mol H2O时所放出的热量表示方法燃烧热ΔH=-a kJ·mol-1(a>0)强酸与强碱反应的中和热ΔH=-57.3 kJ·mol-14.ΔH计算的几种方法(1)从宏观角度分析计算ΔH=H1(生成物的总能量)-H2(反应物的总能量)(2)从微观角度分析计算ΔH=E1(反应物的键能总和)-E2(生成物的键能总和)(3)从活化能角度分析计算ΔH=E1(正反应的活化能)-E2(逆反应的活化能)(4)根据盖斯定律计算计算步骤(5)根据反应过程中的热量变化Q计算ΔH=+(-)Qn kJ·mol-1分类训练角度一反应热的基本概念、能量图像1我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如图。
2021年高三化学复习:反应与能量变化测试 含答案

2021年高三化学复习:反应与能量变化测试含答案一、选择题1.下列叙述正确的是().A、化学反应除了生成新的物质外,还伴随着能量的变化B、物质燃烧一定是放热反应C、放热的化学反应不需要加热就能能发生D、吸热反应不加热就不发生2. 下列变化属于吸热反应的是().①液态水气化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰与水反应生成熟石灰⑥水煤气反应⑦二氧化碳与赤热的炭反应生成一氧化碳A.①④⑦B.②③⑥C. ①④⑤D.②④⑥⑦3.已知:H2(g)+F2(g) =2HF(g) △H=-270 kJ/mol,下列说法正确的是().A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJB.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJC.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量4.已知:①1 mol H2分子中化学键断裂时需要吸收 436kJ 的能量②1 mol Cl2分子中化学键断裂时需要吸收 243kJ 的能量③由H原子和Cl原子形成1mol HCl分子时释放 431kJ 的能量则下列叙述正确的是().A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g) + Cl2(g) = 2HCl(g)B.氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H = 183kJ/molC.氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H =-183kJ/molD.氢气和氯气反应生成 1 mol 氯化氢气体,反应的△H =-183kJ/mol5.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为().A.920 kJ B.557 kJ C.436 kJ D.188 kJ6.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(、均为正值):有关上述反应的叙述正确的是().A.Q1>Q2 B.生成物总能量均高于反应物总能量C.生成1 mol HCl气体时放出Q1热量D. 1mol HBr(g)具有的能量大于1mol HBr(1)具有的能量7. 分析右面的能量变化图,判断下列选项中正确的是().A. 2A(g)+B(g) ===2C(g) △H<0B. 2A(g)+B(g) ===2C(g) △H>0C. 2A+B===2C △H<0D. 2C ===2A+B △H<08.下列各图中表示正反应是吸热反应的图是().9.在烃分子中去掉2个氢原子变成碳碳双键是吸热反应,而1,3-环己二烯失去了2个氢原子,变成苯是放热反应,根据以上信息判断下列问题正确的是( ).A.1,3-环己二烯比苯稳定B.苯比1,3-环己二烯稳定C.1,3-环己二烯加氢是吸热反应 D.苯加氢生成环己烷是吸热反应10.化学反应N2+3H2= 2NH3的能量变化如题13图所示,该反应的热化学方程式是( ). A.N2(g)+3H2(g) = 2NH3(l);⊿H = 2(a—b—c)kJ·mol-1B. N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2(b—a)kJ·mol-1C.N2(g)+H2(g) = NH3(l) ;⊿H = (b+c—a)kJ·mol-1D.N2(g)+H2(g) =NH3(g) ;⊿H = (a+b)kJ·mol-111.已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g )2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)().A.一定大于92.0 kJ B. 一定等于92.0 kJ C. 一定小于92.0 kJ D. 不能确定12.热化学方程式C(s)+H2O(g)CO(g)+H2(g);△H =+131.3kJ/mol表示()A.碳和水反应吸收131.3 kJ能量B.1 mol碳和1 mol水反应生成一氧化碳和氢气,并吸收131.3 kJ热量C.1 mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3 kJD.1个固态碳原子和1分子水蒸气反应吸热131.1 kJ二.填空题13.红磷 P (s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g)。
