第 3 章 1 着火理论
消防工程 - F-K自燃着火理论

第三节 F-K自 燃着火理论
一、基本出发点及
简化假设 二、导热微分方程
及着火条件分析*
三、应用分析
引入下列无因次温度θ 和无因次距离x1、y1、 z1:θ = (T-Ta)/(RT 2a/E);x1=x/xo,y1=y/yo, z1=z/zo。这里xo、yo、zo是体系的特征尺寸,分别 定义为体系在x、y、z轴方向上的长度。由此整理 得:
为便于分析,作如下假设: 1、反应速率由Arrimus方程描述,即:
反应热、指数前因子、反应物浓度、反应活化能和 气体常数,T为当地温度。
2、物质着火前,反应物消耗量很小,可假定反 应物浓度CAO为常数; 3、体系的Bi数相当大,因此可假定体系的边界 温度与外界环境温度Ta相等; 4、体系的热力参数为常数,不随温度改变。
第三节 F-K自 燃着火理论
cr Ta2,cr
2 x0 C
(3-26) 此式表明,对特定的物质,右边第一项 n ln(EΔ HcKnC AO/KR)为常数,ln(δ crT 2a,cr/x 2oc)是 1/Ta,cr的线性函数。对于许多系统,这种线性关系 是成立的。对于给定几何形状的材料,Ta,cr和x0c (即试样特征尺寸)之间的关系可通过试验确定。例如, 将一个立方形材料试样置于一个恒温炉内加热升温并 用热电偶在材料的中心检测温度,就能测出给定尺寸 试样在不同温度下自身加热的程度或着火趋向。对每 一定尺寸立方体(边长为2x0),通过实验可获得
第三节 F-K自 燃着火理论
一、基本出发点及
简化假设* 二、导热微分方程 及着火条件分析 三、应用分析
第三节 F-K自 燃着火理论
一、基本出发点及
简化假设*
图3-7 自动加热体系内的温度分布示意图
第三章_着火理论

西安交通大学能源与动力工程学院
6
热着火过程与链式着火过程区别——热着火通常比链式着 火过程强烈得多。 热着火过程:温度升高引发的,将使得系统中整体的分子动 能增加,超过活化能的活化分子数按指数规律增加。导致 燃烧反应自动加速。 链式着火过程:主要是活化中心局部增加并加速繁殖引起的, 由于活化中心会被销毁,所以链式着火通常局限在活化中 心的繁殖速率大于销毁速率的区域,而不引起整个系统的 温度大幅度增加,形成“冷焰”。但是,如果活化中心能 够在整个系统内加速繁殖并引起系统能量的整体增加,就 形成爆炸。
西安交通大学能源与动力工程学院
12
3.2 热自燃理论
一、热自燃条件
以封闭容器内可燃物质的着火过程为例,来分析热自燃问题。
为使问题简化,作如下假设: 1. 只有热反应,不存在链式反应; 2. 容器的体积V和表面积F为定值; 3. 容器内的参数(如温度浓度等)处处相同; 4. 容器与环境之间仅存在对流换热,α为定值; 5. 可燃物质的反应热Q为定值; 6. 在整个着火过程中,可燃物质浓度变化很小, 视作不变; 7. 反应开始时,系统温度和容器壁温与环境温 度T0相同; 8. 反应过程中,系统的温度为T,容器壁温与 可燃物质温度相同,均为T。;
燃烧和爆炸理论重点

第三章 物质的燃烧
预混气中火焰的传播理论:火焰(即燃烧波)在预混气中传播,从气体动力学理论可以证明存在两种传播方式:正常火焰传播和爆轰。
(Ⅰ)区是爆轰区。特点:①燃烧后气体压力要增加 ②燃烧后气体密度要增加 ③ 燃烧波以超音速进行传播
(Ⅲ)区是正常火焰传播区。 特点:① 燃烧后气体压力要减少或接近不变;② 燃烧后气体密度要减少; ③ 燃烧波以亚音速(即小于音速)进行传播。
火焰前沿的特点:(1)火焰前沿可以分成两部分:预热区和化学反应区。 (2)火焰前沿存在强烈的导热和物质扩散。
火焰传播机理:(1)火焰传播的热理论:火焰能在混气中传播是由于火焰中化学反应放出的热量传播到新鲜冷混气中,使冷混气温度升高,化学反应加速的结果。
(2)火焰传播的扩散理论:凡是燃烧都属于链式反应。火焰能在新鲜混气中传播是由于火焰中的自由基向新鲜冷混气中扩散,使新鲜冷混气发生链锁反应的结果。
可燃物质在空气充足的条件下,达到一定温度与火源接触即行着火,移去火源后仍能持续燃烧达5min以上,这种现象称为点燃。
在无外界火源的条件下,物质自行引发的燃烧称为自燃。
物质自燃有受热自燃和自热燃烧两种形式。
受热自燃的两个条件:外部热源、有热量积蓄的条件
自热自燃的三个条件:必须是比较容易产生反应热的物质; 此类物质要具有较大的比表面积或是呈多孔隙状的,有良好的绝热和保温性能;热量产生的速度必须大于向环境散发的速度。
爆燃是一种燃烧过程,反应阵面移动速度低于未反应气体中的声速,反应阵面主要通过传导和扩散进入未反应气体中。爆燃是一种带有压力波的燃烧,爆燃发生时,反应阵面的传播速度低于声速。
爆轰的反应阵面移动速度比未反应气体中的声速高。对爆轰来说,主要通过压缩反应阵面前面的未反应气体使其受热,从而使反应阵面向前传播。
南京工业大学燃烧与爆炸理论-第三章--物质的燃烧

图3-8 氢气浓度对火焰传播速度Sl的影响 图3-9 CO浓度对火焰传播速度的影响
(H2 + 空气)
(CO + 空气)
4.惰性气体
• 惰性气体加入量越多,火焰传播速度越小。
5.混气性质
• 主要是指混气的热容CP和导热系数 。
二、液体燃烧速度
(一)液体燃烧速度表示方法
• 燃烧线速度(V)
VH t
• 重量燃烧速度
G g st
二、液体燃烧速度
• 液体燃烧重量速度与线速度关系
G vd 1000
(二)影响液体燃烧速度的因素
• 燃烧区传给液体的热量不同,燃烧速度 不同;
• 液体初温越高,燃烧速度越快; • 液体的燃烧速度随着贮罐直径不同而不
2.火焰传播速度
另外: P
于是:
Sl
n2
Pn2
n 1
P2
公式意味着对于二级反应,火焰传播速度Sl将与压力
无关。
大多数碳氢化合物与氧的反应,其反应级数接近2,
因此火焰传播速度Sl与压力关系不大,实验也证明了
这个结论。
2.火焰传播速度
• 应该指出这一理论还不完善,例如未燃 混气初温如果等于这里的着火温度,则 火焰传播速度为无穷大,这显然是错误 的。
(二)油罐内油品燃烧火焰的特征
1.火焰的倾斜度 • 油罐内油晶燃烧的火焰呈锥形,锥形底
就等于燃烧油罐的面积; • 当风速等于或大于4.0m/s时。火焰的
倾斜角约为60°—70°; • 在无风时,火焰倾斜角为0°~15°。
2.火焰高度
• 油罐火灾的火焰高度取决于油罐直径和 油罐内储存的油品种类。
第三章着火的基本理论习题(共28题)

第三章着火的基本理论习题(共28题)l.可燃物的着火可分几类?各有何特点?体系具备着火条件是否就一定在着火?2.热自燃理论的假设条件和基本出发点是什么?3.什么叫做放热速度?什么叫做散热速度?用公式如何表达它们?并利用放热曲线和散热曲线的位置关系,分析说明谢苗诺夫热自燃理论中着火的临界条件.4.某系统的产热曲线和散热曲线如图所示,试用作图法求:(l)改变系统的散热条件时,系统的自燃点(2)改变系统的坏境条件时,系统的自燃点.这两个自燃点是否相同?如果同,说明什么问题?5.什么叫做着火感应期?可燃体系在着火之前为什么会出现着火感应期?影响着火感应期的因素有哪些?它们分别是如何影响的?6.什么叫做自燃点?自燃点与临界环境温度有何关系?假设可燃混气的反应活化能为16OKJ/mo1,系统达到自燃温度时环境温度为500℃,试求该可燃混气的自燃点是多少?7.在热着火理论中,存在哪些自燃着火极限?这些自燃着火极限是如何得出的?(结合图示说明)8.可燃物的热自燃主要受哪些因素影响?它们分别是如何产生影响的?9.在F-K自燃理论中,自热体系的着火判断准则是什么?该理论与Semenov自燃理论有什么区别?10.条件准数δ的物理意义是什么?自燃临界准则参数δcr取决于什么?δ和δcr的大小关系说明了什么?11.什么是F-K自燃理论的直线形式?它有哪些方面的具体应用?举例说明它在确定可燃物质的自燃火灾原因中的应用是如何实施的?12.各列出一例(写出反应式)说明以下三种情况下的单质或化合物的自燃:(1)与水反应自燃;(2)与空气接触自燃;(3)在摩擦或撞击的条件下自燃.13、某系统的产热曲线和散热曲线如图所示,试用作图法求:(l)改变系统的散热条件时, 系统的自燃点(2)改变系统的坏境温度时, 系统的自燃点.这两个条件下的自燃点是否相同? 为什么?14.与水作用自燃的物质,其自燃反应有那些共同特点?在该类物质的生产和储运过程中,应注意采取哪些安全措施?14.与空气作用及互相接触、摩擦或撞击能自燃爆炸的物质有那些共同特点?在该类物质的生产和储运过程中,应注意采取哪些安全措施?16.比较典型的煤的自燃理论有哪些?如何用固体表面吸附理论解释煤的自燃原理?影响煤自燃能力的因素有哪些?17.植物的自燃主要经历哪几个阶段?其自燃条件是什么?l8.试从化学反应机理上解释涂油物的自燃原理.19.何谓碘值?碘值的高低说明什么问题?碘值在什么范围的涂油物具有自燃能力?20.链锁反应有何特点?举例说明链锁反应的基本过程和类型.21.链锁反应着火理论的基本出发点是什么?链锁反应系统的着火条件是什么?α>1的链锁反应系统是否一定会发生着火爆炸?为什么?22.链锁反应的速度在系统处于低、中、高温时各具有什么特点?如何结合链锁反应理论解释氢-氧化学计量混合物一个温度可能对应两个、甚至三个着火(爆炸)压力极限?23.何谓强迫着火?它有什么特征?结合高温质附近可燃介质的温度分布情况分析高温质点引燃介质的条件?24.什么叫做电极熄火距离?什么叫做最小火花引燃能?电火花引燃混气的条件是什么?25.电火花引燃可燃混气的机理是什么?它可分为哪几个阶段?影响电火花引燃混气的因素有哪些?26.在考虑可燃混气浓度变化的条件下,散热曲线与放热曲线最多可能有几个交点,试分析这几个交点的工作情况.27.什么叫做灭火滞后?结合散热曲线与放热曲线的位置关系分析灭火条件,并说明在热着火理论中.有哪些灭火措施?在散热条件相同情况下.什么措施对灭火的作用更大?28.从链锁反应着火理论可以得出哪些灭火措施?灭火的关键是什么?。
安全课件第3章着火和灭火理论课件

一、着火方式 1.自燃:可燃物在无外部火源作用,因受热或自身发热并蓄热而发生燃烧的现象。 ①热自燃:均匀加热,T↗,达某一温度着火. ②化学自燃:化学反应产热,T↗ 2.点燃(引燃): 可燃物局部受高温热源加热,T↗发生燃烧的现象。
防火措施:隔热、密闭、防潮
(二)在空气中自燃的物质
赛璐璐
1.直接与空气中氧发生反应(1)黄磷(2)烷基铝(甚至可以与空气中水发生反应)
2.分解放出可燃气与氧气反应 硝化纤维及其制品
防火措施:隔热、密闭
一、易自燃的单质和化合物
(三)相互接触自燃的物质
强的氧化剂和强的还原剂相互接触
硫+氯酸钾红磷+氯酸钾
一、引燃与热自燃的区别(整体和局部加热 )
三、引燃条件 1.可燃物 2.助燃物 3.点火源
二、引燃过程 包括热量传递、物质形态变化和火焰传播等一系列过程
可燃物和助燃物要具备一定的数量和浓度 火源具备足够的能量、温度高于可燃物的自燃点
谢谢大家
(四)摩擦撞击能自燃的物质
防火措施: 1.分储分运 2.防止撞击和摩擦
一、易自燃的单质和化合物
二、煤、植物、涂油物
共同特点:发生缓慢氧化反应,放出热量;积热不散
氧化、聚合过程不断进行,放出热量,温度达到自燃点就可着火
第三节 链锁反应着火理论
一、链锁反应
(2)若保持温度不变(W2不变),增大系统的压力,由于自由基发生气相销毁,压力越高,气相销毁速度越大,当压力高于某一值时,W2<W3系统由爆炸变为不爆炸。出现第二极限
(3)继续增大压力时,可能发生新的链锁反应,使得W2>W3,系统由不爆炸变为爆炸。出现第三极限
第四节 着火感应期
第二节 典型物质的自燃
工程燃烧学_3

第三章着火第三章着火(自燃与引燃)本章重点内容:1. 两种着火机理2. 两种着火类型3. 自燃着火4. 强制着火5. 着火范围(燃烧界限)第三章着火(自燃与引燃)着火是一个从不燃烧到燃烧的自身演变或外界引发的过渡过程,是可燃混合气的燃烧化学反应逐渐加速到反应速度即放热速度极快的、形成火焰或爆炸的过程。
因此,着火过程是一个受到化学反应速度控制的过程。
火焰的熄火过程则与着火过程相反,它是一个从极快的燃烧化学反应到反应速度极慢,以至不能维持火焰的形成或几乎停止化学反应的过程,也是一个化学反应速度控制的过程。
第三章着火(自燃与引燃)除化学动力学控制的燃烧外,实际上不同的燃烧过程受控于不同的物理或化学过程。
在实际的燃烧中,需进行可燃混合气的制备,可燃混合气的预热,激化分子的传输以及化学反应等一系列的相互关联的过程,其中进行得慢的环节决定着燃烧速度。
第三章着火(自燃与引燃)3.1 燃烧反应过程中浓度与温度的关系反应速度与温度的关系常用Arrhenius指数项或简单的指数T m的关系式表示。
反应速度只受初始反应物浓度影响的反应为简单反应或热反应;反应速度受中间产物或最终产物浓度影响的为复杂反应或自催化反应。
研究链反应的最常见的方法是保持体系在反应时的恒定以消除热反应对反应发展的影响,其反应速度式则是以初始反应、中间反应及最终反应中参与反应的各种组分间相互作用的“反应机构”来分析,并且是经实验验证决定的。
/E RTe−第三章着火(自燃与引燃) 3.1 燃烧反应过程中浓度与温度的关系图3-1 简单等温反应速度的衰减情况第三章着火(自燃与引燃)3.1燃烧反应过程中浓度与温度的关系对于绝热火焰温度,设火焰最高温度为,也可推导出式(3.6)。
由于能量损失,较绝热火焰温度Tf为低。
式(3.5)可写成这就是说显焓与化学焓之和在整个过程中始终不变,与热力学第一定律相吻合。
T∞V A V0A0V Ac T+H C c T H C c H Cρρρ∞∞Δ⋅=+Δ⋅=+Δ⋅T∞第三章着火(自燃与引燃) 3.1 燃烧反应过程中浓度与温度的关系图3-2 温升与反应物消耗间的关系第三章着火(自燃与引燃)3.2 着火条件3.2.1 热着火可燃混合剂在某一条件下由外界加热,如火花塞、热容器壁、压缩等,到达某一特定温度时,反应物在此温度下的放热速度大于散热损失的速度,则多余的热量使混合剂温度增高,然后又使反应速度增加,从而混合剂的温度得以连续加速地增高知道放热速度达到很高的数值,于是就发生“着火”燃烧。
燃烧学 复习重点
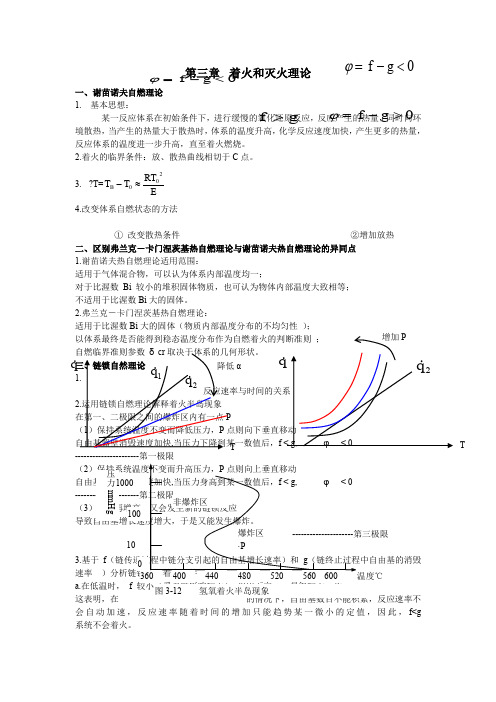
第三章 着火和灭火理论 一、谢苗诺夫自燃理论1. 基本思想: 某一反应体系在初始条件下,进行缓慢的氧化还原反应,反应产生的热量,同时向环境散热,当产生的热量大于散热时,体系的温度升高,化学反应速度加快,产生更多的热量,反应体系的温度进一步升高,直至着火燃烧。
2.着火的临界条件:放、散热曲线相切于C 点。
3.?T=ER 200B T T T ≈- 4.改变体系自燃状态的方法① 改变散热条件 ②增加放热二、区别弗兰克-卡门涅茨基热自燃理论与谢苗诺夫热自燃理论的异同点1.谢苗诺夫热自燃理论适用范围:适用于气体混合物,可以认为体系内部温度均一;对于比渥数 Bi 较小的堆积固体物质,也可认为物体内部温度大致相等;不适用于比渥数Bi 大的固体。
2.弗兰克-卡门涅茨基热自燃理论:适用于比渥数Bi 大的固体(物质内部温度分布的不均匀性 ); 以体系最终是否能得到稳态温度分布作为自燃着火的判断准则 ;自燃临界准则参数 δcr 取决于体系的几何形状。
三、链锁自然理论 1. 反应速率与时间的关系2.运用链锁自燃理论解释着火半岛现象在第一、二极限之间的爆炸区内有一点P(1)保持系统温度不变而降低压力,P 点则向下垂直移动自由基器壁消毁速度加快,当压力下降到某一数值后,f < g, φ < 0 ----------------------第一极限(2)保持系统温度不变而升高压力,P 点则向上垂直移动 自由基气相消毁速度加快,当压力身高到某一数值后,f < g, φ < 0 ----------------------第二极限 (3)压力再增高,又会发生新的链锁反应 导致自由基增长速度增大,于是又能发生爆炸。
----------------------第三极限3.基于f (链传递过程中链分支引起的自由基增长速率)和g (链终止过程中自由基的消毁速率 )分析链锁自燃着火条件 a.在低温时, f 较小(受温度影响较大),相比而言,g 显得较大,故: 这表明,在 的情况下,自由基数目不能积累,反应速率不会自动加速,反应速率随着时间的增加只能趋势某一微小的定值,因此,f<g 系统不会着火。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1)方程的解完全受x0/y0,x0/z0和δ控制 2)当物体的形状确定后,其解,即稳态温度分布仅取决于δ的值。
n 2 H c KnCAO Ex0 E / RTa e 2 KRTa
3)δ表征物体内部化学放热和通过边界向外传热的相对大小。 4) 当δ大于某一临界值δcr时,方程无解,即物体内部不能得到稳态温度分布,
改变体系自燃状态的方法
增加P
q
q1
降低α
q2
q
q2
T
T
① 改变散热条件
②增加放热
二、谢苗诺夫自燃理论的应用
着火感应期 着火极限
浓度极限 压力极限 温度极限
着火感应期的直观意义:混合气由开始化学反应到燃烧出 现所经历的时间。
热理论中的着火感应期:当混合气系统已经达到着火条件 的情况下,由初始状态达到温度骤升的瞬间所需的时间。
e
E RT
e
E R (T Ta Ta )
e
(
(T Ta ) 1 E )[1 ] RTa Ta
e
(
(T Ta ) E )[1 ] RTa Ta
T Ta
e
E / RTa
e
( RTa2 / E )
e E / RTa e
x0 2 2 x0 2 2 2 代入上式得: ( ) ( ) exp( ) 2 2 2 y0 y1 z0 z1 x1
RT02 T TB T0 , E
约为 ~20℃ 10
将 TB T0
RT ,代入 E
E
2 T0 RT0 R E
2 0
K 0QV C AC B e
E RTB
S TB T0
K 0QV C ACB Ee
RT02 S E
2. δcr的求解
如果物质以无限大平板,无限长圆柱体、球体和立方体等简单形
状堆积,则内部导热均可归纳为一维导热形式,则相应的稳态导 热方程式为:
d 2T dT Q ''' 0 2 x dx K dx
催化物质:催化物质可以降低反应的活化能,能加快反应速率。(当 然自燃点较高的物质添加少量的低自燃点的物质也认为是一种催化物 质) 比表面积:在散热条件相同的情况下,某种物质发生反应的比表面积 越大,则与空气中氧气的接触面积越大,反应速率越快,越容易发生 自燃。 新旧程度:氧化反应的物质,一般情况下,其表面必须是没有完全被 氧化的,即新鲜的才能自燃。 压力:体系所处的压力越大,也即参加反应的反应物密度越大,单位 体积产生的热量越多,体系越易积累能量,发生自燃。所以,压力越 大,自燃点越低。
就会自燃。
5)δcr仅取决于体系的外形 6)当达到δcr时,与体系有关的参数均为自燃的临界参数,此时的环境温度称 为临界环境温度Tacr,体系的尺寸为自燃的临界尺寸x0c
n 2 H c K nC AO Ex0c E / RTa ,cr cr e 2 KRTa ,cr
7)当δ <δcr,体系不自燃; δ >δcr,体系自燃; δ =δcr,自燃的临界状态
x
自热体系温度分布模型
F-K 自燃理论的基本出发点:
简化假设:
1. 理论分析
当体系不具备自燃条件时,得到稳态温度分布方程
2T 2T 2T Q ''' 0 2 2 2 K x y z
''' 式中 Q 为反应体系放热速率
温 度 T
n Q''' H c K n C A0 exp(E / RT )
为便于分析,引入无因次温度θ 和 无因次距离x1,y1,z1:
Ta
(T Ta ) / (RT / E)
2 a
-r
0
+r
距离
x1=x/x0, y1=y/y0,z1=z/z0 x0, y0, z0是体系的特征尺寸,分别定义为体系在x, y, z轴 方向上的长度
n 2 x0 2 2 x0 2 2 H c K nC AO Ex0 E / RT 2 ( ) ( ) e 2 2 2 2 y0 y1 z0 z1 KRT0 x1
K 0QV C AC B e
S TB T0
E RTB K 0QV C AC B e S 2 RTB
E
RTB2 2式相除,有 TB T0 E
4 RT0 E E TB 1 2R 2R E
RT02 E E 2 RT0 2 R 2T02 1 TB T0 2 2R 2R E E E
RT02 RT0 T0 T0 1 T0 E E
K 0QV C ACB E
SRT
2 0
e
E RT0
1, 热自燃的条件
V T0 f (k0 , Q, E , C; ) f (热力学因素;流体力学 因素) S T0 , TB不是可燃物的固有物理 常数
散热速率的影响因素
导热作用:可燃体系导热系数越小,则散热速率越小,体系越容易产 生中心蓄热,促进反应物的进行而导致自燃。 对流换热作用:从可燃体系内部经导热达到体系表面的热流由空气对 流换热带走。空气的流动对可燃体系起着散热作用,通风不良的场所 容易蓄热自燃。 堆积方式:大量堆积的粉末或叠加的薄片有利于蓄热,其中心部位近 似处于绝热状态,因而很容易自燃。评价堆积方式的参数是比表面积 /体积比,此值越大,散热能量越强,自燃点越高。
C f 0 C fB
b Hk0C a 0Cox 0e E / RTo f
0CV (TB T0 )
0CV (TB T0 )
Hk0C C e
a f0
E / RTo b ox 0
T0
2. 爆炸极限
爆炸浓度极限 如:甲烷/空气:5~15%
爆炸压力极限
如:甲烷/空气:小于0.065MPa,不爆炸
1. 着火感应期(也称为着火延迟时间、诱导期)
定义:体系的温度从T0自发升高到TB所需的时间
q
qg
ql1 q l2
T
ql 3
C
T03
T02
TC
T01 T01 T02 T03
T
03
02
t
C f 0 C fB W
0CV (TC T0 )
H
b W k0C a 0Cox0e E / RT0 f
化学自燃 热自燃 点燃(或称强迫着火)
自燃:可燃物在无外部火源作用下,因受热或自身发热 并蓄热而发生的燃烧的现象。
点燃引燃:可燃物局部受到火花、炽热物体等高温热源
的强加热作用而着火,然后依靠燃烧波传播到真个可燃
烧中。
三、着火条件
如果在一定的初始条件下,系统将不能在整个时间区段保持低 温水平的缓慢反应态,而将出现一个剧烈的加速的过度过程, 使系统在某个瞬间达到高温反应态,即达到燃烧态,那么这个 初始条件就是着火条件。
1. 基本思想: 某一反应体系在初始条件下,进行缓慢的氧化还原反应,反应产生 的热量,同时向环境散热,当产生的热量大于散热时,体系的温度 升高,化学反应速度加快,产生更多的热量,反应体系的温度进一 步升高,直至着火燃烧。
物理模型
T
其中:
T0
容器体积:V
容器表面积:S
环境温度:T0 对流换热系数:h
a b w k0C ACB e E / RT
a b q1 QVk 0C ACB e E / RT
q2 S (T T0 )
q1 q2 VC dT dt
dT q1 q2 dt VC
q
C
q1
q2
放热和散热曲线相切于B点——自 燃的临界状态
着火条件的函数表达式 f (T0 , h, P, d , u ) 0 :
着火过程 T
度反 应 速
T0--环境温度; h--对流换热系数; p--预混气压力; d--容器直径; u∞--环境气流速度
Ws
着火理论
一、谢苗诺夫自燃理论
二、谢苗诺夫自燃理论的应用
三、谢苗诺夫自燃理论的局限性
弗兰克-卡门涅茨基热自燃理论
适用于比渥数Bi大的固体(物质内部温度分布的不均匀性 ) 以体系最终是否能得到稳态温度分布作为 自燃着火的判断准则 稳态分析方法 自燃准则参数δ 自燃临界准则参数 δcr
y T
△Tmax △Tmax
y T
Ta
Ta
x (a)谢苗诺夫模型 (b)F-K模型
三、谢苗诺夫自燃理论的局限性
固体可燃物的自燃
Pc
氢/氧体系的着火“半岛”
烃类气体燃烧的“冷焰”现象
着 火
卤代烷的高效灭火性能
T0
3.3 弗兰克-卡门涅茨基热自燃理论
谢苗诺夫热自燃理论适用范围:
适用于气体混合物,可以认为体系内部温度均一; 对于比渥数 Bi 较小的堆积固体物质,也可认为物体内部温度大致相等。 不适用于比渥数Bi大的固体。
0.30MPa 280
0.40MPa 250
存在爆炸的浓度极限 温度升高,浓度极限范
围增大,反之减小。
温度下降至某一值,系 统失去爆炸性———存 在爆炸的温度极限
