人教版九年级化学下册10.2《酸和碱的中和反应》优秀课件
合集下载
《酸和碱的中和反应》PPT教学课件

2.处理工厂废水:工厂生产过程中产生的废 水需要进行一系列处理,如硫酸厂的废水可 加入熟石灰中和;
3.用于医疗:人胃液中含有适量盐酸,可以帮助消 化,但盐酸若过量则反而造成胃病,在这种情况 下,可以服用某些含碱性的药物如胃舒平中含 Al(OH)3,可以中和过量的胃酸;
蚊虫及其它很多昆虫分泌的毒液蚊酸呈酸性, 可以涂某些含碱性物质(如NH3·H2O)的药水,减 轻痛痒。
课题2 酸和碱的中和反应
-.
• 碱溶液中都含有OH-,酸溶液中都含有H+, • 酸和碱能否发生反应呢? • 你知道生活中哪些地方利用酸和碱的反应?
探索新知
一、中和反应
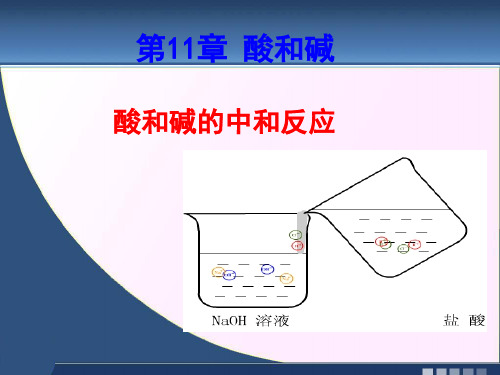
实验10如-8下图所示,在烧杯中加入约5mL稀 氢氧化钠溶液,滴入几滴酚酞溶液。用滴管慢慢 滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好 变成无色为止。
硫酸钠
氯化钙、硫酸钠这些由金属离子和 酸根离子构成的物质都属于盐。
• 思考:是中和反应吗?
• Fe2O3+6HCl=2FeCl3+3H2O • CO2+Ca(OH)2=CaCO3↓+H2O
二、中和反应在实际中的应用
1.改变土壤酸碱性:根据土壤情况,可以利用中 和反应,在土壤中加入酸性或碱性物质,调节 土壤酸碱性,如在酸性土壤中可以加入熟石灰 中和土壤酸性;
仔细观察微粒的变化
原来,稀盐酸中的 H+与氢氧化钠溶液里 的OH-结合生成水分 子。
NaOH+HCl=NaCl+
NaOH+HCl=NaCl+H2O
碱
酸盐
这种酸与碱作用生成盐和水的反 应,叫做中和反应。
CaH酸2O 2NaOH+氯H化2钙SO4= Na碱2SO4+酸2H2O
酸和碱的中和反应-课件.pptx

第9页/共14页
当堂测试
• 1.下列反应属于中和反应的是(BD) • A.2NaOH+CO2==Na2CO3+H2O • B.Cu(OH)2+H2SO4==CuSO4+2H2O • C.Fe2O3+6HCl==2FeCl3+3H2O • D.Ca(OH)2+2HCl==CaCl2+2H2O
第10页/共14页
• 2、中和反应在工农业生产和日常生活中有广泛的用途,下列应用与中和反应原理无关的是( ) • A. 服用含Al(OH)3的药物治疗胃酸过量 • B. 使用熟石灰改良酸性土壤 • C. 用熟石灰和硫酸铜配制波尔多液
C • D. 用NaOH溶液洗涤石油产品中的残余硫酸
第11页/共14页
3. 往稀盐酸中滴加氢氧化钠溶液至完全中和时为止,
生成盐和水的反应都是中和反应 吗? 中和反应是基本反应类型吗?
第6页/共14页
中和反应应用
1.改良土壤的酸碱性 中性土壤
熟石灰
酸性土壤
中性土壤
Ca(OH)2
第7页/共14页
2.处理工厂的废水
用碱性物质(例如熟石 灰)处理。
你能写出 化学方程 式吗?
Ca(OH)2 + H2 SO4 === CaSO4 + 2H2O
溶液的pH变化的图象正确的B 是( )
第12页/共14页
谢谢!
第13页/共14页
感谢您的观看!
第14页/共14页
氯化钙
H2SO4 + 2NaOH == Na2SO4+ 2H2O
硫酸钠
2HCl + Ba(OH)2 == BaCl2 + 2H2O
酸
当堂测试
• 1.下列反应属于中和反应的是(BD) • A.2NaOH+CO2==Na2CO3+H2O • B.Cu(OH)2+H2SO4==CuSO4+2H2O • C.Fe2O3+6HCl==2FeCl3+3H2O • D.Ca(OH)2+2HCl==CaCl2+2H2O
第10页/共14页
• 2、中和反应在工农业生产和日常生活中有广泛的用途,下列应用与中和反应原理无关的是( ) • A. 服用含Al(OH)3的药物治疗胃酸过量 • B. 使用熟石灰改良酸性土壤 • C. 用熟石灰和硫酸铜配制波尔多液
C • D. 用NaOH溶液洗涤石油产品中的残余硫酸
第11页/共14页
3. 往稀盐酸中滴加氢氧化钠溶液至完全中和时为止,
生成盐和水的反应都是中和反应 吗? 中和反应是基本反应类型吗?
第6页/共14页
中和反应应用
1.改良土壤的酸碱性 中性土壤
熟石灰
酸性土壤
中性土壤
Ca(OH)2
第7页/共14页
2.处理工厂的废水
用碱性物质(例如熟石 灰)处理。
你能写出 化学方程 式吗?
Ca(OH)2 + H2 SO4 === CaSO4 + 2H2O
溶液的pH变化的图象正确的B 是( )
第12页/共14页
谢谢!
第13页/共14页
感谢您的观看!
第14页/共14页
氯化钙
H2SO4 + 2NaOH == Na2SO4+ 2H2O
硫酸钠
2HCl + Ba(OH)2 == BaCl2 + 2H2O
酸
九年级化学人教版下册-10.2 酸和碱的中和反应-课件

说明 了什么?
●回答:因为氢氧化钠和盐酸反应被消耗, 这说明了盐酸和氢氧化钠能发生化学反应。
●思考:什么时候盐酸和氢氧化钠恰好完全 反应? ●当滴加盐酸到溶液由红色刚好变为无色时。 ●思考:某同学滴加盐酸时速度太快,溶液 变无色后,如何判断盐酸是否过量? ●(1)滴入氢氧化钠溶液,若没有立即变 红,说明过量 ●(2)滴入石蕊溶液,若变红,说明过量; ●(3)加入镁条,若有气泡冒出,说明过
腌制过程中生成了碱
吃起来有涩味
蘸少量的食醋
皮蛋
涩味消失
探究一 酸和碱会发生反应吗?
【实验验证】
[实验10-8] 在烧杯中 加入约5ml稀氢氧化 钠溶液,滴入几滴无 色酚酞溶液。用滴管 慢慢滴入稀盐酸,并 不断搅拌溶液,至溶 液恰好变成无色为止。 5ml
如何验证他们之间是否发生化学反应呢?
问题
探究 温馨提示:可以借助酸碱指示剂的显色作用。
2HCl + Ca(OH)2 === CaCl2 + 2H2O H2SO4 + 2NaOH === Na2SO4 +2H2O
2 、中和反应:酸和碱作用生成盐和水的反应。
反应实质:H+ + OH- == H2O
请思考?
是不是所有的酸碱中和反应都需 要借助酸碱指示剂的颜色变化,才能 判断反应是否发生?
第十单元
自主学习
阅读书本60-61页的有关内容,完成下列问题: 1.认真观察60页图10-14氢氧化钠与盐酸反应的微观粒 子示意图,HCl在溶液中离解出 H+离子和 Cl- 离子, NaOH在溶液中离解出Na+和OH(- 用粒子符号表示),而 在反应后的溶液中, H+ 离子和OH-离子消失了,变成 了水分子,而Na+离子和 Cl- 仍然以离子的形式存在。 所以酸碱中和反应的实质H+和OH-反应生成了H2O 。 2.由 金属离子 和 酸根离子 构成的化合物叫做盐。 3.酸与碱作用生成 盐 和 水 的反应,叫做中和反应。
●回答:因为氢氧化钠和盐酸反应被消耗, 这说明了盐酸和氢氧化钠能发生化学反应。
●思考:什么时候盐酸和氢氧化钠恰好完全 反应? ●当滴加盐酸到溶液由红色刚好变为无色时。 ●思考:某同学滴加盐酸时速度太快,溶液 变无色后,如何判断盐酸是否过量? ●(1)滴入氢氧化钠溶液,若没有立即变 红,说明过量 ●(2)滴入石蕊溶液,若变红,说明过量; ●(3)加入镁条,若有气泡冒出,说明过
腌制过程中生成了碱
吃起来有涩味
蘸少量的食醋
皮蛋
涩味消失
探究一 酸和碱会发生反应吗?
【实验验证】
[实验10-8] 在烧杯中 加入约5ml稀氢氧化 钠溶液,滴入几滴无 色酚酞溶液。用滴管 慢慢滴入稀盐酸,并 不断搅拌溶液,至溶 液恰好变成无色为止。 5ml
如何验证他们之间是否发生化学反应呢?
问题
探究 温馨提示:可以借助酸碱指示剂的显色作用。
2HCl + Ca(OH)2 === CaCl2 + 2H2O H2SO4 + 2NaOH === Na2SO4 +2H2O
2 、中和反应:酸和碱作用生成盐和水的反应。
反应实质:H+ + OH- == H2O
请思考?
是不是所有的酸碱中和反应都需 要借助酸碱指示剂的颜色变化,才能 判断反应是否发生?
第十单元
自主学习
阅读书本60-61页的有关内容,完成下列问题: 1.认真观察60页图10-14氢氧化钠与盐酸反应的微观粒 子示意图,HCl在溶液中离解出 H+离子和 Cl- 离子, NaOH在溶液中离解出Na+和OH(- 用粒子符号表示),而 在反应后的溶液中, H+ 离子和OH-离子消失了,变成 了水分子,而Na+离子和 Cl- 仍然以离子的形式存在。 所以酸碱中和反应的实质H+和OH-反应生成了H2O 。 2.由 金属离子 和 酸根离子 构成的化合物叫做盐。 3.酸与碱作用生成 盐 和 水 的反应,叫做中和反应。
人教版九年级化学下册《酸和碱的中和反应》课件

名称 化学式 类别
氢氧化钠
NaOH 碱
硫酸铜 硫酸
CuSO4 H2SO4
盐
酸
氧化铁
Fe2O3 氧化物
3.下列反应,属于中和反应的是( C ) A Zn +2HCl == ZnCl2 + H2 B CuO + 2HCl == CuCl2 + H2O C Ca(OH)2 + H2SO4 == CaSO4 + 2H2O D AgNO3 + HCl == AgCl + HNO3
C.红色、蓝色、紫色 D.蓝色、紫色、红色
7.在实验室里,欲使碱性溶液变成中性,下列试剂中
最好选用哪一种组合 ( B )
① NaOH溶液②稀盐酸 ③石灰水 ④酚酞试液
A. ①或③
B. 只有②
C. 只有①
D. ②和④
三、溶液酸碱度的表示法——pH
溶液的酸碱性: 表示溶液是酸性还是碱性的。(用酸碱指示剂检验) 溶液的酸碱度: 表示溶液酸碱性的强弱程度。 (用pH试纸测定) 1.pH的范围通常在0~14之间
二、中和反应在实际中的应用
1、改变土壤的酸碱性 2、处理工厂的废水 3、用于医药
1.改良土壤的酸碱性
盐碱地
碱性土壤
熟石灰
酸性土壤
中性土壤
Ca(OH)2
加入酸 性物质 中性土壤
即:
⑴酸性土壤中通常加碱性物质 如用熟石灰改良酸性土壤
H2SO4+ Ca(OH)2====CaSO4+2H2O
能否用NaOH?
在白瓷板或玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取被测液 滴到试纸上,把试纸显示的颜色与 标准比色卡比较,即可得出被测液 的pH 。
人教版九年级化学下册10.2《酸和碱的中和反应》优秀课件

Na+ OH-
+
A
B
C
D
谈谈本节课的收获
特征
实质
中和反应
定义
应用
探究一酸和碱会发生反应吗?
【实验方案】 向氢氧化钠溶液中滴加稀盐酸,观察现象。
提示 滴加稀盐酸时速度要慢。
稀盐酸
且边滴加边振荡
ቤተ መጻሕፍቲ ባይዱ
A.不发生反应
氢氧化 钠溶液
B.发生反应,但无明显现象
问题 探究
探究一:酸和碱能否发生反应?
分组讨论,你们有哪些方案? 能证明酸和碱确实能发生反应。
各抒 己见
探究一:酸和碱能否发生反应?
1.你的猜想有: ① NaCl ; ② NaCl NaOH ; ③ NaCl HCl ; 2.根据现象 ,排除不合理的猜想 ② ; 滴入酚酞的溶液 变为无色
实验探究二 酸和碱是完全反应吗?
3.分组讨论,设计实验方案,证明你的猜想。
滴入少量石蕊溶液 4.实验步骤: 用PH试纸测定溶液PH
5.实验结论: ①滴入少量石蕊溶液,若变红,证明为酸性, ②用玻璃棒蘸取待测液,滴到PH试纸上,与标准比色卡 对照,若PH<7,证明显酸性; HCl 。 若显酸性,说明溶液中的溶质为: NaCl
方案一:氢氧化钠溶液
滴加酚酞溶液
溶液
滴加盐酸 振荡
溶液
无色
方案二:盐酸
滴加酚酞溶液
红色
溶液
无色
溶液
滴加氢氧化钠溶液 振荡
现象 明显
无色
方案三:氢氧化钠溶液
无色
红色
滴加盐酸
振荡
滴加石蕊溶液
溶液
无色
方案四:盐酸
滴加石蕊溶液
蓝色
酸和碱的中和反应(第1课时)—人教版九年级化学下册精品课件

A
B
C
D
B. ①是苯,②是CCl4,③是酒精
【答案】D
5. 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示的现象,则加入的试剂分别是
A. 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol
考点:考查配制一定物质的量浓度。
Ⅱ.取100 mL废水,加入足量的BaCl2溶液,生成2.33 g白色沉淀。
中和反应的应用 (3)在医药领域
含蚁酸
被蚊虫叮咬后可涂稀氨水止痒,碱性物质能与蚊虫分泌的蚁酸中和。 也可以涂风油精或者用牙膏、肥皂水清洗
中和反应的应用
(4)日常生活中
实验操作 食 实验现象 用实验皮结论蛋 时 常 加 入 一
(27)锌和稀硫酸:Zn+H2SO4 ZnSO4+H2↑[现象同(25)]
些食醋就可以将其含有的 6.(1)铜丝表面变黑
100
44
(2)2Pd+O2+4HCl 2PdCl2+2H2O
(4)红磷在空气中燃烧:4P+5O2 2P2O5(剧烈燃烧、产生大量的白烟、放出热量、生成白色固体;测定空气中氧气含量)
碱性物质中和,从而使涩 [解析] (2)题图中M所代表的物质类别是金属单质,金属单质能和酸反应生成盐和氢气。由表中数据可知,黄铜中铜的质量是6.4 g,则该黄铜样品中含锌的质量分数为(10" " g"-" 6"." 4" "
【解析】
④根据亚铁离子易被氧化为铁离子结合溶液的酸碱性分析判断。
【解析】
氢氧化钠溶液和稀硫酸反应 2NaOH+H2SO4=Na2SO4+2H2O
人教版九年级化学下册10.2《酸和碱的中和反应》课件 (共24张PPT)

课题2 酸和碱的中和反应
1.掌握中和反应的定义,理解酸和碱发
生中和反应的本质; 2.了解中和反应在实际生活中的应用; 3.了解溶液酸碱度的表示方法和测定方 法;
学习 目标
农业和工业上常用熟石灰来改良酸性土壤和处 理酸性废水,你知道其中的原理吗?
一、中和反应
H+ + OH− == H2O
实验10-8:酸与碱的中和反应
3.我们实验室一般使用的pH试纸是广泛pH试纸, 测出的pH值是1~14的整数;
4.为了比较精确的测定溶液
的pH,我们可以用精密pH试纸
和酸度计(pH计)来测量。
知能训练 家庭中一些常见物品的溶液pH,其中酸性最强的是
( D)
A.食盐水pH=7 C.肥皂pH=10 B.牙膏pH=9 D.食醋pH=3
交流讨论:举出生活中利用中和反应的实例。
知能训练
食用松花蛋时常感到有涩味,这是因为制作松花蛋
的过程中用到了熟石灰和纯碱等原料。 为了减轻涩 味,可在食用松花蛋时添加某种调味品,这种调味 品最好是( B ) A、食盐 C、香油 B、食醋 D、味精
二、溶液酸碱度的表示方法—pH
知识回顾:酸碱指示剂可以检验溶液的酸碱性
人体的生理活动要在一定的pH范围内才能正常进行, 因此,人的体液都有一定的pH范围。
体液
血浆 乳汁
pH
7.35-7.45 6.6-7.6
体液
胃液 胆汁
pH
0.9-1.5 7.1-7.3
唾液
6.6-7.1
尿液
4.7-8.4
工厂排放的酸性废气未经处理排放到空气中,可能 导致降雨的酸性增强。人们一般把pH小于5.6 的雨水 称为酸雨。
写出三个酸与碱发生中和反应的实例:
1.掌握中和反应的定义,理解酸和碱发
生中和反应的本质; 2.了解中和反应在实际生活中的应用; 3.了解溶液酸碱度的表示方法和测定方 法;
学习 目标
农业和工业上常用熟石灰来改良酸性土壤和处 理酸性废水,你知道其中的原理吗?
一、中和反应
H+ + OH− == H2O
实验10-8:酸与碱的中和反应
3.我们实验室一般使用的pH试纸是广泛pH试纸, 测出的pH值是1~14的整数;
4.为了比较精确的测定溶液
的pH,我们可以用精密pH试纸
和酸度计(pH计)来测量。
知能训练 家庭中一些常见物品的溶液pH,其中酸性最强的是
( D)
A.食盐水pH=7 C.肥皂pH=10 B.牙膏pH=9 D.食醋pH=3
交流讨论:举出生活中利用中和反应的实例。
知能训练
食用松花蛋时常感到有涩味,这是因为制作松花蛋
的过程中用到了熟石灰和纯碱等原料。 为了减轻涩 味,可在食用松花蛋时添加某种调味品,这种调味 品最好是( B ) A、食盐 C、香油 B、食醋 D、味精
二、溶液酸碱度的表示方法—pH
知识回顾:酸碱指示剂可以检验溶液的酸碱性
人体的生理活动要在一定的pH范围内才能正常进行, 因此,人的体液都有一定的pH范围。
体液
血浆 乳汁
pH
7.35-7.45 6.6-7.6
体液
胃液 胆汁
pH
0.9-1.5 7.1-7.3
唾液
6.6-7.1
尿液
4.7-8.4
工厂排放的酸性废气未经处理排放到空气中,可能 导致降雨的酸性增强。人们一般把pH小于5.6 的雨水 称为酸雨。
写出三个酸与碱发生中和反应的实例:
《酸和碱的中和反应》课件
蜜蜂与马蜂
蜜蜂
被蜜蜂这蛰后,用肥 皂水或氨水清洗
马蜂
被马蜂蛰后,用食 醋止痛止痒
被同样属于蜂的两种蜂蜇,为什么一种 用碱液处理,一种用酸液处理?
• 蜜蜂毒液显酸性,马蜂毒液显碱性。 • 氨水是一种弱碱 ,肥皂水也是显碱性的 ;
食醋是一种酸溶液。 原因:
肥皂水或氨水与蜜蜂的酸性毒液发生中 和反应,食醋与马蜂的碱性毒液发生中和反 应。
结论与提升
1、氢氧化钠溶液与稀盐酸混合伴随:能量的 变化(放热);反应物减少了;生成了新物质。
2、反应实质:是盐酸中的H+与氢氧化钠溶 液中的OH-结合生成了水。
3、无明显现象反应证明方法: (1)证明有新物质生成【检验生成物】 (2)证明反应物减少
NaOH与稀盐酸反应后溶液中溶质的组成探究:
溶液中溶质 实验步骤 实验现象 结论
稀盐酸
氢 氧 化 钠
(1)你认为他得出的结论是否正确 不正确 , 理由是 如果盐酸滴加过量,滴入酚酞试液也不变色。
(2)请你另设计一个实验,探究上述烧杯中的溶 液是否恰好完全反应,填写下表:
实验方法
可能观察到 结 论 的现象
①取样,滴加紫色石蕊试液 试液变红 盐酸过量
②取样,滴加紫色石蕊试液 试液不变红 恰好中和
PH试纸等
变红
无色
【结论】稀盐酸与氢氧化钠溶液混合后氢氧化钠
被消耗了,说明反应。
【实验探究三】探究新物质的生成
【实验仪器】玻璃棒 、酒精灯 【实验药品】稀盐酸与氢氧化钠溶液的混合液 (探究二的反应液)
【结论】稀盐酸与氢氧化钠溶液混合后有新物 质生成,会反应。
反应前后溶液中离子发生了怎样的变化?
稀盐酸与氢氧化钠溶液反应的微观探究
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
或小苏打片(主要成分是NaHCO3)
属于 利用 中和 反应 吗?
讲授新课
4.调节溶液的酸碱性
科学实验需将溶液 的pH控制在一定范围内 。若溶液酸碱性太强或 太弱,都可用适当的碱
或酸调节溶液pH。
课堂小结
1.中和反应:酸与碱作用生成盐和水的反应。
实质:
H+ + OH- = H2O
2.盐:由金属离子(或氨根离子)和酸根离子构成的 化合物。
盐酸与氢氧化钾:
盐酸与氢氧化钙: 硫酸与氢氧化钾: 硫酸与氢氧化钠:
HCl + KOH == KCl + H2O 2HCl + Ca(OH)2== CaCl2 + 2H2O
H2SO4 + 2KOH == K2SO4 + 2H2O
H2SO4 + 2NaOH == Na2SO4 + 2H2O
讲授新课
HCl+NaOH == NaCl+H2O 酸 + 碱 → 盐 + 水 我们化学上所说的“盐”,是否就是我们日常生
酸度计
讲授新课
溶液的浓度与pH的关系 1.酸溶液的浓度越小,酸性越弱,pH越大; 2.酸溶液的浓度越大,酸性越强,pH越小。
3.碱溶液的浓度越小,碱性越弱,pH越小;
4.碱溶液的浓度越大,碱性越强,pH越大。 问:NaCl 的水溶液呢?浓度对pH有什么影响? 由于氯化钠溶液是中性的, pH =7,所以不管溶 液的浓度高低,溶液的pH都是7,因此无影响。
Ca(OH)2 + 2 HNO3 === Ca(NO3)2 + 2H2O
讲授新课
思考:有人说:凡是生成盐和水的反应就是中和反应, 请问对不对? 答:不正确。因为能生成盐和水的反应有3种 酸 + 金属氧化物 = 盐 + 水 如:2HCl+CuO=CuCl2+H2O 酸+碱 =盐 + 水 如:HCl+NaOH=NaCl+H2O 碱 + 非金属氧化物 = 盐 + 水
酸性或碱性废水必须 先进行处理,达标后才可
以排放,否则会造成水体
污染。 思考:化学实验产生的酸性或碱性废液能否直接倒入 下水道中?应如何处理?
讲授新课
3.用于医药卫生
中和蚊虫叮咬时“注 射”的蚁酸可以用含碱性 物质的溶液,如肥皂水、
稀氨水。
讲授新课
胃酸过多导致胃部不适或疼痛时可口服碱性药物,以
降低胃酸的含量。如“胃舒平”(主要成分为Al(OH)3)
导入新课
学习目标 1.会使用pH试纸定量地测定溶液的酸碱性强弱; 2.知道常见物质的pH以及pH对生命活动的影响。
讲授新课
一 溶液酸碱度的表示法—pH
化学上用pH表示溶液酸碱性的强弱程度。 pH数值一般在0~14之间,在常温时:
酸性溶液 pH<7
中性溶液 pH=7 碱性溶液 pH>7
注:溶液酸性越强,pH越小;溶液碱性越强,pH越大。
活中所说的“盐”?
盐:由金属离子(或铵根离子)和酸根离子构成 的化合物。 例如:Na2SO4,K2CO3,NH4NO3, FeCl3等等。
讲授新课
练一练
2 NaOH + H2SO4 === Na2SO4 + 2H2O
NaOH + HNO3 === NaNO3 + H2O
Ca(OH)2 + 2 HCl === CaCl2 + 2H2O
讲授新课
用pH试纸可以测定溶液的酸碱度。
讲授新课
用pH试纸测定pH的方法: 测定时,在玻璃片或白瓷板上放一片pH试纸,用 玻璃棒蘸取待测溶液滴在pH试纸上,半分钟后把试纸
显示的颜色跟标准比色卡对照,即可得出溶液的pH。
标准比色卡
讲授新课
注意: (1)不能直接把pH试纸浸入待测溶液中,以免带入杂
讲授新课
下图是几种生活中常见物质,试着说一说它们的酸碱性。
动手测定一下图中几种物质的pH,与图中数据相比较。
讲授新课
人的体液的pH必须维持在一定范围内,如果超越
正常范围,会导致生理功能失调或发生疾病,甚至出
质,污染试液。同时这种操作可能会泡掉pH试纸上的一
部分指示剂,以致比色发生较大的误差;
(2)不能先用水将pH试纸润湿,再进行测试,因为用
水润湿后的pH试纸会将待测溶液稀释,从而导致误差;
讲授新课
(3)我们实验室一般使用的pH试纸是广泛pH试纸,
测出的pH值是1~14的整数; (4)为了比较精确的测定溶液的pH,我们可以用精 密pH试纸和酸度计(pH计)来测量。
3.中和反应在日常生活和工农业生产中有广泛的应用:
改良酸性土壤;处理酸性废水; 治疗胃酸;处理蚊虫叮咬。
第十单元 酸和碱
课题2 酸和碱的中和反应 第2课时 溶液酸碱度的表示法——pH
导入新课 讲授新课 课堂小结 随堂训练
导入新课
复习引入 溶液的酸碱性:
表示溶液是酸性还是碱性的。 溶液的酸碱度:
更加准确地表示溶液酸碱性的强弱程度。
讲授新课
一 中和反应
实验探究
讲授新课
【实验10-8】在氢氧化钠溶液中滴加稀盐酸
现象:在氢氧化钠溶液中滴加酚酞后溶液显红色,随着
滴加盐酸,颜色逐渐消失至无色。
讲授新课
思考:上面的实验能否说明酸与碱之间发生了化学 反应,你能解释一下原因吗?
盐酸与氢氧化钠溶液混 合后,氢离子(H+)和氢氧根 离子(OH-)结合成了水分子, 导致溶液原有的酸、碱性相
第十单元 酸和碱
课题2 酸和碱的中和反应
第1课时 中和反应
导入新课 讲授新课 课堂小结 随堂训练
导入新课
H+
OH-
酸溶液中都含有大量的H+,表现出酸性;碱溶液
中都含有大量的OH-,表现出碱性。那么,酸与碱能发 生反应吗?
导入新课
学习目标 1.掌握中和反应的定义,理解酸和碱发生中和
反应的本质;
2.了解中和反应在实际生活中的应用;
互“中和”。
讲授新课
HCl+NaOH == NaCl+H2O
酸 + 碱 → 盐 + 水
点我播放哦!
酸与碱作用生成盐和水的 反应称为中和反应。
HCl→H+ + Cl− NaOH→Na+ + OH−
HCl和NaOH在水中解离出离子
中和反应的实质: H+ + OH− == H2O
讲授新课
试着写出以下反应的化学方程式:
如:NaOH+CO2=Na2CO3+H2O
讲授新课
思考:熟石灰可以用来改良酸性土壤,你知道其中的
原理是什么吗?
讲授新课
二 中和反应在实际中的应用
1.改变土壤的酸碱性
利用中和反应原理, 向土壤中加入酸性或碱性 物质,将土壤pH控制在最 适宜农作物生长的范围之
内。如撒熟石灰中和酸性
土壤。
讲授新课
2.处理工业废水
属于 利用 中和 反应 吗?
讲授新课
4.调节溶液的酸碱性
科学实验需将溶液 的pH控制在一定范围内 。若溶液酸碱性太强或 太弱,都可用适当的碱
或酸调节溶液pH。
课堂小结
1.中和反应:酸与碱作用生成盐和水的反应。
实质:
H+ + OH- = H2O
2.盐:由金属离子(或氨根离子)和酸根离子构成的 化合物。
盐酸与氢氧化钾:
盐酸与氢氧化钙: 硫酸与氢氧化钾: 硫酸与氢氧化钠:
HCl + KOH == KCl + H2O 2HCl + Ca(OH)2== CaCl2 + 2H2O
H2SO4 + 2KOH == K2SO4 + 2H2O
H2SO4 + 2NaOH == Na2SO4 + 2H2O
讲授新课
HCl+NaOH == NaCl+H2O 酸 + 碱 → 盐 + 水 我们化学上所说的“盐”,是否就是我们日常生
酸度计
讲授新课
溶液的浓度与pH的关系 1.酸溶液的浓度越小,酸性越弱,pH越大; 2.酸溶液的浓度越大,酸性越强,pH越小。
3.碱溶液的浓度越小,碱性越弱,pH越小;
4.碱溶液的浓度越大,碱性越强,pH越大。 问:NaCl 的水溶液呢?浓度对pH有什么影响? 由于氯化钠溶液是中性的, pH =7,所以不管溶 液的浓度高低,溶液的pH都是7,因此无影响。
Ca(OH)2 + 2 HNO3 === Ca(NO3)2 + 2H2O
讲授新课
思考:有人说:凡是生成盐和水的反应就是中和反应, 请问对不对? 答:不正确。因为能生成盐和水的反应有3种 酸 + 金属氧化物 = 盐 + 水 如:2HCl+CuO=CuCl2+H2O 酸+碱 =盐 + 水 如:HCl+NaOH=NaCl+H2O 碱 + 非金属氧化物 = 盐 + 水
酸性或碱性废水必须 先进行处理,达标后才可
以排放,否则会造成水体
污染。 思考:化学实验产生的酸性或碱性废液能否直接倒入 下水道中?应如何处理?
讲授新课
3.用于医药卫生
中和蚊虫叮咬时“注 射”的蚁酸可以用含碱性 物质的溶液,如肥皂水、
稀氨水。
讲授新课
胃酸过多导致胃部不适或疼痛时可口服碱性药物,以
降低胃酸的含量。如“胃舒平”(主要成分为Al(OH)3)
导入新课
学习目标 1.会使用pH试纸定量地测定溶液的酸碱性强弱; 2.知道常见物质的pH以及pH对生命活动的影响。
讲授新课
一 溶液酸碱度的表示法—pH
化学上用pH表示溶液酸碱性的强弱程度。 pH数值一般在0~14之间,在常温时:
酸性溶液 pH<7
中性溶液 pH=7 碱性溶液 pH>7
注:溶液酸性越强,pH越小;溶液碱性越强,pH越大。
活中所说的“盐”?
盐:由金属离子(或铵根离子)和酸根离子构成 的化合物。 例如:Na2SO4,K2CO3,NH4NO3, FeCl3等等。
讲授新课
练一练
2 NaOH + H2SO4 === Na2SO4 + 2H2O
NaOH + HNO3 === NaNO3 + H2O
Ca(OH)2 + 2 HCl === CaCl2 + 2H2O
讲授新课
用pH试纸可以测定溶液的酸碱度。
讲授新课
用pH试纸测定pH的方法: 测定时,在玻璃片或白瓷板上放一片pH试纸,用 玻璃棒蘸取待测溶液滴在pH试纸上,半分钟后把试纸
显示的颜色跟标准比色卡对照,即可得出溶液的pH。
标准比色卡
讲授新课
注意: (1)不能直接把pH试纸浸入待测溶液中,以免带入杂
讲授新课
下图是几种生活中常见物质,试着说一说它们的酸碱性。
动手测定一下图中几种物质的pH,与图中数据相比较。
讲授新课
人的体液的pH必须维持在一定范围内,如果超越
正常范围,会导致生理功能失调或发生疾病,甚至出
质,污染试液。同时这种操作可能会泡掉pH试纸上的一
部分指示剂,以致比色发生较大的误差;
(2)不能先用水将pH试纸润湿,再进行测试,因为用
水润湿后的pH试纸会将待测溶液稀释,从而导致误差;
讲授新课
(3)我们实验室一般使用的pH试纸是广泛pH试纸,
测出的pH值是1~14的整数; (4)为了比较精确的测定溶液的pH,我们可以用精 密pH试纸和酸度计(pH计)来测量。
3.中和反应在日常生活和工农业生产中有广泛的应用:
改良酸性土壤;处理酸性废水; 治疗胃酸;处理蚊虫叮咬。
第十单元 酸和碱
课题2 酸和碱的中和反应 第2课时 溶液酸碱度的表示法——pH
导入新课 讲授新课 课堂小结 随堂训练
导入新课
复习引入 溶液的酸碱性:
表示溶液是酸性还是碱性的。 溶液的酸碱度:
更加准确地表示溶液酸碱性的强弱程度。
讲授新课
一 中和反应
实验探究
讲授新课
【实验10-8】在氢氧化钠溶液中滴加稀盐酸
现象:在氢氧化钠溶液中滴加酚酞后溶液显红色,随着
滴加盐酸,颜色逐渐消失至无色。
讲授新课
思考:上面的实验能否说明酸与碱之间发生了化学 反应,你能解释一下原因吗?
盐酸与氢氧化钠溶液混 合后,氢离子(H+)和氢氧根 离子(OH-)结合成了水分子, 导致溶液原有的酸、碱性相
第十单元 酸和碱
课题2 酸和碱的中和反应
第1课时 中和反应
导入新课 讲授新课 课堂小结 随堂训练
导入新课
H+
OH-
酸溶液中都含有大量的H+,表现出酸性;碱溶液
中都含有大量的OH-,表现出碱性。那么,酸与碱能发 生反应吗?
导入新课
学习目标 1.掌握中和反应的定义,理解酸和碱发生中和
反应的本质;
2.了解中和反应在实际生活中的应用;
互“中和”。
讲授新课
HCl+NaOH == NaCl+H2O
酸 + 碱 → 盐 + 水
点我播放哦!
酸与碱作用生成盐和水的 反应称为中和反应。
HCl→H+ + Cl− NaOH→Na+ + OH−
HCl和NaOH在水中解离出离子
中和反应的实质: H+ + OH− == H2O
讲授新课
试着写出以下反应的化学方程式:
如:NaOH+CO2=Na2CO3+H2O
讲授新课
思考:熟石灰可以用来改良酸性土壤,你知道其中的
原理是什么吗?
讲授新课
二 中和反应在实际中的应用
1.改变土壤的酸碱性
利用中和反应原理, 向土壤中加入酸性或碱性 物质,将土壤pH控制在最 适宜农作物生长的范围之
内。如撒熟石灰中和酸性
土壤。
讲授新课
2.处理工业废水
