水溶液第一课时学案
溶液组成的表示(第一课时)教学案-江苏省句容市2021届沪教版(全国)九年级化学下册

课题:第六章第二节溶液组成的表示课时:第一课时班级:姓名:教学要求:1.知道什么是溶质和溶剂,能区分溶液中的溶质和溶剂;2. 理解溶液的组成溶质、溶剂与溶液三者的关系;3.掌握溶液组成的一种表示方法。
4.能进行溶质质量分数的简单计算;教学重点:溶液中的溶质、溶剂的判断,能进行溶质质量分数的简单计算;教学难点:发生化学反应后形成的溶液中的溶质、溶剂的判断教学设计:一、课前预习1.溶液是由两部分组成的,其中被溶解的物质叫,溶解的物质叫。
2.溶质可以是体、体,也可以是体。
溶剂有多种,可以是水、汽油、酒精等,但在一般情况下都指的是,除特殊说明外。
3.人们把溶液中所含的量叫做溶液的浓度。
人们常用溶液中所含来表示溶液的浓度。
与之比叫做溶液的溶质质量分数,常用表示。
二、教学过程(一)溶液的组成【阅读理解】1.溶液都是由和组成的。
【交流讨论】:你知道下列生活中常见的溶液是哪些物质混合而成的吗?【归纳总结】:2.溶液中溶质与溶剂的判断:当固体溶于液体时,是溶质,是溶剂;当气体溶于液体时,是溶质,是溶剂;当液体溶于液体时,是溶质,是溶剂;如果物质与水混合形成溶液时,通常作溶剂。
3.溶液的命名规律。
如:把白磷溶解在二硫化碳中形成的溶液名称叫。
(二)溶液浓度的表示【讨论交流】1.50毫升酒精和50毫升水混合后的溶液的体积是100毫升吗?为什么?2.一定质量的高锰酸钾溶解到一定量的水中,所得溶液的质量与溶质和溶剂的关系?【学生小结】溶液中存在的一些量的关系:1.溶液的体积不能是和的简单相加2.溶液的质量= +【活动与探究】课本P11—12配制两份蔗糖溶液1.请你猜一猜,下述两个实验所得的糖水哪个更甜一些?2.将实验数据填入【讨论】利用表格中的数据,你能用哪些比值来说明你的猜想?【归纳总结】溶液组成的定量表示方法:在化学上常用溶质质量分数......来表示溶液的组成。
叫做溶质的质量分数。
溶质的质量分数=溶质质量分数越大,说明溶液中溶质的越高。
第1节水溶液学案

第1节水溶液学案(一)[考纲要求]1、知道水的离子积常数。
2、了解强弱电解质的概念及电离方程式书写。
[知识梳理]一、水的电离1、水的电离方程式为________________。
水的电离是一个________过程,在一定的条件下可以达到电离平衡,平衡常数为________。
2、[H+][OH-]=K[H2O],在一定温度下,K与[H2O]都是常数,其乘积也必然是常数,因此[H+][OH-]也是常数,我们可以用式子表示为________________________,式中K W称为水的离子积常数,简称为水的离子积。
说明:①任何水溶液中均存在水的电离平衡。
水的离子积不仅适用于纯水,也适用于其他酸碱盐溶液,常温下K W=[H+]·[OH-]=10-14mol2·L-2。
②K W是温度的函数,与[H+]、[OH-]的变化无关。
3、影响水电离平衡的因素(1)温度:水的电离是________热过程,升高温度水的电离程度________,降低温度水的电离程度________。
(2)加入酸或碱:使溶液中[H+]或[OH-]增大,________水的电离,水的电离程度________。
(3)加入能水解的盐:由于盐电离出的弱酸根离子或弱碱阳离子能结合水电离出的H+或OH-生成________或________,________了水的电离。
例1、某温度下,纯水中,c(H+)=2×10-7mol/L,则此时水的c(OH-)=_______,保持温度不变,加入稀H2SO4,使c(H+)=5×10-6mol/L,则c(OH-)=________(跟踪练习1)纯水在25℃和80℃的氢离子浓度,前后两个量的大小关系为()A、大于B、等于C、小于D、不能肯定(跟踪练习2)水的电离过程为H2O===H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14mol/L-2,K(35℃)=2.1×10-14mol/L-2,则下列叙述正确的是()A、c(H+)随着温度的升高而降低B、在35℃时,[H+]>[OH-]C、水的电离百分率α(25℃)>α(35℃)D、水的电离是吸热的二、电解质在水溶液中的存在形态1、在水溶液或熔融状态下能导电的化合物叫电解质。
第三章物质在水溶液中的行为第一节水溶液学案

第三章物质在水溶液中的行为第一节水溶液学案(第1课时)一、学习目标:1、了解水的电离,离子积常数。
2、了解电解质在水溶液中的电离,以及电解质溶液的导电性。
3、了解电解质的概念。
了解强电解质和弱电解质的概念。
二、自主学习学案:阅读课本P73~75,完成下面内容。
㈠、水的电离1、水的电离方程式:。
水的电离是一个过程,在一定条件下可以达到电离平衡,平衡常数为。
2、K c×[H2O]=[H+][OH-],温度一定,K c与[H2O]都是常数;则在一定温度下也是一个常数,可以表示为,其中的K w称为常数,简称水的离子积。
3、K w的值与有关,温度升高,有利于水的电离,K w将。
在25℃时[H+]=[OH-]= ,K w= ,可见水的电离程度是很小的,水主要是以分子形式存在。
㈡、电解质在水溶液中的存在形态1、在稀的水溶液中的电解质称为强电解质,NaCl、HCl等是电解质。
强电解质溶于水后全部电离成。
2、在水溶液中的电解质称为弱电解质,弱酸、弱碱和水都是电解质。
3、强电解质在水溶液中全部以的形式存在;弱电解质主要以的形式存在。
4、电解质溶于水后并不是以离子或分子存在的,而是与水分子以_________或_________的形态存在,这种溶质离子或溶质分子与溶剂相互吸引的作用叫做__________作用。
三、课堂探究学案:1、水的电离的特点:2、影响水电离平衡的因素3、水的离子积对水的离子积的影响因素[例1]计算25℃ 0.1 mol·L-1的NaOH溶液的OH-离子浓度、H+离子浓度、由水电离的OH-离子浓度分别为多少?4、电离方程式的书写(1)强电解质完全电离,在写电离方程式时,用“=”H2SO4 = Ba(OH)2 = (2)弱电解质部分电离,在写电离方程式时用“”一元弱酸、弱碱一步电离 CH3COOH NH3•H2O多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)H2CO3(主) HCO3-(次)(3)酸式盐的电离【巩固与应用】1、的电离过程为H2O H++OH-,在不同温度下其离子积为K w(25℃)=1.0×10-14mol2•L-2,K w(35℃)=2.1×10-14mol2•L-2,则下列叙述正确的是()A [H+]随着温度的升高而降低B 在35℃时[H+]>[OH-]C 水的离子积K w(25℃)> K w(35℃)D 水的电离是一个吸热过程2、给蒸馏水中滴入少量盐酸后,下列说法中错误的是()。
高中化学水溶液平衡教案

高中化学水溶液平衡教案
教学目标:
1. 了解水溶液的基本概念和特点。
2. 理解水溶液中的平衡现象及相关的化学方程式。
3. 掌握水溶液平衡的影响因素和调节方法。
教学内容:
1. 水溶液的定义和性质。
2. 溶解度和溶解平衡。
3. 酸碱平衡和盐水平衡。
教学步骤:
第一步:导入(5分钟)
教师引导学生回顾有关水溶液的知识,提出学习的主题是水溶液平衡。
同时,引入水溶液
的平衡概念。
第二步:讲解水溶液的定义和性质(15分钟)
教师通过讲解,图像展示和示例演示等方式介绍水溶液的定义和性质,包括溶解度、溶解
平衡等内容。
并通过实验让学生亲自观察水溶液的形成。
第三步:探讨溶解度和溶解平衡(20分钟)
教师引导学生讨论溶解度和溶解平衡的概念,以及影响溶解度的因素。
通过实验和计算演
示不同物质的溶解度及平衡的动态过程。
第四步:学习酸碱平衡和盐水平衡(20分钟)
教师讲解酸碱平衡和盐水平衡的定义、反应特点及相关的化学方程式。
并通过实例讲解如
何调节水溶液的酸碱程度和盐水浓度。
第五步:课堂练习(10分钟)
教师布置针对水溶液平衡的练习题,让学生在课堂上进行解答并相互讨论,巩固所学知识。
第六步:总结与评价(5分钟)
教师对学生的学习情况进行总结和评价,强调水溶液平衡的重要性,并为下节课的学习内容做铺垫。
教学反思:
在教学过程中,应注重让学生通过实验和讨论来掌握水溶液平衡的相关知识,激发他们的学习兴趣和主动性。
同时,也要关注学生的实际学习情况,根据学生的反馈进行及时调整和指导。
高一化学初高中衔接课程 离子反应第一课时 酸碱盐在水溶液中的电离学案
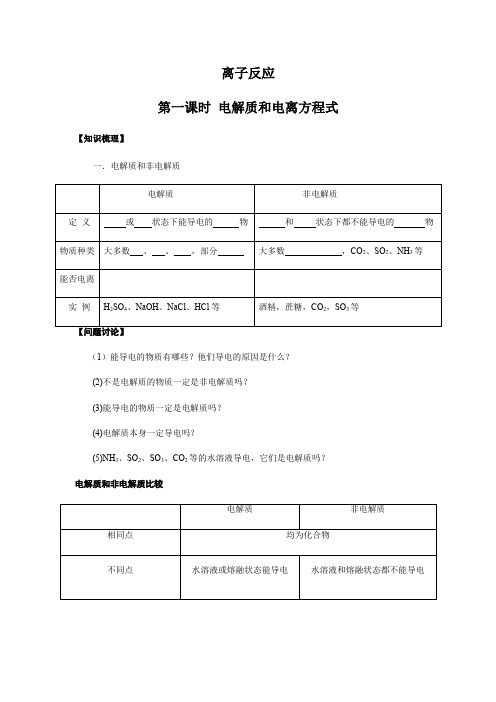
离子反应第一课时电解质和电离方程式【知识梳理】一.电解质和非电解质(1)能导电的物质有哪些?他们导电的原因是什么?(2)不是电解质的物质一定是非电解质吗?(3)能导电的物质一定是电解质吗?(4)电解质本身一定导电吗?(5)NH3、SO2、SO3、CO2等的水溶液导电,它们是电解质吗?电解质和非电解质比较[例1] 今有九种物质:①铝线②石墨③氯气④BaSO4晶体⑤纯硫酸⑥金刚石⑦石灰水⑧乙醇⑨熔化的NaCl其中能导电的是,属于电解质的是,既不是电解质,也不是非电解质的是。
[例2]下列说法正确的是()A.固体氯化钠不导电,所以氯化钠是非电解质B.铜丝能导电,所以铜是电解质C.氯化氢水溶液能导电,所以氯化氢是电解质D.CO2的水溶液能导电,所以CO2是电解质【小结】1.电解质与非电解质的判断方法(1)从物质分类角度:电解质与非电解质都属于化合物。
单质、混合物既不是电解质,也不是非电解质,如铜、铝、石墨,盐酸溶液等(2)从物质性质角度:电解质导电的条件是电解质溶于水或熔融状态下,二者具备其一即可。
①有些电解质溶于水导电,但熔融状态下不导电,如HCl气体。
②有些电解质只在熔融状态下才能导电,如BaSO4。
2.SO2、SO3、CO2等的水溶液能导电,导电原因是与水作用后的生成物(H2SO3、H2SO4、H2CO3)电离所致,并非自身产生自由移动的离子,所以SO2、SO3、CO2等为非电解质,而H2SO3、H2SO4、H2CO3为电解质。
3.强电解质和弱电解质(1)判断依据:根据电解质在水溶液中能否完全电离判断。
(2)与物质类别的关系(3)注意事项:电解质的强弱与溶液导电能力没有必然联系。
电解质溶液的导电能力与离子浓度和离子所带电荷数有关系,强电解质溶液的导电能力不一定强。
电解质的强弱与其溶解度无关,某些盐虽然难溶,但是溶于水的部分完全电离,仍是强电解质,如BaSO4;有少数盐虽然能溶于水,但是只有部分电离,仍属弱电解质,如醋酸铅。
初中化学水溶液的配置教案

初中化学水溶液的配置教案
教学内容:水溶液的配置
教学目标:
1. 了解水溶液的定义和特点;
2. 了解溶液的浓度单位及计算方法;
3. 能够根据实验要求配置不同浓度的水溶液;
4. 掌握在实验中正确使用溶解度表和溶液的稀释计算方法。
教学重点和难点:
1. 溶液的定义和特点;
2. 溶液的浓度单位及计算方法。
教学准备:
1. 实验仪器:烧杯、量筒、搅拌棒等
2. 实验药品:氯化钠、硫酸、氢氧化钠等
3. 实验资料:溶解度表、溶液配制实验步骤
教学过程:
一、导入
教师通过介绍日常生活中常见的溶液现象,引导学生了解溶液的定义和特点。
二、讲解
1. 讲解水溶液的定义和特点;
2. 讲解溶液的浓度单位及计算方法。
三、实验操作
1. 学生根据配制实验步骤,配置不同浓度的氯化钠溶液;
2. 学生使用溶解度表和稀释计算方法,计算和稀释浓度的氯化钠溶液。
四、总结
1. 教师带领学生总结本节课学习的重点和难点;
2. 学生展示实验结果,讨论实验中遇到的问题和解决方法。
五、作业
学生根据实验结果,撰写实验报告,并完成相关习题。
六、延伸
学生可选定其他溶质,进行不同浓度的水溶液配置实验。
教学评价:
1. 学生的实验操作是否准确无误;
2. 学生对水溶液的特点和浓度单位是否掌握。
教学反思:
教师根据学生的学习情况和实验结果,及时调整教学方法和内容,帮助学生更好地理解和掌握水溶液配置知识。
鲁教版化学九年级第一单元 溶液1.1溶液的形成(第1课时)学案

溶液第一节溶液的形成课标要求:认识溶解现象,知道溶液是由溶质和溶剂组成的;知道水是最重要的溶剂,酒精、汽油等也是常见的溶剂;知道水溶液中溶质是以分子或离子存在的;了解饱和溶液的含义;能进行溶质质量分数的简单计算;认识溶质质量分数的含义,能配制一定溶质质量分数的溶液;能说出一些常见的乳化现象;了解溶液在生产、生活中的重要意义。
内容和学情分析:本单元内容主要涉及“什么是溶液?”、“溶液是怎样形成的?”、“溶液组成如何表示?”、“如何配制一定组成的溶液?”等四个问题。
学生对于溶液的知识并不陌生,他们不仅在生活中接触并使用到溶液,在实验室中也用到过溶液,如盐酸、硫酸、氢氧化钠、硫酸铜溶液等。
对溶液有一定的感性认识,从心理上和知识背景上都具备了学习本课题的条件,但他们对溶液的认识仍是感性的、不具体的,甚至还存在着“迷思概念”现象。
对溶液在化学研究中的重要性、溶液在生命活动中、在工农业生产和日常生活中的作用和用途的了解还是远远不够的。
学习建议:根据设置的情境,从自己熟悉的溶液入手,通过实验探究、讨论及观察,借助溶解动画视频,从宏观和微观两个维度认识溶解现象得出溶液的特征及概念,分析溶解过程中通常都伴随能量变化。
联系生活常识,通过实验观察,认识乳化现象。
学习目标:知识与技能:1.认识溶解现象,知道水是最重要的溶剂,酒精、汽油等也是常见的溶剂。
知道水溶液中溶质是以分子或离子存在的。
2.了解饱和溶液的含义,学会饱和和不饱和溶液之间的相互转化。
3.能说出一些常见的乳化现象。
过程与方法:1.能进行溶质质量分数的简单计算。
2.初步学会配制一定溶质质量分数的溶液。
情感态度与价值观:1.了解溶液在生产、生活中的重要意义。
知识点(重点、难点):重点是理解溶液的概念,知道溶液的基本特征;能辨别常见溶液中的溶质、溶剂。
难点是从微观角度解释溶液的形成过程及溶解过程中的能量变化。
实验准备:多媒体;烧杯(50ml)3只,试管2支,玻璃棒、温度计、药匙、胶头滴管;食盐固体、氢氧化钠、硝酸铵、汽油、植物油、洗洁精。
3.1 水溶液 学案2

第一节水溶液(第二课时)学案编制:刘琪年级审核:使用时间:2014-11-20[学习目标] 1.了解溶液的酸碱性与溶液中[H+]和[OH-]的关系。
2.知道pH的定义,了解溶液的酸碱性与pH的关系。
一、溶液的酸碱性(仔细阅读课本76-77页)【针对练习】1.下列溶液一定呈中性的是()A.pH=7的溶液B.[H+]=[OH-]的溶液C.由强酸、强碱等物质的量反应得到的溶液D.非电解质溶于水得到的溶液2.下列溶液一定显酸性的是()A.溶液中[OH-]>[H+] B.滴加紫色石蕊试液后变红色的溶液C.溶液中[H+]=10-6 mol·L-1 D.pH<7的溶液3.90℃时水的离子积K W=3.8×10-13 mol2·L-2,该温度时纯水的pH是() A.等于7 B.小于7 C.大于7 D.无法确定4.下列说法正确的是()A.HCl溶液中无OH-B.NaOH溶液中无H+C.KCl溶液中既无H+也无OH-D.常温下,任何物质的水溶液中都有H+和OH-,且K W=1×10-14 mol2·L-2二、有关pH的计算1、单一溶液pH的计算:▲强酸溶液→[H+]→ pH例1:5.0×10—3mol/L的H2SO4溶液的pH=▲强碱溶液→[OH—]→[H+]→ pH例2:室温下测得强碱NaOH溶液的浓度为1.0×10—3mol/L,计算该溶液的PH。
2、酸碱稀释后pH的计算原则:稀释前后,溶液中H+(或OH—)的物质的量不变。
无限稀释“7”为限。
①酸的稀释(关键:抓住氢离子进行计算!)例题1:在25℃时,pH值等于3的盐酸溶液稀释到原来的100倍,pH值等于多少?②碱的稀释(关键:抓住氢氧根离子进行计算!)例题2:在25℃时,pH值等于12的强碱溶液稀释到原来的100倍,pH 等于多少?3、酸碱混合液pH的计算▲两强酸混合:先求[H+]混例1:将PH=2的H2SO4溶液与PH=4的H2SO4溶液等体积混合后,求溶液的PH值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章物质在水溶液中的行为
第一节水溶液(第1课时)
【学习目标】
1、了解水的电离平衡,知道水的离子积常数,能进行简单计算。
2、能描述弱电解质在水溶液中的电离平衡
【重难点】水的电离过程和Kw的含义的理解
【温故知新】
1、叫电解质。
在化合物中、、和都是电解质。
【自主学习】
1、在水溶液中的电解质称为强电解质;、、以及是强电解质。
在水溶液中的电解质称为弱电解质,、和都是弱电解质。
2、水的电离方程式_________ ___,水的电离平衡常数的表达式为,水的离子积表达式:K W= 。
一定温度时,K W是个常数,K W只与有关,越高,K W越。
25℃时,K W= 。
注意:(1)K W不仅适用于纯水,也适用于酸、碱、盐的稀溶液。
任何水溶液中,由水所电离
.....而生成的c (H+) c (OH-)。
(2)25℃时,任何水溶液中,H+离子浓度和OH-离子的浓度乘积都为1×10- 14
2、影响水的电离平衡的因素
根据影响水的电离平衡的因素填写下表:
条件变化平衡移动方向
c(H+)
(mol/L)c(OH-)
(mol/L)
水的电离程度K W
升高温度H2O H++OH-加入NaCl
加入HCl
加入NaOH
3、写出下列物质的电离方程式:
NaOH:H2SO4:
BaSO4:HF:
【问题探究】
1、探究水的电离有什么特点?纯水中有哪些微粒?根据所学的弱电解质的电离平衡,请列举出可能会影响水的电离平衡的因素。
2、什么叫水的离子积?探究影响水的离子积的因素。
⑪温度:因水的电离是热的,故升高温度,水的电离平衡向移动。
[]和[]
同时,K W=[][] ,但因为由水电离出的[]和[]始终,故溶液呈性。
⑫加入酸(或碱):向纯水中加入酸(或碱),由于酸或碱电离产生(或),致使水
中的[](或[]),使水电离向移动,从而水的电离程度,但由于温度未变,则K W=[][] 。
⑬加入活泼的金属:向纯水中加入活泼的金属,如金属钠,由于活泼的金属钠可与水电离产生的直接发生置换反应,产生,使水的电离向移动。
⑭一定温度下,在不同的溶液中都有K W=[][],故[]和[]成比,但在任何溶液中,由水电离的
.....和的浓度一定等。
【例1】实验测得,在室温下1L H2O(即mol)中只有1×10-7 mol H2O电离,则室温下C(H+)和C(OH-)分别为多少?1×10-3mol/L HCl中C(H+)和C(OH-)分别为多少?0.05mol/L
Ba(OH)2溶液中C(H+)和C(OH-)分别为多少?
3、等体积的0.5 mol/L 的盐酸、氨水、醋酸溶液、NaCl溶液的导电能力一样吗?为什么?溶液
的导电能力与哪些因素有关?
【例2】下列物质中,属于强电解质的有
属于弱电解质的有
①NaCl ②NaOH③NH3·H2O ④CH3COOH ⑤BaSO4⑥AgCl ⑦Na2O⑧K2O⑨H2O⑩SO2
【例3】下列说法正确的是()
A.导电能力强的电解质溶液一定是强电解质溶液
B.强电解质溶液一定比弱电解质溶液的导电性强
C.0.1 mol•L-1NaOH溶液比0.01 mol•L-1 NaOH溶液导电性强,因此前者是强电解质,后者是弱电解质
D.强电解质的水溶液中不存在溶质分子
【课堂练习】
(A级)1.水的电离在某种意义上可以看成是中和反应的逆反应,因此下列说法不正确的是()
A.水的离子积K W随温度的升高而升高B.水的电离程度很小
C.在一定温度下,当溶液中的[H+]变小时,[OH-]一定变大
D.在任何条件下,溶液中的[H+]变大时,[OH-]一定变小
2.下列说法正确的是()
A.HCl溶液中无B.NaOH溶液中无H+
C.NaCl溶液中既无也无H+
D.常温下,任何物质的水溶液中都有H+和,且K W=1×
3.关于强、弱电解质的有关叙述错误的是()
A.强电解质在溶液中完全电离成阴、阳离子
B.在溶液中,导电能力强的电解质是强电解质
C.对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不同
D.纯净的强电解质在液态时,有的导电,有的不导电
4.能证明某物质是弱电解质的是()
A.难溶于水B.溶液中存在已电离的离子和未电离的分子
C.水溶液的导电性差D.熔融状态时不导电
5.在NaHSO4的稀溶液中和熔融状态下都存在的离子是()
A.Na+B.H+C.SO42-D.HSO4-
6.向纯水中加入少量的KHSO4固体(温度不变),则溶液的()
A.pH值升高B.[H+]和[OH-]的乘积增大C.酸性增强D.OH-离子浓度减小7.把0.01mol纯净的烧碱固体分别投入下列100mL的溶液中,溶液的导电能力有明显变化的是()
A.0.5 mol•L-1的硫酸B.0.5 mol•L-1的醋酸溶液
C.0.25 mol•L-1的盐酸D.0.25 mol•L-1的硫酸铜溶液
(B级)8.在0.1 mol/L的氢氧化钠溶液和0.1 mol/L的盐酸中,水的电离程度( ) A.前者大B.前者小C.一样大D.无法确定
9.下列说法正确的是()
A.强电解质溶液的导电能力一定比弱电解质溶液导电能力强
B.因为醋酸是弱电解质,盐酸是强电解质,所以,中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗NaOH比盐酸消耗NaOH用量少
C.足量的锌分别和等体积等物质的量浓度的盐酸和醋酸反应时,产生H2的量相等,放出H2的速率不等
D.物质的量浓度相同的磷酸钠和磷酸溶液中的PO43-的物质的量浓度相同
10.室温下,某酸溶液中的[H+] =1.0×10-5 mol•L-1。
则该溶液中的[OH-]=,由水电离产生的[H+] =。
11.某温度下,纯水的[H+] =2.0×10-7 mol•L-1,则此时[OH-]=,在相同温度下的某酸溶液中[OH-]=2.0×10-10mol•L-1,则此溶液中[H+] =,由水电离产生的[H+] =。
