2016-2017学年高中化学鲁科版必修1课时作业:第3章 第1节 第2课时 Word版含解析
高中化学鲁科版必修1课时作业:第3章 第2节 第1课时 Word版含解析

第2节 氮的循环第1课时 自然界中氮的循环、氮气及氮的氧化物一、自然界中氮的循环 1.氮的存在形态氮是地球上含量丰富的一种元素,以______的形式存在于大气中,以________的形式存在于动植物体、土壤和水体中。
2.氮在自然界中的循环(1)在自然界中豆科植物根部的__________把空气中的氮气转变为__________等含氮的化合物。
在放电条件下,空气中少量的______与______化合生成NO ,NO 和O 2迅速生成______并随水进入土壤和水体。
(2)人们通过化学方法把空气中的氮气转化为____,再根据需要进一步转化成各种含氮化合物(如______、______)。
二、氮气 1.物理性质2.化学性质N 2——⎪⎪⎪⎪――→与氧气 ――→与氢气3.氮的固定(1)概念:使空气中__________的氮转化为____________的过程。
(2)分类氮的固定⎩⎨⎧自然固氮⎩⎪⎨⎪⎧ 固氮 固氮人工固氮⎩⎪⎨⎪⎧固氮 固氮三、氮的氧化物1.2.NO 和2(1)物理性质(2)相互转化(3)影响①NO :是传递神经信息的“信使分子”,但容易与血红蛋白结合而使人体缺氧。
②NO 2:能损坏多种织物和尼龙制品,对金属和非金属材料有腐蚀作用。
知识点1 氮的固定1.下列属于自然固氮的是( ) A .N 2和O 2在雷电作用下生成NOB .某金属化合物将氮气转化为化合态氮C .在一定条件下使N 2、H 2合成NH 3D .NO 生成NO 2知识点2 氮气的性质2.氮气能大量存在于空气中的根本原因是( )A .氮气性质稳定,即使在高温下也很难跟其他物质发生反应B .氮气比空气轻,且不溶于水C .氮分子中两个氮原子结合很牢固,分子结构稳定D .氮气无氧化性,也无还原性,不与其他物质反应 3.下列关于N 2的说法中错误的是( )A .通常情况下N 2性质很稳定,所以N 2可在电焊时作保护气B .N 2+O 2=====高温2NO ,该反应是汽车尾气造成污染的主要原因之一C .N 2在空气中约占总质量的45D .在反应:3Mg +N 2=====高温Mg 3N 2中,N 2作氧化剂 知识点3 一氧化氮的性质4.最新研究表明:NO 吸收治疗法可快速改善SARS 重症患者的缺氧状况,缓解病情。
鲁科版必修1:第三章第三节硫的转化预习学案第二课时

鲁科版必修1:第三章自然界中的元素第三节硫的转化预习学案第2课时设计人:莱芜四中吕荣海20009.12.7学习目标:1.运用氧化还原反反应规律探究不同价态硫之间的转化2.掌握二氧化硫的化学性质(酸性氧化物的通性,氧化性、还原性、漂白性)3.掌握浓硫酸的强氧化性4.了解二氧化硫对空气的污染,酸雨的防治重点难点:1.不同价态硫的转化2.二氧化硫和浓硫酸的性质学习过程:二、实验室里研究不同价态硫元素间的转化(一)、预测不同价态硫元素的性质价态性质-2价的S0价的S+4价的S+6价的S用图示的方法表示不同价态硫元素的相互转化。
(二)、二氧化硫的性质1、物理性质:通常状况下,二氧化硫是一种色,味毒的气体,易溶于水。
2、化学性质:(1)、酸性氧化物的通性:错误!未找到引用源。
与碱溶液(如氢氧化钠溶液)反应,化学方程式错误!未找到引用源。
与水反应化学方程式(2)、氧化性:如与H2S气体反应。
化学方程式(3)、还原性:如与氧气反应。
化学方程式(4)、漂白性:能使品红溶液(该性质用来检验气体)(三)、浓硫酸的性质(1)、吸水性:浓硫酸常用作干燥剂,可以用来干燥等气体。
(2)、脱水性:(3)、强氧化性:在加热的条件下与铜反应。
化学方程式在加热条件下与C反应。
化学方程式在常温下,使、钝化。
可用或来存放浓硫酸。
三、酸雨及其防治【阅读】:自读课90页,完成下列各题。
1.酸雨的形成原理与二氧化硫有何关系?写出有关化学方程式。
2.结合实际谈一下酸雨给人类带来的危害。
3.在防治和减少酸雨形成方面我们应做些什么?我国目前主要利用的能源是煤。
假如你是一位工程师,火力发电厂燃烧废气中有二氧化硫,氧气,一氧化碳等。
你将采取什么措施防止二氧化硫排放到大气中?巩固练习:1.区别二氧化硫气体和二氧化碳气体的方法是()A、通入澄清的石灰水B、根据有无毒性C、用湿润的蓝色石蕊试纸D、用品红溶液2.酸雨形成的最主要原因是()A、森林受到了乱砍滥伐,破坏了生态平衡B、工业上燃烧了大量含硫的燃料C、大气中二氧化碳的含量增多D、汽车排放出大量尾气3.已知SO2+Cl2+2H2O=H2SO4+2HCl,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质()A、立即褪色B、慢慢褪色C、先褪色后复原D、颜色不褪4.下列反应中SO2被氧化的是()A、SO2+2NaOH=Na2SO3+H2OB、2H2S+SO2=3S↓+2H2OC、SO2+H2O+Na2SO3=2NaHSO3D、Cl2+SO2+2H2O=H2SO4+2HCl5.下列气体既具有氧化性又有还原性的是()A.SO2B、SO3C、O2D、CO2。
鲁科版必修1第三章:第2节 氮的循环课件第一课时

3. 在新疆和青海的交界处,有一处山谷,每当 牧民和牲畜进入后,风和日丽的晴天顷刻电闪雷 鸣,人、畜遭雷击而毙命,奇怪的是这里牧草茂 盛、四季常青,被当地人称为魔鬼谷。最近地 质工作者揭开了谜底—该地质表层处有一巨大磁 铁矿,当人畜进入后形成尖端放电。请同学们解 释牧草茂盛的原因,并用简单的化学方程式来表 示。
阅读课本74、75页了解氮的固定方法
(3)氮的固定:使空气中游离态的氮转化为含氮 的化合物。简称固氮(阅读课本74、75) 高能固氮 N2+O2==2NO 自然固氮
2NO+O2==2NO2 3NO2+H2O==2HNO3+NO
放电
氮的 固定
人工固氮
生物固氮 工业固氮 N2+3H2 仿生固氮
高温高压 催化剂
2NH3
2、一氧化氮和二氧化氮
氮的氧化物很多:如NO、 N2O、 NO2、 N2O3 、N2O4 、N2O5等 (1)一氧化氮
无色、难溶于水的气体;在常温下能与氧气 反应生成二氧化氮气体。
缺点:NO结合血红蛋白的能力比一氧化碳还强, 更容易造成人体缺氧。 优点:一氧化氮分子作为一种传递神经信息的“信使分子” 在使血管扩张、免疫、增强记忆力等方面有着极 其重要的作用。
应生成硝酸与一氧化氮。硝酸于土壤里的矿物作 用形成硝酸盐。(俗语“雷雨发庄稼”)
(2)与氢气的反应
氮气与氢气在高温、高压和有催化剂 存在的条件下反应生成氨气
N2+3H2
高温、高压
催化剂
2NH3
(了解)可逆反应:在相同条件下能 同时向正反两个方向进行的反应。 在可逆反应的化学方程式中用 “ ”代替“==”
N2+O2==2NO
放电
2NO+O2==2NO2
2016-2017学年高中化学鲁科版必修1课时作业:第3章 第1节 第2课时

第2课时碳及其化合物间的转化一、自然界中碳及其化合物间的转化1.转化形式2.溶洞及钟乳石、石笋的形成(1)溶洞形成的化学方程式为_______________________________________________。
________________________________________________________________________(2)钟乳石、石笋形成的化学方程式为______________________________________________________________________________________________________________。
二、生产和生活中碳及其化合物间的转化1.高炉炼铁(1)原料:______和__________(主要成分是______)。
(2)过程(实际起还原作用的是______)①CO的产生相关反应的化学方程式为:_______________________________________________②铁矿石被还原相关反应的化学方程式为_________________________________________________;________________________________________________________________________;________________________________________________________________________。
2.木炭燃烧(用化学方程式表示)①________________________________________________________________________,②________________________________________________________________________,③________________________________________________________________________,④________________________________________________________________________。
鲁科版高中化学选择性必修1第3章第3节第1课时沉淀溶解平衡与溶度积作业含答案
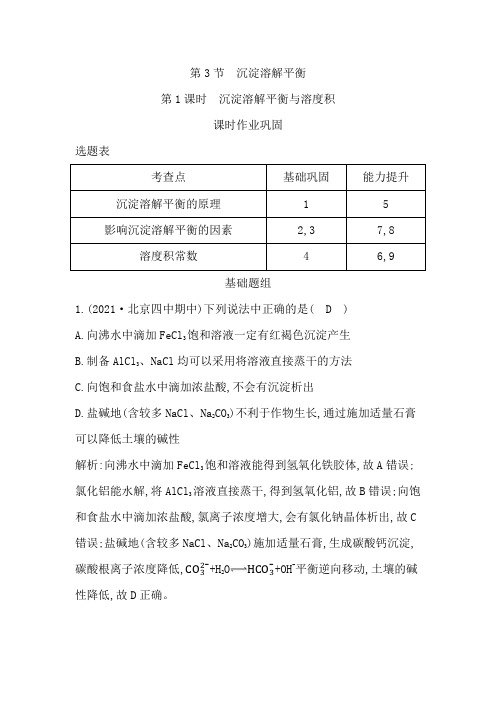
第3节沉淀溶解平衡第1课时沉淀溶解平衡与溶度积课时作业巩固选题表基础题组1.(2021·北京四中期中)下列说法中正确的是( D )A.向沸水中滴加FeCl3饱和溶液一定有红褐色沉淀产生B.制备AlCl3、NaCl均可以采用将溶液直接蒸干的方法C.向饱和食盐水中滴加浓盐酸,不会有沉淀析出D.盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性解析:向沸水中滴加FeCl3饱和溶液能得到氢氧化铁胶体,故A错误;氯化铝能水解,将AlCl3溶液直接蒸干,得到氢氧化铝,故B错误;向饱和食盐水中滴加浓盐酸,氯离子浓度增大,会有氯化钠晶体析出,故C 错误;盐碱地(含较多NaCl、Na2CO3)施加适量石膏,生成碳酸钙沉淀,碳酸根离子浓度降低,CO32-+H2O HCO3-+OH-平衡逆向移动,土壤的碱性降低,故D正确。
2.(2021·辽宁沈阳阶段练习)将足量的AgCl分别加入相同体积的下列物质中,AgCl溶解的质量由大到小的排列顺序是( B )①0.01m o l·L-1K C l溶液②0.02m o l·L-1C a C l2溶液③0.03 mol·L-1 HCl溶液④蒸馏水⑤0.05 mol·L-1 AgNO3溶液A.①>②>③>④>⑤B.④>①>③>②>⑤C.⑤>④>②>①>③D.④>③>⑤>②>①解析:AgCl的沉淀溶解平衡为AgCl(s)Ag+(aq)+Cl-(aq),故溶液中Ag+浓度或Cl-浓度越大,越抑制AgCl的溶解,由选项可知Ag+浓度或Cl-浓度由小到大的排列顺序为④<①<③<②<⑤,故AgCl溶解的质量由大到小的排列顺序为④>①>③>②>⑤,B正确。
3.(2021·湖南衡阳期中)一定温度下,氯化银在水中的沉淀溶解平衡曲线如图,下列说法不正确的是( D )A.向氯化银的浊液中加入氯化钠溶液,氯化银的K sp不变B.向c点的溶液中加入0.1 mol AgNO3,则c(Cl-)减小C.图中a点对应的是不饱和溶液D.升高温度可以实现c点到b点的转化解析:溶度积常数只受温度影响,A正确;c点处于沉淀溶解平衡状态,向c点的溶液中加入0.1 mol AgNO3,则沉淀溶解平衡逆向移动,c(Cl-)减小,B正确;曲线上的点处于沉淀溶解平衡状态,则图中a点对应的Q=c(Ag+)·c(Cl-)<K sp,是不饱和溶液,C正确;升高温度促进沉淀溶解平衡右移,则K sp增大,银离子、氯离子浓度均增大,不能实现c点到b 点的转化,D不正确。
高中化学鲁科版必修1课时作业:第1章第1节含解析

第1章认识化学科学第1节走进化学科学一、化学科学的界定1.定义化学科学是在______、______水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
2.研究对象物质的______、______、______、______、______和______。
3.研究水平______、______水平。
4.学科特征(1)创造性的体现:______自然界中本来就存在的物质、______自然界不存在的具有特殊性质或功能的新物质,基本能够按照人类社会需求进行__________和__________,改造和支配自然界,创造一个新的物质世界。
(2)实用性的体现:合成氨技术、新药物的研制、材料的开发、环境保护、能源的开发和利用。
二、化学科学的形成与发展1.化学的形成最早的化学实践活动是____________,之后人们又学会____________、____________、____________,并希望炼制出长生不老的“仙丹”或把廉价金属炼制成金。
在这些实践的基础上,经过几代化学家的不断努力,近代化学逐渐形成。
2.化学科学的发展(1)近代化学发展的里程碑1661年,英国化学家、物理学家波义耳提出________的概念,标志着近代化学科学的诞生。
1771年,法国化学家拉瓦锡建立燃烧现象的____________,使近代化学取得了革命性的发展。
1803年,英国化学家、物理学家道尔顿提出了____________,为近代化学的发展奠定了坚实的基础。
1869年,俄国化学家门捷列夫发现____________,把__________________纳入一个统一的理论体系。
(2)现代化学科学的发展现代化学的重大成就:____________的发现、________________理论的建立、创造新分子的____________的崛起、____________的创立、化学热力学与化学动力学的开创性研究以及化学工业的迅速发展等。
2016-2017学年高中化学鲁科版必修1课时作业:第1章 第3节 第3课时

第3课时物质的量浓度一、物质的量浓度1.含义用来表示____________溶液里所含溶质B的____________的物理量。
符号为____,常用单位为________(或______)。
(B表示各种溶质)2.表达式:c B=________。
如1 L溶液中含有1 mol溶质,溶质的物质的量浓度就是1 mol·L-1。
二、一定物质的量浓度溶液的配制配制100 mL mol·L-1 NaCl溶液1.主要仪器____________、____________、______、__________、____________、______等。
2.配制步骤(1)计算:根据n B=c B·V可知n(NaCl)=______,则m(NaCl)=______ g。
(2)称量:若用托盘天平可准确称取NaCl固体____ g。
(3)溶解:将称好的NaCl固体放入______中,用适量蒸馏水溶解,用__________搅拌,并冷却至室温。
(4)移液:将烧杯中的溶液用__________引流转移到__________中。
(5)洗涤:用蒸馏水洗涤烧杯内壁________次,并将洗涤液都注入__________中,轻轻摇动容量瓶,使溶液混合均匀。
(6)定容:将蒸馏水注入容量瓶,当液面离容量瓶颈刻度线下__________时,改用____________滴加蒸馏水至__________________。
(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀。
知识点1物质的量浓度的含义1.下列溶液中物质的量浓度为1 mol·L-1的是()A.将40 g NaOH溶解在1 L水中B.将L HCl气体溶于水配成1 L溶液C.将1 L 10 mol·L-1浓盐酸加入9 L水中D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL2.物质的量浓度为2 mol·L-1的NaOH溶液的正确含义是()A.在2 L水中溶有80 g的NaOHB.80 g NaOH溶于水配成的溶液C.每升溶液中含有80 g NaOHD.每2 L溶液中含有80 g NaOH知识点2一定体积的物质的量浓度溶液的配制3.2 g NaOH固体溶于水配成250 mL溶液取出其中50 mL,则这50 mL NaOH溶液的物质的量浓度为()A.mol·L-1B.mol·L-1C.1 mol·L-1D.2 mol·L-14.用98%的浓H2SO4(ρ=g·mL-1)配制1 mol·L-1的稀H2SO4100 mL,配制过程中可能用到下列仪器:①100 mL量筒②10 mL量筒③50 mL烧杯④托盘天平⑤100 mL容量瓶⑥胶头滴管⑦玻璃棒。
鲁科版高中化学选择性必修1第3章第1节第1课时水及强、弱电解质学案

第1节水与水溶液第1课时水及强、弱电解质学习目标1.通过水电离的学习,知道水电离平衡的影响因素,了解水的离子积常数。
2.通过强、弱电解质内容的学习,从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质和反应。
学习任务1 水的电离及其影响因素1.水的电离(1)水是一种极弱的电解质。
(2)水的电离方程式为H2O H++OH-。
(3)水的电离平衡:水的电离是一个可逆过程,当电离速率(v电离)与离子结合为水分子的速率(v分子化)相等时就达到了一种平衡状态,把这种平衡叫电离平衡。
2.水的离子积(1)水的离子积:跟化学平衡一样,水的电离平衡也有一个平衡常数,其平衡常数K=c 平(H +)·c 平(OH -)c 平(H 2O ),在纯水或稀溶液中c 平(H 2O)基本不变,因此K ·c 平(H 2O)也是一个常数,称其为水的离子积常数,简称水的离子积,记为K W 。
(2)水的离子积常数表达式:K W =c 平(H +)·c 平(OH -)。
(3)K W 影响因素:K W 只与温度有关,25 ℃ 时K W =1.0×10-14 mol 2·L -2。
微点拨:K W 适用于纯水及稀溶液,浓溶液不适用。
因为浓溶液中c 平(H 2O)变化较大,K W =K ·c 平(H 2O),不为常数。
3.外界条件对水的电离平衡的影响 分析下列条件的改变对水的电离平衡:H 2OH ++OH - ΔH>0的影响:某老师运用数字手持设备测定K W 与温度的关系。
实验原理:随温度升高,水的电导率发生变化,电导率升高,说明离子浓度增大,据此推测水的电离平衡移动方向。
测得水的电导率随温度变化如图。
据此探究水的电离平衡的影响因素。
探究水的电离平衡的影响因素问题1:如图电导率随温度升高而增大,说明升高温度,水的电离平衡向哪个方向移动。
为什么?提示:正向移动。
因为水电离断裂H—O键,吸收能量,根据平衡移动原理,升温平衡向吸热方向移动,因此水的电离平衡正向移动,由于正向移动造成H+和OH-浓度增大,从而导致水的电导率增大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2课时 碳及其化合物间的转化一、自然界中碳及其化合物间的转化1.转化形式 ⎪⎪⎪⎪化石燃料燃烧—动物遗体分解—火山喷发—动植物呼吸—――→产生 大 气 的CO 2――→消耗⎪⎪⎪⎪ —光合作用—溶解2.溶洞及钟乳石、石笋的形成(1)溶洞形成的化学方程式为_______________________________________________。
________________________________________________________________________(2)钟乳石、石笋形成的化学方程式为______________________________________ ________________________________________________________________________。
二、生产和生活中碳及其化合物间的转化1.高炉炼铁(1)原料:______和__________(主要成分是______)。
(2)过程(实际起还原作用的是______)①CO 的产生相关反应的化学方程式为:_______________________________________________ ②铁矿石被还原相关反应的化学方程式为_________________________________________________; ________________________________________________________________________; ________________________________________________________________________。
2.木炭燃烧(用化学方程式表示)①________________________________________________________________________,②________________________________________________________________________, ③________________________________________________________________________, ④________________________________________________________________________。
3.水垢(1)主要成分:____________。
(2)形成过程(用化学方程式表示): ________________________________________________________________________。
4.碳在无机物和有机物间的转化1828年,德国化学家______用无机物氰酸铵(NH 4CNO)首次合成了有机物__________[分子式为CO(NH 2)2],开创了以含碳无机化合物合成有机化合物的先河。
知识点1 自然界中碳元素的转化1.(1)图瓦卢是由多个珊瑚礁形成的岛国。
由于大气中CO 2含量的剧增,大量珊瑚礁(主要成分是碳酸钙)被海水侵蚀,其原因是(用化学方程式表示):_____________________。
(2)温室效应导致海平面上升,引起温室效应的人为原因主要是_________________。
(3)为了控制温室效应,各国科学家提出了不少方法和设想。
有人根据液态CO 2密度大于海水密度的事实,设想将CO 2液化后,送入深海海底以减小大气中CO 2的浓度。
为使CO 2液化,可采用的措施是( )A .减压、升温B .增压、升温C .减压、降温D .增压、降温(4)科学家研究发现,用“汽水”(一种能释放CO 2的弱酸性溶液)浇灌植物能促进植物的生长。
原因是它能( )①加强呼吸作用 ②加强光合作用 ③改良碱性土壤、调节pH ④加强植物蒸腾作用A .①②B .②③C .③④D .②③④(5)快速、有效地减缓大气中CO 2大量增加的生态学措施是( )A .使用天然气等燃料B .控制全球人口增长C .植树造林,保护森林D .立即减少煤和石油的燃烧知识点2 生产和生活中碳元素间的转化2.古代的“药金”外观与金相似,常被误认为是金子。
冶炼方法如下:将碳酸锌、赤铜(Cu 2O)、木炭混合加热至800℃得金光闪闪的“药金”。
(1)“药金”的主要成分是_________________________________________________。
(2)有关冶炼的化学方程式是__________________,____________________,____________________。
练基础落实1.下列不属于自然界中碳的循环过程的是( )A .植物光合作用B .动物的遗体被微生物分解破坏,最终变成二氧化碳等物质C .空气中的二氧化碳被海水吸收,通过水生生物的贝壳和骨骼转移到陆地D .石墨矿的开采利用2.具有可燃性和还原性的固体单质是( )A .H 2B .C C .FeD .CO3.下列能与人体血液中的血红蛋白结合的一种有毒气体是( )A .氯气B .氮气C .一氧化碳D .甲烷4.要除去CO 2气体中的CO ,常用的方法是( )A .通过澄清的石灰水B .通过燃烧的炭层C .通过水D .通过燃烧的CuO 粉末5.形成钟乳石的主要化学反应是( )①CaO +H 2O===Ca(OH)2 ②Ca(OH)2+CO 2===CaCO 3+H 2O ③CaO +CO 2===CaCO 3 ④CaCO 3+CO 2+H 2O===Ca(HCO 3)2 ⑤Ca(HCO 3)2=====△CaCO 3+H 2O +CO 2↑A .①②B .②③C .③④D .④⑤6.地球大气中CO 2、CH 4等气体含量上升,会使地球表面温度升高,即产生“温室效应”,下列说法不正确的是( )A .控制温室气体排放,遏制全球变暖趋势是社会可持续发展的保障B .CH 4是目前全球变暖的最主要温室气体C .大气中CO 2含量猛增,会破坏自然界中碳及其化合物的平衡D .遏制全球变暖趋势的最有效措施是减少使用化石燃料 练方法技巧——利用反应本质巧判断7.用足量的CO 还原32.0 g 某氧化物,将生成的气体通入足量澄清石灰水中,得到60 g 沉淀,则该氧化物是( )A.FeO B.Fe2O3C.CuO D.Cu2O练综合拓展8.设定下图所示装置中的反应是完全进行的:(1)分别写出A、B、C装置中的化学反应方程式:____________________________________________________________________________________________________;(2)若D装置中的澄清石灰水是少量的,将可能观察到的现象:___________________;用化学方程式解释上述现象:_____________________________________________。
9.用下面的装置将一定量的CO2和CO的混合气体进行分离和干燥。
(图中的a、b均为可以控制气体的通过和液体的加入的止水夹和活塞,实验前均已关闭,仪器的固定装置已省略)。
请选择适宜的试剂,完成上述实验。
可供选择的试剂有:浓硫酸、稀硫酸、浓盐酸、稀盐酸、澄清石灰水、氢氧化钠溶液、紫色石蕊试液。
(1)甲装置的瓶中盛放的试剂是______________,分液漏斗中盛放的试剂是_____,乙装置的瓶中盛放的试剂是______________。
(2)打开a时,首先分离出的气体是________(填名称);要得到另一种气体,正确的操作是________________________________________________________________________ ________________________________________________________________________。
10.为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外活动小组设计了如图所示的实验装置:实验用过量NaOH溶液吸收气体中的CO2,准确测量瓶Ⅰ中溶液吸收CO2后增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空。
(1)图中瓶Ⅱ的作用是____________________________________________________。
(2)对实验装置尚有如下A、B、C、D 4种建议,你认为合理的是________(填代号)。
A.在E处增加CaCl2干燥管B.在F处增加CaCl2干燥管C.在E、F两处增加CaCl2干燥管D .不必增加干燥管(3)将插入溶液的导管下端改成具有多孔的球泡(如图Ⅲ),有利于提高实验的准确度,其理由是________________________________________________________________________________________________________________________________________________。
(4)实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶Ⅰ增重a g ,收集到的气体体积(标准状况)为b L ,该呼出气体中CO 2的体积分数(列出算式)为________。
(5)实验时若猛呼猛吸,会造成不安全后果。
猛吸时会______________,猛呼时会______________。
第2课时 碳及其化合物间的转化基础落实一、2.(1)CaCO 3+CO 2+H 2O===Ca(HCO 3)2(2)Ca(HCO 3)2=====△CaCO 3+CO 2↑+H 2O二、1.(1)焦炭 铁矿石 Fe 2O 3 (2)CO ①C +O 2=====点燃CO 2;C +CO 2=====高温2CO ②3Fe 2O 3+CO=====高温2Fe 3O 4+CO 2 Fe 3O 4+CO=====高温3FeO +CO 2 FeO +CO=====高温Fe +CO 22.①2C +O 2(不足)=====点燃2CO ②2CO +O 2=====点燃2CO 2 ③C +O 2(充分)=====点燃CO 2 ④CO 2+C=====高温2CO3.(1)CaCO 3等 (2)Ca(HCO 3)2=====△CaCO 3↓+CO 2↑+H 2O4.维勒 尿素对点训练1.(1)CaCO 3+CO 2+H 2O===Ca(HCO 3)2(2)大量燃烧煤、石油等矿物燃料(3)D (4)B (5)C解析 二氧化碳微溶于水,溶于水后会与碳酸钙反应,导致碳酸钙溶解。
