(完整word版)高一化学必修一离子方程式大全.docx
高一化学必修一化学方程式及离子方程式大全

高一化学必修一化学方程式及离子方程式大全1、金属钠投到硫酸铜溶液中的化学方程式:2na+2h2o=2naoh+h2↑2、金属钠与盐酸的化学方程式:2na+2hcl=2nacl+h2↑3、氢氧化钠方在空气中变质的化学方程式:2naoh+co2=na2co3+h2ona2co3+10h2o=na2co3·10h2o4、金属钠放到空气的水解:4na+o2=2na2o (银白色变暗)5、金属钠在空气燃烧:2na+o2=na2o2 δ (生成淡黄色粉末)6、过氧化钠在空气中变质:2na2o2+2h2o=4naoh+o2↑2na2o2+2co2=2na2co3+o27、过氧化钠与酸反应:2na2o2+4hcl=4nacl+2h2o+o2↑8、氧化钠在空气中变质:na2o+h2o=2naohna2o+co2=na2co39、氧化钠与酸反应:na2o+2hcl=2nacl+h2o10、氧化钠在空气中冷却:2na2o+o2=2na2o211、氯气与铁的反应方程式:2fe+3cl2=2fecl3 点燃(红棕色的烟)12、氯气与铜的反应方程式:cu+cl2=cucl2 熄灭(棕黄色的烟)13、氯气与氢气的反应方程式:cl2+h2=2hcl 点燃(苍白色火焰,生成白雾)14、氯气与钠单质的反应方程式:2na+cl2=2nacl 熄灭(淡黄色的烟)15、工业制漂白:2cl2+2ca(oh) 2=cacl2+ca(clo) 2+2h2o (为ca(oh) 2石灰乳)16、氯气与水的方程式:cl2+h2o=hcl+hclo17、消毒、处置多余的氯气、制84消毒液:cl2+2naoh=naclo+nacl+h2o18、次氯酸钠在空气中变质:2naclo+co2+h2o=2hclo+na2co3naclo+co2+h2o=hclo+nahco320、次氯酸见光分解:2hclo=2hcl+o2↑ 光照21、氯化铁灌入沸水中制氢氧化铁胶体:fecl3+3h2o=fe(oh) 3 (胶体)+3hcl δ22、碳酸钠与盐酸的反应方程式:na2co3+2hcl(过)=2nacl+co2↑+h2ona2co3+hcl(太少)=nahco3+nacl23、碳酸氢钠与盐酸的反应方程式:nahco3+hcl=nacl+h2o+co2↑24、碳酸氢钠与碱反应方程式:nahco3+naoh=na2co3+h2o25、碳酸氢钠熔化极易水解:2nahco3=na2co3+co2↑+h2oδ26、二氧化碳通入碳酸钠溶液中:na2co3+co2+h2o=2nahco327、混浊石灰水变小回应:co2+caco3+h2o=ca(hco3) 228、碳酸氢钙受热分解:ca(hco3) 2= co2↑+caco3+h2o δ29、氢氧化亚铁在空气中变质:4fe(oh) 2+o2+2h2o=4fe(oh) 3(由白色沉淀变成灰绿色再变成红褐色沉淀) 30、留存氯化亚铁溶液:2fecl3+fe=3fecl2 2fe3++fe=3fe2+31、生产印刷线路板:2fecl3+cu=2fecl2+cucl2 2fe3++cu=2fe2++cu2+32、2fecl2+cl2=2fecl3 2fe2++cl2=2fe3++2cl-33、fe2o3+3co = 2fe+3co2 高温35、zn+cu2+= zn2++cu zn+fe2+= zn2++fe36、溶洞的形成:co2+caco3+h2o=ca(hco3)2ca(hco3)2=co2↑+caco3+h2o δ37、nahco3+bacl2 ?不反应(通常情况下,强酸就可以制弱酸)38、工业上制取水煤气:c+h2o(g)=co+h2 高温39、自然界通过振动把氮气转变为一氧化氮:n2+o22no 振动(no无色、容易溶水)40、工业上制备氨气:n2+3h22nh3 高温、高压、催化剂41、一氧化氮在常温下被水解:2no+o2=2no2(no2红棕色、存有刺激性气味的有毒气体、易溶于水)42、工业上制取硝酸、二氧化氮溶于水生成硝酸和一氧化氮:3no2+h2o=2hno3+no43、氨溶解于水:nh3+h2onh3·h2o(一水合氨、弱碱性、能使酚酞溶液变红)44、一水合氨的电离:nh3·h2onh4++oh-45、氨与盐酸的反应:nh3+hcl=nh4cl46、工业上制取硝酸须要的一氧化氮的方程式:4nh3+5o2=4no+6h2o 高温催化剂47、碳酸氢铵受热分解:nh4hco3=nh3↑+co2↑+h2o δ (密封保存在阴凉处、施肥时埋在土下)48、氯化铵受到热分解:n h4cl=nh3↑+hcl↑ δ49、铵态氮肥不能与碱(如草木灰)混合施用:nh4++oh-=nh3↑+h2o δ50、实验室制氨气:2nh4cl+ca(oh)2=2nh3↑+cacl2+2h2o δ(向上排在空气法搜集、湿润的红色石蕊试纸)51、硝酸受热分解:4hno3=4no2↑+o2↑+2h2o 受热或见光(应保存在棕色试剂瓶中、阴凉处)52、铜与硝酸的反应:cu +4hno3(浓) =cu(no3)2+2no2↑+2h2o (遇浓硝酸生成二氧化氮)3cu+8hno3(叶唇柱) =3cu(no3)2+2no↑+4h2o (突遇叶唇柱硝酸分解成一氧化氮)53、浓硝酸与木炭的反应:4hno3(浓)+c=co2↑+4no2↑+2h2o δ54、硫单质铁的反应:fe+s=fes δ(硫单质的氧化性、s黄色或淡黄色固体,不溶水、微溶酒精、易溶cs2)55、硫单质与氧气的反应:s+o2=so2 熄灭(硫单质的还原性、so2有刺激性气味的有毒气体、易溶于水)56、硫粉突遇碱出现异构化反应:3s+6naoh=2na2s+na2so3+3h2o δ57、黑火药爆炸的化学方程式:s+2kno3+3c=k2s+3co2↑+n2↑58、二氧化硫被氧气水解:2so2+o22so3 催化剂δ60、浓硫酸与铜加热发生反应:2h2so4(浓)+cu=cuso4+so2↑+2h2o δ61、浓硫酸与木炭冷却出现反应:2h2so4(淡)+c=2so2↑+co2↑+2h2o δ63、二氧化硫与氯气发生氧化还原反应:so2+cl2+2h2o=h2so4+2hcl64、酸雨的构成:2so2+o22so3 粉尘等催化剂so3+h2o=h2so4so2+h2oh2so32h2so3+o2=2h2so465、海水加镁第一步:mg+2h+=mg2++h2↑ (盐酸、稀硫酸)66、镁与氮气的反应:3mg+n2=mg3n2 点燃67、镁与二氧化碳反应:2mg+co2=2mgo+c 熄灭(镁起火无法用二氧化碳驱散)68、海水提溴单质:2br-+cl2=br2+2cl-69、半导体硅与氧气的'反应:si+o2=sio2 δ(自然界没游离态的硅)70、工业上制粗硅:sio2+2c=si+2co↑ 高温(光导纤维、沙子和石英的主要成分是sio2)71、硅与氟气的反应:si+2f2=sif472、硅与氢氟酸的反应:si+4hf=sif4+2h273、制作黏合剂:si+2naoh+h2o=na2sio3+2h2↑74、玻璃与烧碱反应:sio2+2naoh=na2sio3+h2o (na2sio3的水溶液称为水玻璃)75、二氧化硅与碱性氧化物的反应:sio2+cao=casio3 高温76、刻蚀玻璃:sio2+4hf=sif4↑+2h2o77、工业制玻璃:caco3+sio2=casio3+co2↑ 高温na2co3+sio2=na2sio3+co2↑ 高温78、金属铝在氧气中燃烧:4al+3o2=2al2o3 点燃79、铝热反应:2al+fe2o3=al2o3+2fe高温(铝粉与氧化铁粉的混合物称为铝热剂,用于焊接钢轨)80、金属铝与酸的反应:2al+6hcl=2alcl3+3h2↑81、金属铝与碱的反应:2al+2naoh+6h2o=2na[al(oh)4]+3h2↑ (四羟基再分铝酸钠)83、氢氧化铝溶于强酸中:al(oh)3+3h+=al3++3h2o84、氢氧化铝溶强碱中:al(oh)3+oh-=[al(oh)4]- (四羟基合铝酸根离子)85、氧化铝溶强酸:al2o3+6h+=2al3++3h2o (氧化铝为两性氧化物)86、氧化铝溶强碱:al2o3+2oh-+3h2o=2[al(oh)4]-87、碱式碳酸铜的制取:2cu+o2+h2o+co2=cu2(oh)2co3 (绿色)88、铜与氧气的反应:cu+o2=2cuo δ89、铜与硫粉的反应:2cu+s=cu2s δ90、4cuo=2cu2o+o2↑ 高温(黑色物质变成红色物质)91、cuso4·5h2o=cuso4+5h2o↑ δ (蓝色晶体变为白色粉末)93、氯化铝与过量的氢氧化钠反应:al3++4oh-=[al(oh)4]-95、实验室制取氯气:4hcl(淡)+mno2 =mncl2+cl2↑+2h2o δ (黄绿色气体、有害、密度比空气小) 96、实验室制取二氧化碳:caco3+2hcl=cacl2+h2o+co2↑ (无色无味、密度比空气小,溶水)。
(完整word版)高一上学期化学方程式汇总

高一上学期化学方程式汇总(一)氯、溴、碘的单质及其化合物1.电解饱和食盐水:2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑ 2Cl - +2H 2O 2OH - +H 2↑+Cl 2↑ 2.实验室制氯气:MnO 2+4HCl(浓)MnCl 2+Cl 2↑+2H 2O MnO 2+4H + +2Cl -Mn 2+ +Cl 2↑+2H 2O3.铁丝在氯气中燃烧: 2Fe+3Cl 22FeCl 34.铜丝在氯气中燃烧: Cu+Cl 2 CuCl 25.铝在氯气中燃烧: 2Al+3Cl 2 2AlCl 3 6.钠在氯气中燃烧: 2Na+Cl 2 2NaCl7.氢气在氯气里安静地燃烧: H 2+Cl 2 2HCl氢气和氯气在光照时爆炸化合: H 2+Cl 22HCl8.氯气和水的反应: Cl 2+H 2O HCl+HClO Cl 2+H 2OH + +Cl - +HClO9.次氯酸具有不稳定性,受热或光照分解: 2HClO2HCl+O 2↑ 10.氯气的尾气处理: Cl 2+2NaOH =NaCl+NaClO+H 2O Cl 2+2OH - =Cl - +ClO - +H 2O11.工业制漂白粉的原理: 2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O12.漂白粉工作原理(与CO 2的反应): Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO13.氯水滴入溴化钠溶液: Cl 2+2NaBr =2NaCl+Br 2 Cl 2+2Br - =2Cl - +Br 214.氯水滴入碘化钾溶液或湿润的淀粉碘化钾试纸检验氯气:Cl 2+2KI =2KCl+I 2 Cl 2+2I - =2Cl - +I 2 (I 2使淀粉变蓝)15.溴水滴入碘化钾溶液: Br 2+2KI =2KBr+I 2 Br 2+2I - =2Br - +I 216.溴离子检验: NaBr+AgNO 3=AgBr ↓+ NaNO 3 Br - + Ag + =AgBr ↓ (淡黄色沉淀)17.碘离子检验: KI+AgNO 3=AgI↓+ KNO 3 I - + Ag + =AgI ↓ (黄色沉淀)18.AgBr 的感光性: 2AgBr == 2Ag + Br 2 (见光分解,AgBr 用于照相)(二)钠单质及其化合物1.钠投入水中: 2Na+2H 2O =2NaOH+H 2↑ 2Na+2H 2O =2Na + + 2OH - +H 2↑2.钠露置空气中表面变暗: 4Na+O 2 === 2Na 2O 3.钠在空气或氧气中燃烧: 2Na+O 2Na 2O 24.钠在氯气中燃烧: 2Na+Cl 2=2NaCl (白烟)5.钠和硫单质混合后敲击或研磨爆炸:2Na+S =Na 2S6.钠应用于冶炼金属: 4Na+TiCl 4 Ti+4NaCl7.工业用电解熔融状态的氯化钠生产钠: 2NaCl2Na+Cl 2↑8.氧化钠是碱性氧化物 (1)与水反应: Na 2O+H 2O ==2NaOH点燃 点燃 点燃点燃 通电光照 通电 点燃 光照 光照700~800电解 点燃(2)与酸性氧化物(CO2)反应生成盐:Na2O+CO2=Na2CO39.过氧化钠作潜水艇或航天飞机供氧剂(反应中过氧化钠既是氧化剂又是还原剂)与水反应:2Na2O2+2H2O=4NaOH +O2↑与CO2反应:2Na2O2+2CO2=2Na2CO3 +O2 10.碳酸钠溶液中滴加少量盐酸:Na2CO3+HCl=NaCl+NaHCO3 CO32- + H+ = HCO3- 11.实验室制CO2:CaCO3+2HCl=CaCl2+H2O+CO2↑CaCO3+2H+ =Ca2+ +H2O+CO2↑12.碳酸氢钠俗称小苏打,用于治胃酸过多(比Na2CO3和盐酸反应剧烈、碱性比碳酸钠弱):NaHCO3+ HCl=NaCl+H2O+CO2↑ HCO3- + H+ =H2O+CO2↑13.碳酸氢钠具有不稳定性,受热分解:2NaHCO 3Na2CO3+H2O+CO2↑14.碳酸氢钠是酸式盐,和强碱反应生成正盐(1)与烧碱:NaHCO3+NaOH=Na2CO3+H2O HCO3- +OH- =CO32- +H2O(2)与足量Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2OHCO3-+Ca2++OH- =CaCO3↓+H2O与不足量Ca(OH)2反应:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O2HCO3-+Ca2++2OH-=CaCO3↓+CO32- +2H2O15.碳酸是二元弱酸,与正盐反应生成酸式盐CO2通入Na2CO3溶液中:CO2 +H2O+Na2CO3=2NaHCO3 CO2 +H2O+CO32- =2HCO3-16.二氧化碳是酸性氧化物,与碱反应生成盐和水烧碱过量(CO2少量):CO2+2NaOH=Na2CO3+H2O CO2 + 2OH- = CO32- + H2O烧碱不足(CO2过量):CO2 + NaOH=NaHCO3 CO2 +OH- = HCO3-17.醋酸与碳酸钠反应的离子方程式:2CH3COOH+CO32-=2CH3COO- +H2O+CO2↑(三)镁单质及其化合物1.工业上从海水中提取镁工艺流程涉及的方程式高温(1)制石灰乳:CaCO3CaO+ CO2↑ CaO+H2O=Ca(OH)2(2)制取Mg(OH)2 :Ca(OH)2+MgCl 2=Mg(OH)2↓+CaCl 2 Ca(OH)2+Mg 2+ =Mg(OH)2↓+Ca 2+(3)制取MgCl 2:Mg(OH)2+2HCl =MgCl 2+2H 2O Mg(OH)2+2H + =Mg 2++2H 2O (4)电解法制镁:MgCl 2Mg+Cl 2↑2.镁是一种活泼金属,可以和很多物质反应而表现出强还原性。
高一化学必修一 离子方程式大全

(1)HCl——(2)HNO3——(3)H2SO4——(4)HF——(5)H2S——(6)H2CO3——(7)H2SO3——(8)H3PO4——(9)HClO——(10)CH3COOH——(11)KOH——(12)Ca(OH)2——(13)NaOH——(14)Ba(OH)2——(15)Fe(OH)2——(16)Mg(OH)2——(17)Al(OH)3——(18)NH3 H2O——(19)NaCl——(20)KNO3——(21)NH4Cl——(22)Na2CO3——(23)Na2SO4——(24)MgCl2——(25)CuCl2——(26)CuSO4——(27)FeCl2——(28)AgNO3——(29)NH4NO3——(30)BaBr2——(31)AlCl3——(32)Al2(SO4)3——(33)CH3COONa——(34)NaHCO3——(35)NaHSO4——书写离子方程式-1 完成下列化学方程式,并改写为离子方程式1. 硫酸和氢氧化钠2. 碳酸钾和盐酸3. 硫酸钠和氯化钡4. 盐酸和氢氧化钾5. 碳酸钠和盐酸6. 硫酸钾和硝酸钡7. 硫酸和氢氧化钾8. 碳酸钠和硫酸9. 硫酸镁和氯化钡10.碳酸氢镁与澄清的石灰水书写离子方程式-2 完成下列化学方程式,并改写为离子方程式1. 在氢氧化钡溶液加入过量的碳酸氢钠溶液:2. 在氢氧化钡溶液中加入少量碳酸氢钠溶液:3. 碳酸氢钡溶液加入足量的氢氧化钠溶液4. 碳酸氢镁溶液与过量苛性钠溶液反应5. 过量氨水与氯化铝溶液混合6. 氯气溶于冷水中8. 碳酸氢钠溶液中加入过量的石灰水10.钠粒投入到水中书写离子方程式-3 完成下列化学方程式,并改写为离子方程式1. 钠投入硫酸铜溶液中3. CaCl2溶液中通入CO2气体6. 硫酸铜溶液和氢氧化钡溶液作用7. NH4HCO3与足量NaOH溶液混合加热9. 稀NH4Cl溶液和稀NaOH溶液作用书写离子方程式-4 完成下列化学方程式,并改写为离子方程式1. 氯气与氢氧化钠溶液2. 石灰石与稀盐酸反应3. 碳酸氢钠溶液中加入少量氢氧化钙溶液4. 碳酸氢钙溶液中加入过量的氢氧化钠溶液5. 次氯酸钙 [Ca(ClO)2] 溶液中通入适量二氧化碳6. 碳酸钠和稀盐酸反应7. 氯化铜和氢氧化钠溶液反应8. 盐酸与氢氧化钠溶液中和9. 硫酸钠溶液中加入浓的氯化钙溶液10.氢氧化铜和稀盐酸反应书写离子方程式-5 完成下列化学方程式,并改写为离子方程式1. 向氯化钡溶液中滴加硝酸银溶液2. 大理石和盐酸反应3. 在氢氧化钙溶液中滴加碳酸钠溶液4. 铁屑放入硫酸铜溶液5. 氧化铜粉末加入稀硫酸6. 向氨水中通入氯化氢气体7. 硫酸和Ba(OH)2溶液反应8. 用稀硫酸清洗铁锈(Fe2O3)9. 碳酸钠溶液与盐酸混合10.硫酸铜溶液和氢氧化钡溶液混合书写离子方程式-6 完成下列化学方程式,并改写为离子方程式1. 向足量澄清石灰水中通入二氧化碳2. 氯化铁溶液和氢氧化钾溶液反应3. 锌与硫酸铜反应4. 向澄清石灰水中加硝酸5. 用石灰石与盐酸反应制取二氧化碳6. 锌粉加入硫酸氢钠溶液中7. 向Na2CO3溶液中滴加几滴稀盐酸8. 硫酸中加入氢氧化钾溶液9. 氢氧化钡和稀硫酸离子反应离子反应方程式练习题-11. 下列各化学反应的离子方程式中,有错误的是()A. 氢氧化铝跟盐酸反应:Al(OH)3+3H+ = Al3++3H2OB. 浓三氯化铁溶液跟铜反应:Fe3++Cu = Fe2++Cu2+D. 甲酸跟氢氧化钠溶液反应:HCOOH+OH- = HCOO-+H2OE. 金属钠跟水反应:Na+2H2O=Na++2OH-+H2↑2. 下列反应的离子方程式不正确的是()A. 醋酸加入氨水CH3COOH + NH3·H2O CH3COO- +NH4+ +H2OB. 铜片插入硝酸银溶液:Cu+Ag+= Cu2++AgC. 碳酸钙加入醋酸:CO32- +2CH3COOH = CO2↑+2CH3COO- +H2OD. 硫氰化钾溶液加入三氯化铁溶液:Fe3+ +SCN- = [Fe(SCN)]2+3. 在强酸性溶液中能大量共存并且溶液为无色透明的离子组是A. NH4+,Al3+,SO42-,NO3-B. K+,Na+,AlO2-(弱酸酸根),NO3-C. K+,NH4+,MnO4-,SO42-D. Na+,K+,NO3-,HSO3-4. 下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是()A. K+、MnO4-、Cl-、SO42-B. Na+、AlO2-、NO3-、CO32-C. Na+、H+、NO3-、SO42-D. Na+、SO42-、S2-、Cl-5. 下列各组离子在水溶液中能大量共存的是()A. K+、HCO3-、CO32-、Br-B. CO32-、HCO3-、OH-、K+C. Fe3+、Cu2+、NO3-、SO42-D. H+、Cl-、Na+、SO32-6. 下列各组中,各种微粒能大量共存在的是()A. NH3 H+ Cl- Na+B. Na+ Cl2 Br- Cu2+C. HCO3- K+ OH- S2-D. Zn2+ NO3- Fe3+ H+离子反应离子反应方程式练习题-21. 在无色透明强酸性溶液中,能大量共存的离子组是()A. K+、Cu2+、NO3-、SO42- B、K+、Na+、Cl-、CO32-C. Zn2+、NH4+、NO3-、Cl- D、K+、Na+、MnO4-、SO42-2. . 在PH=1无色透明溶液中能大量共存的离子组是()A. Al3+、Ag+、NO3-、Cl-B. Mg2+、NH4+、NO3- 、Cl-C. Ba2+、K+、S2-、Cl-D. Cu2+、Na+、NO3-、SO42-3. 某工厂排放的工业废水中可能含有K+、Ag+、NH4+、Mg2+、SO42-、Cl-、NO3- 、HCO3- 等离子。
高一化学必修1化学方程式及离子方程式汇总(背诵版)

高一化学必修1重要方程式及离子方程式汇总(精选)序号化学方程式离子方程式1 2Na+2H2O=2NaOH+H2↑2Na + 2H2O == 2Na+ + 2OH-+ H2↑2 Na 与CuSO4 溶液2Na+2H2O=2NaOH+H2↑2NaOH+ CuSO4=Cu(OH)2↓+ Na2SO42Na + 2H2O == 2Na+ + 2OH-+ H2↑Cu2++2OH-== Cu(OH)2↓3 2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2H2O =4Na++4OH-+O2↑4 2Na2O2+2CO2=2Na2CO3+O2过氧化钠可用在呼吸面具和潜水艇中作供氧剂52Fe +3Cl2点燃2FeCl3铁在氯气中剧烈燃烧(棕红色烟)6 Cl2+H2O =HCl +HClO Cl2+H2O =H++Cl -+HClO7 2NaOH+Cl2=NaClO+NaCl+H2O Cl2+2OH-=ClO-+Cl -+H2O8 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O工业制漂白粉9 实验室制Cl2 ::MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O MnO2+4H++2Cl-Mn2++Cl2↑+2H2O10 FeCl3+3NaOH =Fe(OH)3↓+3NaCl Fe3++ 3OH -= Fe(OH)3↓11 4Fe (OH)2+O2+2H2O =4Fe (OH)3氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)12 氯化亚铁溶液中通入氯气(或加氯水)Cl2 +2FeCl2=2FeCl32 Fe2++ Cl2= 2 Fe3++ 2Cl-13 2FeCl3+Fe =3FeCl2 2Fe3++ Fe = 3Fe2+14 FeCl3溶液腐蚀铜板做印刷线路板:FeCl3+Cu=2FeCl2+Cu Cl22Fe3++Cu=2 Fe2++Cu2+153Fe+4H2O(g)高温Fe3O4+4H2Fe粉与水蒸汽反应16 Na2CO3+2HCl =2NaCl+H2O+CO2↑CO32-+2H+=H2O +CO2↑17 NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑182NaHCO3△Na2CO3+H2O +CO2↑小苏打受热分解(可鉴别Na2CO3与NaHCO3)19 NaHCO3+NaOH =Na2CO3+H2O HCO3-+OH -=H2O +CO32-20 2NaHCO3+Ca(OH)2=Ca CO3↓+Na2CO3+2 H2O2HCO3-+2OH -+Ca2+=Ca CO3↓+CO32-+2 H2O21 向澄清石灰水中不断通入CO2至过量:(先浑浊):Ca(OH)2+CO2=Ca CO3↓+H2O (后澄清):Ca CO3↓+CO2+H2O=Ca(HCO3)2Ca2++2OH -+CO2=Ca CO3↓+H2O Ca CO3+CO2+H2O=Ca2++2HCO3-22 CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl2NaHCO3△Na2CO3+H2O +CO2 ↑侯氏制碱法:向饱和NaCl溶液中先通入NH3后通CO223 向Na2CO3溶液中通入CO2Na2CO3+CO2+H2O=2NaHCO3CO32-+CO2+H2O=2HCO3-24C+ CO2△2CO高炉练铁主要反应:3CO+Fe2O3=3CO2+ 2Fe25 石灰石与盐酸反应制CO2:Ca CO3+2HCl=Ca Cl2+CO2↑+H2OCa CO3+2H+=Ca2++CO2↑+H2O26N2+3H2催化剂高温高压2NH3N2+O2 =2NO273NO2+H2O=2HNO3+NO 2NH4Cl + Ca(OH)2△CaCl2 + NH3↑ + H2O28 4NO2+O2 +2H2O 错误!未找到引用源。
鲁科版高中化学必修一离子方程式书写汇总.docx

高中化学学习材料(灿若寒星**整理制作)离子方程式书写汇总1、氯化钠溶液滴加硝酸银溶液2、钠与水反应3、钠与硫酸铜溶液4、过氧化钠与水反应5、碳酸氢盐溶液与强酸溶液混合6、碳酸氢盐溶液与醋酸溶液混合7、氢氧化钙溶液与碳酸氢镁反应8、向碳酸氢钙溶液中加入过量的氢氧化钠9、向碳酸氢钙溶液中加入少量的氢氧化钠10、澄清石灰水与少量小苏打溶液混合11、澄清石灰水通入少量CO212、澄清石灰水通入过量CO213、碳酸氢钠溶液与少量石灰水反应14、碳酸氢钠溶液与过量石灰水反应15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合16、碳酸钠溶液与盐酸反应17、向氢氧化钠溶液中通入少量的CO218、过量的CO2通入氢氧化钠溶液中19、碳酸氢铵溶液中加入过量氢氧化钠溶液20、碳酸钙与盐酸反应21、碳酸钙与醋酸反应22、澄清石灰水与稀盐酸反应23、磷酸溶液与少量澄清石灰水24、磷酸溶液与过量澄清石灰水25、碳酸镁溶于强酸26、硫酸镁溶液跟氢氧化钡溶液反应27、硫酸溶液跟氢氧化钡溶液反应28、硫酸氢钠溶液与氢氧化钡反应至中性29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀30、硫酸铝溶液中加入过量氢氧化钡溶液31、氢氧化镁与稀硫酸反应32、铝跟氢氧化钠溶液反应33、物质的量之比为1:1NaAl合金置于水中34、氧化铝溶于强碱溶液35、氧化铝溶于强酸溶液36、氢氧化铝与氢氧化钠溶液37、氢氧化铝与盐酸溶液反应38、硫酸铝溶液与碳酸氢钠溶液39、硫酸铝溶液与碳酸钠溶液40、氯化铝溶液中加入过量氨水41、明矾溶液加热水解生成沉淀42、氯化铝溶液与偏铝酸钠溶液43、偏铝酸钠溶液中加入氯化铁溶液44、偏铝酸钠溶液中加入少量盐酸45、偏铝酸钠溶液中加入过量盐酸46、偏铝酸钠溶液中加入氯化铵溶液47、金属铁溶于盐酸中48、铁粉与氯化铁溶液反应49、铜与氯化铁溶液反应50、硫化亚铁与盐酸反应51、硫化钠与盐酸反应52、硫化钠溶液中加入溴水53、氯化亚铁溶液中通入氯气54、向硫酸铁的酸性溶液中通入足量的H2S55、氯化铁溶液中滴加少量硫化钠溶液56、硫化钠溶液中滴加少量氯化铁溶液57、氯化铁溶液中滴加少量碘化钾溶液58、氯化铁溶液与氢氧化钠溶液反应59、氯化铁溶液跟过量氨水反应60、氯化铁溶液与硫氰化钾溶液61、氯化铁溶液跟过量锌粉反应62、锌与稀硫酸63、锌与醋酸64、锌与氯化铵溶液65、氯化铁溶液加入碘化钾溶液66、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液68、四氧化三铁溶于浓盐酸69、氧化铁溶于盐酸70、氧化铁溶于氢碘酸溶液71、用氯化铁与沸水反应制氢氧化铁胶体72、向溴化亚铁溶液通入足量的氯气73、向溴化亚铁溶液通入少量氯气74、向碘化亚铁溶液通入足量氯气75、向碘化亚铁溶液通入少量氯气76、碘化钾溶液中加入氯水77、碘化钾溶液中加入过量氯水78、溴化钠溶液中加入氯水79、亚硫酸溶液中加入氯水80、亚硫酸溶液中加入氯化铁81、亚硫酸溶液中加入双氧水82、氯气通入水中83、氯气通入碳酸氢钠溶液中84、亚硫酸钠溶液中加入溴水85、亚硫酸钠溶液中加入双氧水86、二氧化硫通入溴水中87、单质铁溶于过量稀硝酸中(NO)88、过量单质铁溶于稀硝酸中(NO)89、单质铜与稀硝酸反应90、单质铜与浓硝酸反应91、铜片插入硝酸银溶液92、用氨水吸收少量SO293、用氨水吸收过量的SO294、稀硝酸中通入SO295、浓硝酸中通入SO296、氯化铵与氢氧化钠两种浓溶液混合加热97、向次氯酸钙溶液中通入SO298、用碳酸钠溶液吸收过量SO299、硫酸铜溶液中通入硫化氢100、硫酸铜溶液中加入硫化钠溶液101、电解饱和食盐水102、电解硫酸铜溶液103、电解氯化铜溶液104、电解熔融氯化钠105、电解熔融氧化铝106、二氧化锰与浓盐酸共热107、氯气通入冷的氢氧化钠溶液中108、氯气通入热的氢氧化钾溶液中109、次氯酸钙溶液通入过量的二氧化碳110、次氯酸钠溶液中加入浓盐酸111、氯酸钾与浓盐酸112、硫化钠、亚硫酸钠混合液中加入稀硫酸113、NO2溶于水114、NO2通入亚硫酸钠溶液115、硫化钠的第一步水解116、碳酸钠的第一步水解117、氯化钡溶液与硫酸反应118、硫溶于热的氢氧化钠溶液119、醋酸钡溶液与硫酸反应120、醋酸与氢氧化钾溶液反应121、醋酸与氨水反应122、苯酚溶于氢氧化钠溶液123、苯酚与氯化铁溶液反应124、苯酚钠溶于醋酸溶液125、苯酚钠溶液中通入少量CO2126、碳酸钠溶液中加入过量苯酚127、碳酸钙跟甲酸反应128、甲酸钠跟盐酸反应129、小苏打溶液与甲酸溶液反应130、Na2C2O4溶液中加入酸性高锰酸钾溶液131、酸性高锰酸钾溶液与双氧水132、酸性氯化亚铁溶液与双氧水133、SO2通入酸性高锰酸钾溶液134、乙烯通入酸性高锰酸钾溶液生成CO2135、乙酸乙酯与氢氧化钠溶液136、硬脂酸甘油酯与氢氧化钠溶液137、氯乙烷在氢氧化钠溶液中水解138、硝酸银溶液中滴入少量氨水139、硝酸银溶液中滴加氨水至过量140、葡萄糖发生银镜反应141、硫酸铜溶液中加入氢氧化钠溶液142、硫酸铜溶液中加入少量氨水143、硫酸铜溶液中加入过量氨水144、硫酸锌溶液中加入少量氨水145、硫酸锌溶液中加入过量氨水146、甘氨酸与氢氧化钠溶液147、甘氨酸与盐酸溶液148、邻羟基苯甲酸与氢氧化钠溶液149、邻羟基苯甲酸与碳酸氢钠溶液150、邻羟基苯甲酸与碳酸钠溶液参考答案:1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓2、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O6、碳酸氢盐溶液与醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓8、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH–=CaCO3↓+H2O10、澄清石灰水与少量小苏打溶液混合:Ca2++OH–+HCO3-=CaCO3↓+H2O11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O12、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O14、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3·H2O16、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O17、向氢氧化钠溶液中通入少量的CO2:CO2+2OH–=CO32–+H2O18、过量的CO2通入氢氧化钠溶液中:CO2+OH–=HCO3-19、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O20、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O22、澄清石灰水与稀盐酸反应:H++OH–=H2O23、磷酸溶液与少量澄清石灰水:H3PO4+OH–=H2O+H2PO4–24、磷酸溶液与过量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O25、碳酸镁溶于强酸:MgCO3+2H+=Mg2++CO2↑+H2O26、硫酸镁溶液跟氢氧化钡溶液反应:Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓27、硫酸溶液跟氢氧化钡溶液反应:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O28、硫酸氢钠溶液与氢氧化钡反应至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:H++SO42–+OH–+Ba2+=BaSO4↓+H2O30、硫酸铝溶液中加入过量氢氧化钡溶液:2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H+=Mg2++2H2O32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑33、物质的量之比为1:1NaAl合金置于水中:Na+Al+2H2O=Na++AlO2–+2H2↑34、氧化铝溶于强碱溶液:Al2O3+2OH–=2AlO2–+H2O35、氧化铝溶于强酸溶液:Al2O3+6H+=2Al3++3H2O36、氢氧化铝与氢氧化钠溶液:Al(OH)3+OH–=AlO2–+2H2O37、氢氧化铝与盐酸溶液反应:Al(OH)3+3H+=Al3++3H2O38、硫酸铝溶液与碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+CO2↑39、硫酸铝溶液与碳酸钠溶液:2Al3++3CO32–+3H2O=2Al(OH)3↓+3CO2↑40、氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+41、明矾溶液加热水解生成沉淀:Al3++3H2O=Al(OH)3↓+3H+42、氯化铝溶液与偏铝酸钠溶液:Al3++3AlO2–+6H2O=4Al(OH)3↓43、偏铝酸钠溶液中加入氯化铁溶液:Fe3++3AlO2–+6H2O=Fe(OH)3↓+3Al(OH)3↓44、偏铝酸钠溶液中加入少量盐酸:AlO2–+H++H2O=Al(OH)3↓45、偏铝酸钠溶液中加入过量盐酸:AlO2–+4H+=Al3++2H2O46、偏铝酸钠溶液中加入氯化铵溶液:AlO2–+NH4++H2O=Al(OH)3↓+NH3↑47、金属铁溶于盐酸中:Fe+2H+=Fe2++H2↑48、铁粉与氯化铁溶液反应:Fe+2Fe3+=3Fe2+49、铜与氯化铁溶液反应:Cu+2Fe3+=Cu2++3Fe2+50、硫化亚铁与盐酸反应:FeS+H+=Fe2++H2S↑51、硫化钠与盐酸反应:S2–+2H+=H2S↑52、硫化钠溶液中加入溴水:S2–+Br2=S↓+2Br–53、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–54、向硫酸铁的酸性溶液中通入足量的H2S:2Fe3++H2S=2Fe2++S↓+2H+55、氯化铁溶液中滴加少量硫化钠溶液:2Fe3++S2–=S↓+2Fe2+56、硫化钠溶液中滴加少量氯化铁溶液:2Fe3++3S2–=S↓+2FeS↓57、氯化铁溶液中滴加少量碘化钾溶液:2Fe3++2I–=2Fe2++I258、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH–=Fe(OH)3↓59、氯化铁溶液跟过量氨水反应:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+60、氯化铁溶液与硫氰化钾溶液:Fe3++3SCN–=Fe(SCN)361、氯化铁溶液跟过量锌粉反应:2Fe3++3Zn=2Fe+3Zn2+62、锌与稀硫酸:Zn+2H+=Zn2++H2↑63、锌与醋酸:Zn+2CH3COOH=CH3COO–+Zn2++H2↑64、锌与氯化铵溶液:Zn+2NH4+=Zn2++NH3↑+H2↑65、氯化铁溶液加入碘化钾溶液:2Fe3++2I-=2Fe2++I266、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O68、四氧化三铁溶于浓盐酸:Fe3O4+8H+=2Fe3++Fe2++4H2O69、氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O70、氧化铁溶于氢碘酸溶液:Fe2O3+2I-+6H+=2Fe2++I2+3H2O71、用氯化铁与沸水反应制氢氧化铁胶体:Fe3++3H2O Fe(OH)3+3H+72、向溴化亚铁溶液通入足量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-73、向溴化亚铁溶液通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-74、向碘化亚铁溶液通入足量氯气:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-75、向碘化亚铁溶液通入少量氯气:2I-+Cl2=I2+2Cl-76、碘化钾溶液中加入氯水:2I-+Cl2=I2+2Cl-77、碘化钾溶液中加入过量氯水:I-+3Cl2+3H2O=6H++IO3-+6Cl-78、溴化钠溶液中加入氯水:2Br-+Cl2=Br2+2Cl-79、亚硫酸溶液中加入氯水:H2SO3+Cl2+H2O=4H++2Cl-+SO42-80、亚硫酸溶液中加入氯化铁:H2SO3+2Fe2++H2O=4H++2Fe2++SO42-81、亚硫酸溶液中加入双氧水:H2SO3++H2O2=2H++H2O+SO42-82、氯气通入水中:Cl2+H2O=H++Cl-+HClO83、氯气通入碳酸氢钠溶液中:Cl2+HCO3=Cl-+CO2+HClO84、亚硫酸钠溶液中加入溴水:SO32-+H2O+Br2=SO42-+Br-+2H+85、亚硫酸钠溶液中加入双氧水:SO32-+H2O2=SO42-+2H2O86、二氧化硫通入溴水中:SO2+Br2+2H2O=4H++2Br-+SO42-87、单质铁溶于过量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O88、过量单质铁溶于稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O89、单质铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O90、单质铜与浓硝酸反应:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O91、铜片插入硝酸银溶液:2Ag++Cu=2Ag+Cu2+92、用氨水吸收少量SO2:SO2+2NH3+H2O=2NH4++SO32-93、用氨水吸收过量的SO2:SO2+NH3+H2O=NH4++HSO3-94、稀硝酸中通入SO2:3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+95、浓硝酸中通入SO2:SO2+2NO3-=SO42-+2NO2↑96、氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH-NH3↑+H2O97、向次氯酸钙溶液中通入SO2:Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+98、用碳酸钠溶液吸收过量SO2:CO32-+H2O+2SO2=CO2↑+2HSO3-99、硫酸铜溶液中通入硫化氢:H2S+Cu2+=CuS↓+2H+100、硫酸铜溶液中加入硫化钠溶液:S2-+Cu2+=CuS↓101、电解饱和食盐水:2Cl-+2H2O2OH-+H2↑+Cl2↑102、电解硫酸铜溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+103、电解氯化铜溶液:Cu2++2Cl-Cu↓+Cl2↑104、电解熔融氯化钠:2Na++2Cl-(熔融)2Na+Cl2↑105、电解熔融氧化铝:4Al3+ +6O2-4Al+3O2↑106、二氧化锰与浓盐酸共热:MnO2+2Cl-+4H+Mn2++Cl2↑+2H2O 107、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O108、氯气通入热的氢氧化钾溶液中:3Cl2+6OH-=5Cl-+ClO3-+3H2O109、次氯酸钙溶液通入过量的二氧化碳:ClO-+H2O+CO2=HClO+HCO3-110、次氯酸钠溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O111、氯酸钾与浓盐酸:ClO3-+5Cl-+6H+=3Cl2↑+3H2O112、硫化钠、亚硫酸钠混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O 113、NO2溶于水:3NO2+H2O=2H++NO3-+NO↑114、NO2通入亚硫酸钠溶液:SO32-+NO2=SO42-+NO↑115、硫化钠的第一步水解:S2-+H2O HSO3-+OH-116、碳酸钠的第一步水解:CO32-+H2O HCO3-+OH-117、氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓118、硫溶于热的氢氧化钠溶液:3S+6OH-=2S2-+SO32-+3H2O119、醋酸钡溶液与硫酸反应:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH 120、醋酸与氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O121、醋酸与氨水反应:CH3COOH+NH3·H2O=CH3COO-+NH4++2H2O 122、苯酚溶于氢氧化钠溶液:C6H5OH+OH-=C6H5O-+H2O123、苯酚与氯化铁溶液反应:6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+124、苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH=C6H5OH+CH3COO-125、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-126、碳酸钠溶液中加入过量苯酚:C 6H 5OH+CO 32-=C 6H 5O -+HCO 3-127、碳酸钙跟甲酸反应: CaCO 3+HCOOH=Ca 2++CO 2↑+H 2O+HCOO -128、甲酸钠跟盐酸反应: HCOO -+H +=HCOOH129、小苏打溶液与甲酸溶液反应:HCOOH+HCO 3-=CO 2↑+H 2O+HCOO - 130、Na 2C 2O 4溶液中加入酸性高锰酸钾溶液:5C 2O 42-+2MnO 4-+16H +=10CO 2↑+2Mn 2++8H 2O131、酸性高锰酸钾溶液与双氧水:5H 2O 2+2MnO 4-+6H +=5O 2↑+2Mn 2++8H 2O 132、酸性氯化亚铁溶液与双氧水:2Fe 2++H 2O 2+2H +=2Fe 3++2H 2O133、SO 2通入酸性高锰酸钾溶液:5SO 2+2MnO 4-+2H 2O=5SO 42-+2Mn 2++4H + 134、乙烯通入酸性高锰酸钾溶液生成CO 2:5C 2H 4+12MnO 4-+36H +=10CO 2↑+12Mn 2++28H 2O135、乙酸乙酯与氢氧化钠溶液:CH 3COOCH 2CH 3+OH -=CH 3COO -+HOCH 2CH 3 136、硬脂酸甘油酯与氢氧化钠溶液:(C 17H 35COO)3(C 3H 5O 3)+3OH -=3C 17H 35COO -+CH 2(OH)CH(OH)CH 2OH137、氯乙烷在氢氧化钠溶液中水解:CH 3CH 2Cl+OH -=CH 3CH 2OH+Cl - 138、硝酸银溶液中滴入少量氨水: Ag ++NH 3·H 2O=AgOH ↓+NH 4+ 139、硝酸银溶液中滴加氨水至过量:Ag ++2NH 3·H 2O=[Ag(NH 3)2]++2H 2O 140、葡萄糖发生银镜反应:CH 2(OH)(CHOH)4CHO+2[Ag(NH 3)2]++2OH -=CH 2(OH)(CHOH)4COO -+NH 4++3NH 3+H 2O+2Ag ↓141、硫酸铜溶液中加入氢氧化钠溶液:Cu 2++2OH -=Cu(OH)2↓142、硫酸铜溶液中加入少量氨水:Cu 2++2NH 3·H 2O=Cu(OH)2↓+2NH 4+ 143、硫酸铜溶液中加入过量氨水:Cu 2++4NH 3·H 2O=[Cu(NH 3)4]2++4H 2O 144、硫酸锌溶液中加入少量氨水:Zn 2++2NH 3·H 2O=Zn(OH)2↓+2NH 4+ 145、硫酸锌溶液中加入过量氨水:Zn 2++4NH 3·H 2O=[Zn(NH 3)4]2++4H 2O146、甘氨酸与氢氧化钠溶液:NH 2CH 2COOH+OH -=NH 2CH 2COO -+H 2O 147、甘氨酸与盐酸溶液: NH 2CH 2COOH+H +=[ NH 3CH 2COOH]+ 148、邻羟基苯甲酸与氢氧化钠溶液:149、邻羟基苯甲酸与碳酸氢钠溶液:150、邻羟基苯甲酸与碳酸钠溶液: 2OH- OHCOOH + O -COO - +2H 2O OHCOO -HCO 3-OH COOH + +H 2O+CO 2↑OHCOOH + O -COO -CO 32-+H 2O+CO 2↑。
(完整版)高一必修一化学方程式总结(全)

高一化学方程式总结一.钠:(1).Na在空气中与O2:4Na + O2 = 2Na2O(白色)(2).Na在O2中燃烧:2Na + O2Na2O2(淡黄色)(3).Na与S:2Na + S = Na2S(研磨即爆炸)(4).Na与Cl2:2Na + Cl22NaCl(5).Na与H2O:2Na + 2H2O = 2NaOH + H2↑ (2Na + 2H2O = 2Na+ + 2OH- + H2↑)(6).Na与HCl:2Na + 2HCl = 2NaCl + H2↑ (2Na + 2H+ =2Na+ + H2↑ )(7).Na与CuSO4溶液:2Na + 2H2O + CuSO4 = Na2SO4+ Cu(OH)2↓ + H2↑(8).Na与FeCl3溶液:6Na + 6H2O + 2FeCl3 = 6NaCl + 2Fe(OH)3↓ + 3H2↑(9).Na2O与H2O:Na2O + H2O = 2NaOH(10).Na2O与CO2:Na2O + CO2= Na2CO3(11).Na2O2与H2O:2Na2O2 + 2H2O = 4NaOH + O2↑(2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑)(12).Na2O2与CO2:2Na2O2 + 2CO2 = 2Na2CO3 + O2(供氧)(13).Na2CO3与HCl:Na2CO3 +2HCl = 2NaCl + H2O +CO2↑(互滴鉴别)(CO32- + 2H+ = H2O + CO2↑)(14).NaHCO3与HCl:NaHCO3 + HCl = NaCl + H2O + CO2↑(HCO3- + H+ = H2O + CO2↑)(15).NaHCO3与NaOH:NaHCO3 +NaOH=Na2CO3 + H2O (HCO3- + OH- = CO32- + H2O)(16).Na2CO3与H2O 与CO2 :Na2CO3 + H2O + CO2 =2NaHCO3(鉴别、除杂)(CO32- + H2O + CO2 = 2HCO3-)(17).NaHCO3 分解:2NaHCO3Na2CO3+H2O+ CO2↑(18).NaOH与CO2 (少量):2NaOH + CO2 (少量) = Na2CO3 + H2O (2OH-+ CO2 (少量) = CO32- + H2O)(19).NaOH 与CO2(过量):NaOH + CO2(过量)= NaHCO3(OH -+ CO2(过量)= HCO3-)二.铝:(1).Al与6HCl:2Al+6HCl=2AlCl3+3H2↑(同H2SO4)(2Al+6H+ =2Al3+ + 3H2↑ )(2).Al 与NaOH 与H2O:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑(2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑)(3).Al2O3与HCl:Al2O3 + 6HCl = 2AlCl3 + 3H2O(Al2O3 + 6H+ =2Al3+ + 3H2O)(4).Al2O3与NaOH:Al2O3+2NaOH=2NaAlO2+H2O(Al2O3 + 2OH- = 2AlO2- + H2O )(5).Al(OH)3与HCl:Al(OH)3 + 3HCl = AlCl3 + 3H2O(Al(OH)3 + 3H+ = Al3+ + 3H2O)(6).Al(OH)3与NaOH:Al(OH)3+NaOH=NaAlO2+2H2O (Al(OH)3 + OH- = AlO2- + 2H2O)(7).2Al(OH)3Al2O3 + 3H2O(8).AlCl3与NH3·H2O:AlCl3 + 3NH3·H2O = Al(OH)3↓ + 3NH4Cl (Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+)(9).NaAlO2与HCl与H2O:NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ (AlO2- + H+ +H2O = Al(OH)3↓ )(10).NaAlO2 与CO2(少量)与H2O:2NaAlO2 + CO2(少量)+3H2O=2Al(OH)3↓+Na2CO3(12).AlO2- + CO2(少量)+ 3H2O = 2Al(OH)3↓ + CO32-)(11).NaAlO2与CO2(过量)与2H2O:NaAlO2+CO2(过量)+2H2O=Al(OH)3↓+NaHCO3(AlO2- + CO2(过量) + 2H2O = Al(OH)3↓ + HCO3-)(12).Al 与O2 :4Al + 3O2 = 2Al2O3三.铁:(1).Fe与O2:3Fe+2O2Fe3O4(2).Al2O3电解:2Al2O34Al+3O2↑(3).Fe与H2O(g)高温:3Fe+4H2O(g)Fe3O4+4H2(4).FeCl3 + Fe :2FeCl3 + Fe = 3FeCl2(2Fe3+ + Fe = 3Fe2+)(5).FeCl2+Cl2:2FeCl2+Cl2=2FeCl3(2Fe2+ + Cl2 = 2Fe3++2Cl-)(6).FeCl3与Cu:2FeCl3 + Cu = 2FeCl2 + CuCl2(用于雕刻铜线路板) (2Fe3+ + Cu = 2Fe2++ Cu2+)(7).FeO与HCl:FeO+ 2HCl = FeCl2 + H2O(同H2SO4)(FeO+2H+=Fe2+ +H2O )(8).Fe2O3 与HCl :Fe2O3 + 6HCl = 2FeCl3 + 3H2O(同H2SO4)(Fe2O3 + 6H+=2Fe3+ + 3H2O)(9).Fe3O4 与HCl:Fe3O4 + 8HCl = 2FeCl3 + FeCl2 +4H2O(同H2SO4)(Fe3O4 + 8H+=Fe2+ +2Fe3+ +4H2O)(10).FeSO4与NaOH:FeSO4 + 2NaOH=Fe(OH)2↓ +Na2SO4(Fe2+ + 2OH-=Fe(OH)2↓)(11).FeCl3与NaOH:FeCl3 + 3NaOH=Fe(OH)3 ↓+ 3NaCl (Fe3+ + 3OH-=Fe(OH)3 ↓)(12).Fe(OH)2 与H2O 与O2:4Fe(OH)2 + 2H2O + O2 =4Fe(OH)3 (白色沉淀→灰绿色沉淀→红褐色沉淀)(13).Fe(OH)2与HCl.Fe(OH)2+2HCl==FeCl2+2H2O(Fe(OH)2 + 2H+=Fe2+ + 2H2O)(14).Fe(OH)3与HCl:Fe(OH)3+3HCl==FeCl3+3H2O(Fe(OH)3 + 3H+ = Fe3+ + 3H2O)(15).Fe(OH)3加热:2Fe(OH)3Fe2O3 + 3H2O(16).FeCl3与KSCN:FeCl3+3KSCN==Fe(SCN)3+3KCl(Fe3++ 3SCN- = Fe(SCN)3)(红色溶液,用于鉴别Fe3+) (17).FeCl3与H2S(少量):2FeCl3 + H2S(少量) = 2FeCl2 + 2HCl + S↓ (18).FeCl3与KI:2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2↓(19).FeCl3与H2O:FeCl3+3H2O Fe(OH)3(胶体)+3HCl (20).C与H2O:C+H2O CO+H2 (生成水煤气)四.硅:(1)Si与NaOH与H2O:Si + 2NaOH + H2O = Na2SiO3 +2H2↑ (Si+2OH-+H2O= SiO32- + 2H2↑)(2)Si与HF:Si+ 4HF = SiF4 + 2H2↑(3)Si与F2:Si+ 2F2 = SiF4(4)Si与O2:Si+O2SiO2 (研细的硅与纯氧)(5)Si 与C:Si + C SiC(6)C与SiO2:2C+ SiO22CO↑+Si(工业制粗硅)(7)Cl2:与Si:2Cl2+Si= SiCl4(8)SiCl4 与H2:SiCl4 +2H2=Si+4HCl(粗硅提纯)(9)SiO2 与NaOH:SiO2 + 2NaOH = Na2SiO3 + H2O(SiO2 + 2OH- = SiO32-+ H2O )(10)CaO与SiO2::CaO+SiO2CaSiO3(11)SiO2 与HF:SiO2 + 4HF = SiF4 + 2H2O(12)Na2SiO3 与HCl:Na2SiO3 +2HCl=2NaCl+H2SiO3↓(13)Na2SiO3 与H2O与CO2:Na2SiO3 + H2O+CO2 =Na2CO3 + H2SiO3↓(强酸制弱酸)(14)Na2SiO3与H2O与CO2 (过量):Na2SiO3 + H2O+ 2CO2 (过量) = 2NaHCO3+H2SiO3↓(15)SiO2与Na2CO3:SiO2 + Na2CO3Na2SiO3+ CO2↑ (16)SiO2 与CaCO3:SiO2 + CaCO3CaSiO3+ CO2↑(工业制玻璃)(17)H2SiO3与NaOH:H2SiO3 + 2NaOH == Na2SiO3 +2H2O(18)H2SiO3分解:H2SiO3 SiO2 + H2O五.氯:(1)Cu与Cl2:Cu+Cl2CuCl2 (棕黄色烟)(2)Cl2与Fe:3Cl2+2Fe2FeCl3(棕黄色烟) (高价产物)(3)Na 与Cl2 :2Na + Cl2 2NaCl (白烟)(4)Cl2 与H2:Cl2 +H22HCl (燃烧苍白色火焰,光照会爆炸)(5)Cl2 与P:3Cl2 + 2P 2PCl3 (液体)(6)Cl2 与P:5Cl2 + 2P 2PCl5(固体) (白色烟雾)(7)Cl2与H2O:Cl2+H2O HCl+HClO (新制氯水成分三分子H2O,Cl2,HClO四离子H+,Cl-,ClO-,OH-)(8)Cl2 与2NaOH:Cl2 + 2NaOH = NaCl + NaClO + H2O(9)Cl2与Ca(OH)2:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (工业制漂白粉)(10)漂白粉的漂白原理Ca(ClO)2与H2O与CO2(少量) :Ca(ClO)2+H2O+ CO2(少量) = CaCO3↓+2HClO (强酸制弱酸)(11)漂白粉的失效原理Ca(ClO)2与H2O与CO2(少量):Ca(ClO)2+H2O+CO2(少量) = CaCO3↓+ 2HClO2HClO2HCl+O2↑(12)FeCl2与Cl2:2FeCl2 + Cl2 = 2FeCl3(13)NaBr 与Cl2:2NaBr + Cl2 == 2NaCl + Br2(2Br - + Cl2 == 2Cl- + Br2)(14)KI + Cl2:2KI + Cl2 == 2KCl + I2(2I- + Cl2 == 2Cl- + I2)(15)实验室制备氯气MnO2与HCl(浓):MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O (MnO2+ 4H+ + 2Cl-Mn2+ + Cl2↑ + 2H2O)(16)NaX与AgNO3:NaX+AgNO3=AgX↓+NaNO3(X=Cl,Br,I)(沉淀不溶于HNO3,根据沉淀颜色鉴别卤离子)(17)NaCl 与AgNO3:NaCl + AgNO3 = AgCl↓ + NaNO3 (白色沉淀)(18)NaBr 与AgNO3:NaBr + AgNO3 = AgBr↓ + NaNO3 (浅黄色沉淀)(19)KI 与AgNO3:KI +AgNO3 = AgI↓ + KNO3 (黄色沉淀)六.硫:(1)Na 与S加热:2Na + S Na2S(2)Fe与S:Fe+S FeS(3)Cu与S:2Cu+S Cu2S (低价产物)(4)H2与S:H2 + S H2S(5)S 与O2:S + O2 SO2(6)S 与NaOH:3S + 6NaOH 2Na2S + Na2SO3 + 3H2O (3S + 6OH-2S2- + SO32- + 3H2O)(7)SO2:与H2O:SO2+H2O H2SO3(注意“可逆反应”的定义)(8)NaOH与SO2 (少量):2NaOH+ SO2 (少量) = Na2SO3 + H2O(9)NaOH与SO2(过量):NaOH+ SO2(过量)= NaHSO3(10)Ca(OH)2 与SO2 (少量) :Ca(OH)2 + SO2 (少量) =CaSO3↓+ H2O(11)Ca(OH)2 与SO2(过量):Ca(OH)2 + SO2(过量)=Ca(HSO3)2(12)CaO与SO2:CaO+ SO2 = CaSO3(13)SO2与O2:2SO2+O2 2SO3(14)Cl2与SO2:Cl2+SO2 +2H2O=H2SO4+2HCl (同Br2、I2) (Cl2+SO2 +2H2O= 4H+ + SO42- + 2Cl-)(15)H2S 与SO2:2H2S + SO2= 2H2O + 3S↓(16)SO3与H2O:SO3+H2O=H2SO4(17)CaO与SO3:CaO+ SO3 = CaSO4(18)H2S 与O2(少量):2H2S + O2(少量) 2H2O+2S (19)H2S + O2(足量):2H2S + 3O2(足量) 2H2O + 2SO2(20)FeS 与HCl:FeS + 2HCl = H2S↑ + FeCl2(同H2SO4,实验室制备H2S)(21)FeS2与O2:4FeS2+11O22Fe2O3 + 8SO2(22)SO3与H2O:SO3+H2O=H2SO4(工业制硫酸)七.氮(1)N2与H2:N2+3H22NH3(工业合成氨)(2)N2与O2:N2+O22NO(3)N2 与Mg:N2 + 3Mg Mg3N2(4)NO 与O2:2NO + O2 = 2NO2(5)2NO 2 N2O4(6)NO2与H2O:3NO2+H2O = 2HNO3+NO(7)NO与3O2与2H2O:NO+3O2+2H2O=4HNO3(8)NO2与O2与H2O:4NO2+O2+2H2O=4HNO3(9)Na2SO3与H2SO4:Na2SO3+H2SO4=Na2SO4+SO2 +H2O (实验室制备SO2)(10)Na2SO3 + O2:2Na2SO3 + O2 = 2Na2SO4(11)SO2(少量) 与NH3 与H2O: SO2(少量) + 2NH3 + H2O = (NH4)2SO3(12)NH3+H2O NH3·H2O NH4++OH-(13)NH3 与HCl :NH3 + HCl = NH4Cl(白烟)(14)NH3 与HNO3:NH3 + HNO3 = NH4NO3(白烟)(15)NH3 与H2SO4:2NH3 + H2SO4 = (NH4)2SO4(16)NH3与O2:4NH3+5O2 4NO+6H2O(17)NO + O2:2NO + O2 = 2NO2(18)NO2+H2O:3NO2+H2O=2HNO3+NO(工业制硝酸)(19)NH4Cl受热分解:NH4Cl NH3↑+HCl↑(20)NH4HCO3受热分解:NH4HCO3NH3↑+ H2O +CO2↑(21)(NH4)2SO4与NaOH:(NH4)2SO4 + 2NaOHNa2SO4 + 2NH3↑+ 2H2O (用于检验NH4+)(22)NH4Cl 与Ca(OH)2:2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑+2H2O(实验室制氨气)八.硫酸(1)H2SO4(浓) 与Cu:2H2SO4(浓) + Cu CuSO4 + 2H2O + SO2↑(2)H2SO4(浓) 与Zn:2H2SO4(浓) +Zn = ZnSO4 + 2H2O + SO2↑(3)H2SO4(浓) 与Fe(少量):6H2SO4(浓) + 2FeFe2(SO4)3 + 6H2O + 3SO2↑ (Fe少量)(4)H2SO4(浓) 与C:2H2SO4(浓) + C CO2↑ + 2H2O + 2SO2↑(5)H2SO4(浓) 与S:2H2SO4(浓) + S 2H2O + 3SO2↑(6)H2S + H2SO4(浓):H2S + H2SO4(浓)= S↓+ SO2↑+ 2H2O(7)HBr + H2SO4(浓):2HBr + H2SO4(浓)= Br2 + SO2↑+ 2H2O(8)HNO3遇光分解:4HNO3 4NO2↑+ O2↑+ 2H2O(硝酸显黄色的原因)(9)Cu与HNO3(浓)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑+ 2H2O)(10)HNO3(稀)与Cu:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O)(11)HNO3(浓)与Fe:6HNO3(浓) + Fe Fe(NO3 )3+ 3H2O + 3NO2↑(12)HNO3(稀)与Fe(足量):8HNO3(稀) + 3Fe(足量)= 3Fe(NO3)2+2NO↑+4H2O(13)HNO3(稀)与Fe(少量):4HNO3(稀) + Fe(少量)= Fe(NO3)3 + NO↑ + 2H2O(14)C与HNO3(浓):C + 4HNO3(浓) CO2↑+ 4NO2↑+ 2H2O。
高一化学必修1重要方程式及离子方程式汇总(精选)
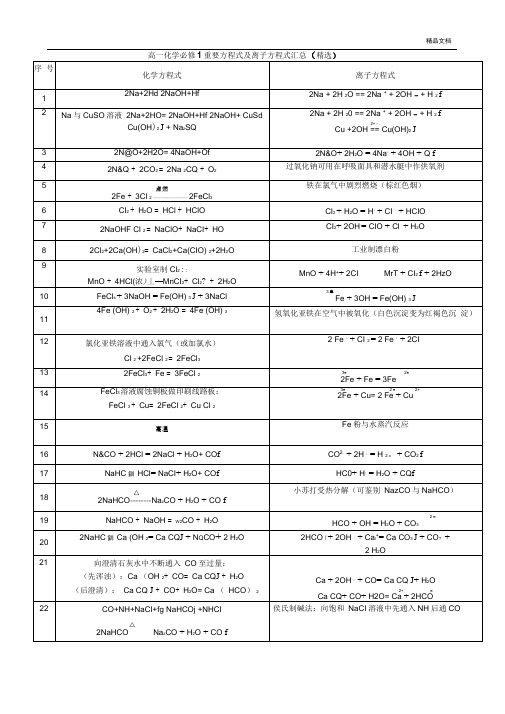
2FeCl3+Fe=3FeCl2
3+2+
2Fe+Fe=3Fe
14
FeCl3溶液腐蚀铜板做印刷线路板:
FeCl3+Cu=2FeCl2+Cu Cl2
3+2+2+
2Fe+Cu=2Fe+Cu
15
高温
Fe粉与水蒸汽反应
16
N&CO+2HCl=2NaCl+H2O+ COf
CO2-+2H+=H2。+CO2f
17
△
2fSQ(浓)+CuCuSO+ SO2T+2H2O
42
△
2H2SO(浓)+S3SOT+2H2O
Mg+2H2O=2Mg(OH)2J+H2T
43
点燃
2Mg+CO22MgO+C
现象:发出耀眼白光,试管壁纸生成黑色小颗粒
44
海水中提镁
Mg +Ca(OH)2(石灰乳)=Mg(OH)2J+Ca2
Mg(OH)+2HCI = MgCI2+2H2O MgCb(熔融)=Mg+CI2T
38
2NaOH+SQ(少量)=Na2SO + H2O
SO+2OH—==SO32—+H2O
39
NaOH+SO(足量)=NaHSO
SQ+OH—==HSOs—
40
Na^SO+H2SQ = NazSQ+SO2T+H2O
(实验室制SO)
SQ+2H==SO2T+H2O
高一化学必修化学方程式及离子方程式汇总(背诵版)

47
Cl2+ 2KI=2KCl + I2
Cl2+ 2I-== 2Cl-+ I2
48
2C+SiO2 Si+2CO(制得粗硅)
Si(粗)+2Cl2 SiCl4SiCl4+2H2 Si(纯)+4HCl
SiCl4+2H2 Si(纯)+4HCl
49
Si+2NaOH+H2O=Na2SiO3+2H2↑
38
Cl2+SO2+2H2O=H2SO4+2HCl(Cl2可换成Br2或I2)
Cl2+ SO2+ 2H2O == 2Cl-+ SO42-+ 4H+
39
2NaOH+SO2(少量)=Na2SO3+H2O
SO2+ 2OH-==SO32-+ H2O
40
NaOH+SO2(足量)=NaHSO3
SO2+ OH-== HSO3-
Cl–
加AgNO3溶液和稀HNO3
产生白色沉淀
Ag++ Cl–=AgCl↓
SO42–
先加HCl,后加BaCl2
产生白色沉淀
Ba2++SO42–=BaSO4↓
CO32–
加盐酸后,产生的气体通入澄清石灰水
产生无色气体,此气体能使澄清石灰水变浑浊
2H++CO32–=CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O
13
2FeCl3+Fe=3FeCl2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
( 1) HCl ——
( 2) HNO 3—— ( 3) H 2SO4—— ( 4) HF—— ( 5) H 2S—— ( 6) H 2CO3—— ( 7) H 2SO3—— ( 8) H 3PO4—— ( 9) HClO —— ( 10) CH 3COOH —— ( 11) KOH —— ( 12) Ca(OH) 2—— ( 13) NaOH —— ( 14) Ba(OH) 2—— ( 15) Fe(OH) 2—— ( 16) Mg(OH) 2—— ( 17) Al(OH) 3—— ( 18) NH 3 H2O—— ( 19) NaCl —— ( 20) KNO 3—— ( 21) NH 4Cl—— ( 22) Na2CO3—— ( 23) Na2SO4——
( 24) MgCl 2——
( 25) CuCl 2——
( 26) CuSO4——
( 27) FeCl2——
( 28) AgNO 3——
( 29) NH 4NO3——
( 30) BaBr 2——
( 31) AlCl 3——
( 32) Al 2(SO4)3——
( 33) CH3COONa ——
( 34) NaHCO 3——
( 35) NaHSO4——
书写离子方程式
-1
完成下列化学方程式,并改写为离子方程式
1. 硫酸和氢氧化钠
2. 碳酸钾和盐酸
3. 硫酸钠和氯化钡
4. 盐酸和氢氧化钾
5. 碳酸钠和盐酸
6. 硫酸钾和硝酸钡
7. 硫酸和氢氧化钾
8. 碳酸钠和硫酸
9. 硫酸镁和氯化钡 10.碳酸氢镁与澄清的石灰水 书写离子方程式 -2 完成下列化学方程式,并改写为离子方程式 1. 在氢氧化钡溶液加入过量的碳酸氢钠溶液: 2. 在氢氧化钡溶液中加入少量碳酸氢钠溶液: 3. 碳酸氢钡溶液加入足量的氢氧化钠溶液 4. 碳酸氢镁溶液与过量苛性钠溶液反应 5. 过量氨水与氯化铝溶液混合 6. 氯气溶于冷水中 8. 碳酸氢钠溶液中加入过量的石灰水 10.钠粒投入到水中 书写离子方程式 -3 完成下列化学方程式,并改写为离子方程式 1. 钠投入硫酸铜溶液中 3. CaCl2 溶液中通入 CO2 气体 6. 硫酸铜溶液和氢氧化钡溶液作用
7. NH 4HCO 3 与足量 NaOH 溶液混合加热
9. 稀 NH 4Cl 溶液和稀 NaOH 溶液作用
书写离子方程式
-4
完成下列化学方程式,并改写为离子方程式
1. 氯气与氢氧化钠溶液
2. 石灰石与稀盐酸反应
3. 碳酸氢钠溶液中加入少量氢氧化钙溶液
4. 碳酸氢钙溶液中加入过量的氢氧化钠溶液
5. 次氯酸钙 [Ca(ClO) 2] 溶液中通入适量二氧化碳
6. 碳酸钠和稀盐酸反应
7. 氯化铜和氢氧化钠溶液反应
8. 盐酸与氢氧化钠溶液中和
9. 硫酸钠溶液中加入浓的氯化钙溶液
10.氢氧化铜和稀盐酸反应
书写离子方程式
-5
完成下列化学方程式,并改写为离子方程式
1. 向氯化钡溶液中滴加硝酸银溶液
2. 大理石和盐酸反应
3. 在氢氧化钙溶液中滴加碳酸钠溶液
4. 铁屑放入硫酸铜溶液
5. 氧化铜粉末加入稀硫酸
6. 向氨水中通入氯化氢气体
7. 硫酸和 Ba(OH) 2 溶液反应
8. 用稀硫酸清洗铁锈( Fe2O3)
9. 碳酸钠溶液与盐酸混合
10.硫酸铜溶液和氢氧化钡溶液混合
书写离子方程式
-6
完成下列化学方程式,并改写为离子方程式
1. 向足量澄清石灰水中通入二氧化碳
2. 氯化铁溶液和氢氧化钾溶液反应
3. 锌与硫酸铜反应
4. 向澄清石灰水中加硝酸
5. 用石灰石与盐酸反应制取二氧化碳
6. 锌粉加入硫酸氢钠溶液中
7. 向 Na2CO3 溶液中滴加几滴稀盐酸
8. 硫酸中加入氢氧化钾溶液
9. 氢氧化钡和稀硫酸
离子反应 离子反应方程式练习题
-1
1. 下列各化学反应的离子方程式中,有错误的是( )
+ 3+
A. 氢氧化铝跟盐酸反应: Al(OH) 3+3H = Al
+3H 2O
3+ 2+ 2+
B. 浓三氯化铁溶液跟铜反应: Fe +Cu = Fe +Cu
D. 甲酸跟氢氧化钠溶液反应: HCOOH+OH - = HCOO -+H 2O
E. 金属钠跟水反应: Na+2H 2O=Na+ +2OH -+H 2↑
2. 下列反应的离子方程式不正确的是( )
A. 醋酸加入氨水
CH 3COO - +NH 4 + +H2O
CH3COOH + NH 3·H2O
B. 铜片插入硝酸银溶液:
Cu+Ag += Cu2++Ag
2- 3 -
2
C. 碳酸钙加入醋酸: CO 3 2↑ +2CH3 O
+2CH COOH = CO COO +H
D. 硫氰化钾溶液加入三氯化铁溶液:
Fe3+ +SCN - = [Fe(SCN)]
2+
3. 在强酸性溶液中能大量共存并且溶液为无色透明的离子组是
A. NH
4
+,Al 3+, SO4 2-, NO 3-
B. K
+ , Na+, AlO 2-(弱酸酸根 ), NO 3-
C. K + , NH 4+, MnO 4- ,SO4 2- D. Na +,K + ,NO3 -, HSO
3
-
4. 下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是(
A. K + 、 MnO 4 -、 Cl -、 SO4 2- B. Na +、 AlO 2 -、 NO 3-、 CO
3
2-
C. Na +、 H +、 NO 3-、SO42- D. Na + 、SO42-、 S2- 、Cl
-
5. 下列各组离子在水溶液中能大量共存的是(
)
A. K + 、 HCO 3 -、 CO32-、 Br - B. CO 32- 、HCO 3 -、 OH -、 K
+
C. Fe3+、 Cu2+、 NO 3-、 SO42- D. H +、 Cl -、 Na+ 、 SO
3
2-
6. 下列各组中,各种微粒能大量共存在的是(
)
A. NH 3 H + Cl - Na+ B. Na+ Cl 2 Br - Cu
2+
- K + OH -2- D. Zn 2+ NO - 3+ H +
C. HCO 3 S 3 Fe
离子反应 离子反应方程式练习题
-2
1. 在无色透明强酸性溶液中,能大量共存的离子组是(
)
A. K + 、 Cu2+、 NO 3- 、SO42- B、 K +、 Na +、 Cl -、 CO
3
2-
C. Zn 2+ 、NH 4 +、 NO 3-、 Cl - D、 K +、 Na +、 MnO 4-、 SO
4
2-
2. . 在 PH=1 无色透明溶液中能大量共存的离子组是(
)
A. Al 3+、 Ag +、 NO3 -、 Cl- B. Mg 2+、 NH 4 + 、NO 3- 、 Cl
-
C. Ba2+ 、K +、S2- 、Cl - D. Cu 2+、 Na +、NO 3- 、SO
4
2-
3. 某工厂排放的工业废水中可能含有 K+ 、Ag + 、NH 4+、Mg 2+、SO42-、Cl -、NO 3- 、
HCO 3- 等离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离
子组合是( )
A. Ag +、 K +、 NO3 - 、 HCO 3 - B. K + 、 NH 4+ 、NO 3- 、 SO
4
2
C. Ag+ 、 NH 4+ 、Mg 2+ 、 HCO 3- D. K + 、Mg 2+ 、SO42- 、 Cl
-
4. 向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略)
,能引起
离子浓度减小的是( )
A. HCO 3- B. Cl - C. OH - D. Cu
2+
5. 下列离子方程式,书写正确的是(
)
A. 盐酸与碳酸钡反应: CO
3 2- +2H+ = CO 2↑ +H2
O
B. 硫酸铜溶液中滴加氢氧化钡溶液:
2+ - 2+ 2-
↓ +Cu(OH) ↓
Ba +2OH +Cu +SO4 = BaSO
4 2
C. 硝酸银溶液中加入铜粉:
Ag + +Cu==Cu 2++Ag↓
D. 铁与稀盐酸反应: + 3+ 2Fe+6H ==2Fe +3H 2↑
) 6. 重金属离子具有毒性。实验室中有甲、乙两种重金属离子的废液,甲废液经化
验呈碱性,主要为有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明
显降低。则乙废液中可能含有的离子是( )
A. Cu 2+和 SO42- B. Cu 2+和 Cl C. K +和 SO
4
2-
D. Ag +和 NO
3
