2013-2018年全国卷高考化学双向细目表(超全)
近三年高考理综考试化学双向细目表

高考化学考试双向细目表2013年化学卷的知识点分布如下2014山东高考化学知识点高仿真试题一7.近来雾霾频现,“PM2.5”数据监测纳入公众视野.“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物.下列有关说法中,错误的是()A.雾霾有可能产生丁达尔现象B.近来雾霾的形成与工业排放的烟气有关系C.“PM2.5”没有必要纳入空气质量评价指标D.雾霾天气严重危害人体健康8.下列关于氮的说法正确的是()A.N2分子的结构较稳定,因而氮气不能支持任何物质燃烧B.23g NO2和N2O4混合气含有0.5N A个氮原子(N A表示阿伏加德罗常数)C.NO可用向上排空气法或者排水法收集D.浓硝酸保存在棕色瓶内是因为硝酸易挥发9.下列离子方程式正确的是()A.硫酸与氢氧化钡溶液反应:Ba2+ + SO42-=BaSO4↓B.铝和氢氧化钠溶液反应:Al+OH- + 3H2O=Al(OH)4-+ H2↑C.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-D.向沸水中逐滴加入FeCl3饱和溶液:Fe3+ +3 H2O Fe(OH)3(胶体) +3H+ 10.下列与有机物的结构、性质有关的叙述正确的是()A.乙烷和乙烯分别与C12反应均有二氯乙烷生成,反应类型相同B .纤维素−−→−水解葡萄糖−−→−氧化CO 2和H 2O (释放能量维持人体生命活动) C .乙醇、乙酸和乙酸乙酯能用饱和Na 2CO 3溶液鉴别D .汽油、水煤气、石蜡和纤维素的主要成分都是碳氢化合物11.臭氧是常见的强氧化剂,广泛用于水处理系统。
制取臭氧的方法很多。
其中高压放电法和电解纯水法原理如下图所示,下列有关说明不正确...的是 ( )A .高压放电法,反应的原理为:3O 2 2O 3B .高压放电出来的空气中,除含臭氧外还含有氮的氧化物C .电解法,电极b 周围发生的电极反应有:3H 2O-6e -=O 3+6H +;2H 2O-4e -=O 2+4H +D .电解时,H +由电极a 经聚合固体电解质膜流向电极b12.25℃,pH=3的醋酸溶液(I )和pH=l l 的氢氧化钠溶液(II ),下列说法正确的是( )A .I 和II 的物质的量浓度均为0.001mol•L﹣1B .将I 稀释l0倍,溶液中c (CH 3COOH )、c (OH ﹣)均减小 C .I 和II 溶液混合,若c (OH ﹣)>c (H +),则氢氧化钠过量D .I 和II 等体积混合后,溶液中离子浓度大小为c (CH 3COO ﹣)>c (Na +)>c (H +)>c (OH ﹣)13.如图,25℃时,在含有Pb 2+、Sn 2+的某溶液中,加入过量金属锡(Sn ),发生反应Sn (s )+Pb 2+(aq )Sn 2+(aq )+Pb (s )△H 体系中c (Pb 2+)和c (Sn 2+)变化关系下列判断正确的是( )A .往平衡体系中加入金属铅后,c (Pb 2+)增大B .往平衡体系中加入少量Sn (NO 3)2固体后,c (Pb 2+)不变 C .升高温度,平衡体系中c (Pb 2+)增大,说明该反应△H<0 D .c (Pb 2+)曲线表示正反应的快慢,c (Sn 2+)曲线表示逆反应的快慢28.(17分)工业上通常以铝土矿(主要成分为Al 2O 3,含有少量Fe 2O 3、SiO 2等杂质)为原料制备无水氯化铝:2Al 2O 3+6Cl 24AlCl 3+3O 2 ↑回答以下问题:(1)画出Al 的原子结构示意图 ;Cl 元素在元素周期表第 周期 族。
高考化学试题双向细目表

6
7 一般
全部
常见无机物及其应用-卤素及其化合物-氯及其化合物-氯气
6
7 较难
全部
化学反应原理-化学反应原理综合考查
6
7 一般
全部
物质结构与性质-元素周期表 元素周期律-元素周期律-元素周 6
期律的应用-微粒半径大小的比较方法
7 一般
全部
化学反应原理-化学能与电能-原电池-原电池原理-原电池电极反 6
11 困难
全部
化学反应原理-化学能与热能-化学反应中能量变化-盖斯定律及 14
11 较难
全部
五、有机推断题
12 较难
全部
其有关计算-盖斯定律与热化学方程式
物质结构与性质-原子结构与性质-基态原子核外电子排布的表 15
示-核外电子排布规律
共 15
分
有机化学基础-烃的衍生物-卤代烃-卤代烃的性质-卤代烃的消去 15
反应
应式书写
7 较难
全部
化学反应原理-水溶液中的离子平衡-水的电离及溶液的酸碱性6
酸碱中和滴定
二、工业流程题
共 14 分
8 一般
全部
认识化学科学-氧化还原反应-氧化还原反应综合分析-氧化还原 14
反应方程式的配平
பைடு நூலகம்
三、实验题
共 14 分
9 一般
全部
常见无机物及其应用-铁及其化合物-铁盐
14
四、原理综合题
共 29 分
2020 年高考化学试题双向细目表
考查范围:常见无机物及其应用、有机化学基础、化学反应原理、物质结构与性质、认识化
学科学
题号 难度 考查范围
知识点
分值
一、单选题
(完整word)2013-2018年全国卷高考化学双向细目表(超全)

中
12
6
元素周期表及周期律
√
中
13
6
电化学的综合运用
√
√
难
非选择题
26
14
1.实验基本操作及仪器识别
2.方程式的书写,实验分析
3.实验综合考察
√
√
√
中难
27
14
1.氧化还原反应方程式的书写
2.流程图分析
3.电极反应式的书写
4.中和滴定,氧化还原反应方程式的书写
√
√
中难
28
15
1.盖斯定理,速率计算
√
√
中
36
15
流程推断,反应类型判断,分子式书写,官能团,核磁共振氢谱
√
√
中
2017年全国卷I高考化学双向细目表
题号
分数
知识目标
能力目标
试题体现的
主要化学思想
备注
2017考纲要求的核心考点
接受、吸收、整合信息能力
分析和解决
问题的能力
化学实验与
探究的能力
选择题
7
6
有机物的化学组成
√
考察必备知识
8
6
化学实验操作方法(弘扬中华优秀传统文化)
√
选做题
35
15
紫光的波长、能层符号、电子云轮廓图的形状、杂化类型、几何构型、配位数、晶胞的不同取法
√
√
36
15
有机物的推断、名称、反应类型、化学反应方程式的书写、同分异构体的书写、合成路线的设计
√
√
2016年全国Ⅰ卷双向细目表
2.平衡移动,K的计算,
√
√
中难
2018年全国高考理综I(乙)卷化学命题双向细目表
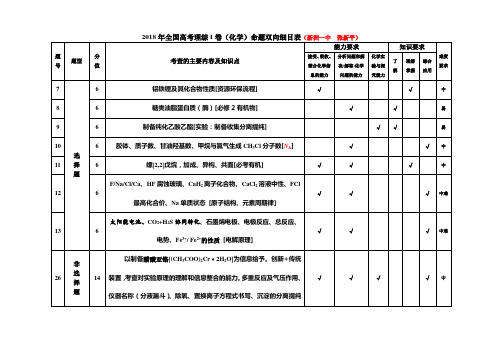
能力要求
题 号 题型 分 值
知识要求
化学实 了 理解 掌握 综合 要求 解 究能力 应用 验与探 难度
考查的主要内容及知识点
接受、 吸收、 分析问题和解 整合化学信 息的能力 决(解答)化学 问题的能力
7 8 9 10 11 选 择 题
中
操作、装置缺陷。 [无机实验] 生产 Na2S2O5 为背景的工艺流程题, 主要考查了 NaHSO3 过饱和溶液经 27 14 结晶脱水、过饱和溶液的获得、电解原理及电极反应式、信息型化学方 程式、氧化还原离子方程式、S 守恒的计算等。 [概理+元化+计算] N2O5 为硝化剂的一种新型的绿色硝化技术为背景的化学反应原理题。 考查涉及氧化产物判断、盖斯定律计算(△H) 、分压及依据分压计算速 28 15 率、平衡常数,温度对体系分压及平衡的影响,有效碰撞、活化能等。 [概理+计算] 锂及其相关化合物/电子排布图及其能力高低、 离子半径大小及其原因、
C12H18O3、ห้องสมุดไป่ตู้成乙醇酯的试剂、条件、同分异构体及结构简式书写(核 磁共振氢谱) 、含氧官能团的名称羟基和醚键、苯甲醇为起始原料制备
√
√
√
√
中
苯乙酸苄酯的合成路线[选 5]
√ √ √ √ √ √ √ √
√
中
易
易
√ √
中
中
12
6 最高化合价、Na 单质状态 [原子结构、元素周期律] 太阳能电池、CO2+H2S 协同转化、石墨烯电极、电极反应、总反应、
√
√
√
中难
13
6 电势、Fe / Fe 的性质 [电解原理]
全国二卷2013年高考双向细目表(金存会)
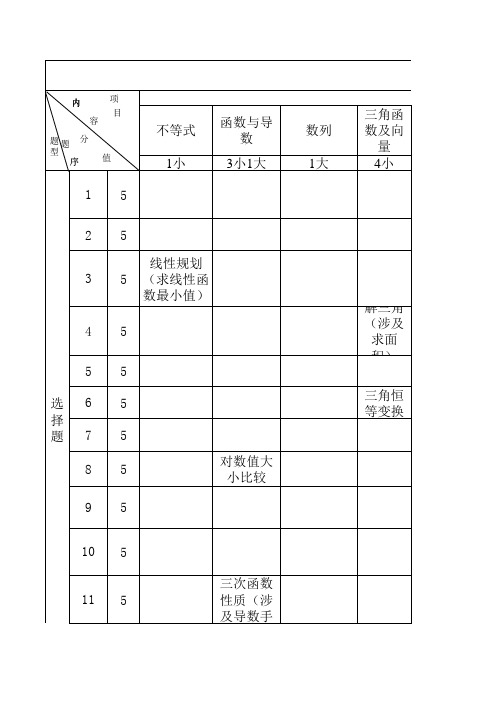
11
5
12 13 14 15 16 17 18
5 5 5 5 5 12 12
函数性质 综合(涉 及恒成 数量积
三角函 数图像 等差数列综 合
19 解 答 题
12
20 21 22
12 12 10 导数(涉 及指数函 数)
23 选 10 考 24 10
总 150 5 27 12 20 计 备注:难度系数在0.8以上为易,在0.5-0.8之间为中,在0.3-0.5之间为较难
2013
内
项 容 目
知识 不等式 函数与导 数 3 小1 大 数列 1大 三角函 数及向 量 4小
题题 分 型 序
值
1小 5 5 5 线性规划 (求线性函 数最小值)
1 2 3
4 5 选 择 题 6 7 8 9 10
5 5 5 5 5 5 5 三次函数 性质(涉 及导数手 对数值大 小比较
解三角 (涉及 求面 三角恒 等变换
22
22
17
5
,在0.3-0.5之间为较难,在0.3以下的为难。
细目表
知识要求 集合与简易 逻辑、复数 了 理 掌 解 解 握 及选考 能力要求 空 运 抽象 推理 数据 应用 创新 间 算 概括 论证 处理 意识 意识 想 求 能力 能力 能力 象 解 √ √ √ √ √
交集运算 求复数模(涉 及复数运
2013年高考数学全国二卷文科双向细目表
知识内容 立体几何 2 小1 大 解析几何 2 小1 大 排列组合二项式 概率统计 1小1大 算法与推理 1小
椭圆离心率
程序框图(涉 及求和)
三视图(在坐标系 下的投影) 抛物线与直 线
古典概型
四棱锥和球
以直三棱柱为背景 证明线面平行和求 其中三棱锥体积 建立随机变量函 数关系以及求其 取值概率(以农 产品销售为背 景) 圆与双曲线
近三年高考理综考试化学双向细目表

近三年高考理综考试化学双向细目表高考化学考试双向细目表年份题号呈现形式考查知识点考查层次分值 9 选择题化学基本概念、化学与生活综合考查了解 4 10 选择题考查基础知识掌握情况了解 4 11 选择题物质结构、元素周期律理解 4 12 选择题石油产品、乙醇、乙烯的性质理解4 13 选择题阿伏加德罗常数理解 4电离平衡常数、焓变、化学反应速率4 14 选择题理解影响因素15 选择题沉淀溶解平衡、溶度积常数关系图像应用 4 2008年 28 填空题氧化还原原理、离子检验综合应用 14 考题热化学方程式焓变、燃料电池原理、12 分析 29 填空题综合应用电离平衡、盐类水解等除杂、洗涤、溶液的配制、电解原理、16 30 实验题综合应用仪器组装等。
31 选做题钢铁冶炼等化学与技术知识综合应用 8电子排布式、共价键类型、晶体类型8 32 选做题综合应用等有机结构简式的推断与书写、反应类8 33 选做题综合应用型、官能团等综合考查化学基本概念、化学与生活、化学与4 9 选择题了解社会的综合考查10 选择题基本概念、基本理论、实验室制法理解 4物质结构、元素周期律 4 11 选择题理解有机物的性质、基本反应类型、有机4 12 选择题理解物鉴别 13 选择题元素化合物知识综合考查理解 4 14 选择题化学反应速率和化学平衡理解 4 2009年 15 选择题电解质、平衡常数综合应用 4 考题化学平衡的移动、焓变、盖斯定律、14 分析 28 填空题沉淀溶解平衡、电离平衡常数有关计综合应用算 29填空题原电池原理和电解原理综合应用 12 化学实验的基本操作、物质的提纯与16 30 实验题综合应用鉴别、尾气处理等31 选做题化学与技术模块、电解铝的有关问题综合应用 8物质结构与性质、原子结构、杂化方8 32 选做题综合应用式综合考查有机推断与合成、官能团、结构简式8 33 选做题综合应用综合考查同位素、同分异构体、阿伏加德罗常 4 数、物质的量基本计算、化学研究的9 选择题了解理解 2010年范畴考题化学反应的能量、盖斯定律、反应速4 10 选择题了解率化学键、元素周期律的实质、同周期4 11 选择题理解同主族的递变规律。
(完整版)高中化学高考试卷双向细目表分析

精典样卷分析姓名:__ 分值:_____ _一、试卷与命题1、命题依据和原则依据:本套试题在设计要求按照新课程理念要求,依据广东省考试大纲,以能力考查为基本出发点,立足基础知识,重点加强对重要化学知识、实验与探究能力的考查。
重点考查了元素化合物重要性质、电解质溶液、原电池、元素周期表及元素周期律、化学平衡、氧化还原反应和有机化学等化学主干知识,知识回忆与化学计算相结合,无机与有机相结合,考查考生思维的灵活性、广阔性和全面性。
原则:本着试卷要有较高信度,效度,适宜难度,和很好区分度的原则,全套试卷考查范围须知识点全面,不偏不倚,较少或没有重复考查,没有偏题怪题,能很好地区分各类水平的学生。
2、命题特点(指出优点和不足)本套试卷覆盖知识点全面,考查知识点均为考试大纲中重要考查要点。
题量题型均符合考纲要求。
整张试卷的试题体现了考生对重要知识点的理解掌握能力,和对所学化学知识的全面了解熟悉程度以及考生对知识理解延伸能力。
整体考试难度处于中点偏上水平,对考生能力和水平的考查有良好的信度,效度,区分度。
不足在于,同类型题目出得略有重复(如选择题中图像考查);无机推断题涉及太多没学的化学方程式(可设计1,2个未学方程式,但这道题有4个),导致普遍考生推断困难。
实验题考查题目设计不够严谨,给考生模棱两可的理解,和下笔困难的感觉。
3、试卷结构及双向细目表二、学生考试基本情况分析本试卷既考查了学生的基础知识,又考查了学生对高中化学所学重要知识点的掌握和熟悉程度。
还侧重了学生对所学知识的延伸思考和学习能力。
学生普遍对试卷中考查的重要知识点掌握良好,如阿伏伽德罗常数;化学反应原理及化学反应平衡;离子检验;元素周期律的知识点等。
但对思维要求能力偏高如最后一道有机推断题的推断和填写这类解题能力有待提高;对知识延展思维能力考核的题目如无机推断题的推断和掌握都有所欠缺;另外对实验题的解题能力和技巧以及题型的应变处理能力都需要努力地提高。
近5年化学高考题双向细目表 总
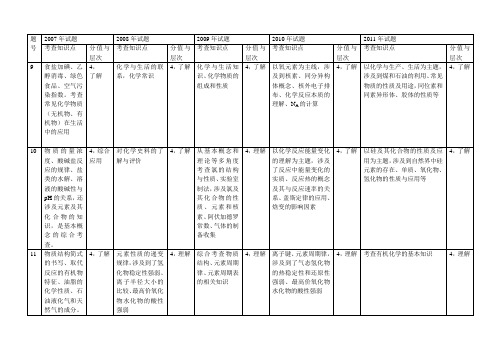
电子排布式,键能,晶体,微粒间作用力
8,了解,理解
电子排布式、电负性、杂化、离子晶体以及σ键、π键的形成
8,了解,理解
杂化、微粒间的作用力、电负性、价层电子对互斥理论、晶胞结构与计算
8,了解,理解
综合考查了原子核外电子排布、轨道杂化、微粒间的作用力、晶胞结构与计算等主干知识,覆盖面较广
主要考查弱电解质的电离平衡及影响因素
4,综合应用
15
与化学反应相关的物质的量浓度计算
4,综合应用
沉淀的溶解与沉淀的生成过程、影响Ksp的因素
4,综合应用
考查强弱电解质稀释过程中水的离子积、pH、微粒浓度等的变化
4,了解,理解
沉淀溶解平衡的有关概念和原理
4,综合应用
着重考查电化学知识,涉及电解池、原电池、金属的腐蚀和防护、相关化学计算,并与反应速率相结合
题号
2007年试题
2008年试题
2009年试题
2010年试题
2011年试题
考查知识点
分值与层次
考查知识点
分值与层次
考查知识点
分值与层次
考查知识点
分值与层次
考查知识点
分值与层次
9
食盐加碘、乙醇消毒、绿色食品、空气污染指数。考查常见化学物质(无机物、有机物)在生活中的应用
4,
了解
化学与生活的联系,化学常识
以钠、硫及其化合物为载体,除了考查常见无机物的应用外,重点考查原电池的形成条件、电极反应式的书写、电解质在水溶液中的行为等
12,综合应用
30
气体的除杂干燥,CO还原CuO的实验操作,二氧化碳的检验,二氧化碳与氢氧化钠的反应,稀硫酸与碳酸钠(碳酸氢钠)的反应,过氧化钠与二氧化碳的反应,乙醇的催化氧化,浓氨水与氢氧化钠固体产生氨气的原因分析,氨的催化氧化反应,一氧化氮转化为二氧化氮的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选做题
35
15
紫光的波长、能层符号、电子云轮廓图的形状、杂化类型、几何构型、配位数、晶胞的不同取法
√
√
36
15
有机物的推断、名称、反应类型、化学反应方程式的书写、同分异构体的书写、合成路线的设计
√
√
2016年全国Ⅰ卷双向细目表
√
古文阅读
9
6
有机物的结构、性质、同分异构体种数
√
10
6
H2还原金属氧化物的实验操作、除杂顺序、注意事项、启普发生器的使用
√
知识迁移能力
11
6
金属的防护—外接电源的阴极保护法
√
√
辅助阳极不参与反应
12
6
元素周期律(元素的推断、位置、物质性质、结构)
√
氨气做制冷剂、S2O32-与H+的反应
13
6
弱电解质的电离、电力平衡常数、盐类水解、离子浓度大小比较
分析和解决
问题的能力
化学实验与
探究的能力
选择题
7
6
化学与生活,环保,蛋白质,
√
易
8
6
质子数,中子数,化学键,原子个数的计算
√
中
9
6
有机物的性质
√
易
10
6
实验操作
√
√
中难
11
6
电化学的综合运用
√
中
12
6
滴定曲线图
√
√
难
13
6
元素周期表及周期律
√
√
中难非Biblioteka 择题26141.实验操作2溶液的配置
3中和滴定,纯度计算
√
√
读图能力、数学与化学联系
运用图像中的数据对信息进行加工整理
非选择题
26
15
化学实验基本操作、仪器的使用、识别、计算
√
√
√
观察、自学、综合分析、判断、计算
27
14
实验条件的选择、离子(化学)方程式的书写、KSP的应用
√
√
氧化还原
28
14
酸性强弱的比较、盖斯定律、化学平衡的计算、移动、热效应的判断
√
分析和解决
问题的能力
化学实验与
探究的能力
选择题
7
6
化学与生活(漂白粉,钡餐,抗酸药)
√
易
8
6
化学与环境保护,识图
√
中
9
6
有机物甲烷的取代反应
√
易
10
6
元素周期表及周期律,化学键
√
中难
11
6
NA的相关计算
√
中
12
6
电化学的综合运用
√
中难
13
6
实验综合考察(溶液的配置,气体纯化,探究速率,维生素C的还原性检验)
√
√
中
36
15
流程推断,反应类型判断,分子式书写,官能团,核磁共振氢谱
√
√
中
2017年全国卷I高考化学双向细目表
题号
分数
知识目标
能力目标
试题体现的
主要化学思想
备注
2017考纲要求的核心考点
接受、吸收、整合信息能力
分析和解决
问题的能力
化学实验与
探究的能力
选择题
7
6
有机物的化学组成
√
考察必备知识
8
6
化学实验操作方法(弘扬中华优秀传统文化)
2.平衡移动,K的计算,
√
√
中难
选做题
35
15
电子排布图,微粒半径判断,空间结构,杂化,化学键,电离能,键能,晶格能,晶胞密度计算
√
√
中
36
15
流程推断,反应类型判断,分子式书写,官能团,同分异构体
√
√
中
2018年全国卷Ⅱ高考化学双向细目表
题号
分数
知识目标
能力目标
难度要求
2017考纲要求的核心考点
接受、吸收、整合信息能力
35
15
电子排布图,电子轮廓图,价层电子对互斥理论,分子的性质,空间结构,杂化,化学键,电离能,晶胞密度计算
√
√
中
36
15
流程推断,反应类型判断,分子式书写,官能团,核磁共振氢谱,同分异构体
√
√
中
2018年全国卷Ⅲ高考化学双向细目表
题号
分数
知识目标
能力目标
难度要求
2017考纲要求的核心考点
接受、吸收、整合信息能力
√
中
12
6
元素周期表及周期律
√
中
13
6
电化学的综合运用
√
√
难
非选择题
26
14
1.实验基本操作及仪器识别
2.方程式的书写,实验分析
3.实验综合考察
√
√
√
中难
27
14
1.氧化还原反应方程式的书写
2.流程图分析
3.电极反应式的书写
4.中和滴定,氧化还原反应方程式的书写
√
√
中难
28
15
1.盖斯定理,速率计算
√
√
√
中难
27
14
1.名称书写;氯气性质,氧化还原反应
2.电极反应式的书写;电池具体分析
√
√
中难
28
15
1.反应方程式书写
2.盖斯定律计算
3.转化率计算,平衡常数,平衡移动,图像分析
√
√
中难
选做题
35
15
电子排布式,第一电离能,价层电子对互斥理论,分子的性质,空间结构,杂化,化学键,金属的堆积方式,晶胞密度计算
√
√
√
难
非选择题
26
14
锌元素1.方程式的书写,流程图分析。
2离子方程式书写3电化学,电极反应式的书写
√
√
中难
27
14
1.盖斯定理,平衡移动,K的计算
2.看表格整合知识,识图,速率,平衡常数
√
√
中难
28
15
1.氧化还原方程式,2实验操作3物质检验(Fe2O3)4中和滴定(终点判断,计算)
√
√
√
中难
选做题
2018年全国卷I高考化学双向细目表
题号
分数
知识目标
能力目标
难度要求
2017考纲要求的核心考点
接受、吸收、整合信息能力
分析和解决
问题的能力
化学实验与
探究的能力
选择题
7
6
新型电池、环境保护、流程图
√
中
8
6
基本营养物质及性质
√
易
9
6
乙酸乙酯的制备及基本实验操作
√
易
10
6
NA的相关计算
√
中难
11
6
有机物结构及同分异构体、性质
