2018年全国卷I-Ⅱ-Ⅲ高考化学双向细目表
(完整word)2013-2018年全国卷高考化学双向细目表(超全)

中
12
6
元素周期表及周期律
√
中
13
6
电化学的综合运用
√
√
难
非选择题
26
14
1.实验基本操作及仪器识别
2.方程式的书写,实验分析
3.实验综合考察
√
√
√
中难
27
14
1.氧化还原反应方程式的书写
2.流程图分析
3.电极反应式的书写
4.中和滴定,氧化还原反应方程式的书写
√
√
中难
28
15
1.盖斯定理,速率计算
√
√
中
36
15
流程推断,反应类型判断,分子式书写,官能团,核磁共振氢谱
√
√
中
2017年全国卷I高考化学双向细目表
题号
分数
知识目标
能力目标
试题体现的
主要化学思想
备注
2017考纲要求的核心考点
接受、吸收、整合信息能力
分析和解决
问题的能力
化学实验与
探究的能力
选择题
7
6
有机物的化学组成
√
考察必备知识
8
6
化学实验操作方法(弘扬中华优秀传统文化)
√
选做题
35
15
紫光的波长、能层符号、电子云轮廓图的形状、杂化类型、几何构型、配位数、晶胞的不同取法
√
√
36
15
有机物的推断、名称、反应类型、化学反应方程式的书写、同分异构体的书写、合成路线的设计
√
√
2016年全国Ⅰ卷双向细目表
2.平衡移动,K的计算,
√
√
中难
2018年全国高考理综I(乙)卷化学命题双向细目表
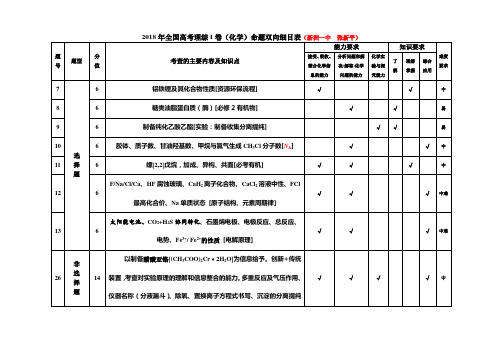
能力要求
题 号 题型 分 值
知识要求
化学实 了 理解 掌握 综合 要求 解 究能力 应用 验与探 难度
考查的主要内容及知识点
接受、 吸收、 分析问题和解 整合化学信 息的能力 决(解答)化学 问题的能力
7 8 9 10 11 选 择 题
中
操作、装置缺陷。 [无机实验] 生产 Na2S2O5 为背景的工艺流程题, 主要考查了 NaHSO3 过饱和溶液经 27 14 结晶脱水、过饱和溶液的获得、电解原理及电极反应式、信息型化学方 程式、氧化还原离子方程式、S 守恒的计算等。 [概理+元化+计算] N2O5 为硝化剂的一种新型的绿色硝化技术为背景的化学反应原理题。 考查涉及氧化产物判断、盖斯定律计算(△H) 、分压及依据分压计算速 28 15 率、平衡常数,温度对体系分压及平衡的影响,有效碰撞、活化能等。 [概理+计算] 锂及其相关化合物/电子排布图及其能力高低、 离子半径大小及其原因、
C12H18O3、ห้องสมุดไป่ตู้成乙醇酯的试剂、条件、同分异构体及结构简式书写(核 磁共振氢谱) 、含氧官能团的名称羟基和醚键、苯甲醇为起始原料制备
√
√
√
√
中
苯乙酸苄酯的合成路线[选 5]
√ √ √ √ √ √ √ √
√
中
易
易
√ √
中
中
12
6 最高化合价、Na 单质状态 [原子结构、元素周期律] 太阳能电池、CO2+H2S 协同转化、石墨烯电极、电极反应、总反应、
√
√
√
中难
13
6 电势、Fe / Fe 的性质 [电解原理]
2018年全国卷I Ⅱ Ⅲ高考化学双向细目表

2018年全国卷I Ⅱ Ⅲ高考化学双向细目表2018年全国卷I高考化学双向细目表知识目标:1.新型电池、环境保护、流程图2.基本营养物质及性质3.乙酸乙酯的制备及基本实验操作4.N A 的相关计算5.有机物结构及同分异构体、性质6.元素周期表及周期律7.电化学的综合运用能力目标:1.分析和解决问题的能力2.化学实验与探究的能力难度要求:1.___2.易3.易4.中难5.中6.中7.难非选择题:1.盖斯定理,速率计算2.平衡移动,K 的计算,电子排布图,微粒半径判断,空间结构,杂化,化学键,电离能,键能,晶格能,晶胞密度计算选做题:1.氧化还原反应方程式的书写2.流程图分析3.电极反应式的书写4.中和滴定,氧化还原反应方程式的书写2018年全国卷Ⅱ高考化学双向细目表知识目标:1.化学与生活(漂白粉,钡餐,抗酸药)2.化学与环境保护,识图3.有机物甲烷的取代反应4.元素周期表及周期律,化学键5.N A 的相关计算6.电化学的综合运用7.实验综合考察(溶液的配置,气体纯化,探究速率,维生素C的还原性检验)8.锌元素能力目标:1.分析和解决问题的能力2.化学实验与探究的能力难度要求:1.易2.中3.易4.中难5.中6.中难7.难非选择题:1.物质检验(Fe2O3)2.中和滴定(终点判断,计算)选做题:1.方程式的书写,流程图分析。
2.离子方程式书写3.电化学,电极反应式的书写4.盖斯定理,平衡移动,K 的计算5.看表格整合知识,识图,速率,平衡常数6.氧化还原方程式,实验操作。
2018年高考全国I、Ⅱ、Ⅲ-卷-(化学试题)含答案

2018年普通高等学校招生全国统一考试试卷(全国I卷)化学可能用到的相对原子质量:H 1 7 C 12 N 14 O 16 23 S 3235.5 40 56 I 127一、选择题:本题共6个小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.硫酸亚铁锂(4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有、、C.“沉淀”反应的金属离子为3+D.上述流程中可用硫酸钠代替碳酸钠8.下列说法错误的是A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使₂4褪色D.淀粉和纤维素水解的最终产物均为葡萄糖9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是10.是阿伏加德罗常数的值,下列说法正确的是A.16.25 g 3水解形成的()3胶体粒子数为0.1B.22.4 L(标准状况)氨气含有的质子数为18C.92.0 g甘油(丙三醇)中含有羟基数为1.0D.1.0 4与2在光照下反应生成的3分子数为1.011.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。
下列关于该化合物的说法错误的是A.与环戊烯互为同分异构体B.二氯代物超过两种C.所有碳原子均处同一平面D生成1 C5H12至少需要2 H212.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Z 最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
下列说法正确的是A.常温常压下X的单质为气态B.Z的氢化物为离子化合物C.Y和Z形成的化合物的水溶液呈碱性D.W与Y具有相同的最高化合价13.最近我国科学家设计了一种22S协同转化装置,实现对天然气中2和H2S的高效去除。
高中化学双向细目表

高中化学双向细目表高考化学双向细目表分类序号知识点内容1 物质的组成、性质和分类2 化学基本概念3 物质的分子、原子、离子、元素等概念的含义;初步了解原子团的定义4 物理变化与化学变化的区别与联系5 混合物、纯净物、单质和化合物、金属和非金属的概念6 同素异形体的概念7 酸、碱、盐、氧化物的概念及其相互联系8 熟记并正确书写常见元素的名称、符号、离子符号9 熟悉常见元素的化合价;能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价10 掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法;理解质量守恒定律的含义;掌握热化学方程式的含义11 能正确书写化学方程式、离子方程式、电离方程式、电极反应式12 了解相对原子质量、相对分子质量的涵义13 掌握物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)的含义14 物质的量浓度(mol·L-1)、阿伏加德罗常数的含义15 掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系16 掌握化学反应的四种基本类型:化合、分解、置换、复分解17 理解氧化还原反应,了解氧化剂和还原剂等概念;掌握重要氧化剂、还原剂之间的常见反应18 能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式19 了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念20 了解溶液的涵义21 了解溶液的组成,理解溶质的质量分数的概念22 了解饱和溶液、不饱和溶液的概念;了解溶解度的概念;了解温度对溶解度的影响及溶解度曲线23 初步了解结晶、结晶水、结晶水合物、风化、潮解的概念24 了解胶体的概念及其重要性质和应用25 了解原子的组成及同位素的概念26 掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系注:综合应用部分不在此表中列出。
2019-2020高考备考:2018年高考化学全国卷试题分析含双向细目表及高三复习备考策略

一、2018全国理综化学I卷试题分析
• 今年化学试题与近三年新课标一卷相比风格有所改变,难
度下降,今年试题延续全国新课标高考试题多年来命题的 原则,以生产、生活及科研中的化学现象为问题情境,以考 查考生学科能力为命题立意,全面考查考生的化学基础知 识、基本技能、重要的学科思想和方法,并重视对考生的实
验探究能力以及分析问题、解决问题能力的考查,增大了
电化学及有机化学方面的考察。
(1)2018全国理综化学I卷试题双向细目表
考纲要求 内容 化学实验基 本方法 化学计量在 实验中的应 用
必修1
要求层次 B
B
2018年考查知识及赋分 题号 涉及知识点 赋分 物质的分离提纯;实验 6+6+3+2+ 7,9,26(1)(2)②(3)(4) 操作;实验仪器的名称、 5+2 选择、作用 摩尔质量与物质的量、 质量的关系;气体摩尔 10,27(4)第二空, 6+2 体积与物质的量、体积 的关系;物质残余量的 计算 26(2)①,27(4)第一空 27(4),28(1),8C 离子方程式的书写 方程式书写,氧化产物 的书写,氧化剂 2+2 4+2+6*
2、变化观念和平衡思想,注重化学原理的应用 变化观念和平衡思想指能认识物质是运动和变化的, 知道化学变化需要一定的条件,并遵循一 定规律;认识化学变化的本质特征是有新物质生成,并伴有能量转化;认识化学变化有一定限度、 速率,是可以调控的;能从多角度、动态地分析化学变化,运用化学反应原理解决简单的化学实际 问题。2018年化学全国课标Ⅰ卷主要通过化学原理考查变化观念与平衡思想,注重化学原理的运用。 如第28题的(2)化学原理模块考查题,试题带我们从多角度认识N2O5分解的实质,并提供相关的信 息,考查了盖斯定律、化学反应三段式原理的应用、利用勒夏特列原理解释压强变化、利用分压计 算平衡常数等等。本题对化学平衡的原理应用进行了多方位、多角度的综合考查,涉及到了计算(7
2018年高考化学新课标I卷试题分析与近五年考点分布细目表及2019届高三备考建议与三轮复习时间安排-学术金刚

固体洗涤剂的选择
3、回归课本-----题在课本外,理在课本中
选修4 P26页
•13
3、回归课本-----题在课本外,理在课本中
(2016新课标II卷)27(1)两个反应在热力学上趋势均很大,其原 因是_____;有利于提高丙烯腈平衡产率的反应条件是_______;提 高丙烯腈反应选择性的关键因素是_______。
k1 A+B k2 E+F C+D
平行反应 (竞争反应)
3、回归课本-----题在课本外,理在课本中
流程问题的原型 ——粗盐的提纯
转 化 BaCl2溶液 粗盐 转 化 Na2CO3溶液 混合体系 过滤 滤液 分 离 滤渣
转 化
盐 酸
调pH
蒸发
精盐
NaOH溶液
分 离
3、回归课本-----题在课本外,理在课本中
元素周期律
化学基本实验
元素周期律
化学基本实验 电化学 阿伏伽德罗常数
元素周期律
化学基本实验 电化学 阿伏伽德罗常数 化学与生活
元素周期律
化学基本实验、 物质的分离 电化学
元素周期律
化学基本实验 电化学 阿伏伽德罗常数
化学与生活 电离平衡 化学反应速率 溶解度曲线 物质的性质
化学与生活 电离平衡 工业流程
6.试题结构稳定,对定量思想考察分值与2017年基本相当-----稳定性“一Βιβλιοθήκη 四翼”的理念考 查 目 标
四层
考什么
怎么考
为什么考
考 查 要 求
核心立场
一体
四翼
•5
明确几点 指导工作方向
高三复习阶段安排 一轮复习:2018年7月下旬到2019年 2月初 细致全面、重落实、考纲、回归课本、形成知识系统 二轮复习:2019年2月初到4.20号 专题复习:查漏补缺、对重难点知识的强化、必考点的梳理 三轮复习:4.20号以后
高考化学双向细目表

附:2013、20XX 年化学学科高考双向细目表根据重庆市高考化学考试说明,学生参加高考主要涉及两部分的考查,一部分为化学学习能力和品质,另一部分为分层次的化学知识及运用。
具体如下。
一、对化学学习能力的要求1.接受、吸收、整合化学信息的能力(1)对中学化学基础知识能融会贯通,有正确复述、再现、辨认的能力。
(2)能够通过对实际事物、实验现象、实物、模型、图形、图表的观察,以及对自然界、社会、生产、生活中的化学现象的观察,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储的能力。
(3)从试题提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,重组为新知识块的能力。
2.分析问题和解决(解答)化学问题的能力(1)将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。
(2)将分析解决问题的过程和成果,用正确的化学术语及文字、图表、模型、图形等表达,并做出解释的能力。
3.化学实验与探究能力(1)了解并初步实践化学实验研究的一般过程,掌握化学实验的基本方法和技能。
(2)在解决简单化学问题的过程中,运用科学的方法,初步了解化学变化规律,并对化学现象做出科学合理的解释。
二、对知识内容的要求层次为了便于考查,将高考化学命题对各部分知识内容要求的程度,由低到高分为了解、理解(掌握)、综合应用三个层次,高层次的要求包含低层次的要求。
其含义分别为:了解:对化学化学知识有初步认识,能够正确复述、再现、辨认或直接使用。
理解(掌握):领会所学化学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题,即不仅“知其然”,还能“知其所以然”综合应用:在理解所学各部分化学知识的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体化学问题。
考试分为必考和选考两部分。
(必考内容Ⅰ和必考内容Ⅱ-2014 )必考为必修模块“化学1”、“化学2”和选修模块“化学反应原理” 的内容;选考为选修模块“化学与技术”、“物质结构与性质”、“有机化学基础”的内容,考生从3 个选考模块中任意选考1个模块的内容。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中
12
6
元素周期表及周期律
√
中
13
6
电化学的综合运用
√
√
难
非选择题
26
14
1.实验基本操作及仪器识别
2.方程式的书写,实验分析
3.实验综合考察
√
√
√
中难
27
14
1.氧化还原反应方程式的书写
2.流程图分析
3.电极反应式的书写
4.中和滴定,氧化还原反应方程式的书写
√
√
中难
28
15
1.盖斯定理,速率计算
分析和解决
问题的能力
化学实验与
探究的能力
选择题
7
6
化学与生活(漂白粉,钡餐,抗酸药)
√
易
8
6
化学与环境保护,识图
√
中
9
6
有机物甲烷的取代反应
√
易
10
6
元素周期表及周期律,化学键
√
中难
11
6
NA的相关计算
√
中
12
6
电化学的综合运用
√
中难
13
6
实验综合考察(溶液的配置,气体纯化,探究速率,维生素C的还原性检验)
接受、吸收、整合信息能力
分析和解决
问题的能力
化学实验与
探究的能力
选择题
7
6
化学与生活,环保,蛋白质,
√
易
8
6
质子数,中子数,化学键,原子个数的计算
√
中
9
6
有机物的性质
√
易
10
6
实验操作
√
√
中难
11
6
电化学的综合运用
√
中
12
6
滴定曲线图
√
√
难
13
6
元素周期表及周期律
√
√
中难
非选择题
26
14
1.实验操作
2.平衡移动,K的计算,
√
√
中难
选做题
35
15
电子排布图,微粒半径判断,空间结构,杂化,化学键,电离能,键能,晶格能,晶胞密度计算
√
√
中
36
15
流程推断,反应类型判断,分子式书写,官能团,同分异构体
√
√
中
2018年全国卷Ⅱ高考化学双向细目表
题号
分数
知识目标
能力目标
难度要求
2017考纲要求的核心考点
接受、吸收、整合信息能力
√
√
√
难
非选择题
26
14
锌元素
1.方程式的书写,流程图分析。
2.离子方程式书写
3.电化学,电极反应式的书写
√
√
中难
27
14
1.盖斯定理,平衡移动,K的计算
2.看表格整合知识,识图,速率,平衡常数
√
√
中难
28
15
1.氧化还原方程式,
2.实验操作
3.物质检验(Fe2O3)
4.中和滴定(终点判断,计算)
√
√
√
中难
选做题
35
15
电子排布图,电子轮廓图,价层电子对互斥理论,分子的性质,空间结构,杂化,化学键,电离能,晶胞密度计算
√
√
中
36
15
流程推断,反应类型判断,分子式书写,官能团,核磁共振氢谱,同分异构体
√
√
中
2018年全国卷Ⅲ高考化学双向细目表
题号
分数
知识目标
能力目标
难度要求
2017考纲要求的核心考点
√
√
中
36
15
流程推断,反应类型判断,分子式书写,官能团,核磁共振氢谱
√
√
中
2.溶液的配置
3.中和滴定,纯度计算
√
√
√
中难
27
14
1.名称书写
2.氯气性质,氧化还原反应
3.电极反应式的书写
4.电池具体分析式书写
2.盖斯定律计算
3.转化率计算,平衡常数,平衡移动,图像分析
√
√
中难
选做题
35
15
电子排布式,第一电离能,价层电子对互斥理论,分子的性质,空间结构,杂化,化学键,金属的堆积方式,晶胞密度计算
2018年全国卷I高考化学双向细目表
题号
分数
知识目标
能力目标
难度要求
2017考纲要求的核心考点
接受、吸收、整合信息能力
分析和解决
问题的能力
化学实验与
探究的能力
选择题
7
6
新型电池、环境保护、流程图
√
中
8
6
基本营养物质及性质
√
易
9
6
乙酸乙酯的制备及基本实验操作
√
易
10
6
NA的相关计算
√
中难
11
6
有机物结构及同分异构体、性质
