复旦 物理化学 溶液表面的吸附
溶液表面的吸附现象.
棒状
10
表面活性物质
在临界胶束浓度前后, 除表面张力外, 电导率, 渗透压, 蒸气压, 光学性质, 去污能力及增溶作用等皆有很大差异.
去污能力 电导率 增溶作用
渗透压
性质
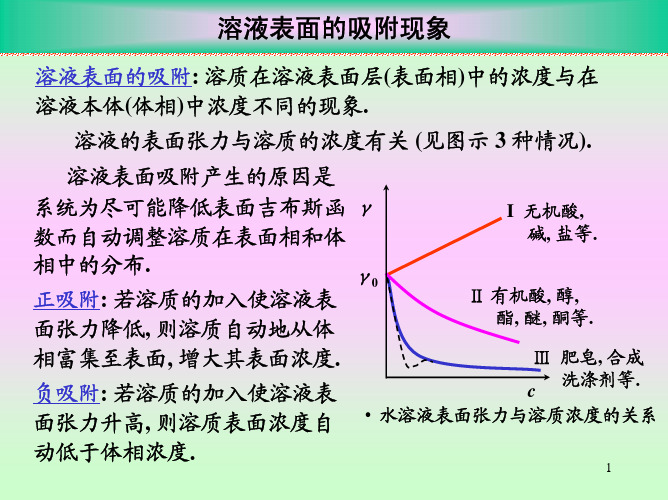
表面张力
摩尔电导
C.M.C
浓度
• 表面活性剂溶液的性质与浓度关系示意图
11
表面活性物质
HLB法: HLB意指亲水亲油平衡(Hydrophile-Lipophile Balance). 用HLB值的大小表示每种表面活性物质的亲水性, HLB值愈大, 亲水性愈强. 该值可作为选择表面活性剂的参考.
(1)去污作用
肥皂的成份是硬脂酸钠(C17H38COONa), 是一种阴离子表 面活性剂. 肥皂能减小水与衣物的界面张力, 增大衣物与油污 之间的接触角而使衣物变为憎油. 这样, 油污经机械摩擦和水 流带动而很容易脱落, 并被肥皂液乳化而分散在水中.
水(w)
σow
σsw大 σso
油(o) 固(s)
洗涤前
β相 Vβ(实) cBβ
b
b
σ界面层 Vσ(实)
s
a
a
α相 V α(实) cBα
β相 Vβ cBβ σ界面相
Vσ= 0
α相 V α cBα
V = Vσ(实) + Vβ(实) + V α(实) V = Vσ+ Vβ • 实际溶液界面(左)与吉布斯界面模型(右)
h
h
cβ(溶剂)
cα(溶剂) cβ(溶质) cα(溶质)
质. 习惯上指溶入少量就能显著降低溶液表面张力的物质.
• 表面活性剂显著降低水的表面张力. (左) 将硫(密度2.1g/cm3)小心地放 到水面上, 水-硫界面张力大而难 以增大其界面积, 使硫不能浸湿. (右) 向水中滴入几滴清洁剂, 水- 硫界面张力减小, 硫沉入水底.
溶液的表面吸附
s s A s A
G = n µ + n µ + Aγ
s s A s A s B s B
s A s A s B s B s B s B
dG = n dµ + µ dn + n dµ + µ dn + γdA + Adγ
表面热力学基本关系式: 表面热力学基本关系式
dG = − S dT + V dp + µ dn + µ dn
代入吉布斯等温吸附式 b′γ 0 a2 Γ2 = ⋅ ' RT K + a2 Ka2 Γ2 = Γ∞ ⋅ 1 + Ka2
两亲分子在气液界面上的定向排列
根据实验, 根据实验,脂肪酸在水中的浓度达到一定数值 后,它在表面层中的超额为一定值,与本体浓度无 它在表面层中的超额为一定值, 关,并且和它的碳氢链的长度也无关。 并且和它的碳氢链的长度也无关。 这时, 这时,表面吸附已达到 饱和,脂肪酸分子合理的 饱和, 排列是羧基向水, 排列是羧基向水,碳氢链向 空气。 空气。
溶液的表面吸附
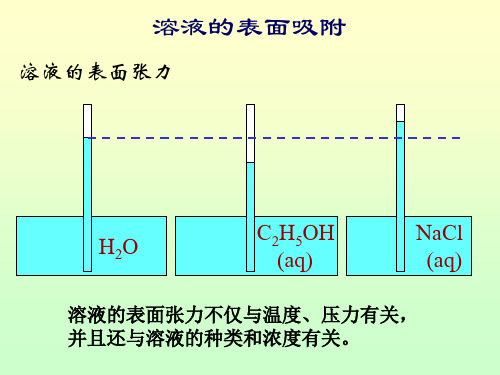
溶液的表面张力
H 2O
C2H5OH (aq)
NaCl (aq)
溶液的表面张力不仅与温度、压力有关, 溶液的表面张力不仅与温度、压力有关, 并且还与溶液的种类和浓度有关。 并且还与溶液的种类和浓度有关。
溶质对表面张力的影响
1.
d γ / dc > 0
非表面活性物质 无机盐、不挥发酸碱
γ
n dµ + n dµ + Adγ = 0
s A s A s B s B
溶液相, 由吉布斯-杜亥姆方程 溶液相 由吉布斯 杜亥姆方程 Gibbs-Duhem equation
溶液表面吸附的测定

溶液表面吸附的测定1. 实验目的① 掌握最大气泡压力法测定溶液表面张力的原理和方法② 根据吉布斯吸附方程,计算溶液表面吸附量和乙醇分子的横截面积2. 实验原理① 表面自由能:从热力学观点看,液体表面缩小是一个自发过程,这是使体系总的自由能减小的过程。
如欲使液体产生新的表面ΔA ,则需要对其作功。
功的大小应与ΔA 成正比:-W=σΔA ,式中σ为液体的表面自由能,亦称表面张力(单位为J ·m-2)。
它表示了液体表面自动缩小趋势的大小,其量值于液体的成分、、溶质的浓度、温度及表面气氛等因素有关。
② 溶液的表面吸附:纯物质液体的表面层与本体(内部)组成相同。
根据能量最低原理,为降低其表面吉布斯自由能,必须尽可能地收缩液体表面。
对溶液则不同,加入溶质后,溶剂表面张力发生变化,根据能量最低原理,若加入的溶质能降低溶剂表面张力时,则溶剂在表面层的浓度比在溶液本体中的浓度大;反之,若溶质使溶剂表面张力升高,溶质在表面层的浓度小于在溶液本体中的浓度。
溶质在溶液表面层与在溶液本体中浓度不同的现象称为溶液的表面吸附,即溶液借助于表面吸附来降低表面吉布斯自由能。
③ 溶液表面吸附溶质的量Γ与表面张力σ、浓度c 有关。
其关系符合吉布斯吸附方程:Γ=-C RT(∂σ∂c)T 。
(∂σ∂c)T ,表示在一定温度下,表面张力随浓度的变化率。
如果溶液表面张力随浓度增加而减小,即(∂σ∂c)T <0,则T>0,此时溶液中溶质在表面层中的浓度大于在溶液本体中的浓度,称为正吸附。
如果(∂σ∂c )T >0,则T<0,称为负吸附。
④ 以表面张力对浓度作图,得到σ-C 曲线,在σ-C 曲线上任选一点作切线,即可得到该点所对应浓度c i 的斜率 ∂σ∂c iT 。
其中MN =-c i ∂σ∂c iT ,则Γ=MNRT,根据此式可求得不同浓度下各个溶液的Γ。
对于溶液表面吸附,可以采用朗格缪尔(Langmuir)吸附等温式描述表面吸附量Γ与溶液浓度c 之间的关系,即θ=ΓΓ∞=kc1+kc 。
溶液表面的吸附现象.

CH3(CH2)7=CH(CH2)7 COO-
• 油酸分子模型图
固定的 障片
可移动 的障片
• 油酸单分子膜示意图
H+
表面活性物质的亲水基
团X受到极性很强的水分子
的吸引而有竭力钻入水面的
趋势, 同时非极性的碳链倾向
于翘出水面或钻入非极性的
有机溶剂或油类的另一相中,
从而在界面上形成单分子膜.
7
表面活性物质
表面活性物质的基本性质: 溶入少量 γ 就可使溶液的表面张力急剧降低; 当浓度 γ0 达到一定值后, 浓度几乎不影响表面张力.
上述性质是由表面活性分子在溶液中
的存在形态和分布引起的(见图示).
c • 表面张力与浓度关系
单分子膜
小型 胶束
球状 胶团
(a) 稀溶液
(b)开始形成胶束 的溶液
(c)大于临界胶束 浓度的溶液
况.
3
表面过剩与吉布斯吸附等温式
总界面过剩量 nBσ = Γ B As = nB − (V α cαB + V β cBβ )
类似地, 定义界面相的其它热力学函数:
Uσ= U-(Uα+ Uβ); Sσ= S-(Sα+Sβ); Gσ= G-(Gα+ Gβ)
当界面相的吉布斯函数Gσ发生微小变化时,
dGσ =-SσdT + Vσdp +γdAs + ΣµBdnBσ
β相 Vβ(实) cBβ
b
b
σ界面层 Vσ(实)
s
a
a
α相 V α(实) cBα
β相 Vβ cBβ σ界面相
Vσ= 0
α相 V α cBα
V = Vσ(实) + Vβ(实) + V α(实) V = Vσ+ Vβ • 实际溶液界面(左)与吉布斯界面模型(右)
溶液表面吸附的测定

溶液表面吸附的测定一、实验目的1、采用最大泡压法测定不同浓度的乙醇水溶液的表面张力2、根据吉布斯吸附公式计算溶液表面的吸附量和乙醇分子的横截面积二、实验原理1、表面自由能 从热力学观点看,液体表面缩小是一个自发过程,这是使体系总的自由能减小的过程。
如欲使液体产生新的表面△A ,则需要对其作功。
功的大小应与△A 成正比:A W ∆=σ-式中σ为液体的表面自由能,亦称表面张力。
它表示了液体表面自动缩小趋势的大小,其量值与液体的成分、溶质的浓度、温度及表面气氛等因素有关。
2、溶液的表面吸附 纯物质表面层的组成与内部的组成相同,因此纯液体降低表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液,由于溶质能使溶剂表面张力发生变化,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原则,溶质能降低溶剂的表面张力时,表面层溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,表面层中的浓度比内部的浓度低。
这种表面浓度与溶液内部浓度不同的现象叫做溶液的表面吸附。
显然,在指定的温度和压力下,溶质的吸附量与溶液的表面张力及溶液的浓度有关,从热力学方法可知它们之间的关系遵守吉布斯(Gibbs)吸附方程:Tdc dσRTc-Γ⎪⎪⎭⎫ ⎝⎛= 式中:Γ为表面吸附量(单位:mol·m -2);T 为热力学温度(单位:K);c 为稀溶液浓度(单位:mol·dm -3);R 为气体常数。
T dc dσ⎪⎪⎭⎫ ⎝⎛<0,则Γ>0,称为正吸附;Tdc dσ⎪⎪⎭⎫⎝⎛>0,则Γ<0,称为负吸附。
以表面张力对浓度作图,即得到c -σ曲线,在c -σ曲线上任选一点作切线,如图12.1所示,即可得该点所对应浓度c i 的斜率:()T i c d /d σ,图12.1 表面张力与浓度的关系其中: ()T i i c c MN d /d σ-= 则: RT MN /=Γ,根据此式可求得不同浓度下各个溶液的Γ值。
复旦大学物理化学题库7.4

73 BET 吸附等温式主要的用途之一是 A 获得高压下的吸附机理 B 获得吸附等量线 C 获得吸附等压线 D 测定固体比表面
Dቤተ መጻሕፍቲ ባይዱ
74 固体在溶液中表观吸附量 A 一定大于零 B 一定小于零 C 一定等于零 D 可正 可负 也可为零
D 固体在溶液中表观吸附量有正吸附 负吸附和零吸附
75 如果固体在溶液中的表观吸附量为零 这表明 A 固体表面对溶质没有吸附 B 溶质在固体表面浓度为零 C 溶质在固体表面浓度与在体相浓度相等 D 溶剂在固体表面没有吸附
1 = 1 ⋅1+ 1 Γ Γm b p Γm
物化练习 1000 题 表面化学
69
某固体对气体吸附符合 Langmuir 式 Γ = Γm bp 1+ bp
截距 M = 1.2×109 Pa⋅m–3 则吸附系数 b 为 A 5×10–6 Pa–1 B 2×105 Pa C 5×103 Pa–1 D 2×102 Pa
C
76
表观吸附量 x 对浓度作图 曲线的斜率 m 表观
A 一定大于零 B 一定等于零 C 一定小于零
复旦大学药学院物化教研室编写
D 可正 可负 也可为零
D
从 x ∼ C 曲线特点看 m
x/m
x 先增大 后减小 m 因此斜率可正 可负 也可为零
物化练习 1000 题 表面化学
C
若 P ∼ p 的斜率 K = 6×103 m–3 , V
A
Langmuir 式的线性方程
P 1 ⋅P+ 1
V V∞
V∞ b
∴b
=
斜率K 截距M
6 ×103 = 5×10-6 Pa -1 1.2 ×109
70 测得气体 B 在 M 表面上饱和吸附量为 0.54 mol ⋅ kg–1 体的比表面 m2⋅kg–1 为 A 4.1×104 B 6.79×10–20 C 1.4×105 D 7.57×104
物理化学实验报告-溶液表面张力的测定及等温吸附(2)

p最大 = p大气 − p系统 = ∆p
毛细管内气体压力必须高于大试管内液面上压力的附加压力以克服气泡的表面张力,此附加压力∆p与 表面张力γ成正比,与气泡的曲率半径R成反比,其关系式为:
2γ ∆p = R
如果毛细管半径很小,则形成的气泡基本上是球形的。随着气泡的形成曲率半径逐渐变小,直到形成
装
半球形。这时曲率半径R与毛细管内半径r相等,曲率半径达到最小值。
数字式微压差测量仪当表面张力仪的活塞使水缓慢下滴而减小系统压力这样毛细管内液面上受到一个比试管中液面上大的压力当此压力差在毛细管尖端产生的作用力稍大于毛细管管口液体的表面张力时气泡就从毛细管口逸出这一最大压力差可由数字式微压差测量仪测出
1.精密恒温水槽;2.带有毛细管的表面张力仪; 3.滴液漏斗;4.数字式微压差测量仪
答:实验中,气泡的速度对实验数据有很大的影响。速度过快,会使数据变大。因此,保持相同的气泡速
度对于实验的成败有很大的关系。而实验装置中,随着滴液漏斗中水的不断流出,滴液的速度会减慢,装
置的此处有待改进。另外,毛细管的竖直以及毛细管进入液面的深度,对于测定结果都有一定的影响,实
装
验中应该注意。实验的数据处理也是很关键的一步,对测量结果有较大影响。
=
71.97 280.7
=
0.2564
mN
∙
m−1
∙
Pa−1
2. 求出各浓度正丁醇溶液的表面张力。
γ溶液 = K∆p溶液
表 1 正丁醇溶液表面张力的测定数据记录表
c mol ∙ L−1
0
0.02 0.04 0.06 0.09 0.12 0.16 0.2 0.24
∆pm1 Pa ∆pm2 Pa ∆pm3 Pa ∆pm Pa γ mN ∙ m−1
溶液表面吸附实验的再讨论

溶液表面吸附实验的再讨论许新华;吴梅芬;王晓岗【摘要】在溶液表面吸附实验中,乙醇和正丁醇水溶液具有不同的吸附行为,但是从σ–c曲线上很难判断,实验测量条件选择不当可能导致错误的结果.鉴于吉布斯吸附等温式与朗格缪尔吸附等温式并不具有相容性,不宜采用任何数学方程或物理模型进行数据拟合.建议实验数据处理方法如下:对σ–nc关系手工拟合曲线,做到单调、平滑;在拟合曲线上密集读点后重新绘制σ–lnc关系曲线;求出各点的导数(?σ/?lnc)T;采用吉布斯吸附等温式Γ=?(?σ/?lnc)T/(RT)计算表面吸附量.在计算溶质分子横截面积时,应考虑本体溶液浓度c对表面层溶质分子密度的影响.【期刊名称】《大学化学》【年(卷),期】2018(033)010【总页数】6页(P91-96)【关键词】溶液表面吸附;数据拟合;吉布斯吸附等温式;朗格缪尔吸附等温式【作者】许新华;吴梅芬;王晓岗【作者单位】同济大学化学科学与工程学院,上海 200092;同济大学化学科学与工程学院,上海 200092;同济大学化学科学与工程学院,上海 200092【正文语种】中文【中图分类】G64;O647;O6–39溶液表面吸附和表面张力的测定是经典的物理化学实验项目之一,实验教材中常见的实验对象有正丁醇水溶液(如北京大学、南京大学、厦门大学、上海交通大学和天津大学等)和乙醇水溶液(如复旦大学、华南理工大学、武汉理工大学、华中科技大学和常州大学等),对该实验也有大量的教学改革研究。
但是,该实验项目的设计在原理上存在几个错误认识,导致在不同的学校、实验室、实验者之间的实验结果各异。
本文通过分析该实验涉及的原始文献数据,研究了这些错误认识的来源,提出了一种利用计算机软件对无数学关系变量进行曲线绘制和数据分析的方法,并对表面张力法计算表面吸附量和推算溶质分子横截面积进行了讨论。
溶液表面吸附实验的理论基础[1]是Gibbs吸附等温式:式中α为溶质(吸附质)的活度;c为溶质的浓度数值,实际为活度系数为1时的活度值,为无因次量;σ为溶液的表面张力;Γ为溶质的相对表面吸附量(也称为表面过剩量),表示在单位面积的表面层中所含溶质的物质的量与具有相同数量的溶剂的本体溶液中所含溶质的物质的量之差值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3) 代入Gibbs吸附等温式求
返回
药学院物理化学教研室
二. Gibbs附等温式
例 测得苯基丙酸25时–c数据如下,求c=4.0 gkg–1时吸附量
c/ gkg–1
/Nm–1
3.5 0.056
4.0 0.054
4.5 0.052
解 从数据特点看–c为直线关系,
线性回归得:= –0.0040c+0.070
0 = 72.7510–3 Nm–1
(1) 求~c关系式
a =13.110–3 Nm–1
(2) 讨论c很大和很小时的
b = 19.6210–3 m3mol–1 (3) 求c = 0.2 molL–1时
解 (1) d a b
dc 1 bc
c RT
ab 1 bc
二. Gibbs附等温式
1.吸附量 概念(表面超量,表面过剩)概念
设有一杯溶液 相与其蒸气 相平衡 相
表面 相: 几个分子厚度
几何分界面:S-S,面积为A
S
相
S
相 忽略气相
由于表面吸附的存在,表面浓度与体相浓度不相等
定义表面吸附量:
nσ
n实际 nα
单位:molm–2
Nm–1 Nm–1 m3mol–1
(1) 求~c关系式 (2) 讨论c很大和很小时的 (3) 求c = 0.2 molL–1时
(2) 当c 很小时,1>>bc,
ab c= Kc,图中①
返回
药学院物理化学教研室
一.溶液表面吸附现象
2.表面张力等温式: ~ c数学表示式
多为经验式,如
(1) 直线式 (2) 二次三项式
= ac + 0 = ac2 + bc + 0
(3) Szyszkowski式 0 bln1 ac
0
(4) 用吸附平衡方法,也可导出
返回
c溶质 n:A3
溶质 > 0,正吸附
c溶质 n:A4–A5
溶质 < 0,负吸附
药学院物理化学教研室
二. Gibbs附等温式
3.Gibbs吸附等温式推导
多组分热力学关系式 dG = –SdT + Vdp + dA + BdnB p,T一定,二组分表面相 dG = dA + ldn1+ 2dn2 ,不变时,积分: G = A + ln1+ 2n2
a RT
bc 1 bc
(2) 当c 很小时,1>>bc,
ab c= Kc,图中①
RT
②
③
当c 很大时,1<<bc,
a = 常数,图中③
RT
① c
返回
药学院物理化学教研室
二. Gibbs附等温式
0 = 72.7510–3
a =13.110–3
b = 19.6210–3
=
0
1-
1
ac bc
0:溶剂 a,b:经验参数
返回
药学院物理化学教研室
一.溶液表面吸附现象
3.溶液的表面吸附:溶质在表面相浓度与体相浓度不相同的现象
正吸附:c表> c体
加入溶质,,溶质自发向表面浓集,降低体系能
量,直至浓集扩散平衡,如Ⅱ,Ⅲ型曲线 负吸附:c表< c体
全微分: dG = dA +Ad + ldn1+ n1dl +2dn2 + n2d2
二式比较得
Ad + n1dl + n2d2 = 0
d
n1σ A
d1σ
n2σ A
d2σ
1=0
2
2
n2σ A
d
RTdlna2
2 = 2(T)+RT ln a2
c
如低分子醇、醛、羧酸、酯、胺等有机物
分子之间作用力
返回
药学院物理化学教研室
一.溶液表面吸附现象
有三种类型
Ⅰ型:c,
Ⅰ
如无机离子
(酸、碱、盐、多羟基化合物)
Ⅱ
分子间作用力
Ⅲ
Ⅱ型:c,
如低分子醇、醛、羧酸、酯、胺等有机物
c
分子之间作用力
Ⅲ型:c,,然后保持不变
如直链脂肪酸(碱)的盐,长链磺酸盐等,称表面活性剂
A
A
n 是指界面S-S以下按体相浓度计算的mol数。
返回
药学院物理化学教研室
二. Gibbs附等温式
2. Gibbs分解面
的值与S-S面划定有关,将S-S面位置放在溶剂 = 0的地方, 这样溶质才能有唯一的定值
S
SS
SS
S
A1 S
A2 S S
A3 S
S A4 A5
S
c溶剂 划定S-S,使
A1=A2 ,溶剂 = 0
加入溶质,,溶质自发向体相转移,降低体系
能量,直至转移扩散平衡,如Ⅰ型曲线
返回
药学院物理化学教研室
二. Gibbs吸附等温式
吸附等温式:一定温度下,溶液表面吸附量与溶质浓度的关系式 Gibbs用热力学方法导出的吸附等温式为:
a
RT a T
返回
药学院物理化学教研室
c RT
c
4.0 (0.0040) T 298R
= 6.4610–6 molm–2
(实验实测值为6.4310–6 molm–2,两者相符)
返回
药学院物理化学教研室
二. Gibbs附等温式
例 丁酸水溶液19C时–c关系为 = 0–a ln (1+bc)
c T
>0,c,,负吸附, Ⅰ型曲线 <0,c,,正吸附, Ⅱ,Ⅲ型曲线
返回
药学院物理化学教研室
二. Gibbs附等温式
4.吸附量的计算 一般方法:
(1) 由–c数据,作表面张力等温线或拟合表面张力等温式
(2) 求 d
dc
对于等温线,作切线求斜率 对于等温式,求导
制作:陈纪岳 第四节 溶液表面的吸附
一.溶液表面吸附现象
1. 表面张力等温线:一定温度下,溶液 ~ c关系图 一定温度下,溶剂的一定;加入溶质改变表面分子间 作用力改变表面张力,与溶质的种类和浓度有关。
有三种类型
Ⅰ型:c,
Ⅰ
如无机离子
(酸、碱、盐、多羟基化合物)
Ⅱ
分子间作用力
Ⅱ型:c,
返回
药学院物理化学教研室
二. Gibbs附等温式
3.Gibbs吸附等温式推导
ห้องสมุดไป่ตู้
d
n1σ A
d1σ
n2σ A
d2σ
1=0
2
2
n2σ A
d
RTdlna2
2 = 2(T)+RT ln a2
当浓度不大时,a c/c c
RT c T
