网上培养caco-2经验总结
Caco_2细胞体外吸收模型的建立及评估

Caco 2细胞体外吸收模型的建立及评估帕丽达 阿不力孜,丛媛媛,米仁沙 牙库甫,王 勇(新疆医科大学药学院,新疆乌鲁木齐830011)摘 要:目的:建立Caco 2细胞体外吸收模型并对其进行评估。
方法:将细胞接种在T ranswel 转运培养槽的微孔滤膜上,进行体外培养。
采用细胞形态学、跨膜电阻值(T EER)和表观渗透系数(P app )及碱性磷酸酶活性等指标对细胞模型进行检测。
结果:培养21d 后,细胞间形成紧密连接,跨膜电阻值达到恒定值,为500 /cm 2,表观渗透系数低于0.5 10-6cm/s;肠腔侧碱性磷酸酶活性显著高于基底侧酶活性。
结论:在本实验室条件下构建的Caco 2细胞模型在形态上与小肠上皮细胞相似,细胞已产生极性,可作为小肠吸收的体外模型。
关键词:Caco 2细胞;吸收;跨膜电阻;表观渗透系数;碱性磷酸酶中图分类号:R927.2 文献标识码:A 文章编号:1673 2197(2011)04 0006 02收稿日期:2011 01 15基金项目:国家自然科学基金资助项目(30860390)作者简介:帕丽达 阿不力孜(1962-),女,新疆医科大学博士研究生,研究方向为维药活性成分和生药学。
Establishment and Assessment of Caco 2Cell in Vitro Absorption ModelPalida A bulizi,Cong Yuanyuan,M irensha Yakufu,Wang Yong(Colleg e of Pharm acy,Xinjiang M edical U niv ersity ,U rumqi 830011,China)Abstract:Objective:To establish and assess the Caco 2cell in vitro absorption model.Methods:Caco 2cells were cultured on t hemillipore filt ers fixed inTranswell transport chamber.T he cell morphology,transepithelial electrical resistance,the apparent peme ability coefficients and alkaline phosphatase activities were monitored during culture.Results:After 21days of in vit ro culture,for mation of tight junction w as observed betw een the cells.T he transepithelial elect rical resistance reach a relatively stable value of 500/cm 2,apparent pemeability coefficient s w as low er than 0.5 10-6cm/s;and the alkaline phosphatase activity in the apical side w as significantly higher t han t hat in t he basolateral side.C onclusion:T he established Caco 2cell model shows similar morphology to in testinal epithelial cells wit h formation of polarity,and can be used as an in vitro model for absorption studies.Key Words:Caco 2Cell;Absorpt ion;T ransepithelial Electrical Resist ance;the Apparent Pemeability Coefficients ;Alkaline Phos phataseCaco 2细胞系来源于人结肠腺癌细胞,在培养条件下形成极性单细胞层,接种到碳酸聚酯膜基质上,可分化出绒毛面(Apical Side,AP 端、肠腔侧、顶端)和基底面(Baso Lat eral Side,BL 端、肠壁侧、底端),能够表达刷状缘(纹绿)酶、某些细胞色素药物代谢酶和异构酶等。
人结肠腺癌细胞系Caco-2单细胞层短期培养法及其评价

'*
复 旦 学 报 医 学 版 !!"#! 年 # 月 $%#!
^_*孔的密度 铺 入 %& 孔 板置 于 $' Y(V.@! 条 件下孵育 !*5细 胞 贴 壁 后 分 别 换 入 正 常 培 养 基 .* M*6* , #"V !H,无 血 清 培 养 基 H* M*6*分化 培 养 基 M*#含 ! 88/9N 丁 酸 的 正常培养基分化培养 基 M*!含 ! 88/9N 丁 酸 的无血清培养基分化培养基 M*$含#" 88/9N 丁 酸 的 正 常 培 养 基 分 化 培 养 基 M**含 #" 88/9N 丁酸的无 血 清 培 养 基各 设 ( 个 平 行 孔 继续 置 于 $' Y(V.@! 条 件 下 孵 育 *)5 然 后 每孔加入!"%N *KK 溶液(838N继续培养* 5后终止小心吸去 孔 内 培 养 液 每 孔 加 入 #("%N 二甲基亚砜置 于 摇 床 上 低 速 振 荡 #" 8'%使 结 晶 物充分溶解 在 酶联 免疫 检测仪 ('"%8 处 测量 各 孔< 值
(45&'/+*')!F5G(*'#3(!K/#+(+9/2$%#+($9"$4+$%+J20/4/-/9B/0$15/0474+08.$-/7!!5"8$%-/9/%$#+%/7 -$0-'%/8$-+999'%+"8/%/9$C+0-"94"0+1C14+8 J'45>"4C0$4'-$-'#:!H('1"!&!.$-/7!-+998/%/9$C+08/#+9 J$1+14$>9'15+#J'45#'BB+0+%4-"94"0+1C14+81$%#+($9"$4+#>C8/025/9/3CB+$4"0+"1'%3'%(+04+#8'-0/1-/2+ $%#40$%1+2'45+9'$9+9+-40'-$90+1'14$%-+!K66<"$11$C:A##'4'/%$99C#45+8/#+9J$1B"045+04+14+#B/045+$-7 4'('4C/B$9?$9'%+25/125$4$1+!AS="$%#45+$22$0+%42+08+$>'9'4C!$$22"/B14$%#$0#-/82/"%#B9"/0+1-+'%: *+$%J5'9+#45+<;A9+(+9/B40$%12/04+01=739C-/20/4+'% !=732"$%#8"94'#0"30+1'14$%-+7$11/-'$4+#20/4+'% ! !*<=!"J$1+D$8'%+#>C<!=.<:!=(&.-'&!.$-/7!-+998/%/9$C+0+14$>9'15+#J'4545+15/0474+08-"97 4"0+1C14+815/J+#3//#'%4+30$9'4C/B-+99"9$08/025/9/3C$%#-+998/%/9$C+00+B9+-4+#>CK66<'(""-. -8!#$%#$$22($9"+/B14$%#$0#-/82/"%#B9"/0+1-+'% %(0#"+(-8'1$%#/>('/"12/9$0#'BB+0+%4'$4'/%/B
想研究药物口服吸收?Caco-2细胞模型来帮你
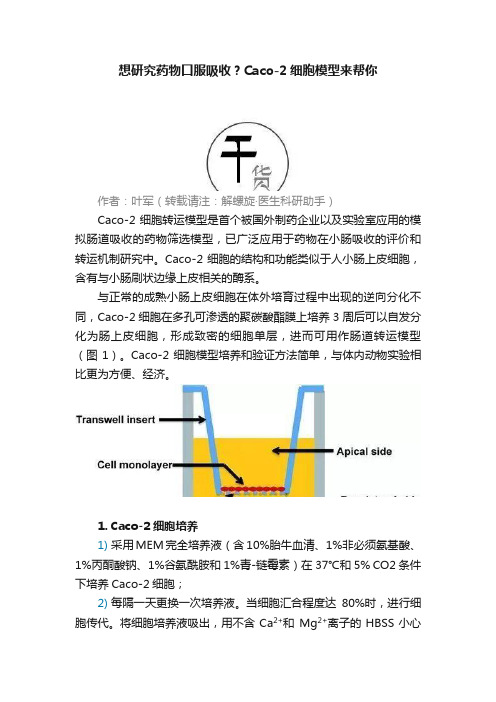
想研究药物口服吸收?Caco-2细胞模型来帮你作者:叶军(转载请注:解螺旋·医生科研助手)Caco-2细胞转运模型是首个被国外制药企业以及实验室应用的模拟肠道吸收的药物筛选模型,已广泛应用于药物在小肠吸收的评价和转运机制研究中。
Caco-2细胞的结构和功能类似于人小肠上皮细胞,含有与小肠刷状边缘上皮相关的酶系。
与正常的成熟小肠上皮细胞在体外培育过程中出现的逆向分化不同,Caco-2细胞在多孔可渗透的聚碳酸酯膜上培养3周后可以自发分化为肠上皮细胞,形成致密的细胞单层,进而可用作肠道转运模型(图1)。
Caco-2细胞模型培养和验证方法简单,与体内动物实验相比更为方便、经济。
1. Caco-2细胞培养1) 采用MEM完全培养液(含10%胎牛血清、1%非必须氨基酸、1%丙酮酸钠、1%谷氨酰胺和1%青-链霉素)在37℃和5% CO2条件下培养Caco-2细胞;2)每隔一天更换一次培养液。
当细胞汇合程度达80%时,进行细胞传代。
将细胞培养液吸出,用不含Ca2+和Mg2+离子的HBSS小心清洗2次,加入0.25%胰蛋白酶-0.02% EDTA 混合消化液进行消化;3)取细胞适量接种到75 cm2培养瓶继续培养或进行铺板操作。
2. Caco-2细胞模型的构建及验证1)收集对数期的Caco-2细胞,用MEM完全培养液将细胞浓度调整为2.0×105 cells/mL;2)在Transwell板(聚碳酸酯膜,0.4 µm,1.12 cm2)(图2)的基底侧(Basolateral side)加入1.5 mLMEM完全培养液,在顶侧(Apical side)加入细胞悬液0.5 mL;3)放入细胞培养箱内培养,每两天换一次培养液,培养一周后每日换液;4)继续培养至21天;5)采用Millicell ERS电阻仪(Millipore公司)测定跨上皮细胞电阻(大于500 Ω·cm2),确定细胞单层的致密性和完整性。
Caco-2细胞转运实验详细讲解

Caco-2 细胞转运实验人结肠癌细胞系Caco-2是用来研究药物经肠吸收的常用模型。
Caco-2细胞体外培养条件下可自发进行上皮样分化,形成与小肠上皮细胞相同的微绒毛结构和紧密连接,形态学、标志酶的功能表达及渗透特征都与小肠柱状上皮细胞很相似。
在Caco-2细胞中,主要药物转运体如寡肽转运体PEPTI,P-糖蛋白MDRI、多药耐药相关转运蛋白MRP2和有机阴离子转运多肽OATP2B1均有较高水平表达,能够快速得到药物的跨膜转运属性。
此外,Caco-2细胞还表达一些肠道常见的糖苷酶、氨肽酶、酯酶和代谢酶,可考察存在代谢的情况下药物的转运情况。
由Caco-2细胞获得的药物表观渗透系数(Papp)与人小肠吸收具有良好的相关性,作为药物吸收研究的一种快速筛选工具,Caco-2细胞模型已广泛用于体外药物分子小肠吸收的研究。
Caco-2细胞模型是将Caco-2细胞接种于半透膜(多为聚碳酸酯多孔膜)上,待细胞生长分化为完整的细胞单层(一般21~24天),即可模拟人体肠道上皮吸收屏障,用于药物通透性实验(图11-5)。
近来研究发现,犬肾上皮细胞系MDCK Ⅱ和Caco-2细胞在许多药物的转运上具有很好的相关性,且其培养周期较短(3~5天)即可形成完整细胞单层,可以作为一种改良的Caco-2细胞模型,进行药物的经肠吸收研究(图11-6)。
【材料】1.状态良好的人结肠癌细胞。
2.试剂胰蛋白酶、小牛血清、培养基(DMEM培养粉)、双抗。
乳酸脱氢酶检测试剂盒、酚磺酞或荧光黄、D-Hanks液(每l000ml含NaCl 8.OOg,KC10.40g,NaH2P04·H20 0.06g, NaHC03 0.35g,酚磺酞0.02g) ,Hanks液(在D-Hanks液加MgS04·7H20 0.20g, CaCl2(无水)0. 14g,葡萄糖1.00g) ,75%乙醇。
3.仪器净化工作台、C02孵箱、倒置显微镜、细胞计数板、电阻仪、酶标仪、TransweⅡ小室、HPLC/MS/MS(或核素标记检测)。
caco-2细胞膜模型实验概述

Caco-2细胞单层膜模型实验概述口服给药是最重要的给药方式之一,药物在肠道内的吸收速度及程度是影响药物生物利用度的重要因素。
药物的肠道吸收研究可以提供吸收机制、吸收部位及影响吸收的因素等重要信息,为药物的研发提供参考。
一、口服药常用的研究方法目前研究药物在肠道吸收的方法主要分为体内法(in vivo )、在体法(in situ )、体外法(in vitro )。
3种研究方法适用不同的研究对象,应根据不同的研究需要进行选择。
1. 体内法 体内法是以整体动物机体为研究对象,进行药动学研究。
口服给药后,在不同时间点采集生物样本如血液、尿液,再通过一定方法测定其药物浓度,计算达峰时间(Tmax )、达峰浓度(Cmax )、药时曲线下面积(AUC )等药动学参数,进而评价药物吸收的程度和速度。
此法采用整体动物进行实验,能真实地反映药物口服后的体内吸收情况,但是它综合了物化、生理、剂型等众多因素的结果,不能特异性地反映肠道对药物的吸收作用。
又由于实验周期长、操作相对繁琐、影响因素较多、动物个体差异较大等原因,故体内法很少应用于药物吸收机制的研究,一般用于研究药物体内药动学特征。
2. 在体法常用的在体法包括在体肠灌流法、肠襻法、肠道血管插管法等。
在体法是建立在整体动物水平上的实验,与体内法不同的是其将干扰因素大大减少,同时保证了肠道神经与内分泌调节的完整性,也保证了血液与淋巴液供应,使得待考察组织的生物活性大大提升,能够较为准确地反映药物在肠道的真实吸收情况,常用于研究药物的渗透和吸收动力学。
在体法由于是建立在整体水平之上,因此个体差异较大,对实验动物的数量有一定要求,以保证最小的数据变异。
3. 体外法常用的体外法主要有外翻肠囊法、组织流动室法、刷状缘膜囊泡法、细胞培养模型法等。
这些实验方法是基于分离部分肠黏膜或肠段,或是采用人肠细胞模拟肠环境评价药物吸收情况。
总的来说体外法优点在于操作简单、试验周期短,可以用于药物早期高通量筛选。
caco2细胞基本特点

caco2细胞基本特点Caco-2细胞是一种人类结肠腺癌细胞系,是体外研究肠道吸收和药物经过肠道屏障的重要模型之一、以下是Caco-2细胞的基本特点。
1. 形态特征:Caco-2细胞在培养基中呈现为密集附着生长的多边形或梭形细胞。
细胞的表面具有微绒毛样纹理。
2. 生长特性:Caco-2细胞具有较高的增殖速度,在适合的培养条件下可快速扩增。
细胞扩增能力强,形成紧密的细胞层,适合用于体外模拟肠道屏障。
3. 转染能力:Caco-2细胞具有较高的转染效率,可经过合适的转染方法用于研究基因的功能。
通过转染可以实现特定基因的过表达或下调,进一步研究其影响肠吸收的机制。
4. 上皮细胞特性:Caco-2细胞是一种类似肠上皮细胞的模型细胞,具有类似肠道上皮细胞的特征。
细胞形成紧密的单层,并具有极性,细胞间紧密连接形成类似肠道上皮细胞的紧密连接。
5. 紧密连接:Caco-2细胞具有紧密连接结构,包括紧密连接蛋白(如ZO-1)和Adherens连接蛋白(如E-钙粘蛋白),这些连接蛋白可以保持细胞层的完整性。
6. 肠道吸收模型:Caco-2细胞可以在适当的培养条件下分化为类似肠道上皮细胞的模型,形成细胞单层。
通过模拟肠道环境,可以研究药物在肠道上皮屏障中的吸收、转运和代谢过程。
7. 转运通路:Caco-2细胞具有多种与肠道吸收相关的转运蛋白,例如多肽转运体1(PEPT1)和脂质转运蛋白(CD36)。
这些转运蛋白使Caco-2细胞具有模拟肠道吸收功能的能力,可以用于研究药物的吸收和转运机制。
8. 炎症反应:Caco-2细胞对于肠道炎症反应也有一定的敏感性,可以用于研究肠道炎症的机制和药物的治疗效果。
总之,Caco-2细胞是一种具有肠道上皮细胞特点的模型细胞,能够模拟肠道吸收和转运过程,是研究肠道屏障功能及药物吸收、转运和代谢的重要工具。
Caco-2细胞的培养

Caco-2细胞在研究中的应用
药物吸收与代谢研究
肠道屏障功能研究
Caco-2细胞常用于药物吸收与代谢的研究 ,模拟肠道上皮对药物的吸收和代谢过程 。
Caco-2细胞单层可以作为肠道屏障功能的 模型,用于研究肠道通透性、紧密连接等 机制。
肠道微生物与宿主相互作用研究
食品和营养研究
Caco-2细胞可以与肠道微生物共同培养, 用于研究肠道微生物与宿主之间的相互作 用。
观察与记录
定期观察细胞的生长状况, 记录生长曲线、细胞形态 等参数,以便评估细胞的 健康状况和功能。
03 Caco-2细胞的培养过程
细胞的复苏与扩增
细胞复苏
将冷冻保存的Caco-2细胞从液氮 中取出,迅速放入37℃水浴中快 速解冻,然后加入5ml培养基,用
吸管轻轻吹打混匀。
细胞接种
将复苏后的细胞悬液接种到培养 瓶中,轻轻晃动培养瓶使细胞均
05 Caco-2细胞培养的实际 应用案例
在药物吸收研究中的应用
药物吸收机制研究
Caco-2细胞可用于研究药物在小肠上 皮细胞层的吸收机制,通过测定药物 透过细胞的速率和程度,了解药物的 渗透特性和吸收机制。
药物相互作用研究
Caco-2细胞培养可以模拟肠道环境, 用于研究药物之间或药物与食物之间 的相互作用,有助于预测临床用药时 可能发生的相互作用。
Caco-2细胞的培养
目录
• Caco-2细胞简介 • Caco-2细胞培养的基本条件 • Caco-2细胞的培养过程 • Caco-2细胞培养的常见问题及解决
方案 • Caco-2细胞培养的实际应用案例 • 未来展望与研究方向
01 Caco-2细胞简介
Caco-2细胞的来源和特性
Caco_2细胞助力药物吸收促进剂研究_王敏

中国医药报/2007年/11月/15日/第B06版科技周刊基础・研发Caco-2细胞模型研究新进展之二Caco-2细胞助力药物吸收促进剂研究王敏齐云当前,作为药物吸收研究的快速筛选工具。
Caco-2细胞模型受到了各国一线研究者的青睐,被越来越多地应用于口服药物吸收促进剂的研发,其研究效果获得了研究者的重视。
细胞旁路转运药物吸收研究亲水性药物及多肽类药物往往表现出较低的口服生物利用度。
这其中的一个重要原因就是肠上皮细胞的紧密连接使得这些药物经细胞旁路的被动扩散受到限制。
最近几年,研究者致力于开发能够调节肠上皮细胞紧密连接,但又不破坏细胞单层的完整性,从而增加肠通透性的吸收促进剂,如中链脂肪酸、壳聚糖及其衍生物。
Caco-2细胞模型作为肠上皮细胞的体外最佳替代模型被用于筛选此类吸收促进剂。
有研究显示,羟丙基-β环糊精和β-环糊精较壳聚糖更能提高优降糖的溶出度。
在Caco -2细胞通透性实验中,将两种环糊精和壳聚糖合用时,出现协同效应,表明合用环糊精和壳聚糖较单用壳聚糖更能增加优降糖的肠上皮通透性。
由于壳聚糖只在酸性环境中可溶,而肠腔为中性至碱性,研究者对壳聚糖的结构进行了修饰,将壳聚糖局部季铵化,制成Ⅳ-三甲基壳聚糖氯化物(TMC),该物质在中性环境下可溶,且仍然具有壳聚糖的黏膜黏附性质。
研究者将其在Caco-2细胞模型上进行转运实验,发现其能够刺激细胞支架的丝状肌动蛋白重新排列,从而打开肠上皮细胞的紧密连接,促进亲水性药物和肽类药物经细胞旁路的被动吸收。
Ventura等采用双氧甲基β-环糊精包合塞来考昔(一种COX-2抑制剂),它们以范德华力互相结合。
包合后的塞来考昔较单体具有更高的水溶性和溶出度。
采用Ca-co-2细胞模型通透实验发现,环糊精能够使肠上皮黏膜失去稳定性,从而使塞来考昔经肠上皮的通透性增高。
肽类药物吸收研究口服蛋白质类药物,如胰岛素,在经过小肠上皮时往往被上皮细胞的代谢酶水解,从而导致其生物利用度降低,失去疗效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上海细胞生物所。
还有我们实验室也有,不知道卖不卖。
如果需要和我e-mail联系:****************求助:有谁培养过HepG2细胞和 Caco-2 细胞吗?细胞, 培养, 求助细胞, 培养, 求助欢迎您访问。
提示:游客只能阅读部份内容,请注册或者登录后继续浏览全部信息,谢谢!本人第一次养细胞,目标细胞是HepG2细胞和 Caco-2 细胞,现在在查文献,可是有不少东西都不懂,如我在网上找到的Caco-2 细胞的培养基是MEM,20%胎牛血清和NEAA,这个?没有量啊,到时怎么配呢?请养过这两种细胞的前辈指点经验啊!我在此多多感谢了! [ 本帖最后由 liushen 于 08-6-16 22:13 编辑 ]超级版主3#发表于 08-6-18 16:19 | 只看该作者MEM,胎牛血清,非必需氨基酸欢迎您访问。
提示:游客只能阅读部份内容,请注册或者登录后继续浏览全部信息,谢谢!MEM是一种细胞培养液,你可以去公司网站去查,有卖的。
有现成的MEM液体,也有MEM干粉,可以自己去配制。
20%胎牛血清,就是在MEM液体里面加入胎牛血清至终浓度为20%。
NEAA是非必需氨基酸吧。
我们用的是Gibco公司的产品,买来的时候是10倍浓度的,用的时候10倍稀释到培养液中即可。
我有養過用DMEM+ FBS10% 含PS 0.05% 然後用trypsin 0.25% 去做subculture 就可以了!很好養!Caco-2细胞培养的一点重要经验这个细胞对生长环境的要求非常之高。
除了大家熟知的培养液条件的苛刻外(此不详述,又不懂的可留言问),对生长的空间问题要求比较高。
在每一次传代消化的时候,要消化足够长的时间,要不停地在镜下观察细胞的消化状态。
这个细胞长的比较厚,所以消化比较困难。
需要耐心。
而消化的结果应该是保证足够多的细胞都是成单个状态而不是抱团或者成片。
对于这一点,常规消化是比较难做到的。
所以需要采取点特殊措施,我一般是这样做的:首先吸干净原培养基,加入少量含EDTA的胰酶(以下简称YE)润洗,快速润洗完细胞生长面后吸走,然后加入适量的YE(我个人一般较常用量多加0.5-1ml),进行充分的消化,保持在镜下适时观察。
待较多细胞被消化下来悬浮于消化液中,大部分细胞边缘皱缩变清晰后,用吸管吸出消化液入离心管中加入适量培养基,常规离心5分钟左右,离心完毕倾倒上清,加入新鲜培养基吹打均匀,然后置于新的小培养瓶中培养。
原培养瓶中加入培养基吹打,细胞吹下来之后,适当多吹打几次细胞悬液以使细胞单个分离均匀。
然后分瓶传代,原瓶加入新培养基继续培养。
很关键的一点就是将YE的消化细胞悬液加培养基离心后培养,这里面的细胞基本上都是被消化下来的单个单个细胞,Caco-2细胞单个单个的生长会比抱团的生长的好很多。
传入新的培养瓶中之后你可以与原瓶进行比较。
caco-2细胞培养遇到的麻烦。
最近从上海细胞库引进一株caco-2(ATCC新引入,大概十代左右吧),在培养中遇到了不小的麻烦,所以来园子里问问各位达人。
简述一下我的操作吧:收到细胞以后,在孵箱里搁了一夜。
第二天,换液(自配的培养基:DMEM 20%Gibco NCS 0.1mM EME),同时留一份自带的培养基;一天后,消化,吸去培液后,加PBS洗一遍(居然给冲下来一块细胞...很诡异),去PBS后再加入0.25%Trypsin 3ml,室温放置5min,镜下观察细胞仍粘连;去除大部分Trypsin后,放入孵箱,10min...20min...后,仍有相当数量的细胞紧密连接;加培养终止后,发现大部分细胞冲不下来;再进行第二次消化10min,总算能冲下细胞,且基本为单个。
传了两盘,一份加自配的培液,另一份加随细胞自带的培液。
一天后,观察:细胞贴壁的不多,且细胞碎片较多,换液处理(干净多了,呵呵);两天后,观察:原来贴壁的细胞也死了不少,可能有密度依赖吧,稀了长不起来.......很头痛!说明几点情况:1.这次是火车运送(奥运的原因...),路上耽搁了三天吧;2.0.25%Trypsin自配,用于消化其它的细胞,都没有问题;3.没有染菌的迹象,呵呵...高手们,给点意见吧,谢过先!消化时间也太长了吧,可以试试消化一段时间后弃去培养基,然后拍打瓶子底部,看看细胞是否脱落,要不就买带EDTA的胰酶试试,消化时间太长,对细胞损伤很大可用细胞刮子来刮,细胞消化太久不好的。
不过caco-2算是比较好养的,消化个30min也不见得死,因为长的太结实了,细胞有融合,一定要消化成单个没什么意义。
置于pbs冲洗脱落是很正常的,长成地毯状的细胞是容易被成片冲洗下来的,所以,培养基,pbs要预热,顺边缘加入,然后晃晃培养板。
动作要轻。
还有一点,有点担心,你的血清浓度是不是太高了。
我曾经用FBS10%(gibco),没问题,后来省钱,用了20%NBS,国产,就出现了很多网页上说的黑胶虫,麻烦的要死,细胞虽然状态不差,但是我还是全扔掉了,所以,建议你降低血清浓度,最好用胎牛。
感谢frankcai大牛的指教!细胞刮,没用过,感觉太“粗暴”了吧.....^_^,好使么?至于想消成单细胞,主要是觉得让一团细胞粘在一起,不利贴壁,可能会卦掉吧?试剂预热,我一般只是让它平衡到室温而已,偷懒~呵呵至于血清,我主要是参考了园子里的评论+细胞库网页+ATCC,可能20%保险一点吧,刚引进的细胞嘛...谁都知道Gibco的FCS好,可是所有细胞都用的话,负担不起咯主要是,我觉得控制不好消化的分寸,郁闷。
前段时间我在养Caco,也是中科院买的,Caco不太好培养。
要用胰酶-EDTA(要预热)消化的,25ml培养瓶加新鲜配置的消化液0.8ml,培养箱37度放2分钟。
有时候这个细胞是不太好消化,细胞养了几代之后稳定了,应该还是比较好消化的。
Caco贴壁比较慢,所以一定要去除胰酶-EDTA,要用一次性培养瓶。
高糖DMEM培养基添加10%血清(FBS、NBS无所谓)。
一两天内细胞贴壁形态不明显,两天之后才能看到细胞贴壁成块状,之后1-2天细胞生长迅速,4天差不多可以传代。
祝好运!楼上的为什么要用一次性培养瓶啊,我们养的发现玻璃瓶比一次性的一直都长的好些,虽然细胞普遍长的不好~谢谢summityoung!摸索摸索咯~我养的时候觉得Caco细胞用玻璃瓶养养,贴壁不好。
丁香园:ATCC建议用MEM+20%FBS,细胞长得也不快,1:4传代需要5-7天才可以传下一代。
但是,细胞会出现很多分泌物,看上比较脏,形态不好看。
如果你使用Gibco血清时,可以用逐渐降到10%FBS,一则省血清,二则减少细胞分泌物。
国产血清就别省了吧。
国内的Caco-2细胞被驯化过了,可以在10%FBS的条件下长得不错。
如果你是从中科院购买细胞,你可要注意了,尤其是使用进口的好血清时,一定要用10%FBS养,千万别用20%FBS,否则细胞会疯长。
个人认为,一、血清的多少对Caco-2的结果有影响的,一定要注意血清比例。
二、Caco-2不应该长得很快,一般5-7天传一代比较好。
三、那些认为Caco-2好养的人要注意了,如果你的细胞长得比较快的话,可能是血清的原因,也可能你的细胞已经不是Caco-2了。
电阻仪,太贵了,但又是必备阿Caco-2 细胞单层模型的评价:1、细胞形态学(小肠微绒毛结构及细胞间紧密连接) ;2、小肠刷状缘细胞标志酶———碱性磷酸酶的活性;3、Caco-2 细胞单层的跨膜电阻( transepithelial electrical resistance ,TEER) ;4、漏出标志物(甘露醇、荧光黄等) 被动扩散的跨膜通量;培养时普通培养瓶就好,等到做药物穿透性试验时才需要铺在TRANSWELL板上,卖得公司挺多的,我们用的是MILLIPORE的电阻仪好贵啊,打算用LC/MS测甘露醇ATCC培养方法师姐教我这样做:1)弃旧培养液,2)PBS洗2-3遍,弃去,3)加入适量消化液,50ml瓶我加入800ul,盖好盖子放进培养箱约3min,4)3min后从培养箱取出培养瓶,在倒置镜下观察,大多数细胞已变圆,弃去消化液,室温下让残留消化液继续作用,5)隔几分钟轻轻拍打瓶壁,待细胞从瓶壁上脱落时,加入适量完全培养基中止消化作用,用吸管轻轻吹打即可,6)将消化下来的细胞转至离心管进行离心,1000rpm,5min,7)取出离心管,弃去上清液,加入1ml新鲜完全培养基,充分混匀后分瓶。
Caco-2对营养,对血清的要求较高,如果你传代后成团,挤着生长,而且你用的是国产血清,试试换成进口的吧,我以前用四季清的,就是你这样情况,总是长不开养不活,换成GIBCO状态就好了,还有,培养液10%的血清比例要足够,传代时培养基体积尽量多点也没关系的。
大家如果感兴趣,可以在园子里搜索一下我对于Caco-2问题的一些解答和建议,希望能有帮助,在这里把大家在这个帖子里的问题逐一解答一下。
1. 对于传代的问题,理论上来讲如果Caco-2细胞不超过70代,形态和功能上一般不会发生太大的变化。
但是如果你是用来做实验,一个批次的实验最好控制在10代以内,如果还想做就要重新复苏细胞,因为已经传了10代了,可能会有一些变化。
2. 对于消化,既然Caco-2细胞属于贴壁细胞,消化的标准是大部分细胞碎片脱落,在此期间可以对其进行轻微震荡,消化下来后用一到两倍的培养基中和胰酶的作用,然后吹散,这一步也很必要。
3. 中和结束后离心,弃去上清后再加入新的培养基。
一般传代的话一分五就行,也就是如果用5毫升培养基重悬细胞,取出1毫升传代就行,当然要视密度和生长状况而定。
4. 楼主说的吹打100次太多了,如果你用移液管吹不散的话,可以用1毫升的移液枪试试,那个力度更大,大概有十几次应当就没有问题了。
5. 对于培养基,一般是采用DMEM,而且要加入10 mM的HEPES,主要作用是稳定pH值,别忘了加,要不然变化很大的。
jyhuang123所说的培养基变紫了,不是不稳定分解,而是pH值发生了变化。
6. 对于jyhuang123的另外一个问题,“很多不贴壁的都在换液的时候吸掉了”,这个是无所谓的。
如果细胞经历24小时仍然没有贴壁,那证明细胞没有长好,长好的肯定已经贴上了,没贴壁的那些肯定状态不好,所以不要也不可惜。
7. contala的新问题是铺板,那个就要注意了,就是铺上后和最初几次换液,尽量避免摇晃,因为晃一下的话很容易将细胞都晃到中间而聚团。
大家再接着努力吧,看看有什么问题再讨论。
我去年从上海细胞库买回来是也是按照他们标示用的1640,后来换成高糖DMEM,一直养到现在,没有问题,这种癌细胞还是非常好养的!传代最好不要等它长的太满传,大概80-90%就可以传了,太满再传后反而状态不好了。
