高考化学二轮复习 专项突破练(十)加试第32题(含解析)
【高三】2021届高考化学第二轮复习预测题(含答案和解释)

【高三】2021届高考化学第二轮复习预测题(含答案和解释)一、(每小题3分,共54分)1.能用能量判据判断下列过程的方向的是( )A.水总是自发地由高处往低处流B.放热反应容易自发进行,吸热反应不能自发进行C.有序排列的火柴散落时成为无序排列D.多次洗牌以后,扑克牌的毫无规律的混乱排列的概率大解析:A.水总是自发地由高处往低处流,有趋向于最低能量状态的倾向。
B.吸热反应也可以自发进行,例如,在25 ℃和1.01×105 Pa时,2N2O5(g)===4NO2(g)+O2(g) ΔH =+56.7 kJ/mol,(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ/mol。
不难看出,上述两个反应都是吸热反应,又都是熵增的反应,显然只根据焓变来判断反应进行的方向是不全面的。
C.有序排列的火柴散落时成为无序排列,有趋向于最大混乱度的倾向,属于熵判据。
D.扑克牌的无序排列也属于熵判据。
答案:A2.NO2中存在下列平衡:2NO2 N2O4(g)(正反应是放热反应)。
在测定NO2的相对分子质量时,下列条件中较为适宜的是( )A.温度130 ℃,压强3.03×105 PaB.温度25 ℃,压强1.01×105 PaC.温度130 ℃,压强5.05×104 PaD.温度0 ℃,压强5.05×104 Pa解析:在测定NO2的相对分子质量时,应该尽量减少N2O4的含量,也就是应该尽量减少N2O4的含量,也就是应该尽量使上述反应平衡向左移动,即应尽量采取高温、低压的条件。
答案:C3.在一定条件下,固定体积的密闭容器中存在反应:2NO2(g) O2(g)+2NO(g) ΔH >0,达到平衡时,当改变其中的一个条件X,Y随X的变化符合图中曲线的是( )A.当X表示温度时,Y表示NO2的物质的量B.当X表示压强时,Y表示NO2的转化率C.当X表示反应时间时,Y表示混合气体的密度D.当X表示NO2的物质的量时,Y表示O2的物质的量解析:选项C是对题目所给的物质的状态都为气态,反应容器为定容容器未注意,而认为随着反应的进行气体密度在变化;选项D应是直线性关系。
高考化学二轮复习提分试题及答案

高考化学二轮复习提分试题及答案一、选择题(16小题,每小题3分,共48分,每小题只有一个正确答案)1.NA表示阿伏加德罗常数的值。
下列说法中正确的是①常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA②常温常压下, 18g H2O中含有的电子总数为10NA③将100 mL 0.1 mol·L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.1NA④在反应KIO3+6HI==KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA⑤电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜A.①⑤B.③④C.②④D.②③【答案】C酸钾中+5价碘元素被还原生成0价碘单质,每生成3 molI2转移5mol电子,转移的电子数为5NA,正确;⑤由于粗铜中含有锌、铁等金属性强于铜的杂质先于铜放电,所以电解精炼铜时,当电路中转移NA个电子,阳极不一定溶解32 g 铜,错误。
考点:考查阿伏加德罗常数的相关计算2.下列各组说法一定正确的是( )A.强电解质:盐酸、氢氧化钡、明矾B.纯净物:冰水混合物;含氧40%的氧化镁C.有单质参加和单质生成的化学反应一定是氧化还原反应D.同位素:H2、D2、T2【答案】B考点:考查物质分类3.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。
若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+ 恰好完全沉淀,则消耗NaOH溶液的体积是( )A.60mLB.45mLC.30mLD.15mL.【答案】A【解析】试题分析:完全反应生成硝酸,则整个过程中硝酸反应前后没有变化,即铜失去的电子都被氧气得到了。
根据得失电子守恒,氧气的物质的量为1.68/22.4=0.075mol,则铜的物质的量为0.075×4/2=0.15mol,根据铜离子结合2个氢氧根离子分析,需要的氢氧根的物质的量为0.3摩尔,则氢氧化钠的体积为0.3/5=0.06L,,即60毫升,选A。
(2021年整理)2019-2020年高考化学二轮复习专项强化突破练三元素及其化合物

(完整)2019-2020年高考化学二轮复习专项强化突破练三元素及其化合物编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)2019-2020年高考化学二轮复习专项强化突破练三元素及其化合物)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)2019-2020年高考化学二轮复习专项强化突破练三元素及其化合物的全部内容。
2019-2020年高考化学二轮复习专项强化突破练三元素及其化合物一、选择题(本题包括10小题,每小题6分,共60分)1.(xx·泉州一模)下列有关化学与生活的说法错误的是()A.铁粉、生石灰均可作食品抗氧化剂B。
明矾、氯化铁均可作净水剂C。
牛奶、鸡蛋清均可用于重金属中毒解毒D.碘酒、双氧水均可用于伤口消毒【解析】选A。
生石灰与水反应生成氢氧化钙,常用作食品干燥剂,常用铁粉等还原性物质做抗氧化剂,A错误;明矾、氯化铁在水中会水解生成氢氧化铝胶体和氢氧化铁胶体,可吸附水中的杂质,起到净水的作用,B正确;牛奶、鸡蛋清均富含蛋白质,可以结合重金属离子,使变性的蛋白质不再是人体的蛋白质,这样就可以保护人体,C正确;碘酒、双氧水均可杀灭细菌,D正确。
【加固训练】(xx·中山二模)化学与生产、生活、社会密切相关。
下列有关说法中正确的是()A.在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因B.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒C.SO2具有漂白性,可用于漂白纸浆,也可以大量用于漂白食品D。
纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污【解析】选D。
在日常生活中,金属的腐蚀以电化学腐蚀为主,电化学腐蚀是造成钢铁腐蚀的主要原因,故A错误;明矾在溶液中电离出铝离子,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,但不能杀菌消毒,故B错误;SO2具有漂白性,可用于漂白纸浆,但是有毒,不可以用于漂白食品,故C错误;纯碱可用于生产普通玻璃,纯碱水解显碱性,能使油脂水解,故日常生活中也可用纯碱溶液来除去物品表面的油污,故D正确.2.(xx·福州二模)下列说法不正确的是()A.84消毒液含有次氯酸钠,洁厕灵中含有盐酸,二者混合使用会产生氯气使人中毒B。
高考化学复习考点知识突破解析32: 有机推断与合成大题(一)(解析版)

高考化学复习考点知识突破解析有机推断与合成大题1.碘海醇是临床中应用广泛的一种造影剂。
化合物H是合成碘海醇的关键中间体,化合物H的合成路线如下:已知:①R-NO2R-NH2②R1COCl+R2NH2R1CONHR2请回答:(1)A的化学名称为______;G的结构简式_______。
(2)下列说法正确的是________。
A.分子式和A相同的芳香族化合物还有3种(除A) B.化合物C生成D的反应为取代反应C.化合物D具有两性,是典型的α-氨基酸D.化合物H的分子式为C14H18N3I3O6(3)由D反应生成E的化学方程式__________。
(4)设计以苯胺和乙烯为原料合成的路线_____(用流程图表示,无机试剂任选)。
(5)J是C的同系物且J比C多一个碳原子,写出符合下列条件的J的所有同分异构体的结构简式_____。
①含有—NO2无—O—CH3和—O—O—的芳香族化合物:②与氯化铁溶液不发生显色反应:③核磁共振氢谱为3组峰,峰面积之比为3:2:2。
【答案】(1)间二甲苯或1,3-二甲苯HOCH2CH(OH)CH2NH2(2)AD(3)3ICl++3HCl(4)CH2=CH2BrCH2CH2Br或者CH2=CH2BrCH2CH2Br(5)【解析】从ABCDEFH的演变过程可知,A含苯环,由信息②知,H中所连的2个肽键由酰氯和胺类反应而成,即和反应生成,故F,G为,ABCDEF的演变中没有引入其它的碳原子,碳原子原来的位置没有发生变化,故A为,由流程知,A→B为氧化反应,B为,B→C为硝化反应,C为,C→D的反应,仿照信息①,则D为,从分子式的变化和H的结构简式知,E为。
(1)据分析:A的化学名称为间二甲苯或1,3-二甲苯;G的结构简式HOCH2CH(OH)CH2NH2;(2)A项,分子式和A相同的芳香族化合物还有3种(除A),分别为邻二甲苯、对二甲苯和乙苯,A正确;B项,化合物C生成D的反应为还原反应,B错误;C项,化合物D含有氨基和羧基,具有两性,但氨基和羧基没有连在同一个碳原子上,故不是α-氨基酸,C错误;D项,由结构简式知,化合物H的分子式为C14H18N3I3O6,D正确;故说法正确的是AD;(3) D为, E为,由D反应生成E的化学方程式3ICl++3HCl;(4)据分析,以苯胺和乙烯为原料合成的路线如下:CH2=CH2BrCH2CH2Br或者CH2=CH2BrCH2CH2Br;(5)J是C的同系物且J比C多一个碳原子,其要满足的条件有:①含有—NO2无—O—CH3和—O—O—的芳香族化合物:②与氯化铁溶液不发生显色反应,则可知J和C是含有相同官能团的,即含有2个羧基、1个硝基,结合条件③核磁共振氢谱为3组峰,峰面积之比为3:2:2,则羧基一定处于对称位置,羧基有一种氢原子、甲基又有一种氢原子、则苯环上还剩一种氢原子,处于对称位置,满足条件的结构简式可以是:、、以及。
高三化学二轮复习:氧化还原反应专题练及答案
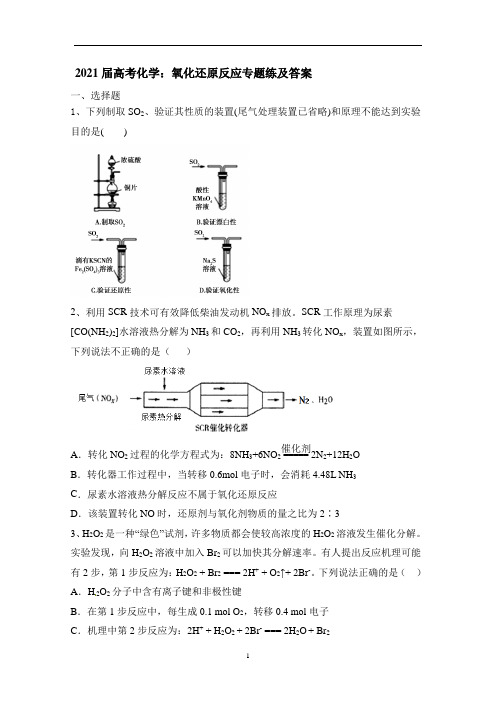
2021届高考化学:氧化还原反应专题练及答案一、选择题1、下列制取SO2、验证其性质的装置(尾气处理装置已省略)和原理不能达到实验目的是( )2、利用SCR 技术可有效降低柴油发动机NO x 排放。
SCR 工作原理为尿素[CO(NH 2)2]水溶液热分解为NH 3和CO 2,再利用NH 3转化NO x ,装置如图所示,下列说法不正确的是( )A .转化NO 2过程的化学方程式为:8NH 3+6NO 2=====催化剂2N 2+12H 2OB .转化器工作过程中,当转移0.6mol 电子时,会消耗4.48L NH 3C .尿素水溶液热分解反应不属于氧化还原反应D .该装置转化NO 时,还原剂与氧化剂物质的量之比为2∶33、H 2O 2是一种“绿色”试剂,许多物质都会使较高浓度的H 2O 2溶液发生催化分解。
实验发现,向H 2O 2溶液中加入Br 2可以加快其分解速率。
有人提出反应机理可能有2步,第1步反应为:H 2O 2 + Br 2 === 2H + + O 2↑+ 2Br -。
下列说法正确的是( )A .H 2O 2分子中含有离子键和非极性键B .在第1步反应中,每生成0.1 mol O 2,转移0.4 mol 电子C .机理中第2步反应为:2H + + H 2O 2 + 2Br - === 2H 2O + Br 2D.若在加入Br2的H2O2溶液中检出Br-,则说明第1步反应发生了4、下列物质的工业生产原理不涉及氧化还原反应的是( )A.氨气B.纯碱C.硫酸D.溴单质5、下列反应一定属于氧化还原反应的是()A.化合反应 B.分解反应C.置换反应 D.复分解反应6、硫代硫酸钠溶液与氯气能发生反应:Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4。
下列说法错误的是()A.氧化产物、还原产物的物质的量之比为1∶1B.若0.5molNa2S2O3作还原剂;则转移4mol电子C.当Na2S2O3过量时,溶液能出现浑浊D.硫代硫酸钠溶液吸收氯气后,溶液的pH降低7、Na2S2O3是重要的化工原料,用途很广,其还原性较强,在溶液中易被Cl2氧化成SO2-4,常用作脱氯剂,主要用于治疗氰化物中毒。
最新高考化学二轮增分优选练 加试题增分练 第32题 有机化学综合题突破(考试必备)

第32题 有机化学综合题突破1.(2017·浙江11月选考,32)某研究小组按下列路线合成药物胃复安:已知:;RCOOR′――→H 2NR″RCONHR″请回答: (1)化合物A 的结构简式________。
(2)下列说法不正确的是________。
A .化合物B 能发生加成反应B .化合物D 能与FeCl 3溶液发生显色反应C .化合物E 具有碱性D .胃复安的分子式是C 13H 22ClN 3O 2(3)设计化合物C 经两步反应转变为D 的合成路线(用流程图表示,试剂任选)_______________ ________________________________________________________________________。
(4)写出D +E→F 的化学方程式_______________________________________________ ________________________________________________________________________。
(5)写出化合物E 可能的同分异构体的结构简式____________________________________ ________________________________________________________________________, 须同时符合:①1H-NMR 谱表明分子中有3种氢原子,IR 谱显示有N —H 键存在;②分子中没有同一个碳上连两个氮()的结构。
答案 (1) (2)BD (3)(4)(5)解析 本题解题思路:应根据题中唯一已知的有机物结构去推断合成其的反应物结构。
(1)根据题中所给已知条件―――→(CH 3)2SO 4,A 为C 7H 7NO 3并可与CH 3OH 以及CH 3COOH 反应,可推出A 中有—COOH 和—OH ,根据胃复安的结构可推知A 为。
山东新高考化学二轮复习专题突破练2化学常用计量 含解析

专题突破练2化学常用计量一、选择题(本题包括10个小题,每小题6分,共60分)1.(2019山东邹城二中模拟)有关阿伏加德罗常数N A的叙述正确的是()A.标准状况下,2.24 L HF含有的HF分子数为0.1N AB.标准状况下,1.12 L 1H2和0.2 g 2H2均含有0.1N A个质子C.等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和分别相等D.将0.1 mol Cl2通入足量水中,充分反应后,转移电子的个数为0.1N A2.(2019福建福州八县一中高三上学期期中)设N A为阿伏加德罗常数的值,下列说法正确的是()A.10 g质量分数为46%的乙醇溶液中,氢原子的总数约为0.6N AB.7.8 g Na2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5N AC.将1 L 0.1 mol·L-1 FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1N AD.常温下,N H4+数目:1 L 0.5 mol·L-1 NH4Cl溶液大于2 L 0.25 mol·L-1 NH4Cl溶液3.(双选)N A为阿伏加德罗常数的值。
下列说法正确的是()A.水蒸气通过过量的Na2O2使其增重2 g时,反应中转移的电子数为N AB.25 ℃时,1 L pH=11的醋酸钠溶液中,由水电离出的OH-数目为0.001N AC.1 mol —OH(羟基)与1 mol N H4+中所含电子数均为10N AD.2.8 g乙烯与2.6 g苯中含碳碳双键数均为0.1N A4.(2019山西太原第五中学高三月考)下列条件下,两种气体分子数一定不相等的是()A.相同质量、不同密度的N2O和CO2B.相同体积、相同密度的CO和C2H4C.相同温度、相同压强、相同体积的O2和O3D.相同压强、相同质量的CO和CO25.(2019甘肃兰州第一中学高三期中)设N A为阿伏加德罗常数的数值,下列说法不正确的是()A.23 g Na与O2充分反应生成Na2O和Na2O2的混合物,消耗O2的分子数N(O2)的范围为0.25N A<N(O2)<0.5N AB.2 mol NO和1 mol O2在密闭容器中充分反应,反应后容器中的分子数小于2N AC.2.5 g Mg-Zn合金与足量盐酸反应,放出的气体在标准状况下的体积可能为2.24 LD.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,转移的电子数目为0.92N A6.设N A为阿伏加德罗常数的值。
2023年高考化学第二轮专项复习真题仿真—化学反应的热效应(含答案)

2023届高考化学第二轮专题复习真题试卷模拟——化学反应的热效应一、单选题A .铝片与稀24H SO 反应B .()22Ba OH 8H O ⋅与4NH ClC .氢气在2O 中的燃烧反应A .A 2(g)+B 2(g)=2AB(g)是一个放热反应B .A 2(g)与B 2(g)每生成2molAB(g)时吸收C .该反应中反应物的总能量低于生成物的总能量D .断裂1molA -A 键和1molB -B 键时放出3.(2023·全国·高三专题练习)由金属单质和氯气反应得到所示(M=Ca 、Ba)。
下列说法不正确的是A .∆H 1+∆H 3<0B .∆H 4>∆H 5C .∆H 2(Ba)<∆H 2(Ca)D .∆H 1+∆H 2+∆H 3+∆H 4+∆H 5+∆H 6=∆H4.(2023春·湖北武汉·高三校联考期中)如图是金属镁和卤素单质2X 反应的能量变化示意图。
下列说法正确的是A .2MgX 中热稳定性最好的是2MgIB .由2MgCl 制取Mg 是放热过程C .金属镁和卤素单质()2X g 的反应都是放热反应D .此温度下四种2MgX 中,()2MgI s 所含化学键的键能最大5.(2023·全国·高三专题练习)已知几种物质之间的能量关系如图所示,下列说法中不正确的是()A .使用合适催化剂,不能减小反应的焓变B .(g)+H 2(g)=()g 中,热能转化为产物内部的能量C .(g)+H 2(g)=(g)28.7kJ /molH ∆=+.(g)=((2023春高三宁南中学校考阶段练习)下列图示与对应的叙述相符的是A .(a)图表示反应物断键吸收的能量小于生成物成键放出的能量B .(b)图是金刚石与石墨分别被氧化生成2CO 的能量关系曲线,说明石墨转化为金刚石为吸热反应C .由(c)图可知,-13222SO (g)2SO (g)+O (g)ΔH=(b-a)kJ mol ⋅ D .(d)图是某反应:A→C(由两步反应A→B→C 完成,B 为中间产物)的能量曲线量),整个反应中4123ΔH=E -E -E -E 7.(2023春·河北邢台·高三河北南宫中学校考阶段练习)已知甲烷、氢气、一氧化碳的燃烧热H ∆依次为1kJ mol a --⋅、1kJ mol b --⋅、1kJ mol c --⋅(a 、b 、c 均大于0)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专项突破练(十) 加试第32题1.(2016·台州9月选考质量评估)某研究小组以烃A 为主要原料,采用以下路线合成药物X 和高聚物Y :已知:(R 或R′可以是烃基或H 原子)请回答下列问题:(1)若反应①、②的原子利用率均为100%,则A 的名称为________________________。
(2)反应③的条件是______________________,反应⑤的反应类型是__________________。
(3)写出反应④的化学方程式________________________________________________。
(4)写出同时符合下列条件的E 的所有同分异构体的结构简式:____________________。
ⅰ.属酚类化合物,且是苯的对位二取代物;ⅱ.能发生银镜反应和水解反应。
(5)以CH 3CHO 为原料可合成Y ,请结合本题信息,设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图。
CH 3CH 2OH ――→浓硫酸170 ℃H 2C===CH 2――→Br 2BrH 2C —CH 2Br 答案 (1)乙炔 (2)NaOH 水溶液、加热 消去反应(3) +2H 2O(4)(5)解析反应①、②的原子利用率均为100%,属于加成反应,结合反应②的产物,可知烃A 为乙炔,B为苯乙烯,反应③为卤代烃在氢氧化钠水溶液加热条件下发生的水解反应,则C为。
C可以发生催化氧化生成D,D发生题给信息Ⅰ中的反应,D为,E为,F为,F分子中含有羟基,在浓硫酸加热条件下发生消去反应得到X。
(1)根据以上分析可知A是乙炔。
(2)反应③是卤代烃的水解反应,其条件是NaOH水溶液、加热,反应⑤的反应类型是消去反应。
(3)根据以上分析可知反应④的化学方程式为+2H2O。
(4)①属于酚类化合物,且是苯的对位二元取代物。
②能发生银镜反应和水解反应,含有甲酸形成的酯基,符合条件的同分异构体有。
(5)以CH3CHO为原料可合成Y,请结合本题信息,设计合成路线(无机试剂及溶剂任选)。
乙醛和HCN发生加成反应,酸性条件下水解得到,在浓硫酸加热条件下发生消去反应生成CH2===CHCOOH,最后发生加聚反应得到,合成路线流程图为2.(2016·浙江省名校协作体高三试题)已知:①R—OH ――→R -XNaOHR —O —R ; ②③C 的化学式为C 15H 13NO 4,—Bn 含苯环但不含甲基。
盐酸卡布特罗是一种用于治疗支气管病的药物,其中间体的合成路线如下:(1)写出下列物质的结构简式:A________________;W________________。
(2)指出反应类型:反应①_____________________________________________________,反应⑤________________。
(3)反应②的总化学方程式(—Bn用具体结构代入)_______________________ _______________________________________________________________。
(4)写出所有同时符合下列条件的同分异构体:______。
①与A属于同系物②1H的核磁共振谱图只有4个峰③分子中碳原子数目等于10(5)试利用上述合成路线的相关信息,由甲苯、(CH3)2NH等合成O2N————CH2N(CH3)2。
(无机试剂任用)答案(1)(2)取代反应加成反应(3)(4)(5)解析 (1)由C 可推知B 为则A 为,由G ――→WH 可知W 为。
(2)A ―→B 为硝化反应,也属于取代反应。
反应⑤:E 中的双键断开属于加成反应。
(3)由C 的分子式为C 15H 13NO 4及可推知—Bn 的化学式为C 7H 7,又Bn 中含有苯环不含甲基,故—Bn 的结构简式为,由此可写出反应②的化学方程式。
(4)与A 互为同系物且分子中C 原子数为10的有机物可在A 的结构简式基础上加饱和链状烃基,又因只有4种氢,故该有机物应高度对称,即或。
(5)采用逆合成分析法把该过程从后向前写出即为答案。
3.某酯类化合物M 为紫外线吸收剂,可用于配制防晒霜。
M 的一种合成路线如下:已知:a .A 分子中只有一个甲基;b .2RCH 2CHO ――→NaOH/H 2O△RCH 2CH CRCHO +H 2O 。
,请回答下列问题:(1)有机物M 的结构简式为 。
(2)下列说法正确的是 。
,A.化合物A 能发生加成反应,B.化合物B 能发生银镜反应,C.化合物C 能发生还原反应而不能发生氧化反应,D.反应①是还原反应 (3)写出B 与新制的2悬浊液反应的化学方程式: 。
(4)同时符合下列四个要求的邻羟基苯甲酸()的同分异构体的结构简式________。
①含有苯环;②既能发生银镜反应,又能发生水解反应;③核磁共振氢谱有4个峰;,④能与氯化铁发生显色反应。
(5)设计以乙醇为原料制备1丁醇的合成路线用流程图表示,无机试剂任选。
答案 (1)(2) B(3) CH 3CH 2CH 2CHO +NaOH +2CH 3CH 2CH 2COONa +Cu 2O↓+3H 2O(4)(5)解析 A 分子式为C 4H 10O ,且A 中只有一个甲基,则A 为CH 3CH 2CH 2CH 2OH ,A 被氧气氧化生成B ,则B 为CH 3CH 2CH 2CHO ,CH 3CH 2CH 2CHO 在氢氧化钠的水溶液、加热条件下发生反应生成C ,结合题目给予的信息,可知C 的结构简式为CH 3CH 2CH 2CHC(CH 2CH 3)CHO ,C 与氢气发生加成反应生成D ,为CH 3CH 2CH 2CH 2CH(CH 2OH)CH 2CH 3,D 和水杨酸发生酯化反应生成M ,则M 的结构简式为。
(1)根据上面的分析可知,有机物M 的结构简式为。
(2)有机物A 是1丁醇,为饱和一元醇,不能发生加成反应,A 错误;B 为丁醛,能够发生银镜反应,B 正确;C 的结构简式为CH 3CH 2CH 2CH===C(CH 2CH 3)CHO ,C 结构中含有醛基,醛基既能被还原为醇羟基又能被氧化为羧基,C 错误;反应①是醇的催化氧化反应,D 错误。
(3)B 为CH 3CH 2CH 2CHO ,B 与新制的Cu(OH)2悬浊液反应的化学方程式为CH 3CH 2CH 2CHO +NaOH +2Cu(OH)2→△CH 3CH 2CH 2COONa +Cu 2O↓+3H 2O 。
(4)①含有苯环;②既能发生银镜反应,又能发生水解反应,说明含有HCOO —,③核磁共振氢谱有4个峰,说明结构较对称;④能与氯化铁发生显色反应,说明含有酚羟基,符合要求的结构简式是。
(5)乙醇合成1丁醇,碳原子数加倍,利用题中所给的信息:可使碳原子数增加,先把乙醇催化氧化成乙醛;合成路线的流程图为4.化合物M 是一种香料,可采用油脂与芳香烃(含苯环的烃)为主要原料,按下列路线合成:已知:①RX ――→NaOH/水△ROH ②E 分子中只有两种不同化学环境的H 原子③(R 1、R 2、R 3与R 4可能是氢、烃基或其他基团)(1)A 中官能团的名称是____________,D→E 的反应类型为____________。
(2)E 的结构简式为____________。
(3)C +F→M 的化学方程式_________________________________________________ ________________________________________________________________________。
(4)下列化合物中属于F 的同分异构体的是__________。
(5)写出从BrCH 2CH 2Br ――→ HCOOCH 2CH 2OOCH 的合成路线(无机试剂任选,合成路线参照题中的书写形式)。
答案 (1)羟基 取代反应(2)(3)(4)bd(5)BrCH 2CH 2Br ――→NaOH/水△HOCH 2CH 2OH ――→HIO 4HCHO ――→i.新制2ii.H +HCOOH ――→HOCH 2CH 2OH浓H 2SO 4,△HCOOCH 2CH 2OOCH解析 油脂水解得到A 为,结合信息③可知A 氧化生成HCHO 、HCOOH ,B 氧化得到C ,故B 为HCHO ,C 为HCOOH 。
芳香烃D 与氯气在光照条件下发生侧链取代反应生成E ,E分子中只有两种不同化学环境的H 原子,则D 为,E 为,F 为,M 为。
(1)A 为,含有的官能团的名称是羟基,D→E 的反应类型为取代反应。
(2)E 的结构简式为。
(3)C +F→M 的化学方程式:2HCOOH +。
(4)F 的结构简式为,与F 的分子式不同,与F 不是同分异构体,、CH 2===CH —CH===CH —CH===CH —CH 2COOH 与F 的分子式相同,结构不同,互为同分异构体。
(5)BrCH 2CH 2Br 在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH 2CH 2OH ,然后被HIO 4氧化生成HCHO ,再与新制氢氧化铜反应,酸化后得到 HCOOH ,最后与乙二醇发生酯化反应得到HCOOCH 2CH 2OOCH ,合成路线流程图为BrCH 2CH 2Br ----------→NaOH/水△HOCH 2CH 2OH ――→HIO 4HCHO ――→i.新制2ii.H+HCOOH ――→HOCH 2CH 2OH浓H 2SO 4,△HCOOCH 2CH 2OOCH 。
