酸碱盐氧化物之间的反应
酸碱盐常见的化学反应

⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)
3 使用时间: 年 月 日
CaCl2 + K2CO3 —
Ba(NO3)2 + Na2SO4 —
※ 不属于四种基本类型的反应:
⑴金属氧化物+CO→金属+CO2
Fe2O3 + CO ——
⑵碱+酸性氧化物→盐+水(可溶性碱) NaOH + CO2 —
3、NH4Cl NaOH Na2CO3----------------------------------------------( ) 4 AgNO3 Na2CO3 选用的试剂 A 、HCl KNO3 ----------------------------------------------( ) B、 H2SO4 C、Fe D、Ba(OH)2 E、Na2CO3 F、AgNO3 G、石蕊试液
7 使用时间: 年 月 日
课 后 作 业
Na + CuSO4 —— Fe(OH)3 + H2SO4 —— BaO + H2SO4 —— H2SO4 + NaCl —— BaCl2 + H2SO4 —— NaOH + KCl —— Ba(OH)2 + Fe2(SO4)3 —— Cu(OH)2 + K2CO3 —— NH4NO3 + Ba(OH)2 —— KNO3 + NaCl ——
中含有
(写离子符号) ,硫酸中含有
(写离子符号) 。
五、 露置空气的烧碱, 会跟空气中
发生反应而混入杂质 , 反应的化学方程式是
;
若要检验某烧碱中是否含有杂质,可选用的试剂是 是 。除去这种杂质的化学方程式为
,有关反应的化学方程式 .
课 后 小 结
酸碱盐的反应规律

酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应,可归纳成下图来表示。
①金属+ 氧气?金属氧化物除Ag、Pt、Au外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,由酸转化成盐有四个途径:某些金属+ 某些酸?盐+ 氢气酸+ 碱性氧化物?盐+ 水酸+ 碱?盐+ 水酸+ 某些盐?另一种酸+ 另一种盐⑧酸?酸性氧化物+ 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨金属+ 非金属?无氧酸盐此处的非金属H2、O2除外。
当金属越活泼,非金属也越活泼时,反应就越容易进行。
⑩酸性氧化物+ 碱性氧化物?含氧酸盐(非初三知识)强酸(H2SO4、HNO3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加热或高温条件下才能发生反应。
碱性氧化物+ 酸?盐+ 水强酸(H2SO4、HNO3、HCl)可与所有碱性氧化物反应,弱酸(H2CO3、H2S等)只能和活碱、4参加反应的两种盐必须都能溶于水,若生成物中有一种是难溶性的盐时,则反应可以进行。
金属+ 盐?另一种金属+ 另一种盐在金属活动性顺序里,排在前面的金属(K、Ca、Na除外)能把排在后面的金属从它的盐溶液里置换出来。
金属+ 酸?盐+ 氢气在金属活动性顺序里,排在氢前的金属能从酸溶液中把氢置换出来。
这里的酸主要是指盐酸和稀硫酸。
浓硫酸和硝酸因有强氧化性,跟金属反应时不会生成氢气,而是生成盐、水和其它气体。
除杂1、CO2(CO):把气体通过灼热的氧化铜,2、CO(CO2):通过足量的氢氧化钠溶液3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体3除去Cu中的Fe,可将混合固体加入CuSO4溶液中,(Fe+CuSO4=Cu+FeSO4),然后过滤后取滤渣。
4除去Na2SO4溶液中的NaOH,可向溶液中加入适量的稀H2SO4溶液(2NaOH+H2SO4=Na2SO4+2H2O)5除去KCl溶液中的K2SO4,可向溶液中加入适量的BaCl2溶液(K2SO4+BaCl2=2KCl+BaSO4),然后过滤后取滤液。
复分解反应发生的微观实质

生成不溶性碱的沉淀
盐的沉淀: Ag
+
Ca2+ 、Ba2+等和CO32-生成不溶性的碳酸盐的沉淀
看图探究
氯化钡与硫酸钠反应 实质:
Ba2+
Cl-
Cl-
-和Na+ Cl 旁观者:
Na+ SO42- BaSO 4
Na+
结论:
有BaSO4沉淀生成的 复分解反应实质是 Ba2+和SO42-反应
HCO3
-
NH4
反应
对于复分解反应三个条件我们进行微观总结: 1、有水生成: H+ + OH- → H2O 2、有气体生成:
H+ + CO32- ( H+ + HCO3- ) + NH + OH 4 NH3 3、有沉淀生成:
co2
碱的沉淀 Mg
2+
、 Al3+ 、Fe3+、 Cu2+等和OH-反应 + Cl- →AgCl Ba2+ + SO42- →BaSO4
H C1 H 2 SO4 + (H + 酸根离子) H NO3 H2 CO3 NaOH KOH ( 金属离子 + OH- ) Ba(OH)2 Ca (OH)2
NaCl Na2CO3 KCl CaCl2 CuSO4
由此我们知道: 酸碱盐中的两种物质在溶液中混合, 实际上是它们的离子与水分 子的混合
看图探究
H+
Ca2+
CO32-
2+
OH-
Mg
2+
Fe Cu
2+
3+
Ba
SO4
2-
Al
3+
Ag
初三酸碱盐八大反应规律

初三化学中,酸碱盐反应是非常重要的一部分,其中有8个反应规律,它们分别是:
1.酸和碱中和反应。酸和碱反应,生成盐和水。反应类型为:酸+碱→盐+水。
2.酸和碱金属反应。酸和碱金属反应,生成氢气、盐和水。反应类型为:酸+金属→氢气+盐。
3.酸和碳酸盐反应。酸和碳酸盐反应,生成盐、水和二氧化碳。反应类型为:酸+碳酸盐→盐+水+二氧化碳。
4.酸和金属氧化物反应。酸和金属氧化物反应,生成盐和水。反应类型为:酸+金属氧化物→盐+水。
5.酸和金属氢氧化物反应。酸和金属氢氧化物反应,生成盐和水。反应类型为:酸&#酸和金属的氧化还原反应,生成盐和氢气。反应类型为:酸+金属→盐+氢气。
7.碱和银盐反应。碱和银盐反应,生成银氧化物、水和碱金属盐。反应类型为:碱+银盐→银氧化物+水+碱金属盐。
单质氧化物酸碱盐相互反应的规律性和特例

单质氧化物酸碱盐相互反应的规律性和特例1. 金属+金属→不反应,但可形成合金。
2. 非金属+非.金属→共价化合物如:P+Cl2、C+S、Xe+F2等反应。
特例:金刚石与石墨、红磷和白磷在一定条件下相互转化,生成物仍为单质,不是化合物。
3. 金属+非金属→无氧酸盐如:Fe + Cl2、Cu + Cl2、Na + S、Cu + S、Fe + S 等反应。
特例:2Na + H2=2NaH、3Mg + N2=== Mg3N2,NaH属氢化物,Mg3N2属氮化物,均不属盐类。
4. 金属+氧气→碱性氧化物如:Na、Mg、Cu 和 O2反应生成 Na2O、MgO、CuO。
特例:Na、Al、Fe在O2中燃烧,其产物 Na2O2属过氧化物,Al2O3属两性氧化物,Fe3O4是特殊的氧化物,确切讲是一种盐。
5. 非金属+氧气→酸性氧化物如:C、S、P 和 O2反应生成 CO2、SO2、P2O5。
特例:N2、C与O2反应生成的NO 、CO均不属于酸性氧化物,为中性氧化物。
6. 碱性氧化物+酸性氧化物→含氧酸盐如:CaO + CO2;CaO+SiO2(高温下);Na2O+P2O5等反应。
7. 碱性氧化物+水→碱如:Na2O、K2O、CaO、BaO、MgO(需热水)均可和水直接化合成碱。
特例:CuO、Fe2O3等不可直接和水反应。
8. 酸性氧化物+水→含氧酸如:SO2、SO3、P2O5等和水反应。
特例:SiO2不溶于水,NO2溶于水生成 HNO3和 NO等反应。
特例:3FeO+ 10HNO3(稀)=3Fe(NO3)3+NO +5H2OFe2O3+ 6HI= 2FeI2+I2 + 3H2O10.酸性氧化物+碱→盐+水如:CO2、SO2和NaOH反应生成Na2CO3和水及Na2SO3和水。
特例:CO2+ NaOH = NaHCO3、SO2.+ NaOH = NaHSO311.酸+碱→盐十水如:HCl + NaOH、H2SO4+Ba (OH)2、HNO3+ Ca(OH)2等。
金属氧化物、酸碱盐的化学性质

一、金属氧化物的化学性质:1、金属氧化物+酸====盐+水 (复分解反应) 除锈 Fe 2O 3 + 3H 2SO 4 === Fe 2( SO 4)3 + 3H 2O2、金属氧化物+水==可溶性碱(若生成的碱不溶于水则该反应不能进行)(化合反应) CaO + H 2O === Ca (OH )2 Na 2O + H 2O === 2NaOH3、金属氧化物+还原剂(CO C H 2)======金属+CO 2/H 2O Fe 2O 3 +3 CO=====Fe + 3CO 2二、酸的化学性质(酸的电离:HmM-=== mH ++M m-):1、与酸碱指示剂作用:能使紫色石蕊 变红(确定溶液酸性),无色酚酞 不变色 。
2、酸+金属===盐+H 2↑ (置换反应) Fe+2HCl= FeCl2+H2↑3、酸+金属氧化物==盐+H 2O (复分解反应) Fe 2O 3 + 3 H 2SO 4== Fe 2 (SO 4) 3 + 3 H 2O4、酸+碱==盐+H 2O (复分解反应) 2NaOH + H 2SO 4==Na 2SO 4 + 2 H 2O5、酸+盐==酸+盐 (复分解反应) BaCl 2+H 2SO 4== Ba SO 4↓ + 2HCl【酸+碳酸盐==盐+ H 2O+CO 2↑】 (复分解反应) CaCO 3+ HCl== CaCl 2+ H 2O + CO 2↑三、碱的化学性质(碱的电离:(碱的电离:N(OH)n=== N n++ nOH -)1、碱能使紫色石蕊变蓝、无色酚酞变红(确定溶液是否显碱性一般用无色酚酞)2、碱 + 非金属氧化物(CO 2、SO 2、SO 3) == 盐+水Ca(OH)2 + CO 2 === Ca CO 3 ↓ + H 2O3、碱 + 酸 == 盐+水 (复分解反应) Cu(OH) 2 + H 2SO 4== Cu SO 4 + 2 H 2O4、碱 + 盐 === 盐 + 碱 (复分解反应)Na 2CO 3 + Ca(OH)2 == Ca CO 3↓ + 2NaOH四、盐的化学性质:1、盐+金属===盐金属 (置换反应) Fe+CuSO 4 = FeSO 4 + Cu2、酸+盐==酸+盐 (复分解反应) AgNO 3+HCl==AgCl ↓ + H NO 3【酸+碳酸盐==盐+ H 2O+CO 2↑】 (复分解反应) Na 2 CO 3+ 2HCl== 2NaCl + H 2O + CO 2↑3、碱 + 盐 === 盐 + 碱 (复分解反应) NaOH + CuSO 4== Na 2SO 4 + Cu (OH)2 ↓4、盐+ 盐===盐 + 盐 (复分解反应) BaCl 2 + CuSO 4== CuCl 2 + Ba SO 4↓【铵盐+碱===盐+水+NH 3↑】 (复分解反应) NH 4Cl+NaOH==NaCl+H 2O+NH 3↑铵根离子的检验:取样滴入氢氧化钠溶液,在试管口放一张湿润的红色石蕊试纸变蓝,说明含有铵根离子 高温 高温。
单质氧化物酸碱盐的关系

单质、氧化物、酸、碱、盐之间的关系简析一、首先将物质进行简单分类(只分到如下的七类物质即可)二、将上述七类物质之间的转化和相互反应的关系列表如下:三、上述七类物质之间相互转化和相互反应的规律及注意问题(一)、六种相互转化关系1、金属+O2→碱性氧化物(化合反应)如:2Mg+O22MgO 2Cu+ O22CuO2、碱性氧化物+ H2O→碱(化合反应)*只有四种可溶性碱KOH,NaOH,Ca(OH)2,Ba(OH)2对应的碱性氧化物K2O,Na2O,CaO,BaO可直接与水化合生成相应碱,其余不能如:Na2O+H2O==2NaOH CaO+H2O==Ca(OH)2故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除Ca(OH)2是微溶碱外,其余都易溶。
3、碱→碱性氧化物+水(分解反应)a、不溶性碱....受热才能发生分解反应b、反应前后元素的化合价不变(特别注意金属元素的化合价)如:2Fe(OH)3Fe2O3+ H2O Cu(OH)2CuO+H2O4、非金属+O2→酸性氧化物(化合反应)如:C+ O2CO2 S+O2SO25、酸性氧化物+H2O→酸(含氧酸)(化合反应)* a除SiO2外,其余酸性氧化物一般都能直接与水化合生成相应酸b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)如:CO2+ H2O==H2CO3SO3+ H2O== H2SO4故:酸性氧化物溶于水时得到的都是相应酸的溶液。
6、酸→酸性氧化物+水(分解反应)* a、仅有含氧酸才能分解b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)c、酸性氧化物又叫酸酐(原因是:酸性氧化物可看作是含氧酸脱水的产物)如:H2SO4H2O+ SO3 ↑H2CO3H2O+ CO2↑写出下列几种含氧酸的酸酐:H2SO4______ HNO3_____ H3PO4_____ H2SO3____ (二)十个相互反应的关系(关系表中有四个横向、四个交叉、两个远距离关系,共十个)7、碱性氧化物+酸性氧化物→含氧酸盐(化合反应)如:CaO+ CO2== CaCO3 CaO+SiO2==CaSiO38、碱性氧化物+酸→盐+水(复分解反应)如:CuO+ 2HCl==CuCl2+ H2O Fe2O3+3 H2SO4==Fe2(SO4)3+3H2O9、酸性氧化物+碱→盐+水(不是基本反应类型)* a、参加反应的碱必须可溶b、注意生成的盐的化学式的书写如:CO2+ Ca(OH)2== CaCO3↓+H2O SO2+2NaOH==Na2SO3+H2OSiO2+2NaOH==Na2SiO3+H2OSO3+2NaOH== Na2SO4+ 2H2O10、碱+酸→盐+水(复分解反应)*酸跟碱作用生成盐和水的反应叫______反应。
单质氧化物酸碱盐之间的反应关系
4. 盐酸和氢氧化钙反应: 2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
5. 盐酸和氢氧化铁反应: 3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
6. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
7. 硫酸和烧碱反应:
变红色”,前者说法正确,后者说法错误。
(二)、酸与某些活泼金属反应,生成H2和盐。
金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
【 注意 】
(1)浓硫酸和硝酸与活泼金属反应,不生成H2,而生 成H2O。
(2) 活泼金属指金属活动顺序表中,氢前面的金属。 (3) Fe参加置换反应,生成物中铁显+2价(亚铁离
3
CaCl2
Na2SO4
BaCl2
NaCl
CaO
Ca(OH)2
Ca(OH)2+CO2= CaCO3↓+H2O
CaCl2→CaCO
3
与Na2CO3、 K2CO3反应
CaCl2
CaCO3
CaCO3+2HCl= CaCl2+H2O+CO2↑
Ca(OH)2+2HCl= CaCl2+H2O
NaOH
CO2
Ca(OH)2
Na2CO3
NaNO Ba(OH)2 Cu(OH)2
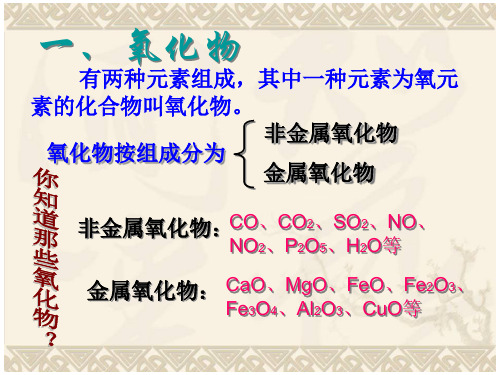
一、氧化物
有两种元素组成,其中一种元素为氧元
素的化合物叫氧化物。
氧化物按组成分为
非金属氧化物 金属氧化物
非金属氧化物:CO、CO2、SO2、NO、
NO2、P2O5、H2O等
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸碱盐氧化物之间的相互反应
书写化学方程式
判断下列之间是否发生反应,如果反应则写出化学反应方程式
1、镁与稀硫酸
2、铁与稀盐酸
3、铜与稀硫酸
4、氧化铁与硫酸
5、氧化钾与硫酸
6、氧化铜与盐酸
7、氢氧化钠与盐酸
8、氢氧化铁与盐酸
9、氢氧化钙与硫酸
10、氢氧化铝与盐酸
11、硝酸银与盐酸
12、氯化钡与硫酸
13、硝酸钡与硫酸
14、碳酸钠与盐酸
15、硫酸钾与盐酸
16、硝酸钙与盐酸
17、二氧化碳与氢氧化钠
18、二氧化碳与氢氧化钙
19、二氧化碳与氢氧化钡
20、氯化铜与氢氧化钠
21、氯化铝与氢氧化钠
22、硫酸铁与氢氧化钡
23、硫酸钡与氢氧化钠
24、硫酸铝与氢氧化铁
25、硝酸钾与氢氧化钠
26、铁与硝酸银
27、铁与硫酸铜
28、铝与氯化银
29、铁与硫酸铝
30、硫酸铝与碳酸钠
31、硫酸镁与碳酸钾
32、氯化钡与硝酸银
33、氯化钡与硫酸钠
34、氯化钡与硝酸钠
35、氯化银与硫酸铜
36、硝酸钠与硫酸钾
37、碳酸钠与氯化钡
38、硝酸钙与碳酸钾。
