酸碱盐之间的转化关系
酸碱盐氧化物单质间的转化关系

酸碱盐氧化物单质间的转化关系1. 酸碱盐的基本概念酸碱盐,这三个小伙伴儿就像是一桌子菜,酸味、碱味、咸味,缺一不可。
你想想,生活中我们每天都能遇到它们,酸奶里的乳酸,洗衣粉里的碱性成分,还有咱们餐桌上的盐,嘿,就是氯化钠。
其实,酸和碱就像老朋友,互相转化,调侃来调侃去,最终形成盐。
咱们常说“酸甜苦辣”,说的就是这个道理。
想想你吃的糖醋排骨,那酸酸甜甜的,真是让人食欲大开。
这里的酸,就是酸味,盐就是它们亲密合作的结果。
2. 酸与碱的相互转化2.1 酸和碱的化学反应咱们来聊聊酸和碱的转化,哎呀,真是个神奇的过程!当酸遇到碱,它们就像是打了一场温柔的架,最终形成盐和水。
就像王子和公主经过波折,最终幸福大团圆。
举个例子,盐酸(HCl)和氢氧化钠(NaOH)反应,嘿,瞧,出现了氯化钠(NaCl)和水(H₂O),这就是化学的魅力所在。
这个过程看似简单,其实背后可是有一整套化学方程式在支撑呢!2.2 日常生活中的应用而且,这些酸碱盐的转化在我们的日常生活中真是随处可见。
洗衣粉里的碱性成分,可以去污去油,而咱们的食盐呢,又是生活中不可缺少的调味品。
不信你看看,没有盐的饭菜,哎呀,简直就像白开水一样乏味。
酸和碱的平衡,就像生活的调味剂,缺一不可。
3. 氧化物的角色3.1 氧化物与酸碱的关系说到氧化物,这可是一个大佬。
它们在化学反应中扮演了重要角色。
氧化物通常是金属和非金属和氧反应后形成的,像是铁锈(Fe₂O₃),它就代表着金属和氧的结合。
氧化物可酸可碱,真是个多面手。
你知道吗?有些氧化物和酸反应后也能产生盐,比如硫酸铜(CuSO₄)和氢氧化钠反应,就能生成氢氧化铜和盐酸。
这就好比是化学界的“变魔术”,瞬间变化,出人意料。
3.2 氧化物的日常应用在生活中,氧化物也是我们耳熟能详的角色。
你看,空气中的氧气(O₂)就是个氧化物。
它让我们能够呼吸,保持生命。
还有很多金属氧化物在建筑、制造中也常常用到,真是生活中无处不在。
高中化学之酸碱盐之间反应的特例

高中化学之酸碱盐之间反应的特例一、酸与碱之间一般发生中和反应生成盐和水,但也有例外,因为酸与碱之间还可以发生的氧化还原反应如:Fe(OH)3 +6HI=2FeI2+ I2 + 6H2O3Fe(OH)2 + 10HNO3=3Fe(NO3)3+ NO↑+ 8H2OCu(OH)2 + HCOOH==Cu2O↓+ CO2↑+ 3H2O二、酸与盐之间一般发生复分解反应生成新酸和新盐,但也有例外,因为酸与盐之间也可以发生化合反应、还可以发生氧化还原反应如:Ca3(PO4)2 + 4H3PO4=3Ca(H2PO4)2,2FeCl3 +2HI=2FeCl2 + I2+ 2HClFeCl3 + H2S=2FeCl2 + S↓+ 2HCl,Na2S2O3 + H2SO4=Na2SO4 + SO2↑+ S↓+ H2O三、酸与酸之间一般不发生化学反应,但也有例外,因为氧化性的酸遇到还原性的酸可以发生氧化还原反应如:2H2S +H2SO3=3S↓+ 3H2O,H2S + H2SO4(浓)=S↓+ 2H2O + SO2↑2HI + 2HNO3(浓)=I2 + 2NO2↑+ 2H2O3H2S + 2HNO3(稀)=3S↓+ 2NO↑+ 4H2OHClO + H2SO3=H2SO4 + HCl四、碱与盐之间一般发生复分解反应生成新碱和新盐,但也有例外如:NaOH + CH3COONa=Na2CO3 + CH4↑4NaOH + AlCl3=NaAlO2+3NaCl +2H2O2NaOH + Ca(HCO3)2=CaCO3↓+ Na2CO3 + 2H2O五、碱与碱之间一般不发生化学反应,但也有例外,如氨水遇到某些碱可形成配位化合物:2NH3·H2O + AgOH=Ag(NH3)2OH +2H2O4NH3·H2O + Cu(OH)2=Cu(NH3)4(OH)2 +4H2O六、盐与盐之间一般发生复分解反应生成两种新盐,但也有例外,如发生氧化还原反应、双水解反应:2FeCl3 + 2KI=2FeCl2 + 2KCl + I22FeCl3 + SnCl2=2FeCl2 + SnCl4NaClO+Na2SO3=NaCl+ Na2SO4;AlCl3 +3NaHCO3=3NaCl + Al(OH)3 + 3CO2↑AlCl3 + 3NaAlO2 +6H2O=4Al(OH)3↓+ 3NaCl2FeCl3 + 3Na2CO3 + 3H2O=6NaCl + 2Fe(OH)3↓+ 3CO2↑七、还有易水解的盐与不容性的盐、强酸的酸式盐与弱酸盐以及多元弱酸的正盐与酸式盐之间的反应:2NH4Cl + BaCO3=BaCl2 + 2NH3↑+ CO2↑+ H2O;2NaHSO4 +Na2CO3=2Na2SO4+ CO2↑+ H2O;Na3PO4 + NaH2PO4=2Na2HPO4。
酸碱盐的反应规律

酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应,可归纳成下图来表示。
①金属+ 氧气?金属氧化物除Ag、Pt、Au外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,由酸转化成盐有四个途径:某些金属+ 某些酸?盐+ 氢气酸+ 碱性氧化物?盐+ 水酸+ 碱?盐+ 水酸+ 某些盐?另一种酸+ 另一种盐⑧酸?酸性氧化物+ 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨金属+ 非金属?无氧酸盐此处的非金属H2、O2除外。
当金属越活泼,非金属也越活泼时,反应就越容易进行。
⑩酸性氧化物+ 碱性氧化物?含氧酸盐(非初三知识)强酸(H2SO4、HNO3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加热或高温条件下才能发生反应。
碱性氧化物+ 酸?盐+ 水强酸(H2SO4、HNO3、HCl)可与所有碱性氧化物反应,弱酸(H2CO3、H2S等)只能和活碱、4参加反应的两种盐必须都能溶于水,若生成物中有一种是难溶性的盐时,则反应可以进行。
金属+ 盐?另一种金属+ 另一种盐在金属活动性顺序里,排在前面的金属(K、Ca、Na除外)能把排在后面的金属从它的盐溶液里置换出来。
金属+ 酸?盐+ 氢气在金属活动性顺序里,排在氢前的金属能从酸溶液中把氢置换出来。
这里的酸主要是指盐酸和稀硫酸。
浓硫酸和硝酸因有强氧化性,跟金属反应时不会生成氢气,而是生成盐、水和其它气体。
除杂1、CO2(CO):把气体通过灼热的氧化铜,2、CO(CO2):通过足量的氢氧化钠溶液3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体3除去Cu中的Fe,可将混合固体加入CuSO4溶液中,(Fe+CuSO4=Cu+FeSO4),然后过滤后取滤渣。
4除去Na2SO4溶液中的NaOH,可向溶液中加入适量的稀H2SO4溶液(2NaOH+H2SO4=Na2SO4+2H2O)5除去KCl溶液中的K2SO4,可向溶液中加入适量的BaCl2溶液(K2SO4+BaCl2=2KCl+BaSO4),然后过滤后取滤液。
九年级化学酸碱盐知识点归纳

九年级化学酸碱盐知识点归纳一、酸碱盐的基本概念酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl、H2SO4、HNO3、CH3COOH 等。
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH、KOH、Ca(OH)2、Ba(OH)2、NH3·H2O等。
盐:由金属离子(或铵根离子)和酸根离子组成的化合物。
如:NaCl、Na2CO3、CuSO4、NH4Cl等。
二、酸碱盐的通性酸的通性:使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应生成盐和氢气。
与金属氧化物反应生成盐和水。
与碱反应生成盐和水。
与盐反应生成新盐和新酸。
碱的通性:使紫色石蕊试液变蓝,无色酚酞试液变红。
与非金属氧化物反应生成盐和水。
与酸反应生成盐和水。
与盐反应生成新盐和新碱。
盐的通性:有些盐能与酸反应生成新盐和新酸。
有些盐能与碱反应生成新盐和新碱。
有些盐能与某些盐反应生成两种新盐。
三、酸碱盐之间的反应酸碱中和反应:酸和碱反应生成盐和水,这类反应属于复分解反应。
如:HCl + NaOH = NaCl + H2O。
盐与酸的反应:生成新盐和新酸。
如:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑。
盐与碱的反应:生成新盐和新碱。
如:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4。
盐与盐的反应:生成两种新盐。
如:Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl。
四、酸碱盐在生活中的应用酸:用于清洁金属表面、除锈、生产化肥等。
碱:用于中和酸性废水、生产洗涤剂、肥皂等。
盐:用于调味、防腐、生产化学原料等。
五、常见的酸碱指示剂紫色石蕊试液:遇酸变红,遇碱变蓝。
无色酚酞试液:遇酸不变色,遇碱变红。
六、溶液的酸碱度pH值:表示溶液酸碱度的数值,范围为0-14。
pH < 7为酸性,pH = 7为中性,pH > 7为碱性。
酸碱指示剂与pH试纸:用于测定溶液的酸碱度。
七、常见的酸碱盐及其性质盐酸(HCl):无色液体,具有刺激性气味,能与多种物质发生反应。
酸碱盐知识点归纳总结

酸碱盐知识点归纳总结酸碱盐是化学中的重要基础知识,以下是一份关于酸碱盐的知识点归纳总结,供您参考:1. 酸的定义:由氢离子 (H+) 组成的化合物称为酸。
例如,硫酸 (H2SO4)、盐酸 (HCl) 和硝酸 (HNO3) 等。
2. 碱的定义:由氢氧根离子 (OH-) 组成的化合物称为碱。
例如,氢氧化钠(NaOH)、氢氧化钙 (Ca(OH)2) 和氨水 (NH3·H2O) 等。
3. 盐的定义:由金属离子 (或铵根离子) 和酸根离子组成的化合物称为盐。
例如,氯化钠 (NaCl)、碳酸钠 (Na2CO3) 和硫酸钙 (CaSO4) 等。
4. 酸碱盐的通性:酸碱盐在水中溶解度较好,可以导电。
酸碱盐在水溶液中能够反应,并且生成的产物可以是盐、酸或碱。
5. 酸的性质:酸具有酸味,可以与金属离子反应产生氢气,也可以与碱反应生成盐和水。
例如,硫酸与锌反应产生氢气,盐酸与铜反应产生氢气。
6. 碱的性质:碱具有碱性,可以中和酸性物质,也可以与酸反应产生盐和水。
例如,氢氧化钠与硫酸反应产生硫酸钠和水,氢氧化钙与盐酸反应产生氯化钙和水。
7. 盐的性质:盐具有中性,可以中和酸性物质,也可以与碱反应产生盐和水。
例如,氯化钠与硫酸铜反应产生硫酸钠和水。
8. 酸碱盐的相互关系:酸碱盐之间可以相互转化,例如硫酸可以转化为硫酸盐,盐酸可以转化为盐酸盐。
此外,酸碱盐也可以在水中溶解度不同而相互转化。
9. 常见的酸碱盐:常见的酸碱盐包括硫酸、盐酸、硝酸、氢氧化钠、氢氧化钙、氯化钠、碳酸钠、硫酸钙等。
以上是关于酸碱盐的知识点归纳总结,希望对您有所帮助。
如果您有任何其他问题,欢迎随时提问。
酸碱盐物质转化关系图
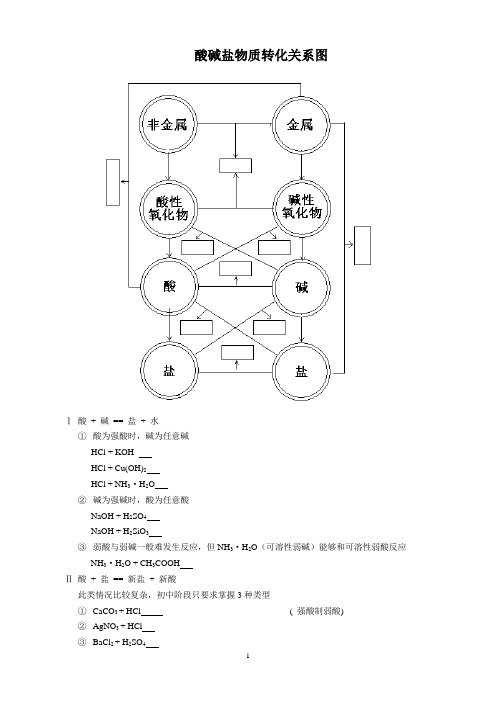
酸碱盐物质转化关系图
Ⅰ酸+ 碱== 盐+ 水
①酸为强酸时,碱为任意碱
HCl + KOH
HCl + Cu(OH)2
HCl + NH3·H2O
②碱为强碱时,酸为任意酸
NaOH + H2SO4
NaOH + H2SiO3
③弱酸与弱碱一般难发生反应,但NH3·H2O(可溶性弱碱)能够和可溶性弱酸反应
NH3·H2O + CH3COOH
Ⅱ酸+ 盐== 新盐+ 新酸
此类情况比较复杂,初中阶段只要求掌握3种类型
①CaCO3 + HCl ( 强酸制弱酸)
②AgNO3 + HCl
③BaCl2 + H2SO4
Ⅲ碱+ 盐== 新盐+ 新碱
反应条件:反应物均能溶于水,产物应有沉淀或气体生成
①NaOH + CuSO4
②NaOH + NH4Cl
Ⅳ盐+ 盐== 新盐+ 新盐
反应条件:反应物均能溶于水,产物至少有一种沉淀
①AgNO3 + NaCl
②BaCl2 + CuSO4
酸、碱、盐、氧化物、单质之间的转化关系
例:用七种方法制取MgCl2
Ⅰ.Mg + Cl2 ==== MgCl2①
Ⅱ.MgO + HCl ==== MgCl2 + H2O ②
Ⅲ.Mg(OH)2 +2HCl ==== MgCl2 +2H2O ④
Ⅳ.MgCO3+2HCl === MgCl2 +H2O+CO2↑⑥
Ⅴ.MgSO4 + BaCl2 === MgCl2 + BaSO4↓⑦
Ⅵ.Mg + CuCl2 ==== MgCl2 + Cu ⑧
Ⅶ.Mg + 2HCl ==== MgCl2 + H2↑⑨。
酸碱盐之间的转化

第十一讲【知识要点】酸碱盐之间的转化1 .酸的通性因为酸在水溶液里电离生成的阳离子全部都是氢离子,所以它们具有相似的化学性 质,即酸的通性。
酸的通性实质上是氢离子的性质。
碱在水溶液中电离生成的阴离子都是氢氧根离子, 因而碱类都具有一些相似的化学性质,即碱的通性。
另外:、不仅不溶于水,而且还不溶于稀硝酸。
2、写出实现下列反应的化学方程式:(1) C —七2)CO 2 — H 2^ H 2CO 3 ______________________(2) Ca _CaO _ H 2°》Ca(OH)2 _____________________3、根据常见离子的检验方法,完成下表。
4 .酸、碱、盐的溶解性钾、钠、硝酸、铵盐溶 硫酸盐不溶硫酸钡 钾、钠、钙、钡的碱能溶盐酸盐不溶氯化银 碳酸盐只溶钾、钠、铵 常见五酸都易溶离子所加试剂现象QH在碱性溶液中,滴加无色酚酞试液。
溶液变色。
在碱性溶液中,滴加硫酸铜溶液。
有产生。
在碱性溶液中,滴加氯化铁溶液。
有产生。
在碱性溶液中,滴加氯化铵等铵盐溶液。
微热后气味。
再在试管口放一张湿润的红色石蕊试纸。
有产生。
红色试纸变__色。
CI-先加入硝酸银溶液,再加稀硝酸。
仍有。
SQ2-先加入硝酸钡溶液,再加稀硝酸。
仍有。
CQ2-先加入稀盐酸,把产生的气体通入澄清石灰水。
澄清石灰水变【典型例题】例1、不能由金属跟稀硫酸直接反应制得的物质是〔〕A、MgSQB、Fe2(SQ) 3C、ZnSQ D例2、等质量的A,B,C三种金属分别与质量相同,质量分数也相同的稀硫酸充分反应放出氢气的情况如右图所示。
则:A、活动性最强的金属是________B活动性最弱的金属是__________C反应不再发生时,最先用完的一种物质是_____________例3、将锌片投入下列盐溶液反应后,使溶液质量减轻的是A. MgCI 2B. CuCI 2C. Hg (NQ 3)2D. AI(NQ 3)3例4、在AgN@ C U(NQ)2、和Zn(NQ) 2混合溶液中,加入一定量铁粉,充分反应后过滤, 在滤液中加入稀盐酸,有白色沉淀产生。
单质氧化物酸碱盐相互关系

单质、氧化物、酸、碱、盐相互转化规律一、氧化物:1.定义:由元素组成的并且含有的化合物叫氧化物。
2.分类:(1)按组成元素分类①金属氧化物(如:Na2O、CaO、MgO、ZnO、MnO2、CuO、Fe2O3、Al2O3)②非金属氧化物(如:CO2、SO2、CO、SO3、P2O5)(2)按化学性质分类①不成盐氧化物:(如:H2O、CO、NO、MnO2)②可成盐氧化物:Ⅰ、酸性氧化物;Ⅱ、碱性氧化物;Ⅲ、两性氧化物。
两性氧化物:是指既能与酸反应生成盐和水、也能和碱反应生成盐和水的氧化物(如氧化铝)。
如:Al2O3+ HCl= Al2O3+ NaOH=二、单质、氧化物、酸、碱、盐相互转化关系图作用1.确定各类物质的转化规律.⑴两条纵向关系:⑵四条横线:①金属+非金属= 盐;②碱性氧化物+酸性氧化物=盐;③碱+酸=盐+水;④盐+盐=盐+盐。
⑶四条交叉线:①碱性氧化物+酸=盐+水②酸性氧化物+碱=盐+水③碱+盐=新碱+新盐④酸+盐=新酸+新盐⑷两条折线:①活泼金属+酸(盐酸、稀硫酸)=盐+氢气②金属+盐=金属+盐2.确定各类物质的反应规律及其主要化学性质.以酸、碱、盐、氧化物为例说明它们具有哪些重要的化学性质?3.确定制取物质的可能方法。
例1:怎样制取烧碱的可能途径有哪些?写出有关反应的化学方程式。
例2:怎样制取MgCl2 ?写出有关反应的化学方程式。
(7种方法)练习:1.试用五种方法制备ZnSO4,写出有关反应的化学方程式。
①;②;③;④;⑤……2.从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)8种物质中选出4种,使得下图中各线条相连的物质均能反应生成难溶物。
将选出物质的化学式按要求填写在下图相应的方框中,并写出(1)(2)、(3)(4)的化学方程式。
(1)_______________________________;(2)_______________________________;(3)_______________________________;(4)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
请你练习下面的化学反应方程式
MgCl2+2NaOH= +2NaOH=Mg(OH)2↓+2NaCl
Ba(OH)2+MgSO4= Mg(OH)2↓+BaSO4↓
Ca(OH) 2+2NH 4NO 3Ca(NO = Ca(OH)2+2 NH4NO 3= 3)2+2NH3↑+H2O
二、相反性质物质间的反应规律
3、金属氧化物+酸==盐+水 Fe2O3+6HCl==2FeCl3+3H2O
请你练习下面的化学反应方程式
CuO+H 2SO 4= CuO+H 2SO 4==CuSO 4+H2O
CaO+2HCl= CaO+2HCl==CaCl 2+H2O
Na 2O+2HCl= Na 2O+2HCl==2NaCl+H 2O
4 、非金属氧化物+碱==盐+水
CO2+Ca(OH)2==CaCO3↓+H2O
请你练习下面的化学反应方程式
CO2 2+2NaOH== +2NaOH==Na2CO3+H2O
SO2 2+2NaOH== +2NaOH==Na2SO3+H2O
SO3 3+2NaOH== +2NaOH==Na2SO4+H2O
三、复分解反应的规律 5、酸+碱==盐+水
HCl+NaOH==NaCl+H2O
请你练习下面的化学反应方程式
Cu(OH)+H 2SO 4==CuSO 4+2H2O Cu(OH)+H 2SO 4==
Fe(OH) 3+3HCl==FeCl 3+3H2O Fe(OH) 3+3HCl==
3KOH+H 3PO 4==K 3KOH+H 3PO 4== 3PO4+3H2O
6、酸1+盐1==酸2+盐2
例: CaCO3+2HCl==CaCl2+H2O+CO2↑
请你练习下面的化学反应方程式
HCl+AgNO3==AgCl↓+HNO == 3
H2SO4+BaCl2==BaSO == 4↓+2HCl
BaCO3+HNO3==Ba(NO == 3)2+H2O+CO2↑
7、碱1(溶)+盐1
8、盐1 4 例:
(溶)
+盐2
(溶)
==盐3+盐
NaCl+AgNO3==AgCl↓+NaNO3
Na2SO4+BaCl2==BaSO4↓+2NaCl
请你练习下面的化学反应方程式
BaCl2+2AgNO3==2AgCl↓+Ba(NO == 3 )2
Na2CO3+BaCl2==BaCO == 3↓+2NaCl
酸、碱、盐知识小结
1、金属+酸==盐+氢气
2、金属1+盐1(溶)==金属2+盐2 3、金属氧化物 5、酸+碱==盐+水 6、酸1+盐1==酸2+盐2 + 酸==盐+水 4 、非金属氧化物 + 碱==盐+水
7、碱1(溶) +盐1(溶) ==碱2+盐2
8、盐1(溶)+盐2(溶)==盐3+盐4
酸、碱、盐之间的关系
一 、置换反应的规律 1、金属+酸==盐+氢气
例:Zn+2HCl==ZnCl2+H2↑
Zn+H2SO4==ZnSO4+H2↑ 请你练习下面的化学反应方程式 Fe+2HCl==FeCl Fe+2HCl== 2+H2↑ Fe+H2SO4==FeSO == 4+H2↑ 2Al+6HCl==2AlCl 2Al+6HCl== 3+ 3H2↑
2Al+3H2SO4==Al == 2(SO4)3+3H2↑
2、金属1+盐1(溶液)==金属2+盐2
例: Fe+CuSO4==FeSO4+Cu Cu+Hg(NO3)2==Cu(NO3)2+Hg
请你练习下面的化学反应方程式
Zn+FeCl2==ZnCl == 2+Fe
2Al+3CuSO4==Al == 2(SO4)3+3Cu
